Solo el 20-26% de los pacientes con esclerosis múltiple presenta déficits en habilidades visuoespaciales-visuoconstructivas (VE-VC) pese a la frecuente afectación témporo-parieto-occipital en resonancia magnética. No hay estudios que analicen la relación entre estas funciones y el volumen lesional (VL) de estas áreas cerebrales.
ObjetivoEvaluar la relación del VL parieto-occipito-temporal y la atrofia subcortical con el rendimiento en funciones VE-VC en esclerosis múltiple.
MetodologíaDe 100 pacientes de esclerosis múltiple con evaluación neuropsicológica rutinaria se seleccionan 21 por afectación en habilidades VE-VC, medidas por Figuras incompletas, Cubos (WAIS-III) y Figura compleja de Rey-Osterrieth, y 13 sin déficit cognitivo (grupo control). El VL regional se cuantifica por un método semiautomático en secuencias FLAIR y T1, y la atrofia subcortical por el ratio bicaudado y la anchura del iii ventrículo (AIIIV). Se utilizan correlaciones parciales (controlando con edad y escolarización) y regresión lineal para analizar la relación entre los parámetros de resonancia magnética y el rendimiento cognitivo.
ResultadosTodas las medidas de VL y de atrofia cerebral son significativamente mayores en pacientes con deterioro cognitivo. El VL regional en FLAIR, ratio bicaudado y AIIIV muestran significativa correlación inversa con el rendimiento cognitivo, mayor entre la AIIIV y VC (Cubos: p=0,001; Figura compleja de Rey-Osterrieth: p<0,000). En el análisis multivariante, la AIIIV influye significativamente en tareas de VC (Cubos: p=0,000; Figura compleja de Rey-Osterrieth: p=0,000) y el VL regional en FLAIR en tareas VE (Figuras incompletas; p=0,002).
ConclusionesLas medidas de atrofia subcortical se relacionan con tareas de visuoconstrucción y el VL regional con tareas VE.
About 20% to 26% of patients with multiple sclerosis (MS) show alterations in visuospatial/visuoconstructive (VS-VC) skills even though temporo-parieto-occipital impairment is a frequent finding in magnetic resonance imaging. No studies have specifically analysed the relationship between these functions and lesion volume (LV) in these specific brain areas.
ObjectiveTo evaluate the relationship between VS-VC impairment and magnetic resonance imaging temporo-parieto-occipital LV with subcortical atrophy in patients with MS.
MethodologyOf 100 MS patients undergoing a routine neuropsychological evaluation, 21 were selected because they displayed VS-VC impairments in the following tests: Incomplete picture, Block design (WAIS-III), and Rey-Osterrieth complex figure test. We also selected 13 MS patients without cognitive impairment (control group). Regional LV was measured in FLAIR and T1-weighted images using a semiautomated method; subcortical atrophy was measured by bicaudate ratio and third ventricle width. Partial correlations (controlling for age and years of school) and linear regression analysis were employed to analyse correlations between magnetic resonance imaging parameters and cognitive performance.
ResultsAll measures of LV and brain atrophy were significantly higher in patients with cognitive impairment. Regional LV, bicaudate ratio, and third ventricle width are significantly and inversely correlated with cognitive performance; the strongest correlation was between third ventricle width and VC performance (Block design: P=.001; Rey-Osterrieth complex figure: P<.000). In the multivariate analysis, third ventricle width only had a significant effect on performance of VC tasks (Block design: P=.000; Rey-Osterrieth complex figure: P=.000), and regional FLAIR VL was linked to the VS task (Incomplete picture; P=.002).
ConclusionsMeasures of subcortical atrophy explain the variations in performance on visuocostructive tasks, and regional FLAIR VL measures are linked to VS tasks
Un 40-65% de los pacientes con esclerosis múltiple (EM) desarrollan déficits cognitivos en el curso de la enfermedad. Con mayor frecuencia se afectan la velocidad de procesamiento de la información (VPI), atención, memoria y funciones ejecutivas1–7. A diferencia de los síntomas físicos, el deterioro cognitivo (DC) no suele remitir. Es más frecuente en fases tardías de la enfermedad pero puede ser causa de invalidez en EM recurrentes-remitentes de poco tiempo de evolución6,8,9.
La mayoría de los trabajos encuentran una correlación débil e inconsistente entre el DC en EM y el volumen lesional (VL) en la sustancia blanca (SB) medido en secuencias potenciadas en T2 y T110. Las medidas de atrofia cerebral, global y regional, guardan una relación más consistente con el DC, específicamente la atrofia de sustancia gris11–13. Los trabajos que analizan dominios cognitivos concretos con el VL y atrofia regional en áreas cerebrales correspondientes son heterogéneos y centrados sobre todo en VPI, memoria y función ejecutiva12,14–19.
Pese a que en la EM es frecuente encontrar lesiones en SB de áreas témporo-parieto-occipitales, el déficit en habilidades visuoespaciales (VE) y visuoconstructivas (VC), detectado en aproximadamente un 25% de los pacientes ha sido rara vez estudiado de forma específica3,7,20. La disfunción en habilidades VE se traduce en déficits en la representación e integración de imágenes y en la localización y seguimiento espacial de un objeto, y el déficit en las VC en la organización espacial de la información visual, con dificultad en el ensamblaje y en el dibujo. Ambas habilidades precisan de la integridad de las vías de procesamiento visual: occipito-parietal o vía dorsal (también llamada magnocelular), encargada del análisis del movimiento y coordinación visuomotora; occipito-temporal inferior o vía ventral (parvocelular), vinculada con la percepción de los objetos (forma y color); y la vía medial occipito-temporal superior, importante en funciones VE21,22.
En este estudio evaluamos en pacientes de EM la relación entre la afectación en habilidades VE y VC y el VL de áreas témporo-parieto-occipitales, cuantificado por un sistema manual con cálculo automatizado del área, y la atrofia cerebral subcortical estimada por medidas lineales.
MetodologíaSe seleccionan 21 pacientes de EM (criterios de McDonald 2010) por afectación VE y VC y 13 sin DC alguno (grupo control), de un total de 100 pacientes de EM con evaluación neuropsicológica rutinaria y extensa que incluye VPI, memoria, aprendizaje, atención, funciones ejecutivas, procesamiento lingüístico, habilidades VE y VC. Se excluyen los pacientes con enfermedad psiquiátrica, en tratamiento con fármacos psicotrópicos y con cualquier déficit visual y/o alteración de los movimientos oculares reseñado en historia clínica, por su potencial interferencia en el rendimiento de los test cognitivos.
Se evalúan edad, sexo, tipo de EM, grado de discapacidad medido por el Expanden Disability Status Scale (EDSS) y tiempo de evolución de la EM en el momento de la evaluación neuropsicológica. Se considera también el nivel educativo en años de escolarización.
El grado de depresión (Inventario de depresión de Beck) y ansiedad (cuestionario de ansiedad estado/raso) se analizan para controlar su efecto en el rendimiento cognitivo.
Instrumentos de medidaLas funciones VE y VC son evaluadas mediante los test de Cubos (CC) y Figuras incompletas (FI) del Wechsler Adult Intelligence Scale (WAIS-III), y Figura compleja de Rey-Osterrieth (FRey): exactitud de copia y reproducción inmediata.
Test de CubosEl paciente debe reproducir diseños geométricos con cubos. Mide la capacidad de analizar y sintetizar dibujos geométricos abstractos, estrategias de solución de problemas, integración psicomotora, rapidez y distracción. Se consideran anormales puntuaciones escalares≤7 (≤−1DE).
Test de Figuras incompletasSe presentan al paciente láminas con objetos comunes a los que le falta un elemento que debe identificar. Es una prueba tiempo dependiente que mide la capacidad de organizar visualmente un objeto. Se consideran anormales puntuaciones escalares≤7 (≤−1DE).
Figura compleja de Rey-OsterriethEstudia la organización perceptual y memoria visual mediante la reproducción de la figura tras un período de interferencia. Valora la capacidad de organizar y planificar estrategias en la resolución de problemas, y las habilidades VC. Consideramos patológica la puntuación centil≤30 por el efecto techo de esta prueba (la mayoría de los sujetos obtienen puntuaciones muy altas y los puntajes se sitúan en la parte superior de la distribución).
El déficit en habilidades VE y/o VC fue definido por la alteración en al menos un test.
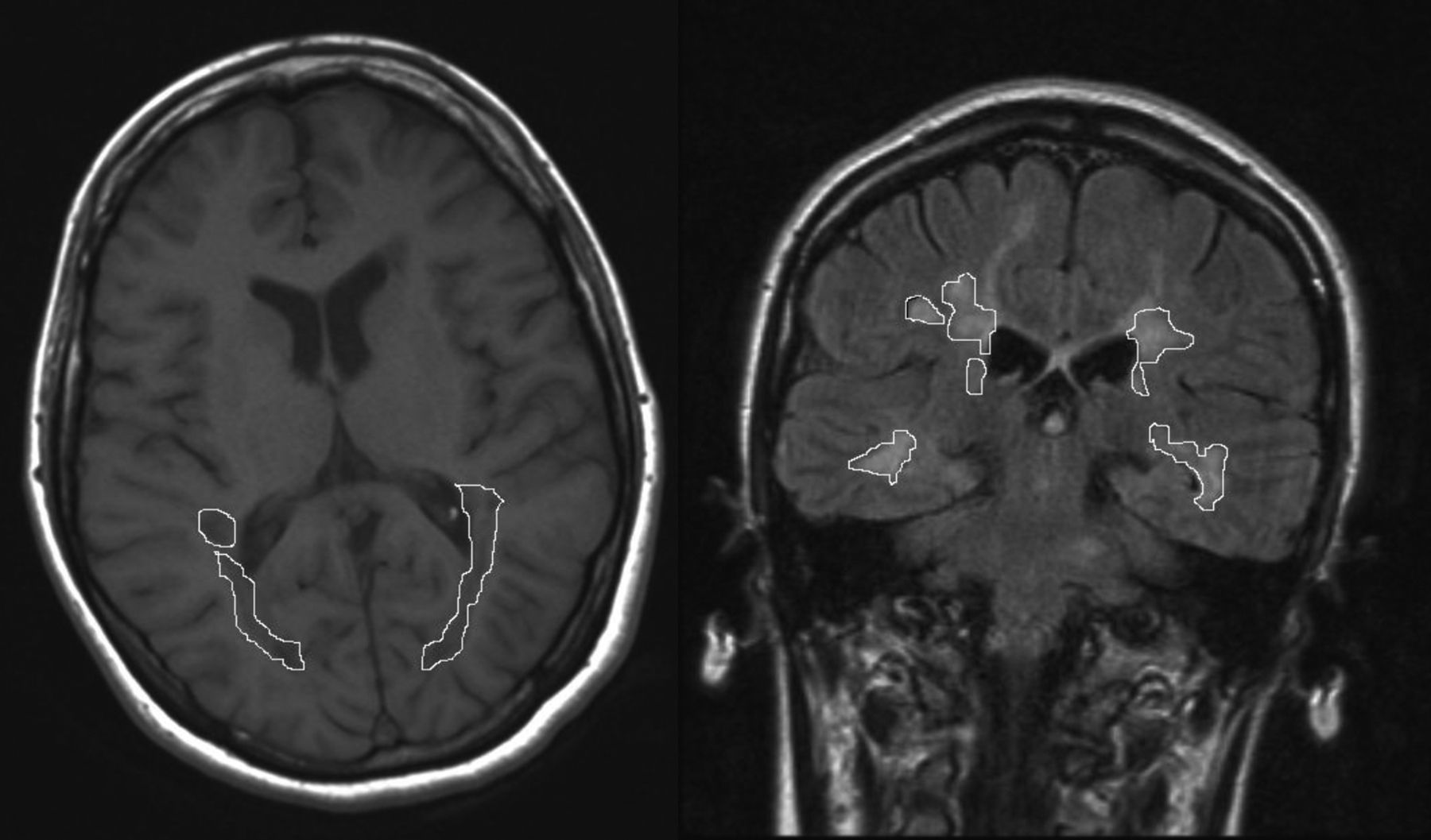
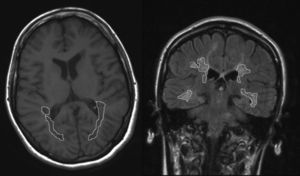
Evaluación del volumen lesional en resonancia magnéticaSe realiza un estudio de resonancia magnética (RM) cerebral estándar para EM (Siemens, 1.5 Tesla) con cortes de 5mm de grosor, que incluye cortes en los planos axial en secuencias potenciadas en T1 y coronal en secuencias «Fluid-Attenuated Inversion Recovery» (FLAIR). Las lesiones de SB se identifican y miden en los cortes axiales en secuencias potenciadas en T1 y en los cortes coronales en secuencias FLAIR. Se cuantifica el VL de SB del área témporo-parieto-occipital localizada entre los surcos poscentral y occipital. Cada una de las lesiones es dibujada manualmente por un investigador ciego con los resultados de los test neuropsicológicos. El área de cada lesión se calcula de forma automatizada por el programa que procesa las imágenes de RM (fig. 1). El VL de SB regional se calcula por la suma del área de todas las lesiones en todos los cortes multiplicado por el grosor del corte. Se realizan también medidas lineales de atrofia cerebral mediante la anchura del iii ventrículo (AIIIV) y el ratio bicaudado (RBC)23-25 en las secuencias FLAIR. La separación entre la exploración neuropsicológica y la RM no es mayor de 3 meses en ningún caso.
Análisis estadísticoSe utiliza el software SPSS versión 18.0. Se realizan análisis descriptivos y de frecuencias de ambos grupos. En la comparación entre grupos, experimental y control, se utiliza la prueba χ2 (variables categóricas) y la t de Student (variables continuas) para muestras independientes.
La relación entre el rendimiento en tareas VE-VC y las variables clínicas y radiológicas se analiza en todos los pacientes de EM, con o sin DC, mediante correlaciones parciales bivariantes y controlando con edad y años de escolarización (Rank de Spearman), y por un modelo de regresión lineal (método por pasos) considerando como variable dependiente cada uno de los 3 test cognitivos e independientes las variables demográficas, clínicas y cada una de las medidas de RM (VL en T1 de hemisferio derecho, izquierdo y ambos, VL en FLAIR hemisferio derecho, izquierdo y ambos, AIIIV y RBC) que muestran relación significativa en el análisis bivariante, con la excepción de la edad, sexo y años de escolarización que fueron siempre consideradas en el modelo.
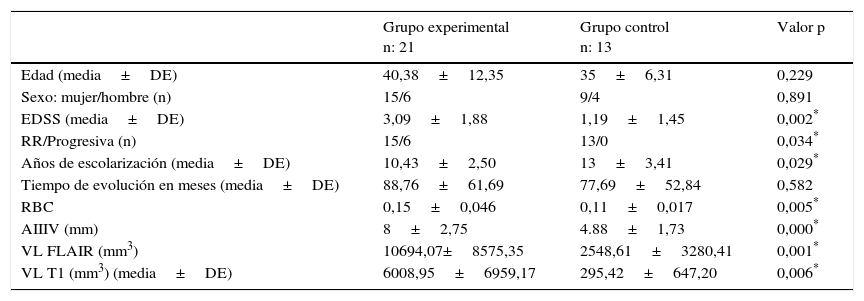
ResultadosEn la tabla 1 se muestran las características clínicas y radiológicas de los 2 grupos de pacientes con EM. Se observan diferencias significativas entre el grupo control (pacientes de EM sin DC) y el grupo de pacientes de EM con déficit en habilidades VE y VC en años de escolarización, EDSS, tipo de EM y todas las medidas de VL y de atrofia subcortical en RM (tabla 1).
Características clínicas y radiológicas
| Grupo experimental n: 21 | Grupo control n: 13 | Valor p | |
|---|---|---|---|
| Edad (media±DE) | 40,38±12,35 | 35±6,31 | 0,229 |
| Sexo: mujer/hombre (n) | 15/6 | 9/4 | 0,891 |
| EDSS (media±DE) | 3,09±1,88 | 1,19±1,45 | 0,002* |
| RR/Progresiva (n) | 15/6 | 13/0 | 0,034* |
| Años de escolarización (media±DE) | 10,43±2,50 | 13±3,41 | 0,029* |
| Tiempo de evolución en meses (media±DE) | 88,76±61,69 | 77,69±52,84 | 0,582 |
| RBC | 0,15±0,046 | 0,11±0,017 | 0,005* |
| AIIIV (mm) | 8±2,75 | 4.88±1,73 | 0,000* |
| VL FLAIR (mm3) | 10694,07±8575,35 | 2548,61±3280,41 | 0,001* |
| VL T1 (mm3) (media±DE) | 6008,95±6959,17 | 295,42±647,20 | 0,006* |
AIIIV: anchura del tercer ventrículo; DE: desviación estándar; EDSS: Expanded Disability Status Scale de Kurtzke; FLAIR: Fluid-Attenuated Inversion Recovery; RBC: ratio bicaudado; RR: remitente recurrente; VL FLAIR: volumen lesional en secuencia FLAIR de resonancia magnética; VL T1: volumen lesional en secuencia T1 de resonancia magnética.
No se obtienen correlaciones significativas entre los test cognitivos y el sexo, tipo de EM ni tiempo de evolución de la EM. Tampoco el grado de depresión (Inventario de depresión de Beck: FI p=0,081; CC p=0,106; FRey p=0,933) ni el de ansiedad (cuestionario de ansiedad estado/raso: FI p=0,142; CC p=0,134; FRey p=0,126) se correlacionan con el rendimiento en los test.
El nivel educativo influye significativamente en la puntuación de los 3 test (FI p=0,010; CC p=0,005; FRey p=0,014) y la edad solo en la FRey (p=0,005), por lo que se controla su efecto en las correlaciones bivariadas significativas (EDSS y medidas de RM).
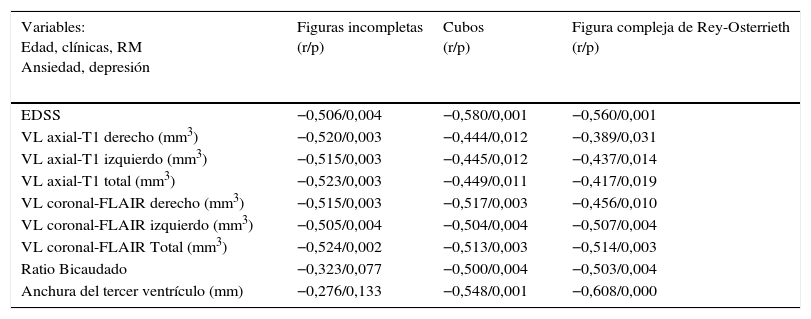
Las variables que sí se relacionan significativamente con el rendimiento en habilidades VE-VC se exponen en la tabla 2; destacar la fuerte correlación inversa con todas las medidas de VL y atrofia en RM (p<0,01), que se mantiene controlando con edad y nivel educativo, salvo para FI con las medidas de atrofia central. El VL en secuencias FLAIR de hemisferio izquierdo y de ambos hemisferios muestra más fuerte y uniforme correlación con los 3 test que otras medidas de volumen, si bien, la asociación más importante se obtiene entre la AIIIV y las tareas de VC (CC y FRey-exactitud de copia, r=0,548/p=0,001 y r=0,608/p<0,000, respectivamente) (tabla 2).
Correlaciones parciales entre EDSS, VL secuencia T1, FLAIR, medidas de atrofia y test cognitivos, controlando el efecto de la edad y nivel educativo
| Variables: Edad, clínicas, RM Ansiedad, depresión | Figuras incompletas (r/p) | Cubos (r/p) | Figura compleja de Rey-Osterrieth (r/p) |
|---|---|---|---|
| EDSS | −0,506/0,004 | −0,580/0,001 | −0,560/0,001 |
| VL axial-T1 derecho (mm3) | −0,520/0,003 | −0,444/0,012 | −0,389/0,031 |
| VL axial-T1 izquierdo (mm3) | −0,515/0,003 | −0,445/0,012 | −0,437/0,014 |
| VL axial-T1 total (mm3) | −0,523/0,003 | −0,449/0,011 | −0,417/0,019 |
| VL coronal-FLAIR derecho (mm3) | −0,515/0,003 | −0,517/0,003 | −0,456/0,010 |
| VL coronal-FLAIR izquierdo (mm3) | −0,505/0,004 | −0,504/0,004 | −0,507/0,004 |
| VL coronal-FLAIR Total (mm3) | −0,524/0,002 | −0,513/0,003 | −0,514/0,003 |
| Ratio Bicaudado | −0,323/0,077 | −0,500/0,004 | −0,503/0,004 |
| Anchura del tercer ventrículo (mm) | −0,276/0,133 | −0,548/0,001 | −0,608/0,000 |
EDSS: grado de discapacidad por la Expanded Disability Status Scale; FLAIR: Fluid-Attenuated Inversion Recovery; RM: resonancia magnética; VL T1: volumen lesional en secuencia T1 de resonancia magnética.
Nivel de significación p≤0,05.
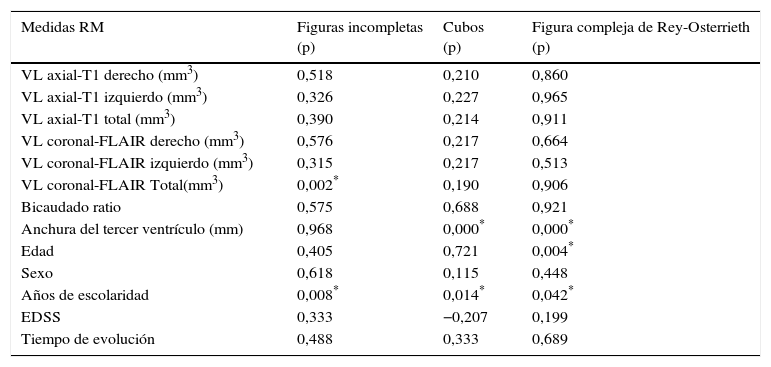
Ninguna variable clínica explica el rendimiento en los test cognitivos, sí lo hacen los años de escolarización y la edad en tareas de VC (FRey). La AIIIV influye de forma independiente y significativa en el rendimiento en los test de VC (CC y FRey). Se objetiva también un efecto significativo independiente del VL regional en FLAIR en tareas VE (FI), con un impacto menor (se requieren importantes aumentos de VL para modificar significativamente la puntación en los test). El resto de las variables radiológicas no muestra relación significativa alguna (tabla 3).
Regresión lineal para evaluar el efecto de los parámetros de RM en tareas VE-VC
| Medidas RM | Figuras incompletas (p) | Cubos (p) | Figura compleja de Rey-Osterrieth (p) |
|---|---|---|---|
| VL axial-T1 derecho (mm3) | 0,518 | 0,210 | 0,860 |
| VL axial-T1 izquierdo (mm3) | 0,326 | 0,227 | 0,965 |
| VL axial-T1 total (mm3) | 0,390 | 0,214 | 0,911 |
| VL coronal-FLAIR derecho (mm3) | 0,576 | 0,217 | 0,664 |
| VL coronal-FLAIR izquierdo (mm3) | 0,315 | 0,217 | 0,513 |
| VL coronal-FLAIR Total(mm3) | 0,002* | 0,190 | 0,906 |
| Bicaudado ratio | 0,575 | 0,688 | 0,921 |
| Anchura del tercer ventrículo (mm) | 0,968 | 0,000* | 0,000* |
| Edad | 0,405 | 0,721 | 0,004* |
| Sexo | 0,618 | 0,115 | 0,448 |
| Años de escolaridad | 0,008* | 0,014* | 0,042* |
| EDSS | 0,333 | −0,207 | 0,199 |
| Tiempo de evolución | 0,488 | 0,333 | 0,689 |
EDSS: grado de discapacidad por la Expanded Disability Status Scale; FLAIR: Fluid-Attenuated Inversion Recovery; RM: resonancia magnética; VC: visuoconstructivas; VE: visuoespaciales; VL T1: volumen lesional en secuencia T1 de resonancia magnética.
El déficit en habilidades VE y VC se detecta en un 20-26%3,7,20 de los pacientes con EM. Este bajo porcentaje sorprende dada la extensa afectación de SB en áreas parieto-occipitales y témporo-occipitales en la RM de la mayoría de los pacientes, regiones involucradas en estas funciones21,22. Varias explicaciones se pueden esgrimir: que los test empleados en el estudio rutinario del déficit cognitivo en EM tienen baja sensibilidad para detectar alteración en estas funciones o, alternativamente, que se trata de funciones que requieren activación de poco volumen cerebral, o se suplen por las extensas conexiones de estas áreas. En este trabajo estudiamos estas funciones con test de uso no rutinario en la evaluación del DC de la EM, pero específicos y extensamente estandarizados y validados en el análisis de estas funciones en diferentes países. Tanto los test de CC y FI, el subtest del WAIS III como el test FRey son test reconocidos que analizan tareas complejas de percepción y organización visual, visuomotoras y VC. Aunque se trata de un estudio retrospectivo con las consiguientes debilidades (que comentaremos al final de este apartado), el interés del mismo radica en el análisis específico de estas funciones y su relación con las alteraciones estructurales de las áreas cerebrales involucradas en estas tareas, abordaje publicado anecdóticamente hasta ahora (búsqueda en MedLine)23,26,27.
En nuestro estudio observamos déficits en tareas VE y VC en un 21% de los pacientes. Posiblemente estemos infravalorando la verdadera prevalencia de estos déficits, porque se excluyen los pacientes con cualquier mínimo síntoma o signo de afectación visual o de motilidad ocular reseñado en la historia clínica, para evitar interferencia en la interpretación de los test. Vleugels et al. encuentran déficit en tareas VE en un 26% de 49 pacientes estudiados con una batería extensa y específica para estas habilidades20, la más alta frecuencia reseñada.
Nuestros pacientes de EM con déficit en estas habilidades tienen significativamente un EDSS mayor, más VL en SB de áreas parieto-témporo-occipitales y mayor atrofia subcortical que los pacientes de EM sin DC alguno.
La asociación entre el DC y el EDSS es descrita por muchos otros autores7,8,11,24, aunque es bien conocido que pacientes con poca disfunción motora pueden mostrar importante DC12,20 y que algunos dominios como la VPI pueden alterarse antes que la función motora6.
Observamos asociación inversa significativa entre el rendimiento en los 3 test (FI, CC y FRey) y todas las medidas de RM. El VL regional en FLAIR muestra una correlación más fuerte con todos los test que las medidas de VL en secuencias T1, manteniendo la significación independiente en el análisis multivariante con tareas VE, aunque con un efecto menor. No sorprende pese a que el VL en T1 es un mejor marcador de daño axonal, porque la secuencia FLAIR permite identificar mejor las lesiones y es más sensible para detectar las periventriculares y de la interfase sustancia gris-SB28,29. La correlación entre el VL en secuencias T2 y T1 y el DC en la literatura médica es modesta e inconsistente27,30,31. A diferencia de nuestros resultados, Lazeron et al.24 no encuentran asociación entre el procesamiento VE y el VL regional en una muestra de 32 pacientes estudiados con una batería extensa que incluye un único test de procesamiento VE. Los distintos resultados pueden explicarse, al menos en parte, por diferencias entre los pacientes (sus pacientes son mayores y tienen EDSS más altos) y los test utilizados (utilizan una tarea VE con una importante carga de memoria VE y no evalúan las habilidades VC). La modesta e inconsistente correlación del VL con el DC se explica en parte por problemas inherentes a la propia medida, se mide volumen, y se incluye en el volumen áreas de inflamación, edema y gliosis, enmascarando la verdadera atrofia de SB; además, se escapan a la medición las placas corticales, no detectadas en las secuencias habituales32 y los cambios estructurales en la SB de apariencia normal, con la consiguiente alteración de la conectividad con áreas corticales, demostrada en estudios de anisotropía31,33.
Aunque ambas medidas de atrofia cerebral, RBC y AIIIV, mantienen una fuerte correlación con el déficit en tareas VE y VC en 2 de los 3 test (CC p=0,004 y 0,001; FRey p=0,004 y 0,000), solo la AIIIV explica las variaciones en las tareas VC, con un efecto mayor e independiente del nivel educativo. Una estrecha asociación entre la atrofia subcortical y la disfunción cognitiva, empleando estas mismas medidas indirectas, ha sido observada por otros autores23,28,34,35, pero solo Benedict et al. evalúan memoria VE mediante el Brief Visuospatial Memory Test-Revised; las habilidades de VC no fueron contempladas23. El aumento del RBC guarda relación con la atrofia de SB frontal profunda y la AIIIV con el volumen del tálamo, estructura que establece conexiones con extensas áreas corticales, conectividad hipotéticamente necesaria en tareas más complejas como la VC, que implica funciones organizativas y práxicas más propias de áreas frontales. El tálamo parece señalarse como una de las regiones del cerebro con mayor frecuencia de atrofia en las fases iniciales de la EM, buena correlación con discapacidad física y cognitiva36,37 y buen marcador de mala evolución38. Finalmente, aunque ambas medidas (RBC y AIIIV) muestran importante variabilidad intra- e interobservador y dependencia del grosor del corte, han mostrado utilidad en la monitorización de la progresión de la atrofia cerebral comparadas con un método automatizado de volumen cerebral, el SIENAX, herramienta muy utilizada en EM25.
Nuestro estudio no está exento de limitaciones. Es retrospectivo con una muestra pequeña de pacientes. Para minimizar la variabilidad inevitable en la adquisición de las imágenes de RM, un único investigador ciego a los parámetros clínicos y neuropsicológicos ha realizado las medidas de VL y atrofia de todos los pacientes, y se ha preestablecido el área de estudio por unas coordenadas fijas. Todos los pacientes fueron evaluados por un mismo neuropsicólogo evitando sesgos en la administración de los test. Otra debilidad es el efecto del diferente nivel educativo entre los grupos de pacientes de EM con y sin DC, minimizado en el análisis de los datos controlando por este parámetro.
En conclusión, nuestro estudio investiga dominios cognitivos concretos, tareas VC y VE, y su relación con el VL de SB en áreas témporo-parieto-occipitales y con la atrofia cerebral subcortical. El VL en FLAIR y las medidas de atrofia subcortical muestran una fuerte correlación con el rendimiento cognitivo en estos dominios, con un efecto mayor de la atrofia subcortical estimada por la AIIIV, medida relacionada con la atrofia talámica, en tareas VC y del VL regional con tareas VE. Estos resultados invitan a ampliar el estudio en una muestra mayor utilizando medidas automatizadas de volumen cerebral.
Conflicto de interesesNingún conflicto de intereses a declarar.
Marta Cerezo Gracia ha recibido una beca para la realización de los test neuropsicológicos por parte de Merck Serono y BioGen.