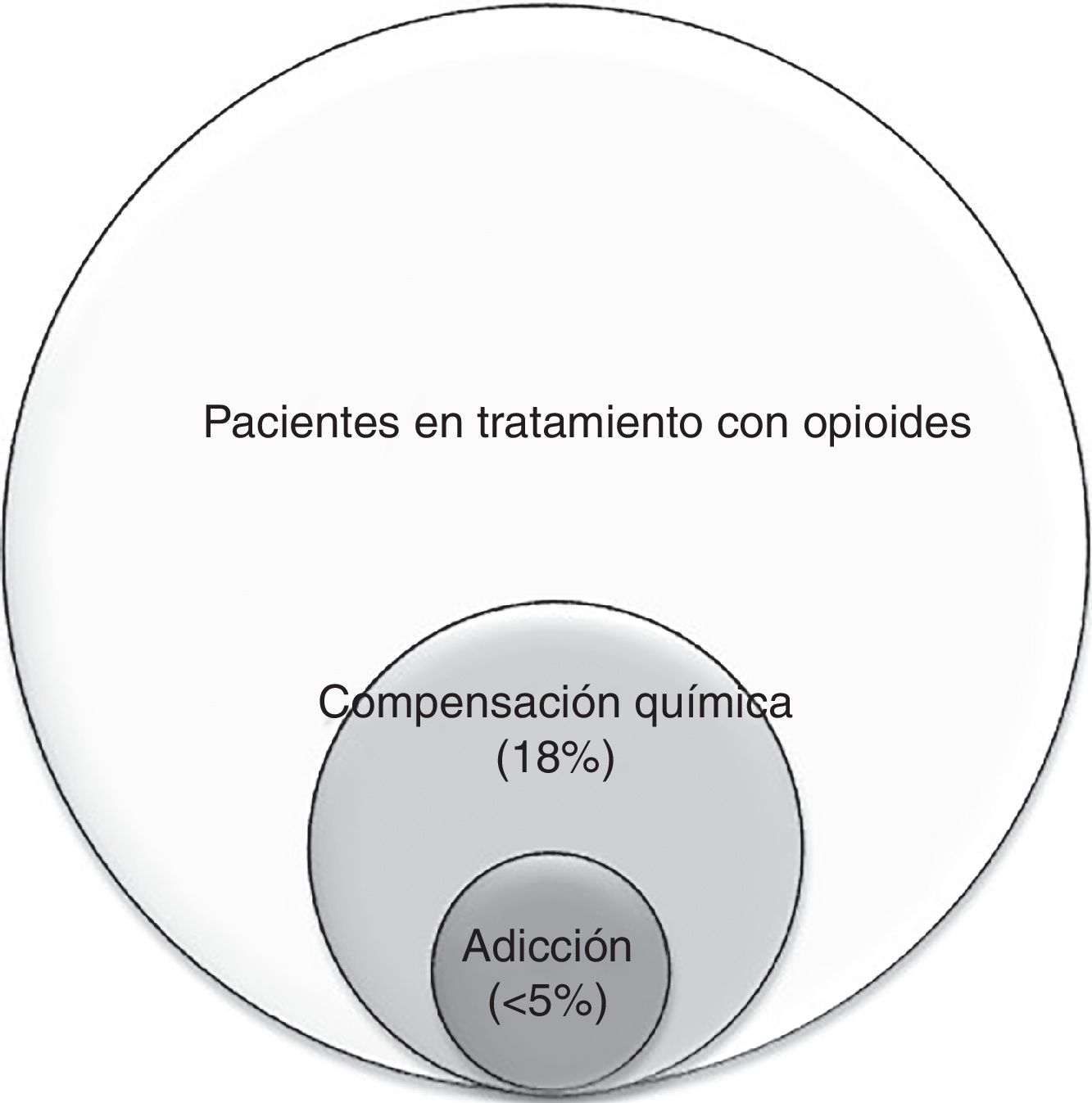
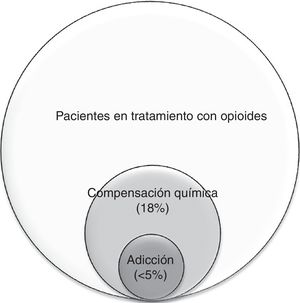
Uno de los objetivos actuales de los cuidados paliativos es la intervención en fases más precoces de la enfermedad. Esto supone atender a un mayor número de pacientes ambulatorios, con un pronóstico de vida más largo y potencialmente expuestos a opioides durante más tiempo, lo que aumenta el riesgo de su mal uso. La mayoría de los datos sobre compensación química y adicción provienen de EE. UU. y de pacientes con dolor crónico no oncológico. Se ha estimado una frecuencia de compensación química del 18% y de adicción a opioides <5% en cáncer avanzado. Pasar por alto estos diagnósticos supone un mayor riesgo de efectos secundarios de los opioides y complica el manejo del dolor. Se recomienda el despistaje de riesgo de mal uso de opioides en todos los pacientes que vayan a ser expuestos, y un seguimiento más o menos estrecho según el riesgo detectado, con especial atención a la aparición de conductas aberrantes. En los pacientes que presentan compensación química y adicción es aún más relevante el manejo integral del «dolor total», entendiendo que el origen principal es la angustia emocional o espiritual, y no la nocicepción.
One of the current goals in palliative care is intervention in the earlier disease phases. This involves caring for more patients as outpatients, with longer survival, and more prolonged exposure to opioids, which increases the risk of opioid misuse. Most of the data on chemical coping and addiction come from the U.S., and from studies on chronic pain patients. The frequency of chemical coping in cancer patients has been estimated at around 18%, whereas the frequency of addiction is less than 5% in the same patients. Disregarding these diagnoses may increase opioids’ side effects and make pain management more difficult. Risk assessment of opioid misuse is recommended in all patients who are given opioids, with especial attention to aberrant behaviours. Multidisciplinary management of «total pain» is particularly important in chemical coping and addiction, understanding that the main cause of pain would be emotional and spiritual distress rather than nociception.
El dolor es uno de los síntomas más frecuentes en el cáncer, presente hasta en el 75% de los pacientes1. La prevalencia del dolor crónico no oncológico es también elevada, y se estima que se da entre el 19 y el 30% de la población2,3. Es una experiencia compleja, modulada por las múltiples dimensiones del ser humano (fisiológica, sensorial, afectiva, cognitiva, comportamental y socio-cultural)4, que va a precisar de un abordaje diagnóstico-terapéutico multimodal y personalizado5.
La OMS considera que el consumo médico de opioides de un país es un buen predictor de cómo se trata el dolor6. Los opioides son considerados el tratamiento farmacológico de elección para el dolor oncológico moderado-severo7, pero su uso sigue siendo controvertido en el dolor crónico no oncológico, por la evidencia más limitada en cuanto a eficacia y potenciales efectos adversos secundarios a largo plazo8-11.
En los últimos años el consumo de opioides ha aumentado significativamente, sobre todo en EE. UU. y Europa12,13. Entre 1992 y 2006 en España se multiplicó por 12 el consumo de opioides mayores. Dicho incremento fue debido probablemente a la mayor sensibilidad de los profesionales respecto al dolor, a la eliminación de trabas administrativas para la prescripción de opioides, a la aparición en el mercado de nuevos fármacos y al aumento de los recursos de cuidados paliativos14.
Estos datos han provocado la preocupación sobre el posible abuso y mal uso de los opioides en el ámbito de los cuidados paliativos, y se ha reflejado en un aumento del interés en la literatura en los últimos años15-30. Desde el movimiento Hospice creado por Cicely Saunders en los años 60 hasta ahora el concepto de los cuidados paliativos ha evolucionado. Aunque aún lejos, el objetivo actual es iniciar la atención integral y multidisciplinar en fases más precoces de la enfermedad, tanto oncológica como no oncológica31, de forma concomitante a otros tratamientos activos32. Esto supone atender a un mayor número de pacientes ambulatorios, con un pronóstico de vida más largo, y con unas características diferentes a las del pasado33, entre ellas, la exposición prolongada a opioides y el riesgo incrementado de mal uso de estos.
El objetivo de esta revisión es actualizar la información sobre la compensación química y los comportamientos adictivos con relación a los opioides, así como proponer pautas para el diagnóstico y manejo en nuestros pacientes.
Definición y conceptos clínicosLas conductas aberrantes relacionadas con opioides se definen como el uso de forma diferente a la prescrita34. La presencia de conductas aberrantes indica compensación química, adicción u otras condiciones relacionadas con los opioides, como pseudoadicción, dependencia, tolerancia, hiperalgesia o intención criminal19: pueden solaparse varias en un mismo paciente15,35 y complicar el manejo del dolor35. González et al.24 resumieron perfectamente en su artículo estas condiciones, las cuales recordamos a continuación para facilitar al lector la comprensión sobre el mal uso de los opioides.
Compensación química: El término chemical coping (traducido en español como «compensación química» o «afrontamiento químico») fue acuñado por primera vez en 1995, con relación a la prevalencia de alcoholismo en pacientes con cáncer terminal36. Recientemente ha sido definido por un consenso de expertos como «el uso de opioides para afrontar el estrés emocional, caracterizado por el uso inapropiado o excesivo»25. Las personas que presentan compensación química suelen tener escasos mecanismos de afrontamiento37 por lo que harán un abuso de opioides en momentos de mayor angustia, independientemente del estímulo nociceptivo19. La escalada de dosis de opioide no solo no mejora la conducta, sino que también aumenta el riesgo de sobredosis, neurotoxicidad y adicción a opioides19,20.
Adicción: La adicción es una enfermedad neurobiológica primaria, crónica y recidivante38. Su etiología es compleja, con factores genéticos, psicosociales y ambientales que influyen en su desarrollo y manifestaciones. Se caracteriza por comportamientos que incluyen uno o más de los siguientes: pérdida de control sobre el uso del fármaco, uso compulsivo, uso continuado a pesar del daño y necesidad compulsiva (craving)39,40. Los pacientes predispuestos genéticamente41 y con comorbilidad psicosocial tendrán mayor riesgo de desarrollar adicción a opioides, sobre todo si el tratamiento no está estructurado y monitorizado cuidadosamente42,43.
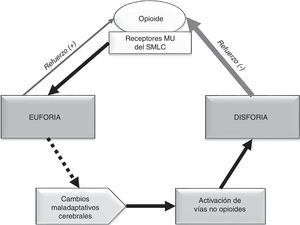
Relación entre la compensación química y la adicción: La compensación química se presenta como un espectro: en su forma más leve se puede observar el uso ocasional del opioide para afrontar el sufrimiento emocional, pero sin presentar la necesidad compulsiva, los trastornos conductuales ni el deterioro funcional que caracteriza a la adicción; en su forma más grave, la compensación química se llega a convertir en adicción: cuando la falta de opioides ocasiona una angustia emocional o disforia tal que lleva a conductas aberrantes más graves20,26. Por ello, es de suma importancia la sensibilización y detección precoz de estos comportamientos. En la figura 1 se muestra la relación entre la compensación química26 y la adicción44. Como expresa Kirsh «todos los adictos son compensadores químicos, pero no todos los compensadores químicos son adictos»45.
Pseudoadicción: Es un síndrome iatrogénico en el que el paciente presenta conductas aberrantes similares a la adicción, pero con la finalidad de conseguir un buen control analgésico, y que es secundario a un manejo inadecuado del dolor46. A diferencia del compensador químico, el paciente con pseudoadicción normalizará su conducta al ajustar la dosis opioide o aplicar otras medidas analgésicas19. No obstante, este concepto se describió con base en un único caso y se ha llegado a poner en duda su existencia47.
Dependencia física: Es un estado de adaptación en el que el cese brusco del opioide (interrupción, reducción brusca o administración del antagonista) produce un síndrome de abstinencia con signos y síntomas físicos característicos39,40.
Tolerancia: La tolerancia es un estado de adaptación por el que la exposición continua al opioide resulta en una disminución del efecto analgésico, que precisa dosis cada vez mayores para mantenerlo39,40.
Hiperalgesia inducida por opioides: Es un estado de aumento de la sensibilización nociceptiva en el contexto de consumo de opioides, secundaria a la liberación de aminoácidos excitatorios. Clínicamente es difícil diferenciarla de la tolerancia48.
Evidencia de compensación química y adicción en la literaturaLa mayoría de la literatura al respecto proviene de EE. UU., donde la prescripción de opiáceos ha aumentado exponencialmente en los últimos años49 y algunos autores hablan de «epidemia de opioides»50. Los datos reportados son preocupantes: durante el año 2013, 1,9 millones de personas tuvieron problemas de adicción a opioides y desde 1999 hastaa 2014 más de 165.000 personas murieron por sobredosis de estos fármacos49.
Si bien los datos del Pain & Policy Studies Group51 indican que el consumo de opioides en España está muy por debajo del de EE. UU., varios estudios han reportado un incremento proporcional en la prescripción de opioides durante las últimas décadas en nuestro país14,52,53. No hemos encontrado datos de compensación química y adicción a medicación opioide en España. Cierto es que el contexto sociocultural y sanitario es diferente en los 2países54, pero el sustrato neurobiológico de la adicción es común en ambas poblaciones.
Esta revisión no pone en duda los beneficios de la terapia opioide, ni resta valor a los logros conseguidos en facilitar la prescripción de dichos fármacos en nuestro país, ni al esfuerzo en sensibilizar a los profesionales respecto al dolor, sino que pretende promover un manejo impecable de los opioides en nuestros pacientes.
La mayor parte de los estudios sobre mal uso de opioides se han llevado a cabo en dolor crónico no oncológico. Los datos reportados en estos pacientes son muy heterogéneos por las diferencias en cuanto al tipo de pacientes, tipo de opioides y rutas de administración, objetivos primarios de los estudios e inexactitud de los términos55. La frecuencia de abuso de opioides se ha estimado en un amplio rango entre el 5 y el 41%34,55,56.
Se han realizado pocos estudios originales sobre el mal uso de opioides en pacientes con cáncer avanzado. Tradicionalmente la adicción se había considerado una rareza en estos pacientes57 aunque, como veremos más adelante, los factores de riesgo son los mismos que en la población general. Una revisión sistemática de la bibliografía reporta una frecuencia de adicción entre el 0 y el 7,7% en pacientes oncológicos55. En el trabajo de Kwon et al.26, realizado por un equipo de cuidados paliativos en 432 pacientes ambulatorios con cáncer avanzado, se estimó una prevalencia de compensación química del 18%.
Mecanismos fisiopatológicos de la adicciónLa adicción se considera una alteración crónica en la estructura y función cerebral58,59. El substrato neurobiológico es muy complejo. Una de las teorías más aceptadas es la de la espiral de desregulación del sistema de recompensa cerebral60,61.
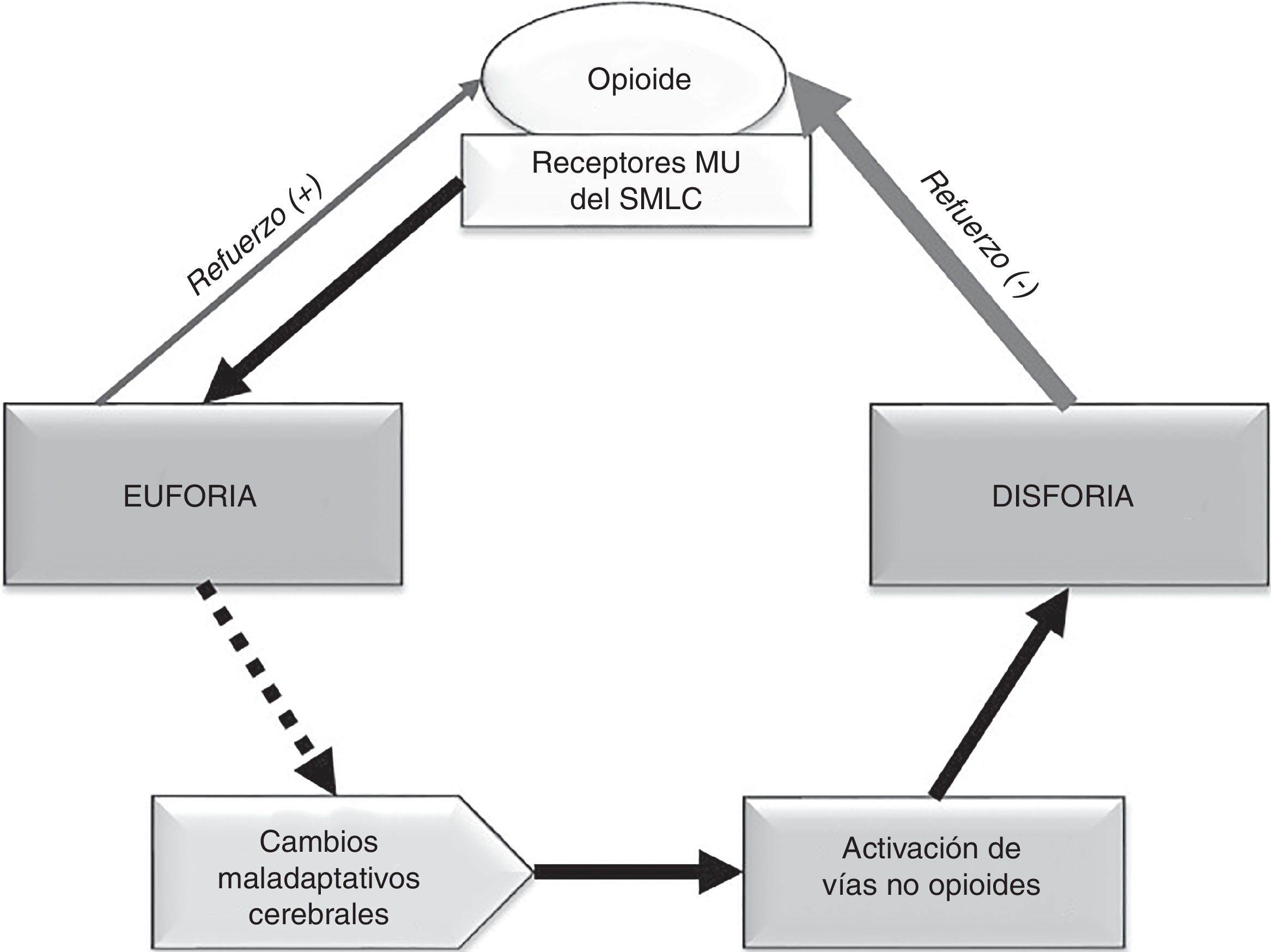
El «centro de la recompensa» está localizado en las vías dopaminérgicas del sistema mesocorticolímbico (SMCL) cerebral62, que se origina en el área tegmental ventral y se proyecta hacia el núcleo accumbens, la amígdala y el córtex prefrontal63,64. Una de las funciones del SMCL es aprender, recordar, conseguir y reaccionar a las recompensas del medio que son necesarias para la supervivencia65,66. Los opioides producen una liberación de dopamina en mayor cuantía y duración que los estímulos naturales, a través de la unión a receptores MU del SMCL67. Esta liberación de dopamina produce euforia y sensación de bienestar42,67, que actúan como refuerzo positivo y alteran la homeostasis cerebral.
Durante la abstinencia aguda a opioides se produce un descenso marcado de la actividad dopaminérgica en el núcleo accumbens68,69. Por otro lado, el consumo continuado de opioides origina en el individuo susceptible una respuesta neuroadaptativa en oposición al efecto euforizante68,70: la activación del eje hipotálamo-hipófisis-adrenal y de la amígdala cerebral. Esta activación conlleva un incremento de hormonas y péptidos de estrés63,71,72, entre los que destaca el papel del factor liberador de corticotropina73 y la dinorfina74. Todos estos fenómenos van a mediar en la aparición de disforia, depresión, irritabilidad y ansiedad típicas del síndrome de abstinencia al opioide. Dichas emociones negativas actúan como refuerzo negativo y producen la necesidad compulsiva del opioide para paliarlas, más allá de la fase aguda67. Existen también otros sistemas de transmisión implicados en los circuitos de recompensa como GABA, glutamato, serotonina y cannabinoides, entre otros68,70,75.
Los fenómenos adictivos están, por tanto, relacionados con la euforia producida por el opioide (inicio y establecimiento de la adicción) y, en mayor medida, con la necesidad que se genera en el adicto para aliviar la disforia durante la abstinencia (mantenimiento y recaída)63,67. Con el tiempo, el efecto placentero del opioide disminuye y la necesidad compulsiva aumenta, lo que lleva a la búsqueda de más dosis60,70. Estos cambios maladaptativos cerebrales a nivel molecular y celular58 conducen a la consolidación del proceso adictivo y contribuyen a la recaída después de un tiempo prolongado de abstinencia66,76. En la figura 2 se presenta un esquema para facilitar la compresión.
Factores de riesgo y herramientas de despistajeAnte un paciente con dolor, el primer paso es siempre una anamnesis impecable seguida de una valoración de pruebas complementarias para dilucidar el mecanismo fisiopatológico de base y, con esto, el tratamiento analgésico más específico posible. Los equipos de cuidados paliativos atendemos cada vez más a pacientes con enfermedades no oncológicas, en los que el tratamiento opioide para el dolor es más discutido49. Por otra parte, es importante recordar que no todo dolor relacionado con el cáncer es indicación de tratamiento opioide de primera elección77, y que los pacientes con cáncer también pueden presentar dolor secundario a comorbilidades (dolor osteomuscular mecánico, neuropatía diabética, vasculopatía periférica…)78.
Una vez confirmada la indicación de la terapia opioide, los pacientes precisan una valoración sobre el riesgo de abuso y mal uso16. Para ello, será necesaria la revisión de la historia clínica, una extensa anamnesis y el buen juicio e intuición médica, además de las herramientas de despistaje79. La intención no es privar a los pacientes de alto riesgo del uso de opioides, sino optimizar su seguimiento y manejo16. En la tabla 1 se recogen los factores de riesgo descritos en la bibliografía.
Factores de riesgo relacionados con la compensación química y la adicción a opioides17,22,25-27,79,80
| • CAGE+ |
| • Historia personal y familiar de consumo de drogas |
| • Alcoholismo y tabaquismo |
| • Edad joven |
| • Peores puntuaciones en escala ESAS (mayor expresión de síntomas) |
| • Mejor estado funcional |
| • Mayor dosis equivalente de morfina (DEM) diaria |
| • Comorbilidad psiquiátrica o psicológica (depresión y ansiedad) |
| • Antecedentes de abuso sexual |
Existen numerosas herramientas de despistaje de riesgo de mal uso de opioides validadas para dolor crónico no oncológico. Lo ideal para nuestros pacientes es que sean escalas breves y fáciles de administrar. Las más usadas en el ámbito de los cuidados paliativos son CAGE/CAGE-AID, SOAPP/SOAPP-SF y ORT, sin que ninguna de ellas pueda recomendarse como gold standard20,29. Según nuestro conocimiento, solo la escala CAGE está validada en español81.
CAGEEl cuestionario CAGE (acrónimo de Cut down, Annoyed, Guilty, Eye-opener) se creó para detectar problemas relacionados con el alcohol. Sin una herramienta específica, el alcoholismo es frecuentemente infradiagnosticado36,82. El CAGE-AID (Adapted to Include Drugs) (tabla 2) se ha desarrollado para incluir otras drogas además del alcohol83. Se considera positivo cuando al menos 2 respuestas son afirmativas (consumo de riesgo), con una S> 90% y una E> 95% para detectar alcoholismo84. Los estudios muestran una amplia variabilidad en la prevalencia de CAGE + en pacientes con cáncer, desde un 4% hasta un 64%85,86. Estas diferencias pueden ser debidas a la heterogeneidad en cuanto al tipo de tumor, el estadio tumoral y los factores demográficos29.
Cuestionario CAGE-AID81
| • ¿Ha pensado alguna vez en reducir o dejar el alcohol o las drogas? |
| • ¿Le ha molestado alguna vez que alguien le criticara por su forma de beber o de consumir drogas? |
| • ¿Se ha sentido alguna vez mal o culpable por su manera de beber alcohol o de consumir drogas? |
| • ¿Alguna vez ha tenido que beber o consumir drogas a primera hora de la mañana para calmar los nervios o mejorar las molestias de la resaca? |
El alcoholismo está estrechamente vinculado a la adicción a otras sustancias, incluyendo el tabaco, fármacos (benzodiacepinas, opioides, estimulantes) y drogas ilícitas87, por lo que se ha utilizado para valorar el riesgo de compensación química en pacientes con cáncer avanzado. El estudio realizado por Kwon et al.26, con 432 pacientes con cáncer avanzado, señaló que casi uno de cada 5 pacientes eran compensadores químicos, con una relación estadísticamente significativa con CAGE+, edad joven, peor puntuación en dolor y bienestar en la escala ESAS y mejor situación funcional. En otro estudio del mismo equipo88 con pacientes con cáncer de cabeza y cuello, se relaciona el CAGE+con el mantenimiento del tratamiento opioide 3 meses después de finalizar la radioterapia. En el estudio de Reddy et al.89, el CAGE+estaba relacionado con mal uso de opioides, antecedentes de abuso de drogas, tabaquismo, expresión de síntomas aumentada y dosis elevadas de morfina (o equivalente). En el estudio de Parsons, el CAGE+se relacionaba también con el sexo masculino90.
SOAPPEl cuestionario SOAPP (Screening and Opioid Assessment for Patients with Pain) está destinado a diagnosticar conductas aberrantes relacionadas con opioides. Consta de 14 preguntas, con una puntuación entre 0 (nunca) y 4 (muy frecuentemente)29. Existe una forma abreviada de 5 preguntas (SOAPP-SF) que se ha usado en pacientes con cáncer, en la que una puntuación> 4 puntos se considera positivo, es decir, alto riesgo de mal uso de opioides (S: 86%, E: 67%)17.
Encontramos 2estudios realizados en consultas de cuidados paliativos que utilizaron el SOAPP-SF: En el estudio de Koyyalagunta17 el 29% de 522 pacientes oncológicos tuvieron un resultado positivo. Estos pacientes tenían mayor intensidad de dolor, tomaban una mayor dosis equivalente de morfina diaria, eran más jóvenes y tenían una mayor puntuación de síntomas en la escala ESAS. Childers27 realizó el estudio en una consulta de paliativos, con pacientes con diferentes enfermedades, en el que el 46% de 57 pacientes fueron de alto riesgo según el cuestionario SOAPP-SF, relacionado con la edad joven.
ORTLa herramienta ORT (Opioid Risk Tool) es un cuestionario breve de 5 preguntas, con respuesta sí/no, creado para predecir conductas aberrantes en los pacientes en tratamiento opioide. Divide a los pacientes en 3 grupos de riesgo basados en varios factores de riesgo: la edad (mayor riesgo entre 16 y 45 años), la historia personal y familiar de abuso de sustancias, comorbilidad psicológica y antecedentes de abuso sexual91. Estudios publicados recientemente por equipos de cuidados paliativos, en pacientes en su mayoría oncológicos, señalan una frecuencia de alto riesgo entre el 21 y el 25%18,22. La herramienta ha demostrado también que los pacientes de alto riesgo presentan más conductas aberrantes, y de forma más precoz91.
Manejo y seguimientoLas «precauciones universales» recomendadas en las guías americanas de dolor crónico92 incluyen el uso rutinario de las herramientas de despistaje de riesgo ya comentadas y la entrega de material informativo a todos los pacientes que van a iniciar tratamiento opioide. Esta información incluye efectos secundarios y riesgo de sobredosis, la importancia de la adherencia terapéutica e información sobre los riesgos del mal uso y abuso de opioides, riesgos de compartir medicación opioide, recomendaciones sobre la forma segura tanto de guardar los opioides en el domicilio como de deshacerse de los no usados y responsabilidades del clínico y el paciente en cuanto al manejo del dolor y los opioides. Según los datos del estudio de Reddy89 realizado en una consulta de cuidados paliativos, el 19% de los pacientes tenía su medicación opioide en un sitio a la vista en su domicilio, el 46% de los pacientes guardaba medicación opioide remanente y el 75% no sabía cómo deshacerse de ella. El 40% no era consciente de que el uso de opioides por otra persona podía llegar a tener consecuencias fatales. El mismo equipo realizó otro estudio tras la implementación de un programa educativo93 en el que se evidencia la mejoría de los resultados tras la entrega de información por escrito.
Una vez que se ha iniciado la terapia opioide es imprescindible hacer un seguimiento continuado en todos los pacientes. Según el riesgo de mal uso detectado, este seguimiento será más o menos estrecho16,94. En los pacientes en los que se ha detectado un alto riesgo de mal uso de opioides, se recomienda aumentar la frecuencia de las visitas y llamadas telefónicas, así como la elaboración por parte del paciente de un diario de medicación opioide y su revisión en cada visita95,96.
Es importante recordar que todos los pacientes bajo tratamiento opioide pueden llegar a desarrollar compensación química e incluso adicción, por lo que el clínico debe estar familiarizado con las conductas aberrantes. Las conductas aberrantes no son un diagnóstico en sí, sino que nos harán sospechar un mal uso de los opioides: desde la compensación química hasta la adicción, o el negocio con opioides. Pasar por alto el mal uso de los opioides implica perpetuar el sufrimiento del paciente, complica el manejo del dolor y otros síntomas, aumenta el riesgo de efectos secundarios y agrava la tensión en la relación del paciente y sus cuidadores97. Recogemos en una sola lista (tabla 3) el resumen de las conductas aberrantes publicadas por diferentes autores. Por otro lado, cabe recordar que existen otras causas que pueden originar conductas aberrantes sin estar relacionadas con los mecanismos de la adicción35,100,101 como la pseudoadicción, la dependencia física, la tolerancia, la hiperalgesia (comentadas anteriormente), los errores de compresión en la posología…
Conductas aberrantes relacionadas con la compensación química y la adicción a opioides15,16,35,80,98,99
| • Uso del opioide para tratar otros síntomas (ansiedad, insomnio, angustia…) |
| • Uso del opioide para inducirse somnolencia o euforia |
| • Escaladas de dosis no autorizadas y mala adherencia a pesar de indicaciones |
| • Resistencia a la rotación de opioides |
| • Solicitud de fármacos opioides concretos |
| • Solicitud de renovación de las recetas antes del tiempo previsto |
| • Empleo abusivo de opioides según la opinión de los cuidadores |
| • Preocupación de los familiares ante las conductas |
| • Deterioro funcional en el ámbito laboral, familiar o social que parece relacionado con el uso del fármaco |
| • Uso concomitante de fármacos no prescritos o de drogas ilícitas |
| • Obtención del opioide con recetas de diferentes fuentes médicas |
| • Acaparamiento de cantidades excesivas del fármaco opioide durante periodos de ausencia de síntomas |
| • Episodio de sobredosis opioide |
| • Falta de adherencia al seguimiento clínico (no acudir a citas médicas, acudir fuera de cita…) |
| • Solicitud de nueva medicación refiriendo pérdida o robo |
| • Quejas agresivas ante la negativa de nueva prescripción |
| • Obtención de prescripción del fármaco de fuente no médica |
| • Falsificación de recetas |
| • Robo o utilización del fármaco de otro paciente |
| • Inyección de fórmulas orales |
| • Venta del opioide prescrito |
Los pacientes que presenten conductas aberrantes con sospecha de compensación química o adicción precisaran un manejo específico. No hay guías concretas para la prescripción segura de opioides en oncología y cuidados paliativos, sino que muchas de las recomendaciones propuestas se adaptan de las guías sobre dolor no oncológico49,102. González et al.24 resumieron en su artículo las estrategias terapéuticas propuestas por varios autores15,103-105 para estos pacientes.
Como resalta Calvo Espinós30, el abordaje integral y multidisciplinar106 es especialmente relevante en los pacientes que presentan compensación química: valorar la dimensión emocional, espiritual y social (origen del distrés en estos pacientes) y facilitarles otras estrategias de afrontamiento diferentes al uso de opioides. Se recomienda contemplar tanto el uso de medidas no farmacológicas para tratar el dolor (psicoterapia y counselling, técnicas de relajación y meditación…) como el empleo de analgésicos no opioides, coadyuvantes y técnicas intervencionistas. Dado que los pacientes que presentan compensación química tienden a la sobreexpresión de los síntomas17 y a la somatización37, es necesario prestar atención a la situación funcional19 y a la actividad psicosocial para valorar el control analgésico, y no solo al nivel de dolor expresado por el paciente20.
En los casos más graves en los que exista adicción será necesario confrontar abiertamente el problema con el paciente sin dejar de lado el abordaje desde la empatía y el no juicio, poner límites a la prescripción de opioides28, evitar dentro de lo posible los de acción corta107 y los fentanilos ultrarrápidos15,21,35 así como contemplar la intervención de un equipo especialista en abuso de sustancias20,107,108.
Las guías americanas recomiendan la detección de tóxicos en orina rutinaria en pacientes con dolor crónico tratados con opioides49. Aporta información objetiva sobre la adherencia terapéutica y posible abuso de otras sustancias: un resultado negativo para opioides indica que el paciente no está cumpliendo el tratamiento (y puede estar vendiéndolo o dándolo a otros); la presencia de otras drogas ilícitas o benzodiacepinas no prescritas implica un potencial peligro para el paciente20. No es una práctica habitual en cuidados paliativos y hay pocos trabajos realizados sobre la detección de tóxicos en orina en nuestro ámbito. Sin embargo, los estudios publicados muestran un llamativo porcentaje de resultados anormales: en el estudio de Rahuenzahn109 el 73% de 80 pacientes tuvieron un resultado alterado (el 36% con resultado negativo y el 59% con resultados positivos para sustancias no prescritas); en el estudio de Arthur28 el resultado fue anormal en el 53% de 61 pacientes (el 27% resultado negativo, el 25% positivo para fármacos no prescritos y el 48% positivo para drogas ilícitas); Childers27 reporta un 56% de resultados anormales. Varios autores señalan que debería realizarse en pacientes con cáncer avanzado y sospecha de mal uso de opioides, aunque su indicación, coste-efectividad e interpretación son problemas que precisan más estudios28,29.
Finalmente, no debemos olvidar que el registro en la historia clínica de todo el proceso (riesgo inicial, seguimiento, evidencia de conductas aberrantes y plan terapéutico) es fundamental y, en ocasiones, se pasa por alto26.
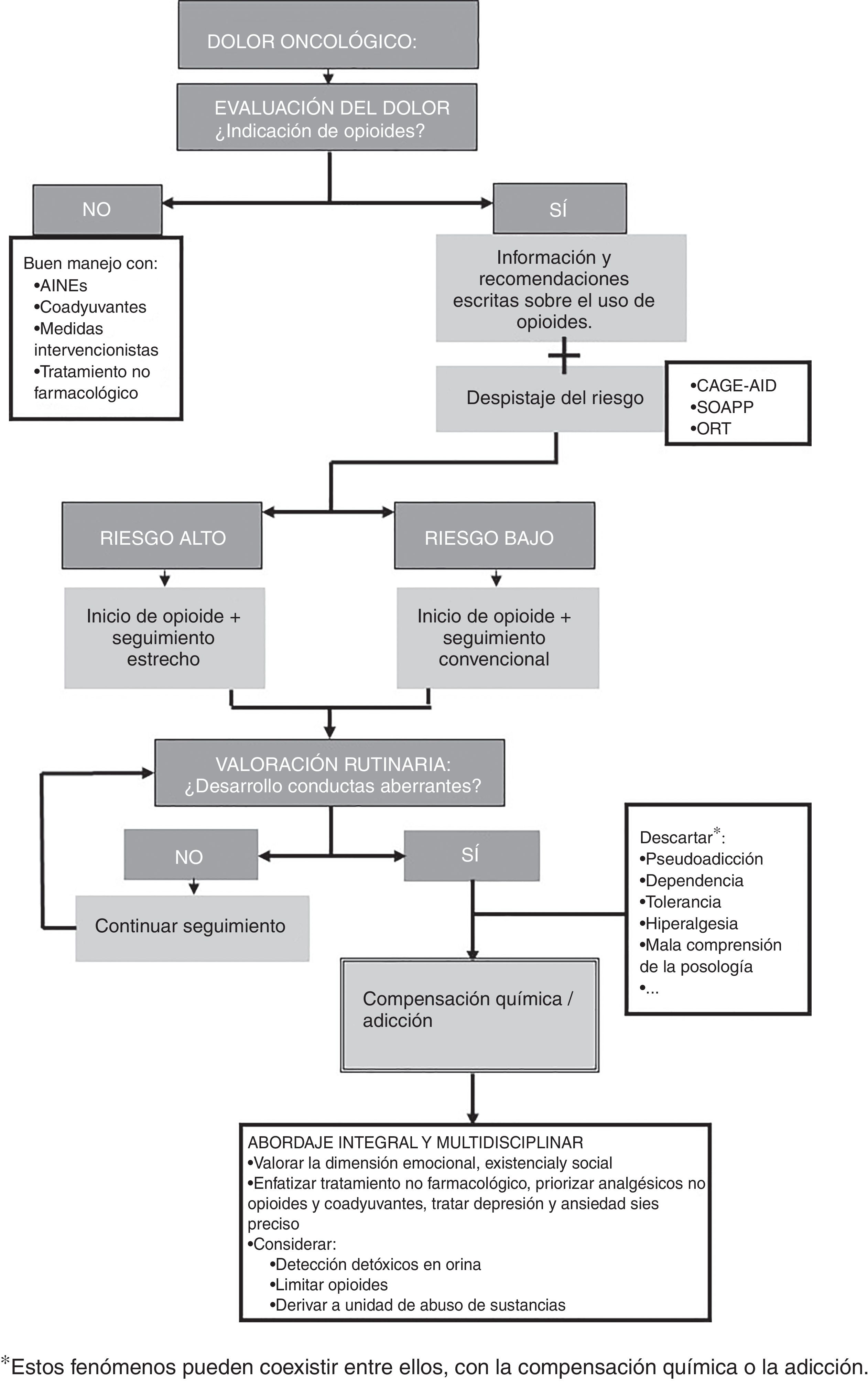
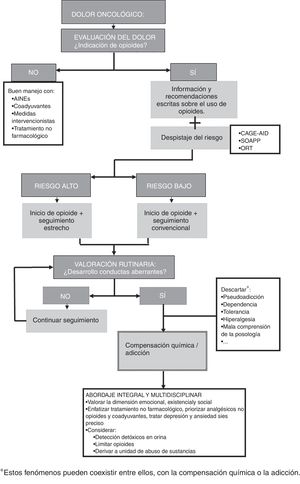
A continuación proponemos un algoritmo que resume las medidas diagnóstico-terapéuticas recomendadas (fig. 3).
ConclusionesLos equipos de cuidados paliativos atendemos cada vez a un mayor número de pacientes ambulatorios, con un pronóstico de vida más largo y un mayor tiempo de exposición a opiáceos. Todos los pacientes bajo tratamiento opioide tienen un riesgo potencial de presentar compensación química y desarrollo de adicción. Existen varias herramientas de despistaje, de aplicación simple, útiles para detectar el riesgo potencial de mal uso de opioides en nuestros pacientes. Se recomienda que aquellos que presenten mayor riesgo reciban un seguimiento más estrecho, pero que el despistaje de conductas aberrantes sea rutinario en todos los pacientes bajo tratamiento opioide en nuestra práctica diaria.
La compensación química y la adicción en pacientes con enfermedades avanzadas son un problema complejo, con connotaciones éticas, que precisa la derivación precoz a un equipo de cuidados paliativos. El abordaje integral y multidisciplinar, valorando las múltiples dimensiones de la persona, es aún más relevante en estos pacientes.
Hay escasos datos procedentes de España y del resto de Europa sobre la frecuencia de la compensación química y la adicción a opioides en el contexto de los cuidados paliativos, por lo que es necesario realizar estudios para valorar la relevancia del problema en nuestro entorno y mejorar su manejo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.