La esclerosis múltiple (EM) es una de las principales enfermedades desmielinizantes del sistema nervioso central. Importante impacto económico social. Etiología no clara, se barajan hipótesis como la infecciosa o factores genéticos. La fisiopatología parece una activación inmunitaria que atacaría a las vainas de mielina, causando degeneración axonal progresiva e irreversible.
Los síntomas son muy variados, su diagnóstico exige el cumplimiento de una serie de criterios y exclusión de otras causas posibles. Además es importante el papel de la neuroimagen, principalmente la RM.
A pesar de disponer de fármacos modificadores de la enfermedad, todavía no hay ninguno que frene su evolución, fármacos útiles son los orientados a paliar la sintomatología de brotes.
En conjunto, la EM requiere importante esfuerzo de investigación que aclare no solo por qué y cómo se produce, sino también el desarrollo de nuevas medidas que mejoren la vida de los pacientes afectados.
Multiple sclerosis is a major demyelinating disease of the central nervous system. It has a significant economic and social impact. Its etiology is unclear, although there are several hypotheses, such as infections or genetics. In its pathophysiology, it seems that immune activation attacks the myelin sheath, causing a progressive and irreversible axonal degeneration.
The disease produces a variety of symptoms, and diagnosis requires fulfilling a number of criteria and the exclusion of other possible causes. The role of neuroimaging is very important, especially Magnetic Resonance Imaging.
Despite the availability of disease-modifying drugs, none of them are able to halt its progress, and the most useful drugs are those designed to alleviate the symptoms of outbreaks.
Overall, multiple sclerosis requires a significant effort in research to clarify not only why and how it occurs, as well as the development of new measures to improve quality of life of affected patients.
El diagnóstico de esclerosis múltiple (EM) se basa fundamentalmente en la clínica. Pero antes se deben excluir todas las causas posibles y es necesario que se cumplan unos criterios de dispersión tanto espacial, es decir, lesiones en diferentes lugares, como temporal, esto es, lesiones en diferentes estadios.
Los avances en las técnicas de imagen, sobre todo la resonancia magnética (RM), y otras exploraciones complementarias, como los potenciales evocados (PE), han permitido crear criterios adicionales que apoyen a la clínica, llegando al diagnóstico de una forma más rápida y segura.
Criterios diagnósticos1Los criterios clínicos más utilizados son los criterios diagnósticos de McDonald (tabla 1). En estos criterios se define un brote como un episodio de alteraciones neurológicas sugestivas de la EM que dura más de 24h. Estas lesiones se pueden objetivar mediante la realización de una exploración neurológica.
Enfermedades que pueden mostrar síntomas semejantes a los de la esclerosis múltiple
| Tipo de enfermedades | |
|---|---|
| Genéticas | Malformación cerebrovascular, vasculopatía cerebrovascular hereditaria, paraparesia espástica hereditaria, degeneración espinocerebelosa, enfermedad por depósitos lisosomales, enfermedad mitocondrial, deficiencia nutricional, academia orgánica, enfermedad de los peroxisomas, enfermedad de Wilson |
| Infecciosas | Infecciones por virus, incluyendo polio, rubéola, VIH y herpes.Infecciones bacterianas, incluyendo las producidas por Brucella y espiroquetas |
| Inflamatorias | Enfermedad de Behçet, enfermedad colágeno-vascular, miastenia gravis, sarcoidosis del sistema nervioso |
| Metabólicas | Deficiencia de vitamina B12, deficiencia de ácido fólico, deficiencia de vitamina E |
| Neoplásicas | Linfoma intravascular, cáncer metastásico, síndrome paraneoplásico, tumor cerebral primario |
| Estructurales | Quiste aracnoideo, aracnoiditis, malformación de Arnold-Chiari, espondilosis o hernia de disco, malformación vascular, siringomielia |
| Vasculares | Síndrome antifosfolípido, CADASIL, enfermedad de Eales, enfermedad cerebrovascular, vasculopatía retrococlear de Susa, migraña, vasculitis |
| Intoxicaciones | Óxido nitroso, mielinólisis pontina central, leucoencefalopatía posquimioterapia, neuropatía por radiación, toxicidad por clioquinol con mielopatía subaguda y neuritis óptica, tricloroetileno |
| Miscelánea | Síndrome de fatiga crónica, leucoencefalopatía con desvanecimiento de materia blanca, neuritis sensitiva migratoria, neuroretinitis, neuropatía periférica, desorden de los plexos braquial o lumbosacro, histiocitosis sistémica |
Fuente: Criterios diagnósticos de McDonald et al.1.
Para definir un segundo brote tiene que pasar un mes o más desde el anterior.
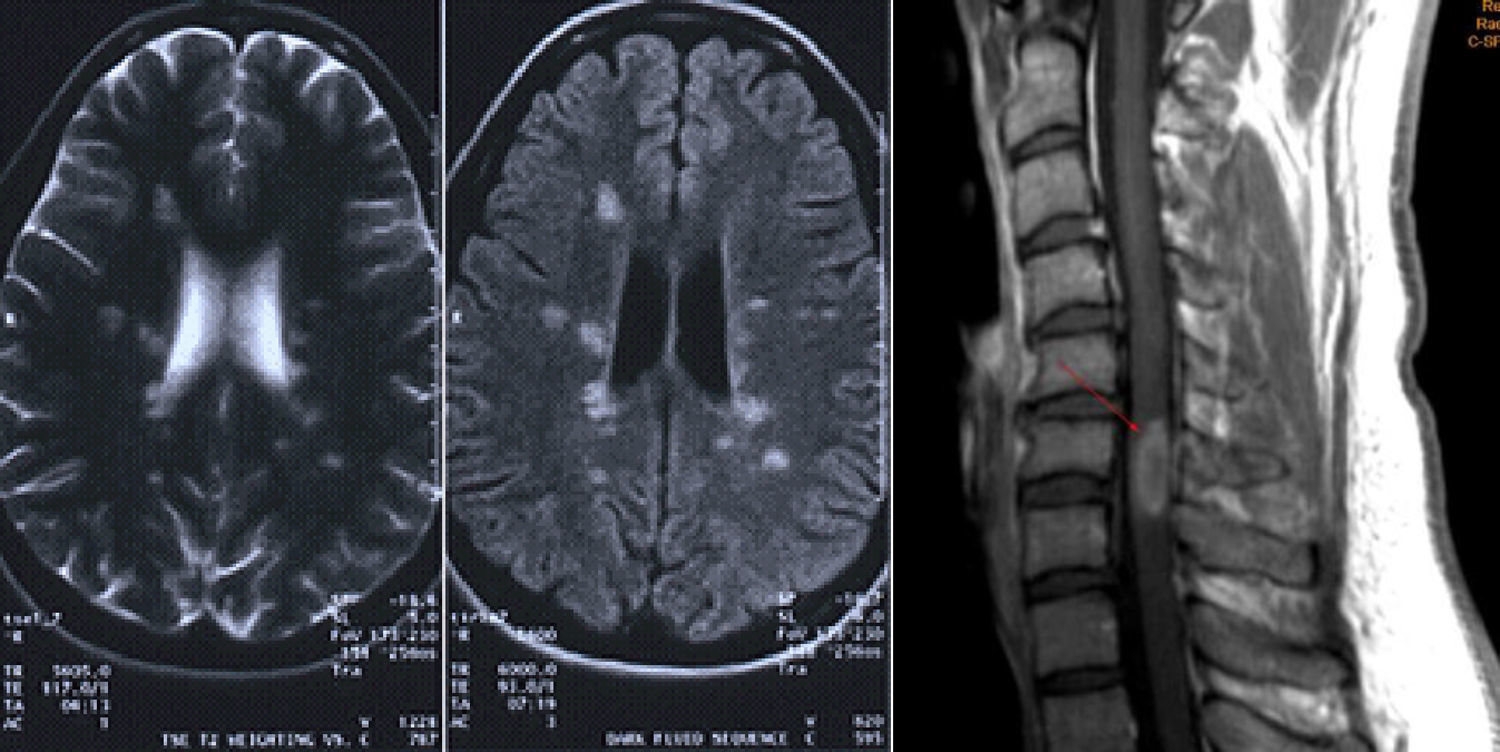
La RM2: los criterios diagnósticos exigen imágenes de la RM en las que se aprecien áreas de desmielinización (fig. 1).
Diseminación en espacioRequiere la existencia de una lesión en T2 en, por lo menos, 2 de las áreas siguientes:
- •
Periventricular
- •
Yuxtacortical
- •
Infratentorial
- •
Médula espinal
En los pacientes con síndrome medular o de tronco encefálico, las lesiones sintomáticas no forman parte de los criterios y, por tanto, no deben contabilizarse.
Diseminación en tiempoAparición de una nueva lesión en T2 y/o lesión gadolinio positiva al hacer el seguimiento mediante la RM.
Aparición de lesiones asintomáticas gadolinio positivas y no positivas en cualquier momento.
Potenciales evocadosInforman sobre el correcto funcionamiento de las vías sensoriales visual, auditiva y somatosensitiva, así como de las motoras. Su utilidad radica en descubrir vías afectas que todavía no han provocado manifestación clínica.
Líquido cefalorraquídeoSe habla de líquido cefalorraquídeo (LCR) positivo cuando existe índice de IgG elevado y/o 2 o más bandas oligoclonales en el LCR (no en suero). Aparte de esto el LCR puede presentar una ligera pleocitosis y un nivel de proteínas totales normal o algo elevado.
La inclusión del LCR en los criterios diagnósticos de McDonald recientemente revisados es el principal punto por el que se debe considerar la importancia de este fluido en el diagnóstico de la enfermedad3.
Los estudios realizados durante la última década han apoyado la necesidad y utilidad del LCR, unido a la RM y los PE, como los factores más importantes, junto a la clínica del paciente, para aumentar al máximo la especificidad en el diagnóstico de la EM3.
En concreto, la determinación de bandas oligoclonales es particularmente útil para el diagnóstico de la EM primaria progresiva, en aquellos pacientes de edad más avanzada que presenten un desarrollo de los síntomas en años posteriores, ya que las lesiones en la RM se han podido atribuir en un primer momento a su edad y no al resultado de la desmielinización inflamatoria4.
Por otra parte, en aquellos casos en que la primera manifestación clínica es atípica y la RM no es claramente patológica, pero la anamnesis y exploración neurológica deriva hacia el diagnóstico de la EM, el estudio del LCR es una importante ayuda en la precisión del diagnóstico3.
Hay que tener en cuenta que tanto el comienzo como el desarrollo de la enfermedad son diferentes en cada paciente, debido a los distintos niveles de afectación y a las distintas respuestas, tanto de tipo inmunitario como degenerativo, que una persona puede tener por su propia identidad celular. De ahí que el propio médico tendrá que evaluar para cada paciente el valor del LCR en ese diagnóstico en particular5.
En cuanto a la cuantificación de la secreción intratecal, los estudios realizados marcan un claro límite de sensibilidad en los métodos de cuantificación, otorgándole mayor importancia al estudio cualitativo4.
Debemos saber que en el análisis cuantitativo cada paciente se compara con una gran población y, por lo tanto, el rango de referencia de las proteínas derivadas de la sangre en el LCR de los pacientes es muy amplio. En el análisis cualitativo los patrones del IgG del LCR de cada paciente se comparan únicamente con su propia muestra de suero. Por ello los artículos referencian el uso de la cuantificación como un dato de interés pero nunca puede suplir el papel que juega la determinación de las bandas oligoclonales (BOC) de IgG, en el diagnóstico de la enfermedad4.
Parece claro, por el número de estudios que así lo corroboran, que la técnica más fiable y sensible para la determinación de las BOC con la que contamos hoy en día es el isoelectroenfoque seguido de inmunodetección.
Diagnóstico diferencial6,7A pesar de que es obligado el diagnóstico de exclusión, el listado de enfermedades con las que la EM se puede confundir es tan amplio que no se pueden descartar todas (tabla 1). De este modo, la búsqueda de la EM también se tiene que realizar activamente.
La presentación clínica y las características asociadas es lo que permitirá variar el rango de enfermedades que deben tenerse en cuenta. En los casos en los que existan síntomas que son atípicos, el paciente tenga una edad que no corresponde con la usual en la que se produce la EM o haya factores de riesgo para otra enfermedad entre otras cosas, se realizarán las exploraciones complementarias necesarias que pueden incluir tanto la detección de anticuerpos, como analizar la concentración de vitamina B12 o la aplicación de técnicas de imagen diferentes de la RM.
TratamientoNo existe ningún tratamiento eficaz que frene completamente la evolución de la EM. A esto hay que añadir que estos tampoco tienen efecto sobre las lesiones ya establecidas. Por tanto es importante iniciarlo lo más rápido posible antes de que aparezcan discapacidades irreversibles.
A falta de fármacos que estimulen y promuevan la remielinización, el tratamiento de la EM se puede dividir en varias categorías: tratamiento de los brotes, tratamiento modificador de la enfermedad y tratamiento sintomático, además de la rehabilitación.
Tratamiento de los brotes8Los glucocorticoides representan la primera línea ante la aparición de un brote. Se administran por vía intravenosa a altas dosis durante 3-5 días.
Reducen la intensidad y acortan la duración de los ataques, aunque no se ha demostrado que afecten la evolución a largo plazo.
Tratamiento modificador de la enfermedad9Su principal objetivo es reducir el número de brotes y sus secuelas, así como frenar la evolución de la enfermedad:
- •
Interferón beta (IFN-β)
- •
Acetato de glatiramer
- •
Natalizumab
- •
Mitoxantrona
Estos fármacos son especialmente eficaces en las formas remitente-recidivante y secundariamente progresivas. Los más usados son el IFN-β y el acetato de glatiramer.
El tiempo mínimo para determinar si ha habido respuesta es de 6-12 meses. Si tras este tiempo no se aprecia una mejoría, en el caso de IFN-β está indicado incrementar la dosis, mientras que si ocurre con el acetato de glatiramer se debe cambiar por IFN-β. Los efectos de una terapia combinada todavía no están bien estudiados.
A pesar de que estos fármacos suelen provocar unos efectos adversos similares a un estado gripal, entre un 6-8% de los pacientes generan una importante intolerancia que obliga a la suspensión de la administración.
El anticuerpo natalizumab, debido a su asociación con leucoencefalopatía multifocal progresiva, se usa en pacientes en los que ha fallado el tratamiento anterior o en formas muy agresivas. Lo mismo ocurre con la mitoxantrona dada su potencial toxicidad cardíaca.
A pesar de ser menos eficaces, se pueden usar otros fármacos inmunosupresores como corticoides, azatioprina, metotrexate o ciclofosfamida. También se ha probado la plasmaféresis aunque se tienen dudas sobre su eficacia en relación con su elevado coste.
Tratamiento sintomático10Los síntomas asociados a los brotes de la EM tienen una importante repercusión en la calidad de vida y en la capacidad funcional de los pacientes. Es por esto que se deben combatir desde una perspectiva multidisciplinar:
- •
Espasticidad: Se puede tratar con baclofeno (oral o intratecal), gabapentina, tizanidina, toxina botulínica o rizotomía como última opción.
- •
Fatiga: Evitar los factores que la agravan, como las elevadas temperaturas o el dolor, y realizar una adecuada planificación de las actividades diarias intercaladas con pausas para descansar. El único fármaco que ha demostrado ser eficaz es la amantadina.
- •
Dolor: Dependiendo del tipo de dolor se pueden usar tanto antiepilépticos como la carbamacepina o antidepresivos tricíclicos como la amitriptilina. En los casos en los que no haya respuesta se puede presentar recurrencias a la cirugía (rizotomía).
- •
Disfunción vesical: Se administrarán anticolinérgicos para evitar la hiperreflexia del detrusor. También puede ser efectiva la administración de toxina botulínica. Si no hay repuesta la desmopresina es una buena opción. En cuanto a la hiperreflexia uretral, los fármacos de primea línea son los alfa-bloqueantes como la tamsulosina o la doxazosina. Como complemento a la medicación se pueden usar empapadores o colectores urinarios.
- •
Ataxia y temblor: Se usarán isoniacida, carbamacepina o levetiracetam.
- •
Depresión: Los fármacos elegidos son los antidepresivos tricíclicos o los ISRS como fluoxetina o paroxetina junto con terapia cognitivo conductual.
Su realización es fundamental dado sus importantes beneficios a nivel físico y psicológico. No solamente mejora el estado general del paciente, sino que también previene las complicaciones y retrasa la evolución de la discapacidad. Debe ir asociada a un adecuado programa de educación tanto del paciente como de los familiares.
Muy importante también es adaptar el entorno social y laboral del paciente para conseguir un desarrollo óptimo de las capacidades en las distintas etapas de la enfermedad.
PronósticoLa mayoría de los pacientes con EM acabaran padeciendo discapacidad neurológica progresiva12. A los 15 años de evolución más del 80% requieren ayuda en la deambulación.
Aunque el pronóstico de cada persona es muy difícil de valorar, sí que existen unos signos que se asocian a un curso más desfavorable:
- •
Edad>40 años
- •
Síntomas iniciales motores, cerebelosos y trastornos de esfínter
- •
Episodios frecuentes durante los primeros años de la enfermedad
- •
Breve intervalo entre los 2 primeros ataques
- •
Remisiones incompletas
- •
Progresión rápida de la enfermedad
En las mujeres el embarazo actúa como un factor protector, ya que durante la gestación el número de ataques se reduce notablemente. Sin embargo éstos aumentan en gran medida los tres meses postparto13.
En un pequeño porcentaje los pacientes sufren una variante llamada benigna, puesto que nunca llegan a desarrollar discapacidad neurológica. Si tras 15 años de evolución todavía no muestran afectación neural, seguramente no la lleguen a sufrir.
La expectativa de vida de los pacientes con EM es de unos 25-30 años. Las causas de muerte suelen ser debidas a una complicación de la enfermedad como infecciones, aunque no debe olvidarse que la tasa de suicidios en esta población es muy elevada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.