La prevalencia de la diabetes tipo 2 diagnosticada en la infancia/juventud está aumentando y se caracteriza por una disminución acelerada de la función de las células beta pancreáticas y resistencia a la insulina. Los principales factores de riesgo para su desarrollo son obesidad e inactividad física. Los criterios diagnósticos son similares a los utilizados en adultos, aunque la HbA1c como método diagnóstico está cuestionada. Las complicaciones son más agresivas que en la diabetes tipo 2 del adulto, siendo la nefropatía la más frecuente. Las complicaciones macrovasculares aparecen precozmente y su mortalidad es elevada.
La alimentación saludable y el ejercicio físico continuado son los pilares básicos del tratamiento, y la metformina, insulina y liraglutide (aprobado por la FDA en Estados Unidos) las opciones farmacológicas con indicación en esta población.
Es importante establecer modelos de transición de la atención pediátrica a la atención adulta para garantizar la continuidad asistencial y evitar pérdidas en el seguimiento de estos pacientes.
The prevalence of type 2 diabetes (DM2) diagnosed in childhood and adolescence is currently increasing, and is characterised by a rapidly progressive decline in beta-cells and insulin resistance. Physical inactivity and obesity are the main risk factors for its development. Diagnostic criteria are similar to those used in adults, although HbA1c as a diagnostic method is questioned. Diabetes-related complications are more aggressive than in adults. Diabetic nephropathy is the most frequent complication in the young population and macrovascular complications appear early, leading to high mortality rates.
Healthy lifestyles are the basis of the treatment, and metformin, insulin and liraglutide (approved by FDA for its use in the United States) are the pharmacological options indicated in this population.
It is important to establish models of health care transition from paediatric to adult care to ensure continuity of care and avoid patient disengagements.
La diabetes mellitus tipo 2 (DM2) de inicio en la juventud es un trastorno emergente y supone un desafío, tanto en investigación como en atención clínica. Tiene un impacto desproporcionado en algunas minorías étnicas y en entornos desfavorecidos, lo que dificulta la puesta en marcha de programas de investigación, dejando grandes lagunas en el conocimiento sobre la fisiopatología y la optimización del tratamiento1. En los últimos 30 años la prevalencia en niños y adolescentes se ha multiplicado por 10, especialmente en determinadas poblaciones2. Se acompaña de la triada obesidad, resistencia a la insulina y ausencia de autoinmunidad pancreática, y se define con criterios diagnósticos similares a los utilizados en población adulta, siendo la prueba de tolerancia oral a la glucosa o la glucemia en ayunas las más adecuadas para el diagnóstico3.
La evidencia científica sugiere que la DM2 en la juventud es diferente no solo de la diabetes mellitus tipo 1 (DM1), sino también de la DM2 en adultos, y tiene características propias como progresión más rápida del deterioro de la función de las células beta pancreáticas y desarrollo más agresivo de las complicaciones1,4.
EpidemiologíaSegún la Organización Mundial de la Salud, y atendiendo a criterios estrictamente cronológicos, la pubertad o adolescencia temprana trascurre de los 10 a los 17 años, la postadolescencia de los 18 a los 24 años y el adulto joven englobaría las edades comprendidas entre los 25 y los 30 años5. La información disponible sobre la epidemiología de la DM2 en jóvenes es escasa, y procede principalmente de estudios clínicos, series de casos y del cribado en niños y adolescentes obesos. Los datos indican una variación considerable en la incidencia y prevalencia según el origen étnico y la región geográfica. En Estados Unidos, antes de finalizar la década de los 90, era una entidad rara en niños; en 1996 se describió un incremento de la prevalencia en jóvenes de minorías urbanas6, y desde 2001 ha aumentado más del 30%, afectando a todas las etnias y representando, según las series, entre el 8% y 45% de todos los casos de diabetes diagnosticados en niños y adolescentes1,2.
La mayoría de los niños con DM2 son mayores de 10 años; a partir de esta edad la prevalencia se triplica hasta los 15-18 años y es más frecuente en niñas, con un aumento anual en la incidencia de casi el doble que en los niños: 6,2% (IC 95%: 4,2-8,2) y 3,7% (IC 95%: 1,6-5,8) respectivamente7. Se estima que la prevalencia en menores de 20 años se cuadruplicará en los próximos 40 años debido, fundamentalmente, a cambios migratorios, redistribución geográfica de minorías raciales y la adopción de las costumbres y modo de vida occidental2,7,8.
Los estudios en Europa son escasos y muestran una incidencia más baja, que puede llegar hasta el 2,4% en adolescentes con obesidad grave9. En España la prevalencia supone el 1-2% de los pacientes con diabetes controlados en unidades de diabetes pediátricas10. Datos más recientes de un estudio transversal, realizado en 133 niños y adolescentes con diagnóstico de obesidad severa, ponen de manifiesto una incidencia de diabetes del 0,75% y de prediabetes del 10,5%11. Estas cifras, ligeramente inferiores a las obtenidas en población americana, se asemejan a las europeas y pueden considerarse bajas, teniendo en cuenta que el sobrepeso/obesidad en edad pediátrica puede alcanzar el 44% en nuestro país12. Por tanto, no se puede apoyar claramente, al menos en algunos países, la existencia de una epidemia de DM2 en los niños.
Fisiopatología y factores de riesgoEn la DM2, por definición, no existe destrucción autoinmune de las células beta pancreáticas, como ocurre en la DM1, sino que la hiperglucemia es consecuencia de una serie de alteraciones causadas por diferentes factores genéticos, ambientales y metabólicos13.
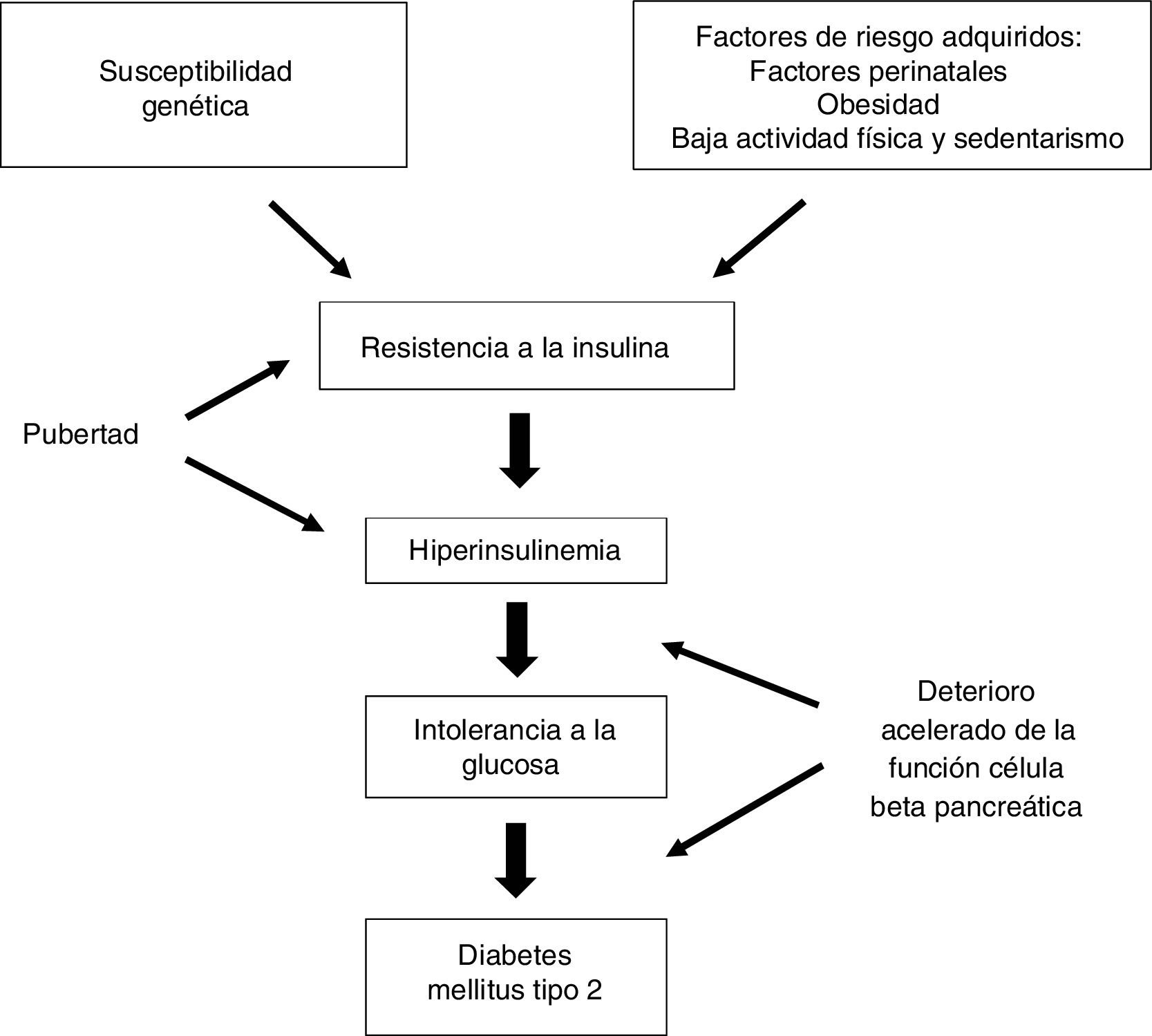
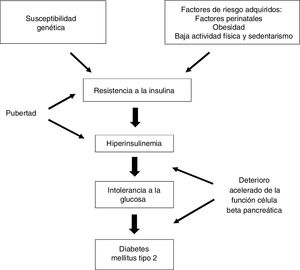
En términos generales se inicia por un aumento de resistencia a la insulina (RI) con la consiguiente respuesta compensatoria del páncreas, que aumenta la secreción de insulina (hiperinsulinemia). Si esta respuesta no es capaz de compensar completamente la RI aparece la hiperglucemia. En este contexto se produce también una pérdida gradual de la función de las células beta pancreáticas, con el concomitante aumento de la secreción de glucagón10,13,14 (fig. 1).
Fisiopatología de la DM2 en el adolescente y adulto joven.
Fuente: Grulich-Henn y Klose14.
Los mecanismos que conducen a la DM2 en los jóvenes son similares a los que ocurren en pacientes mayores; sin embargo, la interacción entre la sensibilidad reducida a la insulina y la secreción defectuosa de la misma pueden ser diferentes.
Durante la pubertad existe una RI fisiológica que revierte al finalizar este periodo, la obesidad agrava esta situación, dando lugar a alteraciones del metabolismo hidrocarbonado que, si persisten, derivan en una diabetes. Sin embargo, en los adolescentes con DM2 la relación directamente proporcional entre obesidad y RI no ha sido un hallazgo consistente, sino que presentan un mayor deterioro en la secreción de insulina en comparación con una sensibilidad reducida a la misma. La pérdida de función de las células beta está acelerada, con una disminución anual del 20% al 35%, frente al 7% en personas mayores con DM215 y los estudios centrados en la RI, el metabolismo de los lípidos y la presencia de marcadores proinflamatorios respaldan la idea de que el desarrollo de hiperglucemia en jóvenes es más dependiente de la disfunción de la célula beta pancreática que en las personas que desarrollan la diabetes en la edad adulta13.
La enfermedad de hígado graso no alcohólico (NAFLD, por sus siglas en inglés) es frecuente en adolescentes con DM2 y se considera un factor de riesgo para esta enfermedad. Las relaciones causa-efecto de diabetes y NAFLD son complejas, y es difícil descifrar si una conduce a la otra o viceversa. La predisposición genética, junto con la obesidad, son probablemente causantes compartidos de ambas. La NAFLD puede preceder al diagnóstico de diabetes, desempeñando un papel fundamental en su desarrollo al aumentar la resistencia a la insulina. Por otro lado, la DM2 se asocia con hiperinsulinemia y aumento de ácidos grasos libres, que promueven la acumulación de lípidos en el hígado16.
La obesidad, principal factor de riesgo de la diabetes, es más frecuente en niños y jóvenes con DM2 que en adultos17, y se ha relacionado con el desarrollo de síndrome metabólico, cuya prevalencia en el estudio TODAY fue de 75%, siendo más común en el sexo femenino (83%) que en los varones (62%) debido a la mayor obesidad abdominal y a cifras más bajas de colesterol HDL en las adolescentes4.
Otros factores de riesgo para la DM2 son la etnia, los antecedentes familiares, la inactividad física, el retraso de crecimiento intrauterino o el peso alto para la edad de gestación, el aumento rápido de peso en el periodo neonatal y las condiciones que predisponen a la resistencia a la insulina, como el ovario poliquístico1. La diabetes gestacional también se asocia con incremento en el peso al nacer y riesgo más elevado de DM2 en la infancia6, mientras que la lactancia materna protege contra el posterior desarrollo de obesidad y DM2 en el niño7.
DiagnósticoLa prediabetes es una alteración en la homeostasis de la glucosa que conlleva un mayor riesgo de diabetes en el transcurso del tiempo. Es muy prevalente entre los adolescentes y jóvenes, suele acompañarse de alteraciones en el perfil lipídico y de cifras de presión arterial elevadas11 y puede ser reversible con medidas terapéuticas y modificaciones del estilo de vida (MEV), por lo que su identificación precoz es importante, ya que permite dirigir prioritariamente las intervenciones a los sujetos con mayor riesgo de desarrollar diabetes18.
En la tabla 1 se relacionan las circunstancias en las que se recomienda la detección de prediabetes o DM2 en niños y adolescentes asintomáticos menores de 18 años19.
Criterios clínicos para la recomendación de detección de DM2
| Sobrepeso (IMC≥percentil 85%) u obesidad (IMC≥percentil 95%) y que tienen uno o más factores de riesgo adicionales: |
| Antecedente materno de diabetes o diabetes durante la gestación del niñoAntecedentes de DM2 en familiares de primer o segundo gradoRaza/etnia (nativos norteamericanos, afroamericanos, latinos, estadounidenses de origen asiático, nativos de islas del Pacífico)Signos de resistencia a la insulina o cuadros asociados con resistencia a insulina (acantosis nigricans, hipertensión, dislipidemia, síndrome de ovario poliquístico o bajo peso al nacer para la edad gestacional) |
Adaptada de la ADA19.
También se recomiendan pruebas de detección de prediabetes y DM2 después del inicio de la pubertad o a los 10 o más años (lo que ocurra primero), en niños con sobrepeso u obesidad (según percentiles para edad y sexo) que tengan uno o más factores de riesgo adicionales de los referidos en la tabla 1. Si el resultado de las pruebas es normal se repetirán, como mínimo, cada 3 años o más frecuentemente si el IMC es elevado19.
En adolescentes y jóvenes recién diagnosticados de diabetes puede ser difícil distinguir entre DM1 y DM2, siendo necesario determinar autoanticuerpos pancreáticos para excluir DM1 autoinmune, aunque su presencia se ha descrito también en algunos casos de DM220. En el diagnóstico diferencial también se debe considerar la diabetes monogénica tipo MODY, sobre todo en aquellos pacientes en los que se inicia de forma variable (insidiosa o aguda), sin cetosis, durante la edad puberal o pospuberal (clásicamente antes de los 25 años) y que no presentan ni obesidad ni autoinmunidad, pero sí antecedentes familiares de diabetes19.
Los criterios diagnósticos de DM2 son los mismos que en el adulto (tabla 2), si bien la relevancia exacta de los distintos métodos utilizados para niños sigue sin estar clara hasta que existan más datos disponibles21.
Criterios diagnósticos de la DM2
| 1. Glucemia plasmática en ayunas≥126mg/dl (7,0mmol/l). Ayuno se define como la ausencia de ingesta calórica durante un mínimo de 8horasa, o |
| 2. HbA1c≥6,5% (48mmol/mol)a. La determinación debe realizarse con un método certificado por el National Glycohemoglobin Standardization Program y estandarizado según el ensayo Diabetes Control and Complications Trial o |
| 3. Glucemia plasmática a las 2horas de la prueba de sobrecarga oral a la glucosa ≥200mg/dl (11,1mmol/l)a. La prueba se debe realizar según la Organización Mundial de la Salud utilizando una sobrecarga oral de glucosa con 75g, o |
| 4. Glucemia plasmática (al azar)≥200mg/dl (11,1 mmol/l) en pacientes con síntomas clásicos de hiperglucemia o crisis hiperglucémica |
Adaptada de la ADA19.
Algunos estudios han cuestionado la validez diagnóstica de la HbA1c en esta población debido a la escasa sensibilidad para identificar a niños con alteraciones de la glucemia y la subestimación de la prevalencia de prediabetes y diabetes3, siendo limitados los datos que respaldan su uso. Los criterios de glucemia en ayunas y la prueba de sobrecarga oral a la glucosa (TSOG) tampoco se han validado en jóvenes. Algunos estudios que utilizaron la monitorización continua de la glucosa en personas obesas de estas edades demostraron que la HbA1c y la TSOG son igualmente efectivas para identificar anomalías glucémicas, pero los patrones glucémicos difieren22.
Otros autores1 afirman que tanto la determinación de la glucemia en ayunas, la TSOG o la determinación de HbA1c son óptimas para el diagnóstico siempre que se apliquen partiendo de un adecuado juicio clínico y reconociendo las fortalezas y debilidades de cada prueba diagnóstica.
Complicaciones crónicas asociadas a la diabetes mellitus tipo 2 en adolescentes y jóvenesLas complicaciones crónicas de la DM2 han sido bien descritas en los adultos, sin embargo, la historia natural de esta enfermedad es menos conocida en adolescentes y jóvenes ya que, al tratarse de un proceso patológico relativamente reciente a estas edades, los estudios a largo plazo son escasos y provienen, mayoritariamente, de poblaciones especialmente vulnerables o con elevada prevalencia de la enfermedad. No obstante, hay datos que sugieren una progresión más agresiva cuando la diabetes se inicia a edades más tempranas2,23–25.
Por otra parte, los jóvenes con DM2, tras ajustar por edad, duración de la enfermedad, control glucémico y obesidad, tienen un riesgo más elevado de complicaciones que aquellos con DM126.
Complicaciones microvascularesLas complicaciones microvasculares están directamente relacionadas con la duración y magnitud de la hiperglucemia y pudiera ser que el elevado riesgo observado en cohortes diagnosticadas de diabetes a una edad más joven sea el resultado de la exposición más prolongada a la hiperglucemia.
Sin embargo, no es infrecuente que estén presentes en el momento del comienzo de la DM2, o que estas tengan una rápida progresión4; así, algunos estudios reseñan que las alteraciones renales y neurológicas comienzan a manifestarse durante los 5 años siguientes al diagnóstico, y las más graves (diálisis, ceguera o amputación) 10 años después de la aparición de la diabetes24,25.
La enfermedad renal diabética (ERD) es la complicación más frecuentemente descrita en personas con DM2 diagnosticada en la juventud26, lo que supondrá, en un futuro próximo, un gran impacto económico y de salud pública, ya que estos pacientes pueden tener una elevada morbilidad durante los años más productivos de su vida y requerir servicios sanitarios de forma sostenida.
Un estudio longitudinal poblacional realizado en indios pima, que compara la incidencia de enfermedad renal terminal (ERT) en sujetos diagnosticados de DM2 antes de los 20 años frente a los diagnosticados entre los 20 y 55 años, puso de manifiesto que la incidencia de ERT ajustada por edad y sexo era casi 5 veces superior en aquellos que habían sido diagnosticados de diabetes antes de los 20 años. Sin embargo, tras ajustar por presión arterial, IMC, tabaquismo, control glucémico y tratamiento antihipertensivo e hipoglucemiante, no hubo asociación entre edad de inicio de la diabetes y ERT (índice de riesgo 1,0; IC 95%: 0,9-1,2). La diferencia de los resultados fue atribuida a la duración más prolongada de la diabetes en aquellos que fueron diagnosticados a edades más tempranas27.
Por el contrario, otros autores, una vez equiparada la duración de la diabetes, observan mayor prevalencia de albuminuria en sujetos diagnosticados de DM2 entre los 15 y 30 años que en aquellos diagnosticados entre los 40 y 50 años23.
En el estudio TODAY28, primer ensayo multicéntrico y multiétnico de DM2 de inicio en la juventud, y en el que participaron adolescentes de 10 a 17 años con DM2 de menos de 2 años de evolución, la albuminuria estaba moderadamente elevada (30-300mg/g creatinina) en el 6,3% de los casos, llegando a afectar al 16,6% tras 4 años de seguimiento de la cohorte. También se ha observado que la hiperfiltración (FGe ≥135ml/min/1,73 m2) es frecuente en estos jóvenes y predice una rápida y progresiva caída de la función renal que, a la larga, conduce a una enfermedad renal terminal.
En relación con el desarrollo de retinopatía diabética (RD) los datos no son homogéneos. La prevalencia es variable según la metodología diagnóstica utilizada y la edad de los participantes. Algunos trabajos29 muestran una ligera disminución en la susceptibilidad a esta complicación en adultos jóvenes con DM2 de aparición temprana. Esta tendencia también se puso de manifiesto en los estudios realizados en jóvenes indios pima30.
En el ensayo TODAY28, en pacientes con una duración media de la diabetes de 4,9 años, se detectó una prevalencia de RD del 13,7%, manifestándose a una edad media de 18,1 años. No hubo evidencia de edema macular o retinopatía proliferativa. Esta prevalencia es similar a la comunicada en adultos con un tiempo semejante de evolución de la diabetes31, y en investigaciones realizadas en poblaciones con diabetes de más larga duración tampoco se encontraron diferencias en la incidencia de RD entre jóvenes y adultos23.
Por el contrario, en el estudio SEARCH, la presencia de RD fue elevada, afectando al 42% de los jóvenes con una DM2 de 7,2 años de evolución32. Igual que ocurre en los adultos la RD se asocia a mayor edad, peor control glucémico y duración más prolongada de la diabetes.
Respecto a la neuropatía diabética su prevalencia no ha sido estudiada de forma sistemática, pero parece desarrollarse, al menos, con la misma frecuencia que en los adultos, e incluso algunos autores describen que es más común cuando la diabetes se diagnostica en la juventud23. En una cohorte india de una edad media de 16 años en el momento del diagnóstico de la DM2, la prevalencia de neuropatía era del 3% en las personas con una diabetes de menos de 5 años de evolución, y del 49% cuando la duración era mayor de 15 años33. En el estudio SEARCH34 el 26% de los jóvenes presentaba polineuropatía distal periférica (duración media de la diabetes: 7,6 años).
Complicaciones macrovascularesLos adultos jóvenes con DM2 de inicio juvenil tienen una prevalencia de HTA, dislipidemia y eventos cardiovasculares muy superior a la esperada para la edad23,35, lo que conlleva un riesgo cardiovascular elevado. Se estima que, por término medio, pierden 15 años de esperanza de vida y pueden tener complicaciones crónicas graves y un exceso de mortalidad a la edad de 40 años36. Se ha documentado que ya presentan durante la adolescencia un aumento de la rigidez arterial e hipertrofia ventricular izquierda en relación, posiblemente, con una mayor adiposidad central, resistencia a la insulina e HTA, y también se ha observado que la fracción de eyección se reduce en un periodo corto de tiempo37,38.
En general, los estudios realizados hasta la fecha en jóvenes con obesidad y DM2 indican un elevado riesgo de progresión a enfermedad cardiovascular manifiesta y la tasa de mortalidad ajustada por duración de la diabetes es más alta, a cualquier edad cronológica, para aquellos sujetos diagnosticados con menor edad23. Es fundamental un plan de manejo integral que incluya el control temprano y agresivo de los factores de riesgo cardiovascular.
Tratamiento no farmacológico de la diabetes mellitus tipo 2 en adolescentes y jóvenesLa alimentación y el ejercicio físico son los pilares fundamentales de la prevención, manejo, autocuidado y tratamiento de la DM2. La mayoría de las intervenciones analizadas en esta población se han centrado en la obesidad y la prediabetes y responden a modificaciones en el comportamiento y educación clásica sobre alimentación y actividad física. La escasa adherencia y eficacia de estas medidas se justifica por diversas razones multifactoriales, como el rápido deterioro de la función de las células beta pancreáticas y una elevada incidencia de trastornos mentales en el contexto de frecuentes adversidades sociales39.
En el estudio Bright Bodies Weight Management Program for Children40 se obtuvo una reducción significativa (y sostenida a los 12 meses postintervención) del IMC, colesterol total y resistencia a la insulina (medida por HOMA) en pacientes sometidos a un programa familiar con sesiones frecuentes sobre ejercicio físico, nutrición y modificación del comportamiento. Sin embargo, en el estudio TODAY41, único hasta la fecha que analiza la combinación de MEV y tratamiento farmacológico para lograr un control glucémico duradero, no se obtuvieron resultados superiores en el grupo tratado con MEV y metformina frente al grupo tratado exclusivamente con metformina. Garnett et al.42 compararon 2 grupos de pacientes de 10 a 17 años con prediabetes que tomaban metformina; a uno se le añadió una dieta rica en hidratos de carbono y baja en grasas y al otro una dieta con aportación moderada de hidratos de carbono y rica en proteínas. A los 6 meses ambos habían aumentado en 0,3 puntos el índice de sensibilidad a la insulina (IC 95%: 0,2-0,4) y disminuido el IMC un 9% (IC 95%: 3-15), sin diferencias significativas entre ellos.
Lo recomendable en estos pacientes es una dieta saludable, equiparable a la del resto de niños y adolescentes sin DM2, adaptada a cada persona respetando las necesidades psicosociales, aspectos culturales y étnicos y que proporcione la energía y nutrientes necesarios para un crecimiento y desarrollo óptimo, manteniendo un IMC apropiado43.
Una dieta muy baja en calorías podría ser una opción terapéutica en sujetos obesos, ya que consigue pérdidas de peso de forma rápida. Jóvenes australianos con DM2 que participaron en un estudio piloto lograron una disminución ponderal del 7,5% a las 8 semanas, y aquellos con buena adherencia perdieron el 12,3% a las 32 semanas; también se redujo de forma llamativa la grasa visceral hepática e incluso en algún caso se logró la remisión de la diabetes44.
La Academia Americana de Pediatría45 y la ADA recomiendan19:
- 1)
Realizar un mínimo de 60minutos al día de ejercicio físico moderado-intenso45 o unos 30-60minutos diarios durante 5 veces a la semana, combinado con 3 sesiones semanales de entrenamiento de fuerza19.
- 2)
Limitar los horarios de uso no académico de «pantallas» (tabletas, móviles, etc.) a menos de 2horas diarias45.
- 3)
Reducir al menos el 10% las calorías diarias (aportadas por ácidos grasos saturados)45.
- 4)
Potenciar una alimentación saludable priorizando el consumo de alimentos nutritivos de calidad, disminuyendo aquellos con un alto aporte calórico y poco nutritivos, como las bebidas azucaradas19.
Es aconsejable también la dieta tipo dietary approaches to stop hypertension, por contribuir a mejorar el perfil cardiovascular en jóvenes con diabetes46. No se han encontrado estudios específicos sobre el papel de la dieta mediterránea en el control glucémico de adolescentes con diabetes, aunque, como se ha mencionado anteriormente, se recomienda una alimentación saludable y equilibrada, requisitos que cumple este tipo de dieta.
Tratamiento farmacológico de la diabetes mellitus tipo 2 en adolescentes y jóvenesEl manejo farmacológico de la DM2 en jóvenes y adolescentes comporta un gran reto en relación con los cambios en la sensibilidad a la insulina, cambios hormonales puberales, variabilidad en las habilidades de automanejo, necesidad de supervisión y riesgo de hipoglucemia47. Todos los pacientes con un diagnóstico reciente de DM2, independientemente del régimen terapéutico prescrito, deben realizar autocontroles de glucemia capilar en ayunas, antes de cada comida y antes de acostarse hasta que se alcance un control metabólico razonable45.
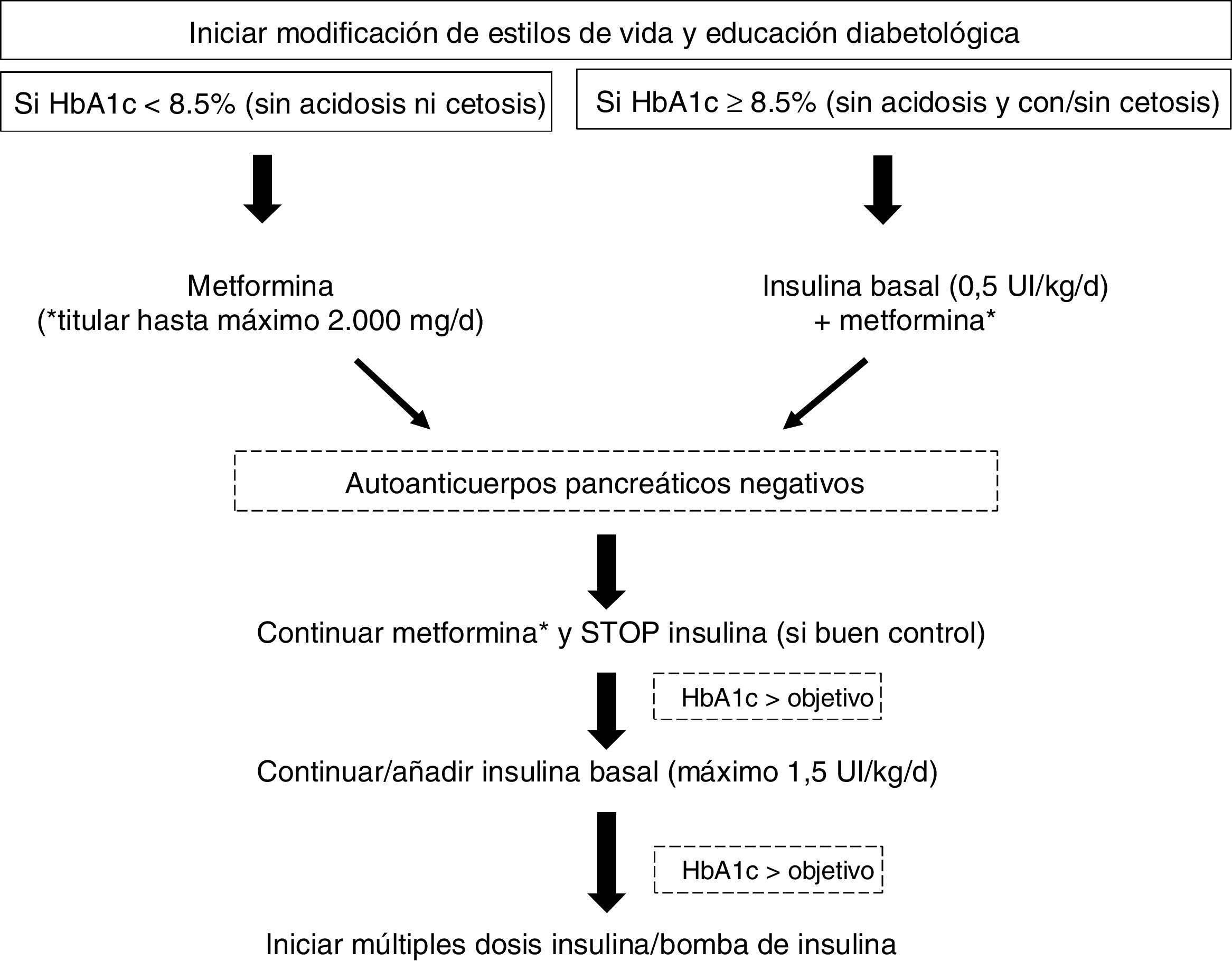
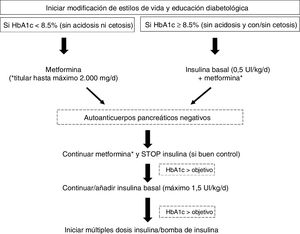
El tratamiento farmacológico de elección para la mayoría de los adolescentes y adultos jóvenes con DM2 en fases tempranas de la enfermedad es la metformina. Sin embargo, el acelerado deterioro de la función de las células beta pancreáticas que caracteriza a esta población, y la resistencia a la insulina, contribuyen a un rápido empeoramiento del control glucémico en pacientes con monoterapia. Por otra parte, datos del Pediatric Diabetes Consortium T2D Registry (base de datos americana) evidencian que la combinación de metformina e insulina (con un uso extendido en esta población en torno al 44-66%) no consigue alcanzar niveles de HbA1c<7,5% en la mayoría de los casos48. La figura 2 esquematiza el manejo de la diabetes recién diagnosticada en el joven obeso, según recomendaciones de la ADA19.
Manejo de la diabetes de nueva aparición en jóvenes obesos.
Adaptada de la ADA19.
El estudio TODAY25 comparó la eficacia de 3 estrategias terapéuticas: metformina, metformina añadida a modificación de estilos de vida y metformina asociada a rosiglitazona. A los 11 meses más de la mitad de los participantes tratados únicamente con metformina no lograba un buen control glucémico; los mejores resultados se obtuvieron al combinar los 2 fármacos (por motivos de seguridad cardiovascular la rosiglitazona no se recomienda actualmente).
La metformina también se ha ensayado en adolescentes insulinorresistentes; así, 62 participantes de edades comprendidas entre 10-16 años con RI fueron aleatorizados a recibir 1.000mg de metformina 2 veces al día frente a placebo. Al cabo de 18 meses se comprobó que este fármaco, más allá del control glucémico, había mejorado la composición de grasa corporal, la presión arterial, el perfil lipídico y el índice de RI sin producir efecto negativo sobre el peso que, inicialmente, se redujo, aunque al finalizar el estudio se aproximaba al estado basal, con un aumento del IMC de 0,2 (IC 95%: 2,9-1,3) en el grupo de metformina frente a 1,2 (IC 95%: 0,3-2,4) en el grupo tratado con placebo (p=0,015)19,49.
En España la metformina es el único fármaco que se puede asociar a la insulina para tratar la DM2 en este grupo etario. Tiene aprobado su uso a partir de los 10 años y los efectos secundarios más frecuentes son los gastrointestinales (dolor abdominal, náuseas, gusto metálico, diarrea y distensión abdominal) que pueden minimizarse titulando la dosis gradualmente según tolerancia. Otros efectos adversos son el déficit asociado de vitamina B12 y algún caso de acidosis metabólica cuando existe insuficiencia renal y/o enfermedad intercurrente sin haber tenido en cuenta medidas preventivas, como retirar el fármaco cuando era necesario50. Las formas de liberación retardada se toleran mejor51.
Recientemente se ha publicado el estudio Ellipse, en el que 134 niños con una edad media de 14,6 años (SD 1,7), se aleatorizaron a recibir 1,8mg de liraglutide frente a placebo52. El cambio en los valores de HbA1c (objetivo primario) a las 26 semanas fue un descenso de –0,64% con liraglutide frente a un aumento de +0,42% con placebo (p<0,001). Esta diferencia de –1,06% aumentaba hasta –1,30% al año de tratamiento. A diferencia de lo que ocurre en adultos no se observaron beneficios en el peso respecto a placebo. El estudio concluye que liraglutide a dosis de 1,8mg diarios, añadido a metformina (con insulina basal o sin ella), es eficaz en la mejoría del control glucémico. Los efectos adversos fueron similares en ambos grupos, excepto las reacciones gastrointestinales más frecuentes en los tratados con liraglutide. La Food and Drug Administration (FDA) ha aprobado en EE. UU. la utilización de este fármaco en niños con DM2 a partir de los 10 años. En Europa, en estos momentos, no existe aprobación por parte de la Agencia Europea del Medicamento (EMEA) para su uso en población infantil.
Existe una disponibilidad limitada de antihiperglucemiantes orales e inyectables para el tratamiento de la DM2 en adolescentes debido a la falta de ensayos clínicos finalizados con éxito. Las principales barreras para realizar estos estudios son la escasa disponibilidad de pacientes de esta edad8 y los criterios de inclusión como, por ejemplo, exigir rangos de HbA1c entre el 7% y el 10%, que excluyen en torno al 87% de los sujetos potencialmente elegibles48. La presentación clínica sutil de la DM2 a estas edades hace que se perciba como una forma menos grave de diabetes por parte de sus familiares, y dificulta que los adolescentes y jóvenes consientan participar en ensayos clínicos y aceptar los riesgos potenciales de un tratamiento experimental53.
La mayoría de los estudios que analizan los efectos de la cirugía bariátrica en población adolescente se han realizado en pacientes obesos, existiendo pocos datos sobre esta opción terapéutica en pacientes adolescentes y adultos jóvenes con DM2. De todas formas, es importante destacar el papel de la obesidad como principal factor de riesgo modificable para el desarrollo y mantenimiento de la DM2. Según datos de estudios a 3 años postintervención54, la remisión de la misma es posible tras cirugía bariátrica en el 95-100% de los adolescentes sometidos a gastrectomía vertical y by-pass gástrico en Y de Roux55. Se ha observado que los niveles basales de insulina pueden normalizarse a los 6 meses56, y un año después de la cirugía se puede abandonar el tratamiento farmacológico antihiperglucemiante en la mayoría de los casos57.
Es importante tener en cuenta esta opción terapéutica en pacientes con alto IMC, depresión, etnia negra y valores altos de HbA1c, predictores a su vez de un posible fracaso de la terapia farmacológica. Una reciente revisión58 establece como indicaciones de cirugía bariátrica en adolescentes: IMC≥35kg/m2 si existe una comorbilidad grave (DM2, apnea obstructiva del sueño, pseudotumor cerebral, esteatohepatitis no alcohólica, reflujo gastroesofágico y deslizamiento de la cabeza femoral) o IMC>40kg/m2 si las comorbilidades son menos graves. Un IMC de 35 y 40kg/m2 es equiparable al 120% y 140% respectivamente del valor del percentil 95 de IMC por edad y sexo. Es primordial implicar a toda la familia para conseguir la adherencia a los estilos de vida y a las normas dietéticas que comporta el tratamiento quirúrgico.
Transición de los pacientes con diabetes de la atención pediátrica a la atención adultaUno de los desafíos más importantes en el seguimiento de las personas con enfermedades crónicas iniciadas en la infancia y juventud es la continuidad asistencial durante el periodo transicional del área pediátrica a la atención adulta. Esta transición se define59 como «el paso planificado de adolescentes y adultos jóvenes con condiciones físicas y médicas crónicas, de un sistema de atención pediátrico a uno de adultos» y tiene 3 momentos cruciales60:
- -
Fase de preparación: proveedores y familias deben asegurarse de que el paciente está capacitado para manejar su salud de la forma más independiente posible.
- -
Fase de planificación o transición: su objetivo es anticiparse a las necesidades y determinar responsabilidades del (auto)cuidado.
- -
Fase de implementación o evaluación: se ensambla esta transición en el sistema sanitario del adulto.
Cuando estas fases no se llevan a cabo se producen pérdidas en el seguimiento, falta de adherencia, deterioro clínico, aumento de las hospitalizaciones y mortalidad prematura61. Las barreras que pueden dificultar el cambio se engloban en factores preexistentes (sociodemográficos y culturales, acceso al sistema sanitario público/privado, nivel de salud) y componentes interrelacionados (desarrollo, conocimiento, habilidades, expectativas y creencias, objetivos, relaciones y aspectos psicosociales)62. Es importante conocer estos obstáculos y vencerlos con formación a los profesionales sanitarios, a los adolescentes y a sus familias63.
Uno de los modelos de transición desarrollado para facilitar la implicación de todos los actores en dicha etapa es el modelo SMART64, en el que se tiene en cuenta, más allá de la edad del paciente, el conocimiento de la enfermedad y sus habilidades en el manejo del proceso patológico.
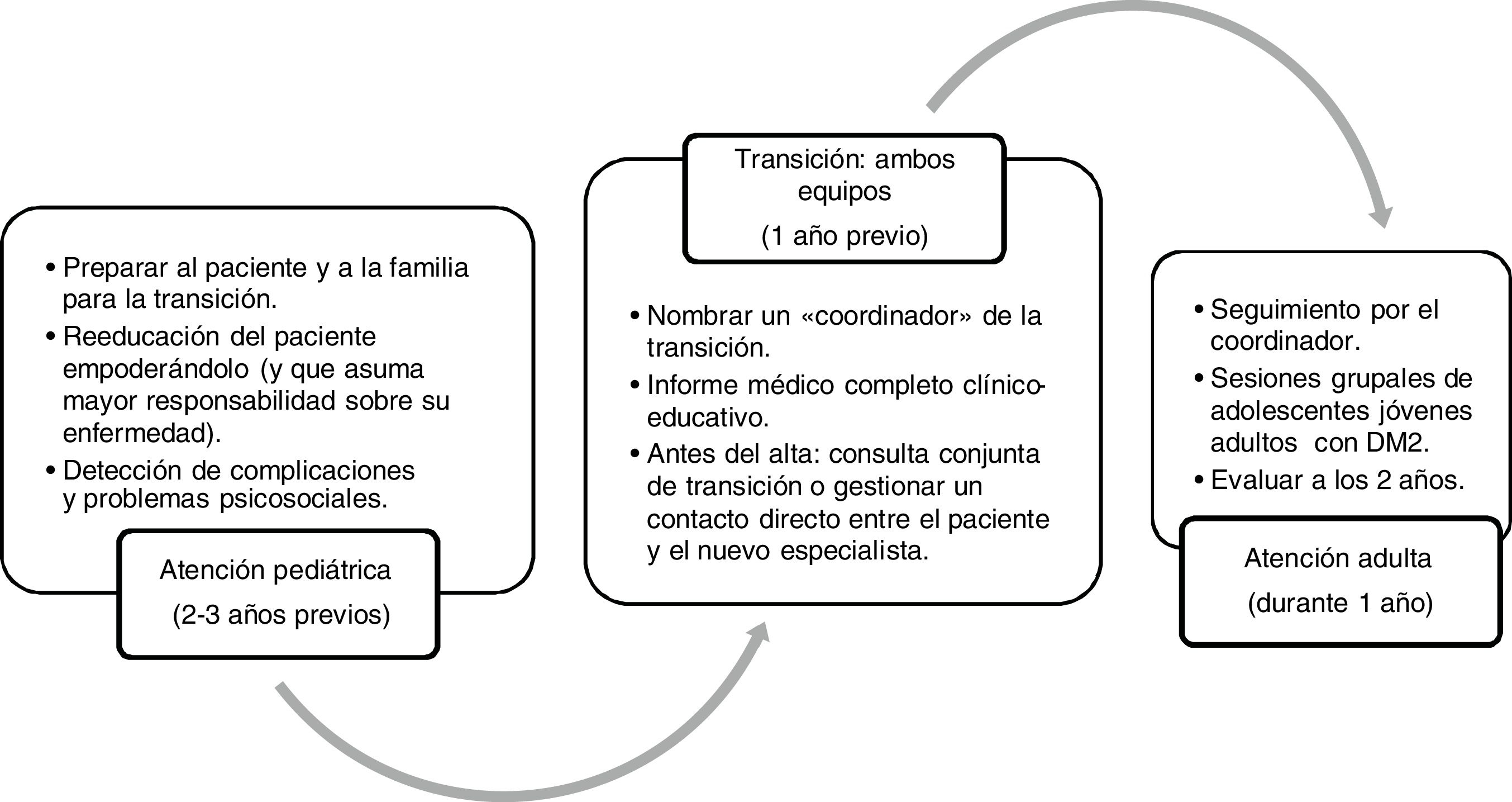
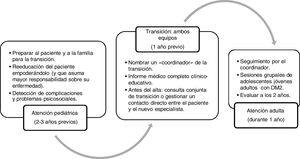
En el año 2014 la Sociedad Española de Diabetes y la Sociedad Española de Endocrinología Pediátrica elaboraron unas recomendaciones y un cronograma de transición que puede resultar útil en Atención Primaria65, y en el que durante un año trabajan conjuntamente los 2 equipos (pediátrico y de adultos) con el objetivo de concretar el momento óptimo para hacer el cambio (no suele ser antes de los 16 a 18 años, según la mayoría de estudios) y programar las actividades previas y posteriores al cambio de equipo (fig. 3).
Cronograma de la transición de la atención sanitaria de adolescentes con DM2 de la atención pediátrica a la atención adulta.
Adaptada de Rica et al.65.
Los trabajos que analizan estas etapas se han focalizado en los jóvenes con DM1. En un estudio realizado en España66 el 52% de los pacientes con DM1 presentaban peor control glucémico en la atención adulta, sin diferencias significativas en los valores medios de HbA1c entre ambas unidades y sin correlación entre el tiempo de evolución de la enfermedad y la HbA1c.
Es relevante conocer qué factores de este periodo podrían estar implicados en la consecución de peores resultados en salud de los jóvenes con DM27. Con este objetivo el estudio SEARCH67 analizó los factores relacionados con mal control glucémico asociados a la transferencia. Participaron 182 jóvenes adultos con DM2, en el 56% de los casos se había realizado esta transición a médico de familia, internista o endocrinólogo, el 29% no se transfirieron y el 15% informaron de que no seguían ninguna atención en ese momento. Aquellos casos que cambiaron de pediatría a la atención adulta, o los que no disponían de un nuevo proveedor de salud, presentaron mayor probabilidad de control glucémico subóptimo (HbA1c≥9%) durante el seguimiento, con una odds ratio de 4,5 (IC 95%: 1,8-11,2) y de 4,6 (IC 95%: 1,4-14,6), respectiva e independientemente del sexo, edad, raza/etnicidad o nivel de HbA1c basal67. Contextualizando estos datos el 74% de las personas en el grupo sin transferencia no disponía de un seguro médico, frente al 15% que sí eran seguidos en la atención adulta (p<0,0001). Las características de la cobertura sanitaria pública en España son bien distintas, con mayor oportunidad de actuación por parte de la administración sanitaria.
Actualmente existe poca evidencia de la efectividad de las intervenciones en este sentido, y la mayoría responden a opiniones y consensos de expertos68, siendo necesario seguir investigando con el objetivo prioritario de desarrollar programas clínicos y políticas sanitarias dirigidas a mejorar el control glucémico y los resultados en salud de esta población emergente de adolescentes y jóvenes adultos con DM2.
Conflicto de interesesLos autores declaran no tener ningún potencial conflicto de intereses en relación con la elaboración de este artículo.
A los miembros del GT de diabetes de la SEMERGEN que han colaborado en este artículo: Abdurrahman Adlbi Sibai, Laia Homedes Celma, Diego Murillo García, Ana Olivares Loro, Andrés Simón Fuentes y a nuestra coordinadora nacional Flora López Simarro.