La litiasis renal es una patología frecuente, constituyendo un importante problema de salud que se asocia, además, con una gran carga económica. La naturaleza de la litiasis varía según factores dietéticos, climáticos y de estilo de vida, entre otros. La mayoría de los pacientes sufrirá un nuevo episodio litiásico en algún momento de su vida, a menos que se pongan en marcha medidas preventivas para evitarlo, cambiando estilos de vida y hábitos dietéticos. Para reducir las recidivas se deben evaluar los factores de riesgo implicados en la litogénesis. El tipo de evaluación dependerá de la composición de los cálculos y de su forma de presentación clínica. Con estos estudios se pueden diagnosticar enfermedades sistémicas y renales de carácter litogénico y permiten adoptar medidas profilácticas precisas que consiguen el control de la recidiva en un gran número de pacientes.
Urolithiasis is a common disease, and is an important health problem that is associated with a great economic burden. The nature of stone disease varies according by dietary and lifestyle factors, including, among others, climate variations. The majority of patients will suffer a new lithiasic episode at some point in their life, unless preventive measures, such as changing lifestyles and dietary habits, are put in place to avoid it. The risk factors involved in lithogenesis should be evaluated in order to reduce recurrences. In the majority of these patients, metabolic changes are observed in the urine that predispose lithogenesis. The kind of evaluation depends on stone composition and on the clinical presentation. A diagnosis of systemic and renal diseases of lithogenic nature can be diagnosed with these studies, and they also enable the adoption of precise prophylactic measures that achieve control of recurrence in a great number of patients.
En las últimas décadas se ha incrementado la prevalencia de la litiasis renal en diversas partes del mundo. En Estados Unidos han pasado del 3,8% entre 1976 y 1980 al 8,8% en el período comprendido entre 2007 y 20101. En España, las cifras de incidencia y prevalencia publicadas recientemente para la población, entre 40 y 65 años, son del 2,9 y 14,6%, respectivamente2. Este incremento parece ser un fenómeno mundial que implica factores geográficos, climáticos (por incremento en las temperaturas), cambios dietéticos, la obesidad y la diabetes, factores étnicos y genéticos3.
La litiasis urinaria es además una enfermedad con alta tasa de recidiva. Después del episodio inicial, y sin ninguna medida preventiva, cerca del 50% recidivarán en el periodo de 5-10 años posteriores al primer episodio, con gran impacto en la calidad de vida de las personas afectadas. En España la tasa de recidiva, definida como más de un episodio de urolitiasis, es del 52,8%,2.
Su alta prevalencia y recurrencia hacen de la enfermedad litiásica una de las patologías urológicas que consume más recursos sanitarios y sociales en forma de pérdida de horas de trabajo. En Estados Unidos el coste anual estimado en la atención de individuos con nefrolitiasis en el año 2000 fue de unos 2.100 millones de dólares, suponiendo un incremento de casi el 50% desde 19944.
Un estudio reciente revela que la nefrolitiasis puede ser un factor de riesgo importante de enfermedad renal crónica5.
Desarrollo del temaLa litiasis urinaria es una enfermedad que depende de múltiples factores, estando en ocasiones relacionada con otras entidades patológicas que favorecen la recidiva y perpetúan la enfermedad. Hay que distinguir dos tipos de pacientes. Unos, con episodios de litiasis única, con un único episodio o que este se repite pasados varios años, donde las transgresiones y alteraciones de la dieta pueden facilitar la formación en un momento dado de una litiasis renal; de aquellos donde los episodios litiásicos se suceden con cierta frecuencia, con aparición de litiasis múltiple o bilateral, donde generalmente existen fenómenos que facilitan la aparición y formación de los cristales y su posterior agregación con relativa rapidez. En estos últimos casos, su aparición no depende de los hábitos higienicodietéticos de forma directa, aunque la aplicación de medidas preventivas puede reducir la carga litiásica6,7.
Cerca del 50% de los pacientes litiásicos tienen solo una recidiva a lo largo de su vida, siendo altamente recurrentes algo más del 10% de los pacientes8,9. Las personas que forman cálculos tienen más probabilidad de tener anomalías metabólicas urinarias en comparación con una población sana10, y aquellos con episodios recurrentes tienden a tener anomalías metabólicas más significativas que aquellos con un único episodio10. Debido a que la expulsión de un cálculo no previene la formación de nuevas litiasis, los pacientes deben ser evaluados y educados sobre la prevención de la litiasis.
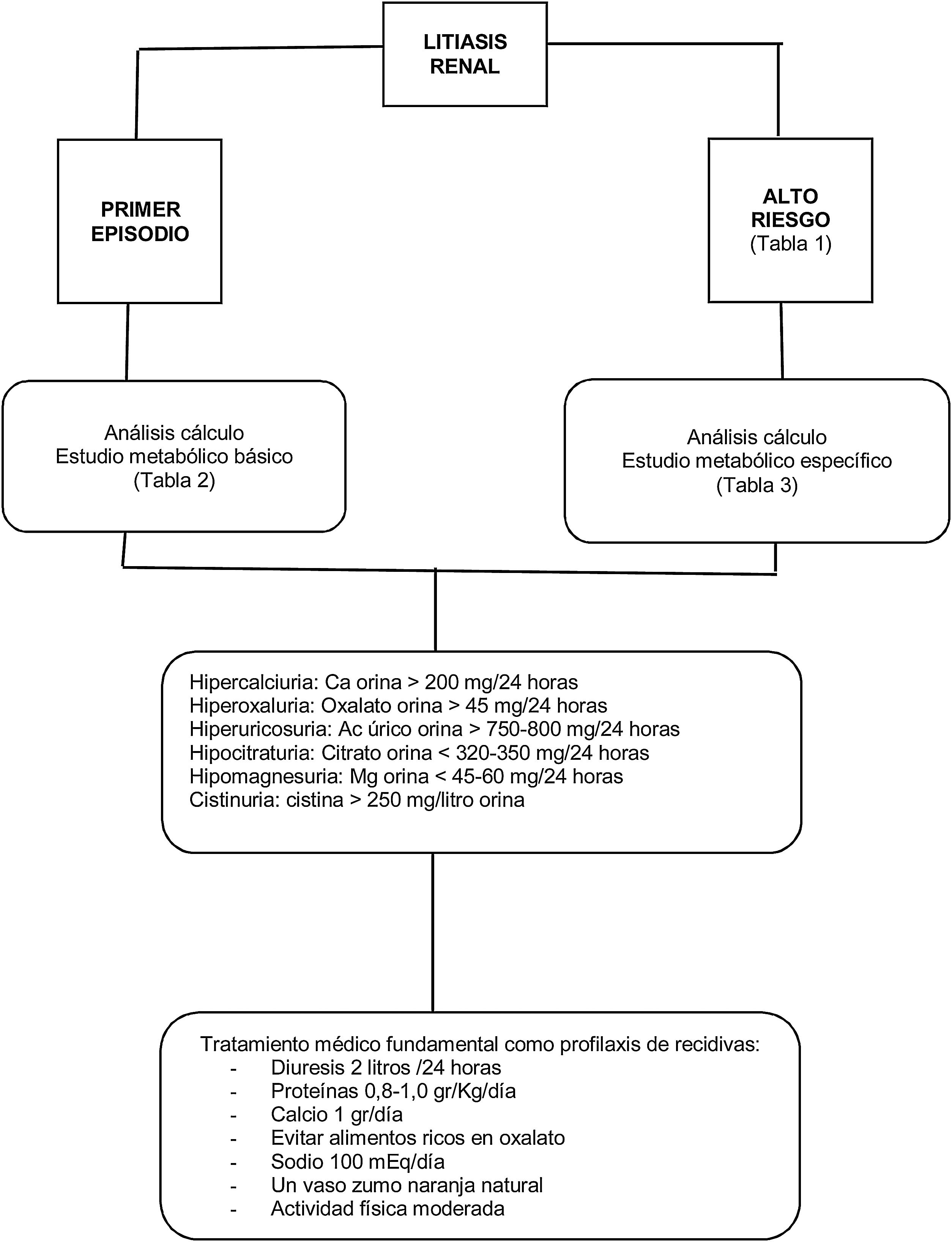
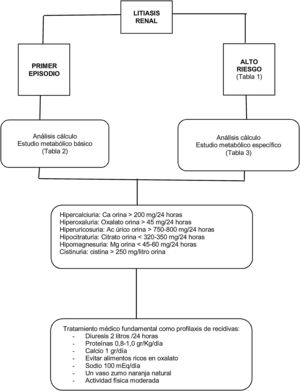
El tipo de cálculo expulsado y la severidad de la enfermedad asociada determinará el bajo o alto riesgo de recidiva (tabla 1)9,11.
Alto riesgo de formación de cálculos
| Factores generales |
| Urolitiasis a edad temprana (niños y adolescentes)Historia familiar de cálculos renalesCálculos de brushitaCálculos de ácido úrico o que contienen uratoCálculos infecciososRiñón solitario (por sí mismo no incrementa el riesgo, pero es importante la prevención) |
| Enfermedad asociada con formación de cálculos |
| Síndrome metabólicoNefrocalcinosisHiperparatiroidismoEnfermedad renal poliquísticaEnfermedades gastrointestinales (resección intestinal, derivación yeyuno-ileal, enfermedad de Crohn, síndromes malabsortivos) y cirugía bariátricaSarcoidosisLesión de médula espinal |
| Alteraciones genéticas que predisponen a cálculos |
| Cistinuria (tipos A, B, AB)Acidosis tubular renal tipo IHiperoxaluria primaria2,8-DihidroxiadeninuriaXantinuriaFibrosis quísticaSíndrome de Lesch-Nyhan |
| Fármacos asociados con formación de cálculos |
| AlopurinolAmoxicilina/ampicilinaQuinolonasCeftriaxonaEfedrinaTriamterenoIndinavirSulfamidasCalcio |
| Anormalidades anatómicas |
| Riñón en esponjaObstrucción pielo-ureteralDivertículo calicialRiñón en herraduraEstenosis ureteralUreterocele |
| Factores ambientales |
| Altas temperaturas ambientalesExposición al plomo y cadmio |
Elaboración a partir de las referencias 11 y16.
El análisis del cálculo debería realizarse en cada expulsión, incluso si ya se conoce la composición por expulsiones previas, debido a las variaciones en la composición que pueden darse en pacientes litiásicos recurrentes12.
Para reducir las recidivas se deben evaluar los factores de riesgo implicados en la litogénesis. De esta manera, podrán ponerse en marcha recomendaciones profilácticas para cada paciente. La atención del paciente litiásico, debido a su carácter recurrente, no debe quedar limitada al tratamiento del episodio en cuestión, sino también a la prevención de nuevos episodios. Los pacientes deben de estar informados en qué consisten los estudios necesarios y qué tipo de profilaxis puede ser requerida. Estos estudios proporcionan información suficiente para un tratamiento específico contra la enfermedad litiásica, consiguiendo reducir la tasa de recidiva por debajo del 25% a largo plazo13,14.
Todo paciente con un primer evento litiásico debería someterse a un estudio metabólico básico de sangre y orina (tabla 2). Este estudio debería realizarse a las tres semanas tras hematuria u obstrucción y a las dos semanas tras haberse sometido a litotricia extracorpórea por ondas de choque o a maniobra endourológica, aunque la evidencia es muy limitada para respaldar el tiempo exacto para realizar la evaluación metabólica15,16. Lo que sí está claro es que retrasar el estudio metabólico después del primer episodio litiásico conlleva empeoramiento de la calidad de vida al presentar mayor número de eventos litiásicos17.
Estudio metabólico básico
| Bioquímica sanguínea |
| CalcioÁcido úricoUreaCreatininaPotasioSodioCloruroPTH (en caso de hipercalcemia)Vitamina D (en caso de hipercalcemia) |
| Pruebas urinarias |
| Sedimento: cristaluria, nitritos, pHUrocultivo: bacterias ureolíticas |
Elaboración propia a partir de la referencia 16.
Solo los pacientes clasificados como de alto riesgo para formar litiasis requieren un estudio metabólico específico (tabla 3)16. Para ello, se requiere la recolección de dos muestras de orina consecutivas de 24 horas18, debiendo seguir el paciente su dieta habitual19. Algún trabajo nos indica que un único estudio metabólico es suficiente para evaluar de manera fiel a este tipo de pacientes20.
Estudio metabólico específico
| Bioquímica sanguínea |
| CalcioÁcido úricoUreaCreatininaPotasioSodioCloruroPTH (en caso de hipercalcemia)Vitamina D (en caso de hipercalcemia)Gasometría arterial |
| Pruebas urinarias (orina de 24 horas) |
| Volumen urinariopHSodioCreatininaÁcido úricoCalcioOxalatoCitratoMagnesio |
Elaboración propia a partir de la referencia 16.
Los estudios metabólicos de seguimiento son necesarios en aquellos pacientes que reciben tratamiento médico para prevenir recidivas21. El primer estudio de seguimiento debería realizarse entre las 8-12 semanas después del inicio del tratamiento. Esto permitirá ajustar la dosis del medicamento si los factores de riesgo urinario no se han normalizado. Una vez lograda su normalización, es suficiente realizar una evaluación de orina de 24 horas cada 12 meses.
Estudios han demostrado asociación entre urolitiasis y enfermedad cardiovascular22, estando ligada a diabetes mellitus, hipertensión arterial, obesidad, hipercolesterolemia y síndrome metabólico. Todos ellos son factores de riesgo litogénico, cardiovascular y de enfermedad renal crónica5,23. De este modo, aplicando las medidas de prevención en los pacientes con urolitiasis, podemos contribuir a una reducción de eventos cardiovasculares y del deterioro progresivo de la función renal.
Interpretación de las alteraciones metabólicas según los diferentes tipos de litiasisLas alteraciones metabólicas pueden verse influenciadas por la dieta, el estilo de vida, enfermedades sistémicas o la toma de medicamentos (tabla 4).
Medidas terapéuticas básicas según la alteración metabólica. Para cualquiera de ellas es importante consumo adecuado de líquidos
| Hipercalciuria | Dieta normocálcicaTiazidasBifosfonatosCitrato potásico |
| Hiperoxaluria | Dieta normocálcicaRestringir oxalato de la dieta (reducir consumo de: espárragos, espinacas, nabos, chocolate, té, vitamina C)Aumentar consumo de fitato (cereales integrales, frutos secos, legumbres)TiazidasCitrato potásico |
| Hiperuricosuria | Evitar sedentarismoDisminuir consumo de proteína animal (carnes rojas), vísceras y mariscoAumentar consumo de verdurasAlopurinolCitrato potásico |
| Hipocitraturia | Disminuir consumo de proteína animal (carnes rojas) y la salAumentar el consumo de frutas, verduras y jugos cítricos (naranja, limón, lima)Citrato potásico |
| Hipomagnesuria | Magnesio oral |
| Cistinuria | Aumentar notablemente el consumo de líquidosDieta hipoproteínica e hiposódicaCitrato potásico y/o bicarbonatoTiopronina, D-penicilamina, captopril |
Elaboración propia a partir de las referencias 16, 28, 29, 37, 44 y 54-56.
Entre el 30 y 60% de los pacientes con litiasis renal presentan hipercalciuria, siendo esta el factor predictivo más relevante para la recidiva litiásica. En más de la mitad de los casos la hipercalciuria se considera idiopática; es decir, no estando causada por hipertiroidismo, sarcoidosis, acidosis túbulo renal, esteroides exógenos o exceso de vitamina D24.
Existe hipercalciuria cuando el nivel de calcio es superior a 4 mg/kg de peso/orina de 24 horas, independientemente del sexo. Hoy en día se admite que el límite de la excreción de calcio en orina de 24 horas debe ser 200 mg para ambos sexos, puesto que valores superiores aumentan el riesgo de formación de litiasis.
El grupo de Pak et al.25 describía tres tipos de hipercalciuria: absortiva, renal y resortiva. Esta clasificación ha ido perdiendo interés clínico debido a las dificultades metodológicas que planteaba. Actualmente existe mayor tendencia a clasificar las hipercalciurias como absortivas y de ayuno26. En la hipercalciuria absortiva, el cociente calcio/creatinina en orina, tras el ayuno o dieta hipocálcica, es inferior a 0,11, y en la hipercalciuria de ayuno (< 5%) este cociente es superior a 0,11.
Se ha demostrado asociación entre la hipercalciuria idiopática de ayuno y la disminución de la densidad mineral ósea, con riesgo de osteopenia y osteoporosis, y mayor riesgo de fractura ósea26,27.
La hipercalciuria absortiva puede ser corregida mediante tiazidas (comenzar con 25 mg/día de hidroclortiazida) y/o dieta normocálcica. El aumento o disminución de la dosis de tiazida estará en función de las cifras tensionales y de los niveles de calciuria conseguidos. Los principales efectos secundarios de las tiazidas son hipotensión, diabetes, hiperuricemia, hipopotasemia e hipocitraturia. En la hipercalciuria de ayuno el aporte dietético adecuado de lácteos y las tiazidas consiguen reducir el calcio urinario; de este modo se previene la recidiva litiásica y se incrementa la densidad mineral ósea28. Los bisfosfonatos pueden también disminuir la excreción urinaria de calcio y las recidivas29.
Otras medidas para el tratamiento de la hipercalciuria incluyen la ingesta de líquidos y alcalinizantes (como el citrato potásico: 6-8 g/día)16. El citrato potásico puede producir trastornos gastrointestinales leves.
Litiasis cálcica con hiperoxaluriaLa hiperoxaluria se observa en el 10-20% de pacientes con litiasis cálcica. Se considera que está presente cuando la excreción renal de oxalato es superior a 45 mg en orina de 24 horas30.
La hiperoxaluria puede clasificarse como primaria (hiperproducción endógena por defectos enzimáticos a nivel del hígado)31 o secundaria (aumento de precursores, aumento en la absorción intestinal por ausencia de bacterias consumidoras o por hiperabsorción intestinal)32.
La mayor parte de pacientes con hiperoxaluria primaria van a presentar litiasis de oxalato cálcico monohidrato (95% de casos) durante la infancia, pudiendo asociarse nefrocalcinosis, depósito de oxalatos en tejidos (oxalosis) y enfermedad renal crónica33.
En cuanto a la hiperoxaluria secundaria, no debemos olvidar que el calcio es un quelante del oxalato en la luz intestinal. Por tanto, una dieta normocálcica mantiene la homeostasis del metabolismo fosfocálcico y óseo, también disminuye la absorción intestinal de oxalato.
Un papel importante en la reducción de los niveles de oxalato intestinal se debe al microorganismo Oxalobacter formigenes34, bacteria habitual del intestino. Su ausencia, por acción de los antibióticos puede facilitar la absorción intestinal de oxalato e incrementar la oxaluria.
De este modo, el tratamiento de los cálculos de oxalato cálcico incluye la ingesta de líquidos, restricción de oxalato en la dieta (espinacas, espárragos, nabos, chocolate, té, vitamina C), tiazidas para reducir la excreción de calcio y agentes alcalinizantes (citrato potásico: 6-8 g/día) que puedan inhibir el crecimiento y la agregación de oxalato cálcico16.
Litiasis cálcica con hiperuricosuriaLa hiperuricosuria se define como la excreción de ácido úrico, en orina de 24 horas, superior a 750 mg/día en mujeres o de 800 mg/día en hombres. Es factor de riesgo tanto de cálculos de ácido úrico como de oxalato cálcico35. La formación de estos últimos se cree que es debida a un proceso de nucleación heterogénea (epitaxia) sobre los cristales de ácido úrico, o bien porque el ácido úrico en orina pueda atraer inhibidores de tal forma que se favorezca la cristalización de oxalato cálcico36.
El origen más frecuente de la hiperuricosuria en países desarrollados es frecuentemente dietético, por excesivo consumo de proteínas de origen animal. Otras causas son la toma de medicamentos uricosúricos, enfermedades mieloproliferativas, la gota úrica, enfermedades intestinales inflamatorias, cirugía bariátrica y de resección intestinal.
El pilar del tratamiento se basa en la ingesta de líquido y la dieta. Otras medidas incluyen evitar el sedentarismo, la alcalinización de la orina (citrato potásico: 6-8 g/día) o el alopurinol, comenzando con dosis de 100 mg/día e incrementar hasta 300 mg/día si la respuesta sérica o urinaria de uratos no es satisfactoria16. El alopurinol debe administrarse con precaución a los pacientes con alteración de la función renal o de la función tiroidea.
Litiasis cálcica con hipocitraturiaEl citrato tiene un efecto protector triple: es un inhibidor de la cristalización de sales de oxalato y fosfato cálcico, modifica el pH de la orina e inhibe la precipitación espontánea de oxalato cálcico y la nucleación de oxalato cálcico inducida por el urato monosódico37.
Existe hipocitraturia cuando su valor está por debajo de 320-350 mg/día en ambos sexos, aunque se recomienda mantener cantidades en torno a 500 mg/día en pacientes con litiasis urinaria. Su prevalencia varía del 17 al 60%, en función de diversos factores genéticos y medioambientales37. La hipocitraturia aparece en un 20-50% de los pacientes con litiasis cálcica.
Las causas más importantes de hipocitraturia son: acidosis tubular renal distal y la diarrea crónica (Crohn, resección, by-pass ileal, colitis ulcerosa, inducida por tiazidas e idiopática38. Otras causas son las dietas ricas en proteínas animales, la hipopotasemia y el hiperaldosteronismo primario, la infección urinaria, el ejercicio físico intenso o el ayuno prolongado37.
Su tratamiento se basa en un adecuado aporte de líquidos, evitar excesos de proteínas de origen animal (< 0,8-1,0 g/kg/día) y de sal, aumentar el consumo de frutas, verduras y jugos cítricos (naranja, limón, lima), así como alcalinizar la orina (citrato potásico: 6-8 g/día)16,37.
Litiasis cálcica con hipomagnesuriaSe considera cuando los niveles de magnesio en orina de 24 horas están por debajo de 45-60 mg. Aunque aparece en el 5-10% de los pacientes con litiasis cálcica, suele estar presente en menos del 1% de pacientes con litiasis recidivante6,31.
El magnesio forma complejos con el oxalato, rediciéndose la supersaturación del oxalato cálcico. Por otro lado, los complejos de oxalato magnésico reducen la absorción intestinal de oxalato39.
Causas frecuentes de hipomagnesuria son las enfermedades inflamatorias intestinales, síndrome de malabsorción, abuso de laxantes y diarrea crónica o en resección intestinal39.
El tratamiento principal consiste en corregir la causa desencadenante y el aporte de magnesio oral (200-400 mg/día)16. El magnesio oral puede producir diarrea e hipocitraturia.
Litiasis de ácido úricoEsta litiasis se ha convertido en la segunda más frecuente después de la litiasis de oxalato cálcico. Ello se debe al incremento del síndrome metabólico y de la resistencia a la insulina por dietas o hábitos inadecuados40. Los cálculos de ácido úrico suponen el 12-15% de los pacientes litiásicos en países desarrollados.
El factor más determinante en su formación es la hiperacidez urinaria (pH < 6,0). En estos pacientes con litiasis de ácido úrico se observa como las variaciones diurnas en el pH de la orina son menores, presentando de forma permanente un pH inferior a 6,0 facilitando la precipitación de ácido úrico41. Otros factores son la hiperuricosuria y una baja diuresis42.
La hiperuricosuria asociada a hiperuricemia aparece en pacientes con gota primaria (20% de pacientes)43, enfermedades mieloproliferativas o tras quimioterapia.
La hiperuricosuria aislada es fundamentalmente consecuencia de dietas ricas en purinas o por fármacos uricosúricos.
Los cálculos puros de ácido úrico pueden ser disueltos mediante alcalinización urinaria, siendo la profilaxis muy eficaz si conseguimos mantener el pH de la orina por encima de 5,5 (suplementos de citrato). Se recomienda medidas de pH urinario con pH-metro calibrado y no con tira reactiva, en orina recogida en ayunas a las dos horas de levantarse. Si elevamos el pH por encima de 6,5 podría formarse hidroxiapatita. Otras medidas son aumentar la ingesta de líquidos (mínimo dos litros al día), evitar el consumo de proteína animal (0,8-1,0 g/kg/día), vísceras y marisco, incrementar el consumo de verduras y, en caso de hiperuricemia, tratar con alopurinol iniciando dosis de 100 mg/día44.
Litiasis infectivaEstas litiasis se forman en presencia de un pH urinario mayor de 7,2 y altos niveles de amonio, resultado del desdoblamiento de la urea por bacterias productoras de ureasa. La ectasia urinaria, catéteres o cuerpos extraños son fenómenos que mantienen un pH alcalino, contribuyendo a la formación de la litiasis infectiva31,45. La mayoría de estas litiasis están compuestas por fosfato amónico magnésico (estruvita), aunque pude estar presente una pequeña cantidad de carbonato de apatita y de urato monoamónico.
Con frecuencia tienen un curso clínico silente y cuando se diagnostican suele alcanzar un gran tamaño adquiriendo aspecto coraliforme.
Existe controversia sobre si realizar o no una evaluación metabólica en este tipo de litiasis. Algunos lo desaconsejan cuando estos cálculos son puros de estruvita, mientras que otros lo aconsejan por la alta frecuencia de alteraciones asociadas, sobre todo hipercalciuria, hipocitraturia e hiperuricosuria, en más del 60% de los pacientes46.
El tratamiento, en la mayoría de los pacientes, requiere cirugía (endourología o cirugía percutánea). El objetivo es conseguir la total eliminación de la litiasis para evitar la recidiva47. El tratamiento de la infección urinaria, que puede ser recidivante, es la mejor garantía para evitar la formación de nuevas litiasis.
Para evitar valores de pH urinario elevados (superiores a 6,0), se recomendará reducir el consumo de verduras y bebidas carbónicas, evitar los cítricos (naranja, pomelo, kiwi), tomar suplementos de L-metionina y aumentar el consumo de acidificantes (carne, pescado, arroz integral, huevos)47. En infecciones urinarias crónicas por gérmenes urealíticos, para inhibición de la ureasa, emplearemos el ácido acetohidroxámico16.
Litiasis de cistinaLa cistinuria es una enfermedad hereditaria autosómica recesiva, donde existe un defecto en el transporte tubulorrenal e intestinal de cistina, lisina, ornitina y arginina. Aunque existe un aumento de estos aminoácidos en la orina, solo la cistina tiene capacidad de formar cristales cuando su concentración alcanza los 250 mg por litro de orina48,49.
Aunque es una causa poco frecuente de litiasis (1-2% de todos los cálculos en adultos y 6-8% en población pediátrica), debemos realizar screening de cistina si se presenta cólico renal en la infancia, en casos de litiasis recidivante y/o bilateral, hermanos con litiasis o un primer episodio antes de los 30 años50.
El test más empleado para detectar la presencia de cistina en la orina de pacientes con sospecha de presentar la enfermedad es el test cualitativo de Brand (test de ciano-nitroprusiato sódico). Tiene una sensibilidad del 72% y una especificidad del 95%, pudiendo existir falsos positivos en el caso de pacientes con homocistinuria y con cetonuria51. Entre un 19-26% de pacientes homocigotos se pueden visualizar directamente en el sedimento urinario los cristales hexagonales planos y transparentes, típicos de cistina.
Para su confirmación se recomienda una determinación cuantitativa de cistina en orina de 24 horas, mediante técnica de cromatografía50.
Se recomienda realizar una evaluación metabólica ampliada en estos pacientes porque pueden estar presentes otras alteraciones como hiperuricosuria, hipocitraturia o hipercalciuria50.
En el tratamiento de este tipo de litiasis es fundamental mantener un volumen de diuresis elevado, por encima de tres litros en 24 horas, y un pH urinario mayor de 7,5 para tratar de mantener una concentración de cistina en orina inferior a 250 mg/L que evite su precipitación50. Mantener un pH urinario por encima de 8,0 aumentaría el riesgo de precipitación de sales de calcio y fosfato, con la consiguiente formación de cálculos52. Para la alcalinización es recomendable utilizar sales de potasio en vez de las sales de sodio. Ello se debe a que el aumento de la ingesta de sodio, produce un aumento en la excreción urinaria de cistina49. Otro alcalinizante empleado en asociación con el citrato potásico es la acetazolamida (250 mg antes de acostarse), inhibidor de la anhidrasa carbónica, con efecto diurético suave y alcalinizante53.
Se recomienda seguir una dieta baja en proteínas de origen animal (para disminuir la ingesta de metionina), hiposódica (para disminuir la excreción urinaria de cistina), y aumentar la ingesta de fibra54.
Si las medidas anteriores no resultan efectivas, es preciso aplicar un tratamiento farmacológico complementario. La tiopronina (α- mercaptopropionilglicina) es en la actualidad la mejor opción. Esta rompe el enlace disulfuro de la cistina formando compuestos mucho más solubles. Sus considerables efectos secundarios (trastornos digestivos, reacciones alérgicas, agranulocitosis, proteinuria, síndrome nefrótico), limitan su utilización a largo plazo16,55. La dosis inicial es de 250 mg/día con un incremento gradual dependiendo de cifras de cistinuria hasta alcanzar dosis 800-1200 mg/día.
La D-penicilamina (2 g/día en adultos) es otro de los derivados del tiol. Crea complejos que son 50 veces más solubles que la cistina, pero presenta gran variedad de efectos secundarios y un déficit de piridoxina (vitamina B6)50,56.
El captopril, en dosis de 50 mg tres veces al día, quedaría como fármaco de segunda línea y en aquellos pacientes que presenten hipertensión arterial50,55.
En la figura 1 se resume de manera esquemática el abordaje general de la litiasis renal.
Conclusiones más relevantesLa prevalencia de la litiasis está en continuo aumento en los países desarrollados. Este incremento es debido a diversos factores, destacando los cambios dietéticos y los estilos de vida de la población. El mayor consumo de proteínas de origen animal, de sal, la tendencia a una vida sedentaria, la obesidad y el síndrome metabólico, tiene una influencia determinante.
La enfermedad litiásica tiene gran tendencia a la recidiva. La mayoría de los pacientes están expuestos a padecer un nuevo episodio litiásico a lo largo de su vida. Es importante que desde el primer nivel asistencial se detecte de forma precoz a los pacientes con síndrome metabólico, pues incidir en los factores asociados no solo es beneficioso para combatir la nefrolitiasis, sino que se evitará la evolución a formas más severas y complicaciones, especialmente los eventos cardiovasculares.
Más de la mitad de los cálculos serán expulsados de forma espontánea, siendo la primera actitud desde atención primaria controlar el dolor y confirmar el diagnóstico. El estudio del cálculo expulsado y de los factores de riesgo bioquímicos y endocrinometabólicos, proporcionará al médico de primaria información suficiente para un tratamiento preventivo racional y específico, pudiendo reconocer las complicaciones que requerirán intervención especializada.
FinanciaciónNo hay ninguna relación financiera.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Comité Editorial de la revista SEMERGEN por la oportunidad que, en múltiples ocasiones, nos brinda a los especialistas la oportunidad de promover la investigación y la competencia profesional con los médicos de atención primaria.