El Mayo Clinic Multiple Myeloma Group (MCMMG) estableció un modelo de riesgo de progresión de las gammapatías monoclonales de significado incierto (GMSI) a mieloma múltiple (MM) a 20 años.
También está descrito que las GMSI con inmunoparesia (IMP), así como aquellas con un aumento progresivo de la concentración de la proteína monoclonal (PM), tienen más tendencia a progresar a MM.
Nuestro objetivo fue revisar estas GMSI y observar cómo se comportaron aquellas que presentaron IMP y/o progresión de su PM frente a las que presentaron riesgo intermedio/alto y alto, según MCMMG.
Material y métodosSe revisaron las GMSI durante la realización de electroforesis sérica (EFs) de 2010-2014 en nuestra área. A todas las GMSI se les determinaron inmunoglobulinas séricas, inmunofijación sérica (IFs) y cociente de cadenas ligeras libres séricas (cociente κ/λ libres).
ResultadosDe las 153 GMSI a las que se realizó seguimiento, seis progresaron a MM. De estos seis mielomas, cinco progresaron con riesgo intermedio/alto, teniendo en cuenta la clasificación MCMMG. De estas cinco, tres presentaron IMP o progresión de su PM, dos presentaron IMP más progresión de su PM. El sexto MM evolucionó desde una GMSI sin ningún factor de riesgo, según MCMMG, pero con progresión de su PM más IMP.
ConclusionesCon base en los datos observados, IMP y/o la progresión de la PM podrían ser factores de riesgo importantes a tener en cuenta en las GMSI en los primeros años tras su diagnóstico, por su posible evolución a MM.
Based on risk factors, the Mayo Clinic Multiple Myeloma Group (MCMMG) established a model of progression from monoclonal gammopathy of undetermined significance (MGUS) to multiple myeloma (MM) at 20 years.
It is also described that MGUS with a progressive increase of monoclonal protein (M-protein) and/or immunoparesis (IMP) may be more predisposed to progress to myeloma.
Our objective was to make a review of MGUS, to see how those who presented IMP and/or progression of their M-protein, contrasting them with MGUS that presented intermediate/high and high risk according to MCMMG.
Methodology and materialsA review of the MGUS objectified during the realization of a serum proteinogram (SPEP) was carried out during 2010–2014, in our area. Serum immunoglobulins, serum immunofixation (IFs), and serum free light chain ratio (FLCr) were determined for all MGUS.
ResultsOf the 153 MGUS that are followed up for 4 years, 6 progress to MM. Of these 6 MM, 5 progress from MGUS with intermediate/high risk taking into account the MCMMG. Of these 5, 3 have IMP or progression of their M-protein. 2 present IMP plus progression of their M-protein. The sixth MM evolves from a MGUS without any risk factor, but with progression of its M-protein plus IMP.
ConclusionsIMP and/or M-protein progression are important risk factors to be taken into account in the MGUS, in the first years after diagnosis, due to their possible evolution to MM.
Las gammapatías monoclonales son un grupo de desórdenes caracterizados por la proliferación de células plasmáticas clonales en médula ósea (MO), que producen una proteína monoclonal (PM). La más común de estas es la gammapatía monoclonal de significado incierto (GMSI), caracterizada por la presencia de una PM menor de 3 g/dL, menos del 10% de células plasmáticas clonales en MO, ninguno de los criterios que clásicamente definen el mieloma: (hipercalcemia, insuficiencia renal, anemia o lesiones óseas) ni biomarcadores de malignidad relacionados con el MM (porcentaje de células plasmáticas de médula ósea clonal ≥ 60%, cociente de cadena ligera involucrada/no involucrada ≥ 100 y > 1 lesiones focales en estudios de resonancia magnética)1,2. El riesgo de progresión a MM u otros procesos relacionados es aproximadamente de un 1% al año3, siendo la evolución a MM la más frecuente.
Entre los factores de riesgo de progresión a MM que han sido propuestos se encuentran: el tamaño del clon de la GMSI, determinado como porcentaje de células plasmáticas en MO4–9 o concentración de la PM3–16; el isotipo de la cadena pesada (IgA o IgM)3,4,8,10–14, un cociente κ/λ libres anormal10,17,18; la presencia de proteinuria de Bence-Jones4,6,16; detección de células plasmáticas circulantes13; heterogeneidad clonal19; aneuploidia del DNA determinado por citometría de flujo6; metafases anormales mediante citogenética19 y anormalidades en cromosomas: del (17p) y t(4;14).
El Mayo Clinic Multiple Myeloma Group (MCMMG) ha construido un modelo de riesgo de progresión de GMSI a MM, basado en el tamaño de la PM (≥ 15 g/L), el isotipo (IgA o IgM) y la presencia de un cociente κ/λ libres anormal (normal 0,26-1,6)10,20. En este modelo, el riesgo de progresión en 20 años fue del 5% para pacientes sin factores de riesgo (bajo riesgo), 21% para pacientes con un factor de riesgo (riesgo bajo-intermedio), 37% para pacientes con dos factores de riesgo (riesgo intermedio-alto) y 58% para pacientes con los tres factores de riesgo (riesgo alto). Las GMSI con riesgo intermedio/alto y riesgo alto son las que requieren un control más estricto, debiendo revisarlas a los seis meses después de su detección para observar su evolución y posteriormente de forma anual de por vida, a menos que presenten síntomas20.
Aunque las GMSI con isotipo IgM suponen un factor de riesgo en el modelo MCMMG, Rajkumar et al. reclasificaron las GMSI en IgM (15%) y no IgM (85%)2. Kyle et al.21 consideraron que las GMSI IgM con dos factores de riesgo, según la clasificación MCMMG (tamaño de la PM ≥ 15 g/L y la presencia de un cociente κ/λ libres anormal) se asocian con un riesgo de progresión a los 20 años del 55%, en comparación con el 41% de los pacientes que tenían un factor de riesgo adverso y el 19% de los pacientes que no tenían ningún factor de riesgo.
También están descritos como factores de progresión la supresión de células plasmáticas no clonales, lo que explicaría la inmunoparesia (IMP)4,6,14,16,22, presente en un 30-40% de los pacientes con GMSI y el aumento progresivo de la concentración de la PM, que incrementa el riesgo de progresión a MM en el 20% de las GMSI6,23–25. Además, la presencia de IMP en el MM recién diagnosticado se asoció con un efecto negativo en la supervivencia del paciente y el control de la enfermedad26.
Así, una GMSI cuya PM progrese tiene un alto riesgo de desarrollar MM (80% a los 20 años)6 y de acortar el tiempo de progresión, pero si permanece estable entre tres y cinco años tiene baja probabilidad de progresión y puede considerarse benigna7.
Nuestro objetivo fue hacer una revisión de las GMSI diagnosticadas en un periodo de cuatro años y evaluar cómo progresaron aquellas que presentaron IMP y/o progresión de su PM, frente a las que presentaron riesgo intermedio/alto y alto clasificadas según los criterios MCMMG, con el fin de dar a conocer herramientas que ayuden al médico de atención primaria a reconocer signos y alteraciones analíticas que puedan llevar a una progresión de esta patología en sus pacientes.
Material y métodosPoblación estudiadaSe trata de un estudio observacional, descriptivo y retrospectivo. Se revisaron las historias clínicas de 278 pacientes con GMSI, detectadas mediante la realización de electroforesis sérica (EFs) de forma rutinaria entre los años 2010 a 2014 en el Hospital Universitario de Badajoz y su área de salud. Se seleccionaron 153, a los que se les había solicitado de forma periódica la analítica correspondiente a su estado durante un periodo de cuatro años. A las GMSI sin factores de riesgo o con un factor de riesgo, según MCMMG, se les solicitó una analítica anual; a las GMSI con dos y tres factores de riesgo se les solicitó analítica cada seis meses, excepto cuando la cuantificación de su PM fuera superior a 15 g/L, en cuyo caso fueron estudiadas cada tres meses.
A las GMSI que permanecieron estables durante el primer año, se les solicitó una analítica de forma anual, excepto en aquellas que presentaron alguna sintomatología relacionada con el MM durante ese periodo. A todas las muestras se les determinaron inmunoglobulinas séricas (IgG, IgA e IgM), IFs y cociente κ/λ libres.
Todas tuvieron una PM < 30 g/L y un cociente de cadenas ligeras libres sérico < 100, representando este cociente la cadena ligera libre involucrada/cadena ligera libre no involucrada. Los pacientes no mostraron evidencia de síntomas clínicos (hipercalcemia, insuficiencia renal, anemia o lesiones óseas).
Las 153 GMSI se clasificaron en función de los factores de riesgo definidos por MCMMG, de la progresión de su PM y/o IMP. Con base en que tuvieran uno, dos o tres factores de riesgo, según MCMMG, fueron clasificadas en: GMSI sin ningún factor de riesgo (GMS-NFR), GMSI con un factor de riesgo (GMSI-1FR), GMSI con dos factores de riesgo (GMSI-2FR) y GMSI que presentaban tres factores de riesgo (GMSI-3FR). Con base en que tuvieran IMP o progresión de su PM fueron clasificadas en: I/P 0 (no presentaban IMP ni progresión de su PM); I/P 1 (presencia de IMP o progresión de su PM); I/P 2 (presencia de IMP más progresión de su PM).
Se definió la inmunoparesia como la inmunoglobulina no implicada por debajo de los valores de referencia (IgG < 7 g/L, IgA < 0,70 g/L y/o IgM < 0,4 g/L) en el momento del diagnóstico27.
Se definió el término GMSI progresiva, para aquellas GMSI en las que se observaba un aumento del 10% de la PM en tres mediciones, separadas seis meses a lo largo de tres años7,28.
Obtención de las muestrasLa extracción de las muestras se realizó entre las 8-10 h de la mañana. Se obtuvo el suero por centrifugación a 3.000 rpm durante 5 min. La EFs, la cuantificación de inmunoglobulinas y de las cadenas ligeras libres se realizaron en la misma mañana. La IFs fue realizada tras conservar las muestras séricas 24 h a 4°C en todos los casos.
Métodos analíticosLa EFs fue realizada usando un sistema de electroforesis capilar, CAPILLARYS 2 (Sebia, París-Francia). La IFs se realizó en el sistema semiautomatico Hydrasis (Sebia, París-Francia), siguiendo el protocolo de trabajo establecido por Sebia para la realización de la IFs en el gel de agarosa (Hydragel 2/4 IF).
Las inmunoglobulinas IgG, IgA e IgM se cuantificaron por nefelometría en un autoanalizador BN II (Siemens, Marburg-Alemania). La cuantificación de cadenas ligeras libres se realizó por nefelometría en un autoanalizador BN Prospec (Siemens, Marburg-Alemania) y se utilizó un inmunoensayo homogéneo altamente sensible (Freelite TM, The Binding Site, Birminghan, UK).
Análisis estadísticoEl tratamiento de los datos fue realizado usando la hoja de cálculo Excel (Office Software) y el programa estadístico SPSS para Windows. SPSS 20.0 y Excel 2010.
Se han seguido las directrices éticas en todo el estudio y ha sido aprobado por el Comité Ético del centro.
ResultadosDe los 153 pacientes con GMSI, seis evolucionan a MM. El grupo I/P 1 estaba formado por 57 GMSI, de las cuales, 26 presentaban IMP y 31 presentaron progresión de su PM. De estas 57, las tres que progresaron a MM presentaban además dos factores de riesgo según MCMMG. El grupo I/P 2 estaba compuesto por 16 GMSI, de las cuales tres progresaron a MM, pero una de ellas no tenía ningún factor de riesgo, según MCMMG (tabla 1).
Clasificación de las gammapatías monoclonales de significado incierto (GMSI) en grupos de riesgo
| Clasificación de las GMSI en grupos de riesgo | ||||||
|---|---|---|---|---|---|---|
| Clasificación según MCMMG | ||||||
| GMSI-NFR | GMSI-1FR | GMSI-2FR | GMSI- 3FR | Total | ||
| I/P 0 | 30 | 37 | 13 | 0 | 80 | |
| I/P 1 | 7 | 28 | 21 (3*) | 1 | 57 | |
| I/P 2 | 1 (1*) | 7 | 8 (2*) | 0 | 16 | |
| Total | 38 | 72 | 42 | 1 | 153 | |
GMSI-NFR: GMSI sin factores de riesgo; GMSI-1FR: GMSI con un factor de riesgo; GMSI-2FR: GMSI con dos factores de riesgo; GMSI-3FR: GMSI con tres factores de riesgo; I/P 0: GMSI sin inmunoparesia o progresión de su PM; I/P 1: GMSI con inmunoparesia o progresión de su PM; I/P 2: GMSI con inmunoparesia + progresión de su PM; MCMMG: Mayo Clinic Multiple Myeloma Group.
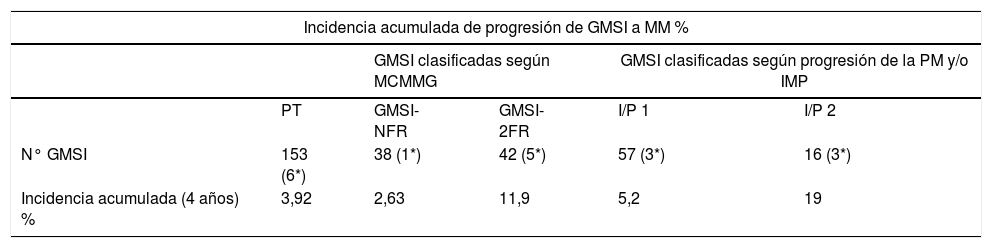
Se calculó también la incidencia acumulada de aparición de MM durante el periodo de seguimiento de cuatro años:
a) En los grupos clasificados según MCMMG, en los que las GMSI evolucionaron a MM.
b) En los grupos de GMSI que presentaban IMP y/o progresión de su PM, que evolucionaron a MM, siendo el grupo I/P 2, el que presentó mayor incidencia acumulada de MM (tabla 2).
Incidencia acumulada de progresión de gammapatía monoclonal de significado incierto (GMSI) a mieloma múltiple (MM)
| Incidencia acumulada de progresión de GMSI a MM % | |||||
|---|---|---|---|---|---|
| GMSI clasificadas según MCMMG | GMSI clasificadas según progresión de la PM y/o IMP | ||||
| PT | GMSI- NFR | GMSI-2FR | I/P 1 | I/P 2 | |
| N° GMSI | 153 (6*) | 38 (1*) | 42 (5*) | 57 (3*) | 16 (3*) |
| Incidencia acumulada (4 años) % | 3,92 | 2,63 | 11,9 | 5,2 | 19 |
PT: población total de GMSI; GMSI-NFR: GMSI sin factores de riesgo; GMSI-2FR: GMSI con dos factores de riesgo; I/P 1: GMSI con inmunoparesia o progresión de su PM; I/P 2: GMSI con inmunoparesia + progresión de su PM; MCMMG: Mayo Clinic Multiple Myeloma Group.
En vista de nuestros resultados:
a) Se podrían considerar de muy bajo riesgo las GMSI que no presenten IMP o progresión de su PM (I/P 0).
b) Las GMSI que presenten IMP o progresión de su PM (I/P 1) tendrían un riesgo medio bajo de progresión a MM.
c) Las GMSI que presenten IMP más progresión de su PM (IMP 2) tendrían un riesgo alto de progresión a MM.
DiscusiónEl estándar actual de atención para la GMSI es monitorizar la progresión a MM, en función de los diversos factores de riesgo propuestos3-19 o de modelos de progresión10,20. Estos factores de riesgo o modelos de progresión nos pondrán de manifiesto las GMSI que tienen mayor riesgo de evolucionar a MM, sobre todo en un corto periodo de tiempo, y diferenciarlas de aquellas cuya PM puede permanecer estable. Esto nos permitiría intervenciones tempranas, derivando en una mejor supervivencia general y una reducción de las complicaciones29,30.
De esta forma, en el modelo de progresión establecido por MCMMG10,20, las GMSI con riesgo intermedio-alto y alto tienen más posibilidades de evolucionar a MM en 20 años10. Estas GMSI son a las que deberían realizarse controles analíticos al cabo de seis meses tras su detección, para ver su evolución, y después anualmente de por vida, a menos que presenten síntomas relacionados, tal como proponen Kyle et al.20 Sin embargo, estos criterios no siempre ponen de manifiesto a pacientes que tienen morbilidad asociada a GMSI31; los pacientes con GMSI tienen una supervivencia más corta que una población de control emparejada por edad y sexo2, y tampoco ponen de manifiesto a todas las GMSI que puedan evolucionar a MM. Como se observa en la tabla 1, cinco GMSI-2FR evolucionaron a MM, pero a su vez, estas cinco GMSI presentaron IMP y/o progresión de su PM, factores de riesgo ya descritos por diferentes autores3,4,6,7,14,16,22. De igual forma, en la tabla 1 se observa que una GMSI del grupo GMSI-NFR, que tiene estipulado un bajo factor de riesgo de progresión (< 5%), evolucionó a MM, pero presentaba IMP y progresión de su PM.
Cuando se estudió la evolución de las GMSI en función de la IMP y/o la progresión de su PM, 80 de ellas (grupo I/P 0) no presentaban estas características, es decir, no presentaban la IMP y su PM permaneció estable. Ninguna GMSI de este grupo progresó a MM en los primeros cuatro años tras su diagnóstico. Una GMSI cuya PM permanece estable durante los tres primeros años desde su diagnóstico tiene muy bajo riesgo de progresar a MM y podría considerarse benigna7. Dentro de este grupo se observaron 13 GMSI-2FR que no evolucionaron a MM.
Por otro lado, los seis MM que evolucionaron desde GMSI presentaban la IMP y/o la progresión de su PM.
Además de que la IMP sea un factor de riesgo, el progresivo incremento de la PM durante los tres primeros años es un importante predictor de transformación maligna7. Cuando las GMSI presentaron ambos factores de riesgo (I/P 2) en nuestra población (16 casos, 10% del total de GMSI), la incidencia de MM en este grupo fue superior al resto, un 19% en cuatro años.
De esta forma, ante la detección casual de una PM en la EFs generalmente solicitada de forma rutinaria por su médico de atención primaria, debería solicitarse una EFs cada seis meses durante el primer año y después de forma anual durante los siguientes años, para verificar si la PM permanece estable o progresa, siempre que no haya síntomas clínicos relacionados con el MM ni biomarcadores de malignidad relacionados con el MM (principalmente un cociente de cadena ligera involucrada/no involucrada ≥ 100)1,2. Estos pacientes con mayor riesgo se podrían beneficiar de terapias para la erradicación de las GMSI, o evitar su progresión, como sucede con el anticuerpo monoclonal anti-CD38 (daratumumab)32. Los pacientes con menor riesgo se podrían beneficiar de terapias más inocuas para prevenir la progresión, como el extracto de té verde, curcumina o antiinflamatorios no esteroideos33,34.
El presente trabajo fue un trabajo de revisión. Es una población pequeña, el número de casos de MM fue escaso para establecer unos factores pronósticos con confianza, así como el periodo de cuatro años de revisión, que fue corto, por lo que no se pudo realizar el estudio de factores pronósticos.
Se necesitarán más años para seguir estudiando la evolución de estos pacientes.
ConclusiónEn nuestra serie, los pacientes con GMSI que más riesgo tienen de progresar a mieloma múltiple son aquellos que presentan IMP, junto con progresión de la PM. Son estos casos sobre los que el médico de atención primaria podría realizar un mayor control clínico y analítico. Esto podría servir para realizar algoritmos de seguimiento en atención primaria y criterios de derivación a hematología.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses ni de ningún otro tipo.