Conocer los microorganismos más frecuentes en nuestro medio nos puede ayudar a tomar decisiones terapéuticas empíricas. El objetivo del estudio fue evaluar la etiología microbiológica de las neumonías adquiridas en la comunidad.
Pacientes y métodosEstudio observacional descriptivo prospectivo. Se incluyeron sujetos≥14 años con diagnóstico clínico-radiográfico de neumonía adquirida en la comunidad durante 383 días consecutivos. Se recogieron variables sociodemográficas, antecedentes personales, escalas pronósticas de gravedad, evolución y agentes patógenos. Para obtener un diagnóstico etiológico se realizaron hemocultivos, detección de antígenos urinarios de Streptococcus pneumoniae y Legionella pneumophila, cultivo de esputo, virus influenza y detección de Streptococcus pyogenes. Se describieron las variables categóricas como valor absoluto y porcentaje y las variables continuas por sus medias y desviaciones estándar.
ResultadosFueron incluidos en el estudio 287 pacientes (42% mujeres; edad media 66±22 años). Falleció el 10,45%, ingresando el 70%. Se consiguió un diagnóstico etiológico en 43 pacientes (14,98%), determinándose 16 microorganismos en 59 muestras positivas. El patógeno más frecuentemente aislado fue Streptococcus pneumoniae (24/59, 41%), seguido de bacilos entéricos gramnegativos, Klebsiella pneumoniae, Escherichia coli, Serratia marcescens y Enterobacter cloacae, aislados en un 20% de las muestras (12/59), virus influenza (5/59, 9%), Staphylococcus aureus, todos resistentes a meticilina (3/59, 5%), Pseudomonas aeruginosa (2/59, 3%), Moraxella catarrhalis (2/59, 3%), Legionella pneumophila (2/59, 3%) y Haemophilus influenzae (2/59, 3%). Las infecciones polimicrobianas supusieron el 14% (8/59).
ConclusiónEncontramos un alto porcentaje de microorganismos no habituales en neumonías adquiridas en la comunidad.
Knowing the most common microorganisms in our environment can help us to make proper empirical treatment decisions. The aim is to identify those microorganisms causing community-acquired pneumonia.
Patients and methodsAn observational, descriptive and prospective study was conducted, including patients over 14 years with a clinical and radiographic diagnosis of community-acquired pneumonia during a 383 consecutive day period. A record was made of sociodemographic variables, personal history, prognostic severity scales, progress, and pathogenic agents. The aetiological diagnosis was made using blood cultures, detection of Streptococcus pneumoniae and Legionella pneumophila urinary antigens, sputum culture, influenza virus and Streptococcus pyogenes detection. Categorical variables are presented as absolute values and percentages, and continuous variables as their means and standard deviations.
ResultsOf the 287 patients included in the study (42% women, mean age 66±22 years), 10.45% died and 70% required hospital admission. An aetiological diagnosis was achieved in 43 patients (14.98%), with 16 microorganisms found in 59 positive samples. The most frequently isolated pathogen was Streptococcus pneumonia (24/59, 41%), followed by gram-negative enteric bacilli, Klebsiella pneumonia, Escherichia coli, Serratia marcescens and Enterobacter cloacae isolated in 20% of the samples (12/59), influenza virus (5/59, 9%), methicillin-resistant Staphylococcus aureus (3/59, 5%), Pseudomonas aeruginosa (2/59, 3%), Moraxella catarrhalis (2/59, 3%), Legionella pneumophila (2/59, 3%), and Haemophilus influenza (2/59, 3%). Polymicrobial infections accounted for 14% (8/59).
ConclusionA high percentage of atypical microorganisms causing community-acquired pneumonia were found.
La neumonía adquirida en la comunidad (NAC) es un problema sanitario, social y económico de grandes dimensiones al tratarse de una de las principales causas de muerte en el mundo. Se considera que en EE. UU. cada año se producen más de 5 millones de NAC, con más de un millón de ingresos1. Según la European Respiratory Society es la primera causa de muerte por infección en nuestro continente2. La incidencia en nuestro país se estima entre 1,6 y 10 casos por 1.000 habitantes y año en España3.
La evolución de la NAC depende de las características del huésped, de la celeridad a la hora de establecer el diagnóstico, del lugar donde se proporcionen los cuidados y del tratamiento y las medidas de soporte instauradas. Determinar el agente etiológico no siempre es posible en el momento del acercamiento al paciente. Por tanto, conocer los microorganismos más frecuentes en nuestro medio nos puede ayudar a la toma de decisiones terapéuticas empíricas.
En una enfermedad en la que la incidencia se incrementa marcadamente con la edad, ante un momento demográfico de envejecimiento poblacional y un aumento de los cuidados sanitarios domiciliarios y en residencias asistidas, el conocer los agentes causales predominantes puede ser relevante para los médicos que trabajamos en el ámbito generalista4.
Por tanto, proponemos un estudio en el que evaluamos la etiología microbiológica de las NAC diagnosticadas en un SUH durante un año.
Pacientes y métodosSe diseñó un estudio observacional descriptivo en el que se recogieron prospectivamente los pacientes diagnosticados de NAC en un servicio de urgencias de un hospital de 130 camas del norte de España, que otorga cobertura a una población aproximada de 100.000 personas.
Se incluyeron sujetos de 14 años o mayores con diagnóstico clínico-radiográfico de NAC durante 383 días consecutivos. Para el diagnóstico de NAC había que cumplir criterios clínico-radiológicos de neumonía y criterios de NAC a juicio de los médicos que realizaban la asistencia. Posteriormente se efectuó una revisión de las radiografías por un especialista en radiodiagnóstico que no participó en la selección ni el seguimiento de los pacientes. Se definió neumonía si cumplía 2 o más de los siguientes requisitos: fiebre de comienzo súbito o con escalofríos, dolor torácico pleurítico, expectoración purulenta, herrumbrosa o hemática, semiología de condensación a la auscultación y disnea sin otra causa que la justifique, acompañada de una condensación en la radiografía torácica. Definimos NAC como aquella que se desarrolla en un paciente que no ha sido hospitalizado en los últimos 14 días, y en el caso de ingreso, aparece en las primeras 48h. Excluimos a los pacientes infectados por el VIH con linfocitos CD4<100/mm3, tratamiento crónico con inmunosupresores, neoplasia con tratamiento inmunosupresor en los últimos 3 meses, criterios de enfermedad terminal con pronóstico vital menor a 6 meses, tratamiento con más de 15mg de prednisona al día o dosis bioequivalente de corticoides, tuberculosis activa, fibrosis quística y probabilidad alta de enfermedad tromboembólica pulmonar.
Se recogieron variables sociodemográficas, antecedentes personales, escalas pronósticas de gravedad, datos evolutivos y agentes patógenos. Se realizó estudio microbiológico a decisión de los médicos responsables. Con el fin de obtener un diagnóstico etiológico se realizaron los siguientes procedimientos: 1) detección de bacterias en sangre mediante sistema automatizado de agitación continua que detecta el CO2 producido por el metabolismo bacteriano a través de un sistema de fluorescencia; 2) detección de antígenos urinarios de Streptococcus pneumoniae mediante técnica inmunocromatográfica que detecta el antígeno soluble del polisacárido C del neumococo; detección del antígeno urinario del serogrupo 1 de Legionella pneumophila mediante test inmunocromatográfico; 3) cultivo de esputo sembrado en placa agar sangre, agar chocolate y agar MacConkey con examen posterior de las placas incubadas; 4) para el diagnóstico del virus influenza se recogieron muestras oronasofaríngeas con hisopo, que se analizaron mediante prueba de diagnóstico rápido que utiliza un análisis inmunocromatográfico para la detección cualitativa de los antígenos de las nucleoproteínas de la gripe; en todas las muestras oronasofaríngeas se realizó diagnóstico biológico molecular por técnicas de amplificación genómica por métodos de reacción en cadena de la polimerasa; 5) detección de Streptococcus pyogenes mediante test rápido de inmunoanálisis cromatográfico para la detección cualitativa de antígenos en muestras de hisopos de garganta.
Consideramos la etiología de la neumonía definitiva si se aislaba una bacteria patógena en hemocultivos en ausencia de un foco extrapulmonar, se aislaba un patógeno respiratorio habitual en un cultivo de esputo que cumplía los criterios de Murray-Washington, se diferenciaba por tinción de Gram, si la antigenuria era positiva para Streptococcus pneumoniae o Legionella pneumophila, si había positividad para Streptococcus beta-hemolítico grupo A por determinación rápida y cultivo posterior y virus influenza positivo por test rápido de inmunocromatografía y diagnóstico molecular por reacción en cadena de la polimerasa.
Para la realización del análisis estadístico se describieron las variables categóricas como valor absoluto y porcentaje, y las variables continuas, por sus medias y desviaciones estándar o medianas y rangos intercuartílicos en función de la normalidad de la distribución. Previamente se comprobó el tipo de distribución gaussiana para las variables cuantitativas por medio del test de la Z de Kolmogorov-Smirnov.
Para evaluar las diferencias entre el grupo en el que se realizó estudio etiológico y el grupo en el que no, se empleó el test de ji al cuadrado o el test de Fisher para variables cualitativas, y el test U de Mann-Whitney para las variables cuantitativas. También se realizó un análisis de los microorganismos aislados más frecuentemente, neumococo y enterobacterias, por los subgrupos de edad, mayor y menor de 65 años, sexo y enfermedad respiratoria crónica. Los valores de p<0,05 fueron considerados estadísticamente significativos.
Este estudio fue diseñado siguiendo los principios éticos de la Declaración de Helsinki y fue evaluado positivamente por el Comité Ético de Investigación Clínica de Cantabria y la Comisión de Docencia del hospital en que se realizó el trabajo de campo.
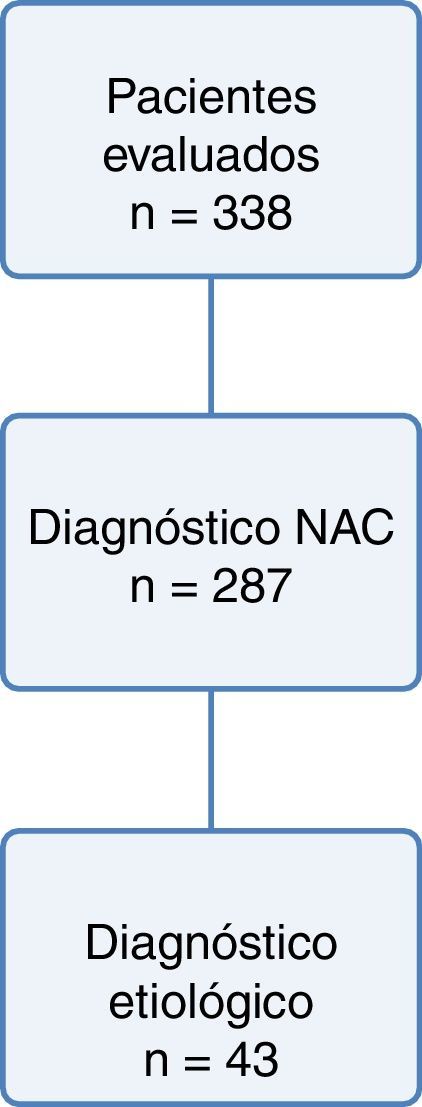
ResultadosSe estudiaron 338 pacientes. Fueron diagnosticados de NAC e incluidos en el estudio 287 pacientes (42% mujeres; edad media 66±22 años) (fig. 1). El 8% presentaban historia de insuficiencia cardiaca, el 6%, de insuficiencia renal crónica, el 8%, de cardiopatía isquémica, el 12%, de deterioro cognitivo, y el 6%, de enfermedad vascular cerebral. Según la escala Pneumonia Severity Index (PSI), el 25% de los pacientes pertenecían al estrato de riesgo i, el 14%, al ii, el 22%, al iii, el 27%, al iv, y el 13%, al v. El 64% de los pacientes tenían 0-1 puntos según la herramienta pronóstica CURB-65 (escala que utiliza 5 variables: confusión, frecuencia respiratoria, tensión arterial, edad≥65 años y la urea >44mg/dl), 2 puntos el 21%, y el 15%, 3-5 puntos. El 70% de los pacientes ingresaron (3% en UCI), falleciendo el 10,45% de aquellos que fueron estudiados. Las características generales de la muestra se exponen en la tabla 1.
Características generales de la muestra. Variables demográficas, comorbilidad y gravedad (n=287)
| Variables | Valor absoluto (%) |
|---|---|
| Variables demográficas | |
| Edad (años) | 66±22 |
| Sexo mujer | 121 (42%) |
| Sexo varón | 166 (58%) |
| Comorbilidad | |
| Insuficiencia cardiaca | 23 (8%) |
| Cardiopatía isquémica | 24 (8%) |
| Insuficiencia renal crónica | 16 (6%) |
| Enfermedad respiratoria crónica | 53 (19%) |
| HTA esencial | 120 (42%) |
| DM-1 | 1 (0,3%) |
| DM-2 | 55 (19%) |
| Hepatopatía crónica | 8 (3%) |
| Enfermedad vascular cerebral | 18 (6%) |
| Enfermedad psiquiátrica grave | 5 (2%) |
| Deterioro cognitivo | 33 (12%) |
| Neoplasia | 23 (8%) |
| Sida | 4 (1%) |
| Enfermedad que impide tratamiento oral | 1 (0,3%) |
| Obras en domicilio o lugar de trabajo | 6 (2%) |
| Convivencia con animales | 37 (13%) |
| Gravedad | |
| PSI I (<51 puntos) | 73 (24%) |
| PSI II (51-70 puntos) | 40 (14%) |
| PSI III (71-90 puntos) | 62 (22%) |
| PSI IV (91-130 puntos) | 76 (27%) |
| PSI V (>130 puntos) | 36 (13%) |
| PSI variable cuantitativa (puntos) | 84±41 |
| CURB-65 1 (0-1 puntos) | 183 (64%) |
| CURB-65 2 (2 puntos) | 60 (21%) |
| CURB-65 3 (3-5 puntos) | 44 (15%) |
| CURB-65 variable cuantitativa (puntos) | 1 (2) |
| Alta a domicilio | 85 (30%) |
| Ingreso planta convencional y UCI | 202 (70%) |
| Ingreso UCI | 8 (3%) |
| Traslado a otro hospital | 2 (0,7) |
| Exitus | 30 (10,5%) |
CURB-65: Confusion, blood Urea nitrogen, Respiratory rate, systolic Blood pressure/diastolicBlood pressure,>65 («confusión, concentración de urea, frecuencia respiratoria, tensión arterial y edad mayor de 65 años»); DM-1: diabetes mellitus tipo 1; DM-2: diabetes mellitus tipo 2; HTA: hipertensión arterial; PSI: Pneumonia Severity Index; Sida: síndrome de inmunodeficiencia humana adquirida; UCI: Unidad de Cuidados Intensivos.,
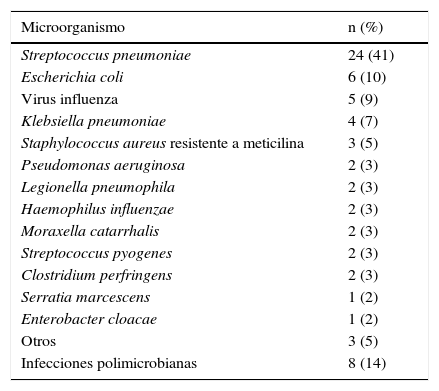
Se consiguió un diagnóstico etiológico en 43 pacientes (14,98%), determinándose 16 microorganismos en 59 muestras positivas. El patógeno más frecuentemente aislado fue Streptococcus pneumoniae, determinándose en 24 de las 59 muestras aisladas (41%), representando el 43% de los hemocultivos positivos, el 36% de los cultivos de esputo positivos, así como el 80% de las muestras en las que aparecieron antígenos positivos en orina. Es decir, se aisló en 18 de los 43 pacientes en los que se consiguió un diagnóstico etiológico (42%). Las segundas bacterias más frecuentemente aisladas fueron bacilos entéricos gramnegativos, Klebsiella pneumoniae, Escherichia coli, Serratia marcescens y Enterobacter cloacae, aislados en un 20% de las muestras (12/59), seguidos del virus influenza, aislado en 5 muestras (5/59, 9%), Staphylococcus aureus (SA), todos ellos resistentes a meticilina (SAMR) (3/59, 5%), Pseudomonas aeruginosa (2/59, 3%), Moraxella catarrhalis (2/59, 3%), Legionella pneumophila (2/59, 3%), Haemophilus influenzae (2/59, 3%), Streptococcus beta-hemolítico grupo A (2/59, 3%) y Clostridium perfringens (2/59, 3%). También se aisló una muestra con Corynebacterium pseudodiphtheriticum (2%), Gemella spp. (2%) y Stenotrophomonas maltophilia (2%). Las infecciones polimicrobianas supusieron el 14% de los aislamientos (8/59) (tabla 2).
Microorganismos aislados (n=59)
| Microorganismo | n (%) |
|---|---|
| Streptococcus pneumoniae | 24 (41) |
| Escherichia coli | 6 (10) |
| Virus influenza | 5 (9) |
| Klebsiella pneumoniae | 4 (7) |
| Staphylococcus aureus resistente a meticilina | 3 (5) |
| Pseudomonas aeruginosa | 2 (3) |
| Legionella pneumophila | 2 (3) |
| Haemophilus influenzae | 2 (3) |
| Moraxella catarrhalis | 2 (3) |
| Streptococcus pyogenes | 2 (3) |
| Clostridium perfringens | 2 (3) |
| Serratia marcescens | 1 (2) |
| Enterobacter cloacae | 1 (2) |
| Otros | 3 (5) |
| Infecciones polimicrobianas | 8 (14) |
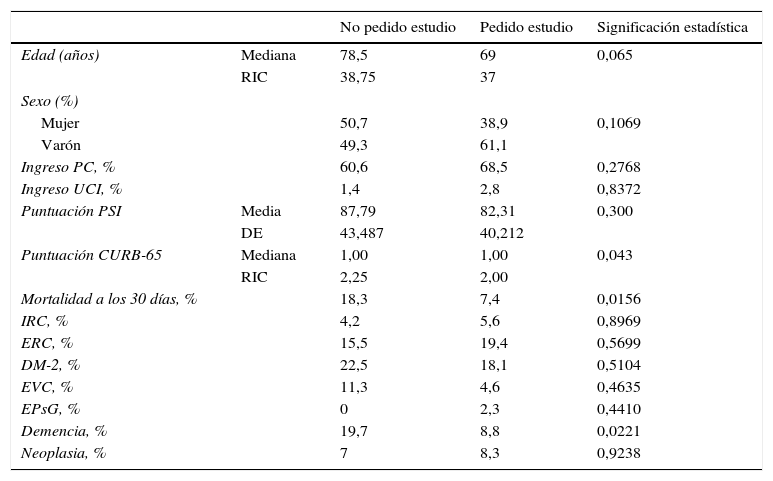
Se compararon las poblaciones en las que se realizó estudio etiológico y en las que no. No se encontraron diferencias significativas entre los 216 pacientes (75,3%) estudiados y los 71 pacientes (24,7%) no estudiados respecto a edad, sexo, ingreso en planta convencional, ingreso en UCI, puntuación PSI, antecedentes personales de insuficiencia renal crónica, enfermedad respiratoria crónica, enfermedad vascular cerebral, DM-2, enfermedad psiquiátrica grave y neoplasia, si bien se encontraron diferencias significativas en la mortalidad a los 30 días en los pacientes en que no se realizó estudio etiológico (p=0,0156) (tabla 3).
Comparación entre las poblaciones en las que se realizó estudio etiológico respecto a aquellas en las que no se hizo
| No pedido estudio | Pedido estudio | Significación estadística | ||
|---|---|---|---|---|
| Edad (años) | Mediana | 78,5 | 69 | 0,065 |
| RIC | 38,75 | 37 | ||
| Sexo (%) | ||||
| Mujer | 50,7 | 38,9 | 0,1069 | |
| Varón | 49,3 | 61,1 | ||
| Ingreso PC, % | 60,6 | 68,5 | 0,2768 | |
| Ingreso UCI, % | 1,4 | 2,8 | 0,8372 | |
| Puntuación PSI | Media | 87,79 | 82,31 | 0,300 |
| DE | 43,487 | 40,212 | ||
| Puntuación CURB-65 | Mediana | 1,00 | 1,00 | 0,043 |
| RIC | 2,25 | 2,00 | ||
| Mortalidad a los 30 días, % | 18,3 | 7,4 | 0,0156 | |
| IRC, % | 4,2 | 5,6 | 0,8969 | |
| ERC, % | 15,5 | 19,4 | 0,5699 | |
| DM-2, % | 22,5 | 18,1 | 0,5104 | |
| EVC, % | 11,3 | 4,6 | 0,4635 | |
| EPsG, % | 0 | 2,3 | 0,4410 | |
| Demencia, % | 19,7 | 8,8 | 0,0221 | |
| Neoplasia, % | 7 | 8,3 | 0,9238 | |
CURB-65: Confusion, blood Urea nitrogen, Respiratory rate, systolic Blood pressure/diastolicBlood pressure,>65 («confusión, concentración de urea, frecuencia respiratoria, tensión arterial y edad mayor de 65 años»); DE: desviación estándar; DM-2: diabetes mellitus tipo 2; EPsG: enfermedad psiquiátrica grave; ERC: enfermedad respiratoria crónica; EVC: enfermedad vascular cerebral; IRC: insuficiencia renal crónica; PC: planta convencional; PSI: Pneumonia Severity Index; RIC: rango intercuartílico; UCI: Unidad de Cuidados Intensivos.
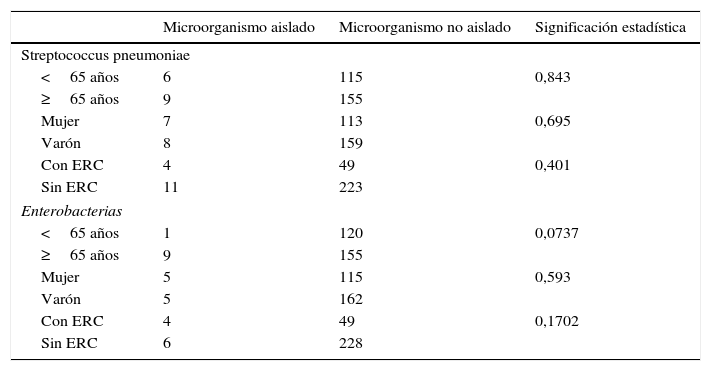
Al analizar los microorganismos aislados más frecuentemente, neumococo y enterobacterias, por subgrupos (edad<y≥65 años, sexo y enfermedad respiratoria crónica), no se encontraron diferencias estadísticamente significativas (tabla 4).
Análisis por subgrupos de los microorganismos aislados más frecuentemente
| Microorganismo aislado | Microorganismo no aislado | Significación estadística | |
|---|---|---|---|
| Streptococcus pneumoniae | |||
| <65 años | 6 | 115 | 0,843 |
| ≥65 años | 9 | 155 | |
| Mujer | 7 | 113 | 0,695 |
| Varón | 8 | 159 | |
| Con ERC | 4 | 49 | 0,401 |
| Sin ERC | 11 | 223 | |
| Enterobacterias | |||
| <65 años | 1 | 120 | 0,0737 |
| ≥65 años | 9 | 155 | |
| Mujer | 5 | 115 | 0,593 |
| Varón | 5 | 162 | |
| Con ERC | 4 | 49 | 0,1702 |
| Sin ERC | 6 | 228 | |
ERC: enfermedad respiratoria crónica.
Los microorganismos implicados en la NAC varían según la edad, la comorbilidad y las características del paciente, el test diagnóstico empleado, la resistencia antibiótica, la gravedad de la enfermedad y el lugar donde se proporcionan los cuidados. Al igual que en nuestra serie, tanto en España como en el resto de Europa se mantiene el Streptococcus pneumoniae como el patógeno más frecuentemente aislado en todos los niveles asistenciales, estando implicado en el 30-35% de los casos5–7.
Las guías de práctica clínica sitúan al SA como un microorganismo poco frecuente en las NAC y más relacionado con neumonías intrahospitalarias y asociadas a ventilación mecánica4. En nuestra serie observamos un elevado aislamiento de SA respecto a estudios españoles8. Cillóniz et al. aíslan SA en el 1% de las NAC ambulatorias, el 2% de las ingresadas en planta convencional y el 2% de las ingresadas en UCI5. Además, el 100% de nuestros pacientes fueron resistentes a meticilina, falleciendo el 67%. En EE. UU. la incidencia de SAMR de presentación comunitaria aumentó más de 5 veces entre 2000 y 20079.En un reciente estudio prospectivo unicéntrico de nuestro país se observó que las neumonías bacteriémicas por SA tenían como comorbilidad más usual la enfermedad pulmonar crónica, y las infecciones por SAMR se producían más frecuentemente en los pacientes de mayor edad y con antecedentes de enfermedades cardiovasculares10. De estos 3 pacientes de nuestra muestra, los 2 con evolución ominosa padecían deterioro cognitivo y tenían una edad de 86 y 101 años, mientras que el paciente que sobrevivió tenía EPOC y presentaba un linfoma. Así que en nuestra muestra, la alta tasa de SAMR puede estar relacionada con la edad y la comorbilidad de nuestros pacientes.
El 20% de las muestras aisladas en nuestra serie son enterobacterias, constituyendo un porcentaje muy elevado respecto a otros estudios. Habitualmente los bacilos gramnegativos aerobios son una causa infrecuente de NAC. Cillóniz et al., en un estudio sobre 3.523 neumonías, aíslan un 1,2% de enterobacterias5. Una revisión de 33 publicaciones sobre la etiología de las NAC en nuestro continente indica que el rango de Klebsiella pneumoniae, Escherichia coli y Serratia marcescens se sitúa entre 3,2 y 9,4%11. Puede ser que más que la edad, sea la comorbilidad, especialmente la pulmonar, lo que determina la predisposición a la infección por bacilos gramnegativos. Sin embargo, en nuestra muestra no tenemos un exceso de pacientes con enfermedades pulmonares crónicas (18,5%), y aun así se aísla un alto porcentaje de enterobacterias. Puede deberse a la edad avanzada de nuestros pacientes o al alto porcentaje de ellos con alteración esfinteriana y sensorial por deterioro cognitivo (11,5%) y enfermedad vascular cerebral (6,3%), lo que podría suponer una mayor predisposición a padecer infecciones por este tipo de bacterias. Estos pacientes pueden proceder de centros asistidos, variable que no está recogida en nuestra población. Hay controversia respecto a las neumonías asociadas a cuidados sociosanitarios (NACS). Las primeras sociedades científicas que introdujeron el concepto de NACS fueron la American Thoracic Society/Infectious Diseases Society of America en su guía de práctica clínica de 200512. Esta guía propone tratar las NACS como si fuesen neumonías intrahospitalarias, con antibióticos de amplio espectro combinados para cubrir microorganismos multirresistentes. Aunque sí parece que las NACS cursan con mayor mortalidad, más días de ingreso en el hospital y mayor gasto sanitario que las NAC8,13,14, hay autores que piensan que se debe principalmente al estado funcional de los pacientes más que a la etiología infecciosa15,16. Otros autores encuentran una distribución patogénica similar entre los pacientes con neumonía que provienen de su domicilio particular y los que provienen de una residencia, con porcentajes de patógenos resistentes y de ineficacia terapéutica similares17. Además, el implementar en la práctica diaria tratamientos antibióticos empíricos contra microorganismos multirresistentes aumentaría el gasto y las tasas de resistencias. La última guía británica sobre neumonía recomienda incluir a las que se desarrollan en una residencia con cuidados de enfermería dentro de la definición de NAC18.
En nuestra serie encontramos que el 1,74% de los pacientes (9% de las muestras) están infectados por el virus influenza. Gracias a las técnicas de biología molecular sabemos que el virus influenza y el virus sincitial respiratorio son las causas más frecuentes de infección viral en NAC19. Hay estudios que objetivan que en época epidémica, el 1,2% de los pacientes con gripe A (H1N1) se sobreinfectaron con SAMR20. Las infecciones mixtas con bacterias y virus se han encontrado en aproximadamente el 20% de los casos de neumonía1 y parece que esta asociación es más frecuente en neumonías graves21. Últimamente en España han coincidido 2 cepas de virus influenza, el habitual, H3N2, y el H1N1 (epidemia 2009 y 2010), ambos virus A. En nuestra serie, el 80% de los pacientes con virus influenza fueron A subtipado H3N2 (4 casos), por un 20% de influenza B. Parece que existe una asociación entre la infección por el virus influenza y la neumonía por SA21,22, encontrándose que el 10% de los pacientes ingresados en Reino Unido por gripe estaban infectados concomitantemente por SA4. En ninguno de nuestros 5 pacientes con gripe confirmada se aisló dicha bacteria. En un paciente se aisló el virus influenza junto con neumococo. Por tanto, habrá que prestar especial atención a los pacientes con neumonía gripal primaria o con neumonía mixta, viral sobreinfectada por SA o Streptococcus pneumoniae, ya que pueden desarrollar un cuadro severo2.
También se aisló en 2 ocasiones Clostridium perfringens en sangre. Se trata de una causa muy poco frecuente de infección pleuropulmonar, muchas veces relacionada con bacteriemia. Es factor predisponente la aspiración orofaríngea o de contenido gástrico y a menudo está asociada a enfermedades crónicas como la diabetes y tumores malignos23. En nuestro estudio, los 2 pacientes eran varones de más de 80 años, hipertensos y diabéticos. Uno, con ictus previo, demencia y adenocarcinoma de próstata, con 201 puntos en el PSI (grupo de riesgo v), 4 puntos en CURB-65, con shock séptico y condensación multilobar, que sobrevivió tras 17 días de ingreso. El otro, con 85 puntos en el PSI (grupo de riesgo iii) y 2 puntos en CURB-65, también evolucionó favorablemente después de 10 días de ingreso, a pesar de padecer un derrame pleural. Posiblemente en ambos las características intrínsecas de los pacientes fueron determinantes a la hora de ser infectados por esta bacteria anaerobia grampositiva, llegando a los pulmones de nuestros pacientes.
Pueden ser limitaciones del estudio el tratarse de un análisis monocéntrico, así como el bajo índice de patógenos aislados. Debido a que el trabajo de campo se realizó en un servicio de urgencias no se realizaron cultivo micológico/actinomicetal, técnicas de estudio microbiológico invasivas, pruebas de biología molecular en líquido pleural, muestras respiratorias por lavado broncoalveolar, catéter telescopado, aspirado traqueal, biopsia bronquial, transbronquial, biopsia a cielo abierto, serología para bacterias atípicas ni serología para virus respiratorios.
Tampoco se protocolizó a qué pacientes se les hacía estudio microbiológico, quedando la decisión en manos del clínico. Para intentar minimizar estos sesgos, se compararon las poblaciones en las que se realizó estudio etiológico y aquellas en las que no. No se encontraron diferencias significativas entre ninguna de las variables estudiadas, salvo en la mortalidad a los 30 días, mayor en los pacientes en los que no se realizó estudio etiológico (p=0,0156). Pensamos que pueda deberse a las características clínicas de los enfermos. Al comparar estas 2 poblaciones en relación con los antecedentes personales, únicamente encontramos diferencias significativas entre los pacientes con demencia, en los que no se pidieron pruebas etiológicas respecto a los que sí fueron estudiados (19,7 vs. 8,8%; p=0,0221). Posiblemente en estos pacientes se fue menos agresivo a la hora de buscar un diagnóstico etiológico por sus características intrínsecas. Así que pensamos que las conclusiones sacadas de los pacientes en que se realizó estudio etiológico son extrapolables al resto de la muestra.
Con el mismo objetivo se realizó un análisis de los microorganismos aislados más frecuentemente, neumococo y enterobacterias, por subgrupos (edad<y≥65 años, sexo y enfermedad respiratoria crónica), no encontrando diferencias estadísticamente significativas en los pacientes en los que se aislaron neumococos. En relación a las enterobacterias, hay diferencias cercanas a la significación estadística respecto a la edad (p=0,0737), que quizá se alcanzase aumentando la potencia del estudio. Así que en los pacientes mayores de 65 años quizá realizar tratamiento empírico encaminado a cubrir este grupo etiológico podría ser productivo.
Por tanto, en nuestra serie, Streptococcus pneumoniae es el agente etiológico más frecuente, aunque encontramos un aumento importante de bacilos entéricos gramnegativos y SAMR. Pensamos que en los próximos años presenciaremos un escenario en el que el envejecimiento de la población, el aumento de habitantes en residencias de cuidados y el aumento de tratamientos intravenosos y cuidados sanitarios en el domicilio incrementarán los microorganismos no habituales que generan las NAC. Así que una buena anamnesis será básica para evaluar la gravedad del paciente24.
Estudios encaminados a conocer las resistencias y la virulencia de los patógenos implicados en las NAC serán de utilidad a la hora de enfrentarnos a esta enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónLos autores no recibieron compensación económica o de otro tipo de ningún laboratorio.
Conflicto de interesesLos autores manifiestan que no tienen ningún conflicto de intereses.