La pandemia por el SARS-CoV-2 persiste con toda su virulencia a pesar de haberse administrado 650.382.819 dosis de vacuna anti-COVID a nivel mundial. La prueba de referencia para la identificación de la infección es la reacción en cadena de la polimerasa con transcriptasa inversa (RT-qPCR). La utilidad de esta prueba puede disminuir al simplificar su resultado como positivo o negativo. Determinar el número de ciclos (Ct) en las pruebas RT-qPCR positivas puede ayudar en la toma de decisiones cuando se interpretan en el contexto clínico de los pacientes.
The SARS-CoV-2 pandemic persists with all its virulence despite 650,382,819 doses of COVID vaccine worldwide. The reference test for infection identification is reverse transcription polymerase chain reaction (RT-qPCR). The usefulness of this test may be diminished by simplifying its result as positive or negative. Determining the number of cycles (Ct) in positive RT-qPCR tests can assist in decision-making when interpreted in the clinical context of patients.
El 11 de marzo de 20201, el director general de la OMS declaró el carácter de pandemia a la enfermedad COVID-19, que causaba un síndrome respiratorio agudo severo (SARS) provocado por la infección ocasionada por un nuevo coronavirus (SARS-CoV-2)2, identificado inicialmente en Wuhan, China, en diciembre del 2019. En la actualidad (05.04.2021), la enfermedad COVID-19 afecta a 224 países y ha provocado 132.730.691 casos confirmados y 2.880.726 fallecidos, a pesar de haberse administrado en el mundo 650.382.819 dosis de vacuna frente al SARS-CoV-23.
La propagación de la COVID-19 se ha visto favorecida porque en el espacio aproximado de 2 semanas, tras un periodo de incubación de 5,1días (IC95%: 4,5-5,8), surge otro periodo de 11,5días (IC95%: 8,2-15,6) durante el cual las manifestaciones clínicas irán apareciendo en aquellos pacientes que finalmente sean sintomáticos aunque, en el 1% de estos, los síntomas pueden aparecer a partir del día 14 de seguimiento mientras que tan solo el 2,5% de los pacientes sintomáticos los desarrollarán durante los 2,2 primeros días de infección (IC95%: 1,8-2,9)4.
Por otra parte, las personas infectadas empiezan a eliminar cantidades significativas de virus desde 3 días antes de ser sintomáticas, presentando su pico máximo durante el día anterior al de su manifestación clínica5.
Finalmente, la propagación también se favorece porque una sexta parte (15,6%) de la población afectada no manifiesta clínica infecciosa6.
Por ello, no solo es muy importante detectar precozmente y aislar a los infectados para favorecer su control y tratamiento, sino también para adoptar aquellas medidas que minimicen la transmisión del virus, identificando aquellos sujetos que tienen capacidad de infectar. La prueba de referencia para identificar la presencia del SARS-CoV-2 es la reacción en cadena de la polimerasa con transcriptasa inversa (RT-qPCR), que ha demostrado una gran sensibilidad y especificidad7, siendo una prueba asequible en nuestro medio, aunque no ocurre lo mismo en otras partes del mundo8.
Reacción en cadena de la polimerasa con transcriptasa inversa (RT-qPCR)La PCR (Polymerase Chain Reaction) permite la amplificación e identificación de secuencias específicas de material genético del ADN. Aunque es utilizada para identificar la presencia de virus como el SARS-CoV-2, es incapaz de determinar la viabilidad del mismo. La RT-qPCR o RT-PCR a tiempo real aporta beneficios añadidos sobre otras técnicas destacando su habilidad para monitorizar el progreso de la reacción de la RT-PCR en tiempo real, la cuantificación realizada en cada uno de los ciclos y que la amplificación y la detección concurren en un solo tubo, por lo que se elimina otro tipo de manipulación posterior9.
El proceso se inicia por la adquisición de la muestra adecuada, con mayor presencia del virus en las muestras de esputo en comparación con las muestras nasales o las orofaríngeas10. En la muestra obtenida, es preciso realizar un proceso que elimine sustancias acompañantes, dejando una mezcla del ARN viral y de material genético del paciente. En este instante y como parte fundamental del proceso, se ha de realizar la transcripción inversa del ARN mediante acción enzimática para conseguir el ADN, que es el que permitirá ser amplificado y copiado11. En cada uno de los ciclos (habitualmente se realizan hasta 40 ciclos) existen 3 pasos. 1. Desnaturalización: se realiza incubación a alta temperatura para que persista una sola hebra del ADN. 2. Emparejamiento: se añaden fragmentos genéticos denominados cebadores, imprimaciones o primers que suelen estar compuestos por 18-24 nucleótidos complementarios a secuencias específicas del ADN y que, preferentemente, hibridan a exones situados a ambos lados de un intrón. En el caso de que los cebadores se complementen con las secuencias específicas, se formarán puentes de hidrógeno entre las bases emparejadas. Algunos de los fragmentos participarán en las futuras amplificaciones mientras que otros, previamente marcados y capaces de emitir una señal fluorescente en presencia de su objetivo, serán los que detecten la presencia del virus o de sus fragmentos. La temperatura a la que se desarrolla esta fase se corresponde con la temperatura de disolución de los cebadores. 3. Extensión o elongación: la actividad óptima de la polimerasa, enzima capaz de transcribir o replicar ácidos nucleicos, se produce a temperaturas de 70-72°C.
Los ciclos se van repitiendo consecutivamente, copiando las partes específicas del ADN viral hasta que el sistema detecta la presencia de la diana molecular estudiada. Si es que se alcanzara el ciclo 40, el número de copias creado sería de 1.100×109 copias nuevas de las partes valoradas del ADN.
La lectura de los resultados llega por la interpretación (por el sistema) de la intensidad de la señal fluorescente en el momento que se identifique la presencia de la secuencia genética correspondiente al virus. Para ello, es preciso determinar una lectura basal utilizada como referencia, que se establece con los primeros ciclos (habitualmente entre el 3 y el 15), en los que los cambios de la señal fluorescente suelen ser mínimos. A partir de aquí, hay que calcular el umbral entendido como el nivel de la señal fluorescente que representa un incremento estadísticamente significativo respecto al nivel basal.
El umbral de ciclos o cycle threshold (Ct) es el número de ciclos en el que la señal fluorescente cruza este umbral. Para valorar la presencia del virus en la muestra, se determina el número de ciclos Ct de RT-qPCR necesarios para que la prueba resulte positiva, es decir, indica el momento preciso de la amplificación en el que la prueba es capaz de identificar la presencia de la diana molecular investigada, sin indicar la cantidad presente. Así, el Ct es un valor semicuantitativo inversamente relacionado con la cantidad de ARN de la muestra, de manera que un número bajo de Ct está relacionado con mayor carga viral y viceversa12.
La RT-qPCR permite detectar cargas virales muy bajas (20-100 copias de ARN/mL) siempre que la muestra se tome de forma adecuada y con la suficiente concentración viral13 y, por otra parte, es capaz de diferenciar microorganismos aunque estos tengan ciertas similitudes. La RT-qPCR ha mostrado una especificidad del 100% y una sensibilidad del 91,8% (83,8-96,6)14, debiéndose su variabilidad a distintos factores como son la precisión mostrada por el test en función de la diana molecular utilizada, el tipo y calidad de la muestra, o al tiempo transcurrido desde el inicio de la infección y la toma de la muestra15. Una de las oportunidades que ofrece esta prueba es la posibilidad de dirigirla a identificar 2 o 3 dianas moleculares del SARS-CoV-2, lo que evita las reacciones cruzadas con otros coronavirus endémicos y minimiza los falsos positivos al realizar la amplificación y detección de manera simultánea16.
Existen algunas limitaciones al interpretar el valor Ct, como serían el no expresarse con unos valores lineales, la dependencia del resultado con el tipo y calidad de la toma, así como con el manejo de la muestra, o variaciones significativas inter- e intraprueba17. A todo ello hay que añadir que la máxima carga viral, alcanzada antes de manifestarse los síntomas, se mantiene hasta el 3.er-5.o día tras la aparición de los mismos para, posteriormente, ir decayendo hasta hacerse indetectable (la duración media de la replicación viral suele ser de 17 días [IC95%:15,5-18,6)18–20, la existencia de un ciclo circadiano de la carga viral21 o la mayor duración de la infección en las nuevas variantes del SARS-CoV-2 (como la B.1.1.7)22. Por otra parte, el valor Ct no se debe utilizar en la cuantificación de la carga viral23, y la identificación de las dianas moleculares no implica la viabilidad del virus ni, por lo tanto, su contagiosidad24, por lo que la interpretación del valor Ct hay que tomarlo con precaución y siempre en el contexto clínico del paciente.
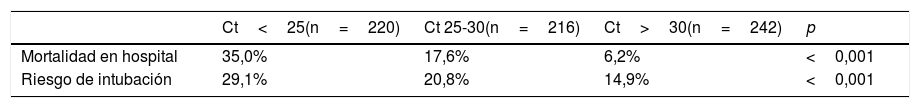
Valor del Ct en la predicción de la evolución en pacientes COVID-19Aunque los valores del Ct se distribuyen de forma similar con independencia de la gravedad de la enfermedad25, un estudio retrospectivo realizado en Nueva York mostró la relación entre el valor del Ct y la mortalidad o la necesidad de intubación (tabla 1), asociándose de forma independiente el valor Ct<25 (en comparación con Ct>30) tanto con la mortalidad intrahospitalaria [ORajustado=6,05 (IC 95%: 2,92-12,52)] como con la necesidad de intubación [ORajustado=2,73 (1,68-4,44)]26.
Mortalidad y riesgo de intubación según valores de Ct
| Ct<25(n=220) | Ct 25-30(n=216) | Ct>30(n=242) | p | |
|---|---|---|---|---|
| Mortalidad en hospital | 35,0% | 17,6% | 6,2% | <0,001 |
| Riesgo de intubación | 29,1% | 20,8% | 14,9% | <0,001 |
Fuente: elaborada a partir de Magleby et al.26.
Los datos no siempre son coincidentes por las limitaciones previamente descritas. Bullard et al. no consiguieron cultivar el virus con valores de Ct>24 (muestras almacenadas a −80°C durante 2-4 semanas), encontrando una disminución de la odds ratio del 32% por cada incremento de 1 unidad del valor Ct27. Otros estudios sí consiguieron cultivar el virus con valores mayores del Ct (en el 70% de los pacientes con Ct=25; en el 20% con Ct=30, o en el 3% con Ct=35)28, mientras que otros autores refirieron una probabilidad de recuperar virus viables en el 8,3% de los pacientes con Ct>35 cuando eran sintomáticos7. Comparando los valores del Ct según la capacidad de replicación del virus (replicación vs. no replicación), los valores del Ct (media±desviación estándar y mediana) eran de 18,8±3,4 y 18,17 cuando se consiguió replicación vs. 27,1±8,7 y 27,5 cuando no se consiguió, aunque con claras excepciones (en el 11,9% de las muestras con Ct<20 no se pudo replicar el virus)29.
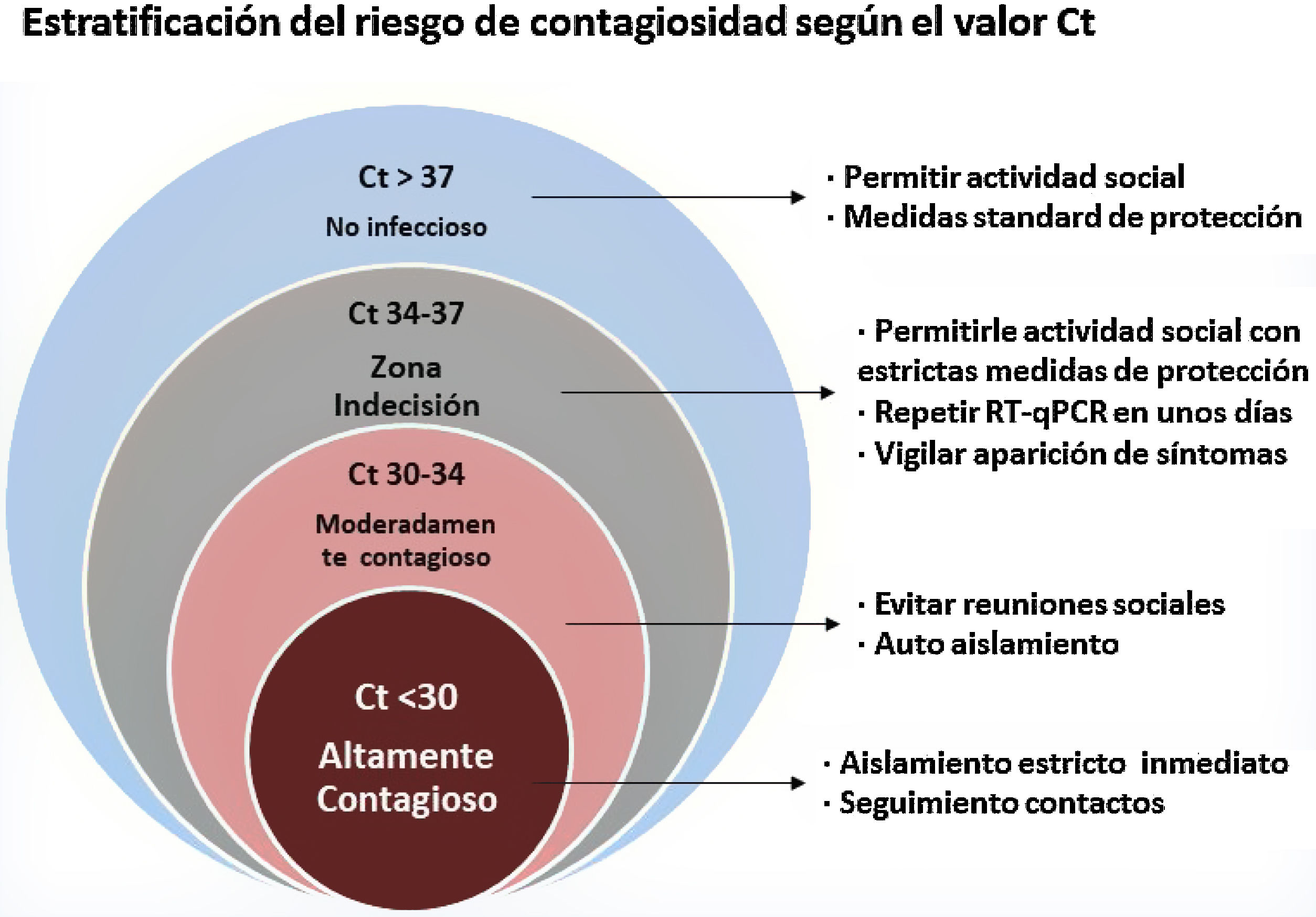
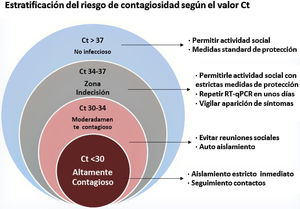
La estrategia del Ministerio de Sanidad admite la opción de valorar el Ct en los pacientes con RT-qPCR positiva, aceptando el criterio de que un Ct entre 31 y 35 equivaldría a una carga viral sin capacidad infectiva aunque, dada la heterogeneidad de la muestra tomada (técnica de adquisición y localización de la toma) y de los diferentes sistemas comercializados, será cada laboratorio el que tenga que validar la prueba y marcar el umbral de ciclos que consideran definitorio de la alta o baja carga viral30. A pesar de ello, persisten dudas sobre cuándo y cómo incorporar al paciente a su actividad social de la forma más segura. En un intento de resolverlo, se ha estratificado en 4 grupos a los pacientes con RT-PCR positiva (fig. 1), en función del valor del Ct y de su relación con la carga viral y la persistencia de virus viable: altamente contagioso; moderadamente contagioso; zona de indecisión; no infeccioso. Existe una zona de indecisión, con valores Ct=34-37, en los que sería preciso repetir la prueba en unos días y vigilar la aparición de síntomas. Tampoco hay que descartar la posibilidad de que valores Ct>37 manifiesten una infección temprana con carga viral baja. Un Ct>35 podría ser considerado como valor permisivo para la reincorporación social, aunque es preciso analizarlos en su contexto clínico y epidemiológico31.
Fuente: elaborada a partir de Oba et al.31.
En resumen, conocer el número indicativo del valor Ct, junto a su validación por el laboratorio responsable, mejorará la toma de decisiones con mayores garantías tanto en la predicción clínica como en la incorporación del paciente a sus actividades sociales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.