Describir las principales alteraciones retinianas detectadas por screening con cámara retinal no midriática y evaluar los factores relacionados con la derivación a oftalmología en una población de alto riesgo cardiovascular en Palmira, Colombia.
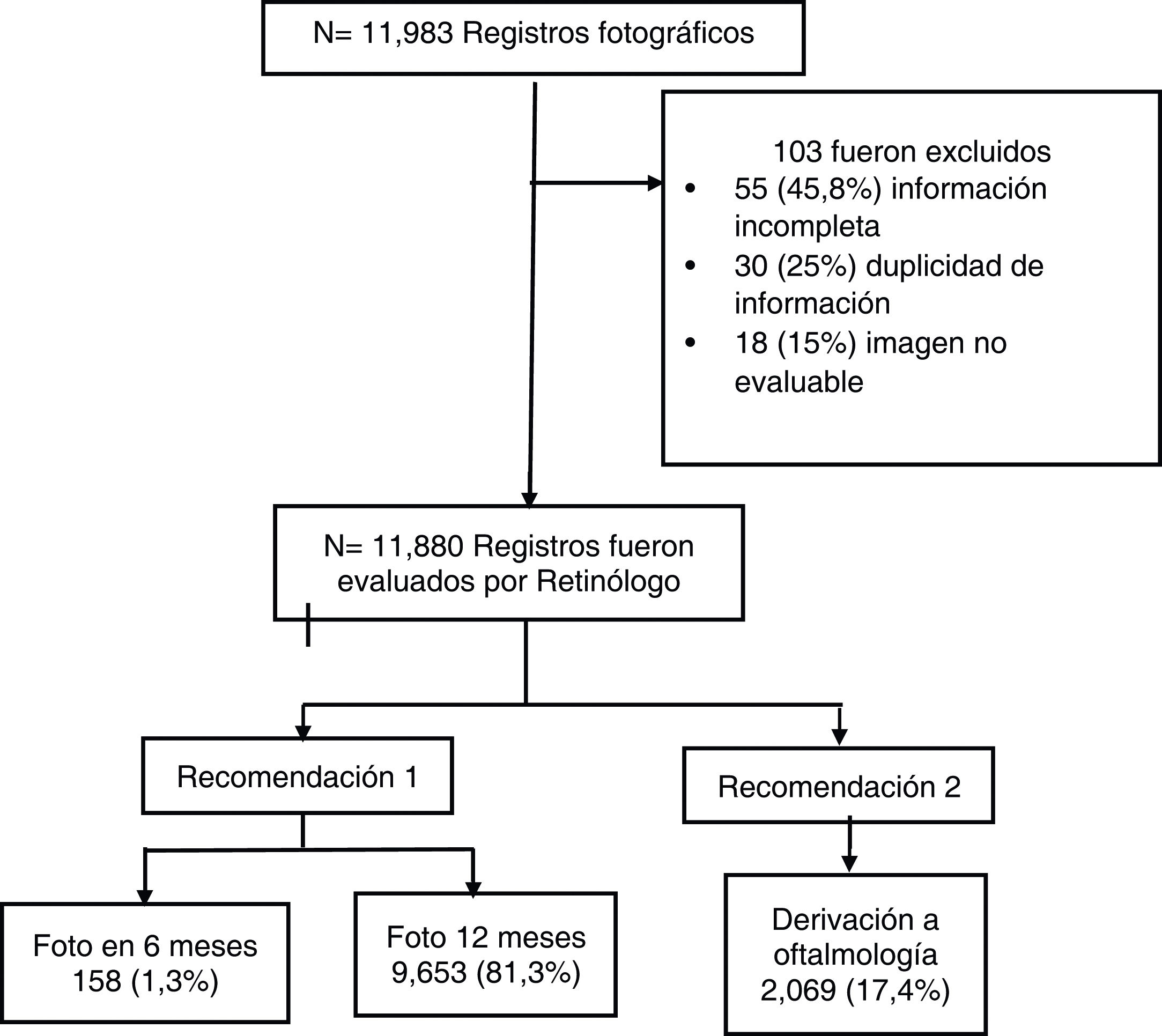
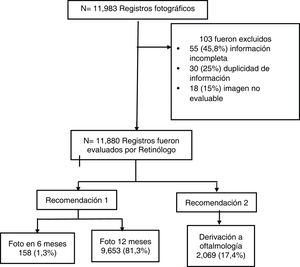
Materiales y métodosEstudio observacional de tipo transversal, con 11.983 registros fotográficos de pacientes con hipertensión y diabetes mellitus del programa de enfermedades crónicas de Gesencro S.A.S. entre 2018 y 2020. Se evaluaron con regresión logística los factores de riesgo relacionados con la derivación a oftalmología y se obtuvieron los odds ratios (OR) crudos y ajustados.
ResultadosSe analizaron 11.880 registros; la edad media fue de 67,7±12años, y el 69,5% fueron mujeres. Entre las alteraciones retinianas se encontraron pacientes con retinopatía diabética clasificada como más que leve (10%) y gradoI de retinopatía hipertensiva (54,9% ojo derecho, 51,9% ojo izquierdo). También se identificó edema macular (15%). Solo 2.069 (17,4%) pacientes requirieron derivación a oftalmología; el 81,3% requirieron control a 1año y el 1,3% a los 6meses. En el análisis multivariado los factores de riesgo que se relacionaron con la probabilidad para ser derivados fueron: el género masculino, la edad mayor o igual a 60años, la hemoglobina glucosilada (HbA1c) fuera de metas, la enfermedad renal crónica avanzada y la razón microalbúmina-creatinina moderada a severamente elevada.
ConclusiónEste estudio permitió determinar la importancia que tiene el screening con cámara retinal no midriática en pacientes de alto riesgo cardiovascular para detectar alteraciones retinianas y evaluar factores de riesgo asociados con derivación a oftalmología. El documentar tempranamente el compromiso ocular en estos pacientes podría prevenir y evitar la discapacidad visual y la ceguera.
To describe the main retinal alterations detected by non-mydriatic retinal camera screening and to evaluate factors related to referral to ophthalmology in a population at high cardiovascular risk in Palmira, Colombia.
Materials and methodsCross-sectional observational study, which included 11,983 photographic imaging records of patients with hypertension and diabetes mellitus from Gesencro's S.A.S. comprehensive chronic disease care program between 2018 and 2020. Risk factors associated to referral to ophthalmology were evaluated with logistic regression, and crude and adjusted ORs (odds ratios) were obtained.
ResultsA total of 11,880 records were analyzed; 67.7±12years old, and 69.5% were women. Among the retinal alterations were patients with diabetic retinopathy classified as more than mild in 10% and gradeI hypertensive retinopathy in 54.9% right eye, 51.9% left eye. Macular edema was also identified. Only 2069 patients (17.4%) required referral to ophthalmology, and for imaging control 82.6%. In the multivariate analysis, the risk factors associated with the probability of being referred were male gender, age 60years and older, glycosylated hemoglobin out-of-target, advanced chronic kidney disease and the microalbumin-to-creatinine ratio moderate to severely elevated.
ConclusionThis study makes it possible to determine the importance of screening with a non-mydriatic retinal camera in patients at high cardiovascular risk to detect retinal abnormalities and assess risk factors associated with referral to ophthalmology. Early documentation of ocular compromise in these patients could prevent and avoid visual impairment and blindness.
Los programas de screening que permiten la detección temprana y el tratamiento oportuno y efectivo de las alteraciones de la retina reducen la carga de discapacidad visual y la ceguera a nivel mundial, sobre todo en poblaciones vulnerables1, incluso en enfermedades con alta prevalencia, como la retinopatía diabética (RD; 35%)2 y la retinopatía hipertensiva (RH; 7-14%)3.
La RD es una de las principales causas de discapacidad visual y de ceguera en edades productivas (25-75años), a pesar que puede ser prevenida hasta en el 90% de los casos1 e incluso puede reducirse hasta diez veces su desarrollo con intervenciones tempranas4.
Por otro lado, la RH es considerada un marcador de enfermedad vascular y de muerte3, teniendo en cuenta la severidad y el tiempo transcurrido desde su diagnóstico5. Su coexistencia con otras condiciones crónicas, como la diabetes mellitus (DM)3, produce daño de órganos diana, como la retina y el riñón, en donde la microalbuminuria se convierte en un predictor de mortalidad cardiovascular más que de insuficiencia renal6, y empeora al asociarse con otros factores de riesgo, como la edad avanzada, el mal control glucémico y la dislipidemia, entre otros7.
Durante el periodo de 2009 a 2014 en Colombia se observó un aumento de las consultas por enfermedades crónicas no transmisibles (ECNT) similar al observado a nivel mundial, especialmente por hipertensión arterial (HTA) y DM, al igual que por sus complicaciones a nivel visual, evidenciándose un aumento en la prevalencia (por 100.000 habitantes) de RD del 13% al 20% y para RH del 13% al 15%8. Además, uno de los principales factores que limita la identificación temprana de estas complicaciones visuales desde la atención primaria es el menor número de oftalmólogos en las áreas más prevalentes y aisladas del país.
Existen diferentes técnicas de screening para la detección de RD y de RH9, y su aplicación depende del país y de la adherencia a las guías. La última directriz estipulada por la Academia Americana de Oftalmología en 20209 sugirió utilizar la biomicroscopia con lámpara de hendidura y oftalmoscopia indirecta para la detección de RD. Sin embargo, estas técnicas requieren la dilatación (midriasis) farmacológica de la pupila, a pesar de los riesgos que esta implica.
Dentro de los métodos de screening, también existe la cámara de fondo de retina no midriática (CFRNM), que desde 2016 es utilizada en el Reino Unido para el diagnóstico de la RD10 y actualmente es empleada como un método no invasivo, menos complejo de manejar y coste-efectivo al compararse con el gold standard (fotografía de fondo de ojo a color con estereoscopio de siete campos y la angiografía con fluoresceína) en países de altos y medianos recursos11. La CFRNM ha sido validada identificando estadios presintomáticos de retinopatía; evidencia cambios sutiles de otras condiciones primarias del nervio óptico (papiledema)10, e incluso determina el riesgo cardiovascular no ateroesclerótico en población hipertensa no diabética12.
En Colombia, y especialmente en el Valle del Cauca, este tipo de herramientas no han sido exploradas en la atención primaria, y no se cuenta con un programa estructurado de screening de salud visual en pacientes con ECNT ni de sus complicaciones visuales. Por lo tanto, el objetivo de este estudio fue describir las principales alteraciones retinianas detectadas por screening con CFRNM y evaluar los factores relacionados con derivación a la especialidad de oftalmología en pacientes de alto riesgo cardiovascular atendidos en la consulta de centros de atención primaria de Palmira, Colombia.
Materiales y métodosDiseño y población del estudioEstudio observacional analítico transversal. La recolección de datos se realizó entre enero de 2018 y enero de 2020. Se incluyeron todos los pacientes adultos que fueron atendidos en la consulta de centros de atención primaria de Palmira (Colombia), siendo un total de 11.983 registros fotográficos. Los criterios de inclusión fueron pertenecer al programa de atención integral de enfermedad crónica de la IPS Gesencro y tener antecedentes de hipertensión (HTA) y/o DM. Los criterios de exclusión fueron no tener un registro completo, información duplicada y pobre calidad de la imagen fotográfica. Se excluyeron en total 103 registros y se analizaron 11.880 registros (fig. 1). Los pacientes provenían tanto del área rural como de la urbana.
ProcedimientoLa toma de la imagen fue realizada con una cámara fotográfica marca Canon modelo EOS60D, serie 341094000107, que contiene un analizador digital de retina modelo CR-2AF. Para la toma de la fotografía se dispone de un consultorio acondicionado con las especificaciones técnicas para su realización. La cámara es operada por una auxiliar de enfermería entrenada por el médico retinólogo, a quien se le programan los pacientes.
Las imágenes obtenidas eran enviadas a la plataforma digital de la historia clínica institucional y, por telemedicina asincrónica, el retinólogo evaluaba y clasificaba si la calidad de la imagen era adecuada (aceptable: permite ver las características del nervio, la mácula y los vasos, y/o baja calidad: no permite ver detalles del nervio, ni de la mácula, ni de los vasos de la retina para clasificación de retinopatía), a la vez que determinaba la lateralidad del ojo (según la posición del nervio); también determinaba el estado del nervio óptico (anormal: cuando hay evidencia del aumento de la excavación, alteración en la relación copa/disco y engrosamiento o borramiento del borde de disco, y/o normal: ausencia de los hallazgos anteriores), edema macular (presente: alteración en la pigmentación macular o engrosamiento de la mácula por exudación, hemorragias o distorsión del trayecto vascular, y/o normal: ausencia de dichos hallazgos). Por último, clasificaba el grado de retinopatía (tabla 1).
Clasificación de la retinopatía diabética e hipertensiva
| Retinopatía diabéticaa | Retinopatía hipertensivab | ||
|---|---|---|---|
| Grado | Signos | Grado | Signos |
| No aparente | Ausencia de signos de retinopatía | 0 | Ninguna lesión aparente |
| Leve | Presencia de microaneurismas | I | Aumento de reflejo luminoso arteriolar con compresión arteriovenosa mínima |
| Más que leve | Presencia de hemorragias, arrostramiento, anormalidades intravasculares o neovascularización | II | Aumento de los signos y desvío de las venas en los cruces arteriovenosos |
| III | Arteriolas en hilo de cobre, hemorragias y manchas algodonosas y marcada compresión arteriovenosa | ||
| IV | Arteriolas en hilo de plata, cambios importantes en los cruces arteriovenosos y edema de disco | ||
Para disminuir la pérdida de pacientes se realizaban dos tomas de fondo de ojo de cada ojo, con el fin de escoger la imagen que incluyera la mejor visualización del nervio, la mácula y la vasculatura. La imagen libre de rojo permitió resaltar la presencia de alteraciones típicas de retinopatía (hemorragias, exudados y/o manchas algodonosas), condiciones que favorecían además identificar la presencia de edema macular. Finalmente, el retinólogo informaba dos posibles conceptos al final de la evaluación de las imágenes: realizar control de foto a 6meses o 12meses, o derivar a valoración por oftalmología.
Definición de las variables independientesTodas las variables fueron obtenidas del sistema de información de historia clínica electrónica registrada por los médicos.
Las variables sociodemográficas evaluadas fueron el sexo, la edad y el régimen de aseguramiento.
Las variables clínicas fueron los índices de masa corporal (IMC) para la subclasificación de los pacientes según el grado de obesidad de acuerdo con la Organización Mundial de la Salud (OMS)14.
La HTA fue definida por las guías europeas de 2018 como normal, normal alta, grado1 y grado215.
Para el diagnóstico de DM y la determinación del punto de corte óptimo de la hemoglobina glucosilada (HbA1c) se siguieron las guías ADA201816, teniendo en cuenta que una HbA1c menor al 7% tanto para DM tipo1 como para DM tipo2 es designado como el mejor control para la prevención del riesgo de complicaciones microvasculares del paciente17.
También se evaluó el perfil lipídico (colesterol total, colesterol HDL, colesterol LDL y triglicéridos), y para determinar la función renal se realizó el cálculo de la tasa de filtración glomerular (eTFG)18 a partir de la creatinina sérica mediante fórmula de Cockroft-Gault para categorizar el daño renal, así como la relación albuminuria creatinuria (RAC) según las guías KDIGO2012 en A1, A2 y A319.
Variable dependiente principalLa derivación a oftalmología basada en la presencia de alteraciones retinianas de las imágenes evaluadas por el retinólogo.
Análisis de los datosLas variables categóricas se presentaron en porcentajes. Se contrastó la normalidad de las variables cuantitativas mediante la prueba estadística de Kolmogorov-Smirnov. Se utilizaron el promedio y la desviación estándar o la mediana y el rango intercuartílico. Para comparar las variables categóricas se utilizó la prueba chi cuadrado o la prueba exacta de Fisher.
Se realizó un análisis logístico bivariado, donde se estimaron los odds ratios (OR) con sus respectivos intervalos de confianza, evaluando la relación entre la variable dependiente (derivación a oftalmología) y las variables independientes. Se seleccionaron variables con un valor de p<0,25 (según Hosmer y Lemeshow)20 para construir modelos de regresión logística múltiple. Estos fueron evaluados mediante la razón de verosimilitud y se basaban en la lejanía, es decir, la ganancia obtenida en cada modelo (−2LogL), hasta obtener el mejor modelo ajustado y parsimonioso. En la validación del modelo final ajustado se utilizó el cociente de verosimilitud para comparar la diferencia entre los dos modelos (saturado y ajustado) y se identificó el mejor modelo.
Finalmente se evaluó la bondad de ajuste para inferir si el modelo se ajustaba bien a los datos y si era adecuado realizar predicciones con él. El nivel de significancia estadística establecido fue un valor de p<0,05; para todos los análisis se utilizó el programa de Microsoft® Excel® y el paquete estadístico Stata corp. 15.0® (College Station, Texas, EE.UU.).
ResultadosSe analizaron 11.880 registros, y el 69,5% fueron mujeres. La edad promedio fue 67,7±12años. El 92% de la población presentaba HTA y el 39,8% tenía coexistencia con DM (tabla 2). Más del 50% de la población tenía una enfermedad renal crónica (ERC) clasificada como G2 y 3a (tabla 3). Según la lateralidad del ojo no se encontraron diferencias con respecto a los cinco hallazgos clínicos, y la calidad de imagen fue aceptable en el 92,1% de las fotos. El nervio óptico fue normal en el 82% de la población. Los pacientes que presentaron alteraciones a nivel de la retina se categorizaron de la siguiente manera: RD más que leve; 10% independientemente del ojo, y gradoI de RH 54,9% en ojo derecho y 51,9% en ojo izquierdo. El edema macular se presentó en el 15% del ojo derecho y en el 14,4% del ojo izquierdo (tabla 3). El 17,4% de la población requirió derivación a oftalmología para algún tipo de intervención temprana; mientras que el 82,6% requirió solo control y seguimiento con nueva imagen de 6 a 12meses.
Características demográficas y clínicas de la población a estudio
| Características | Descripción | n=11.880 |
|---|---|---|
| Sexo | Femenino | 8.257 (69,5) |
| Masculino | 3.623 (30,5) | |
| Edad. Promedio ± DE mín.-máx. | 67,7 ± 12,1 | 20-107 |
| Edad agrupada | < 60 años | 2.707 (22,8) |
| ≥60 años | 9.173 (77,2) | |
| IMC, clasificación | Bajo peso | 244 (2,05) |
| Peso normal | 3.849 (32,4) | |
| Sobrepeso | 4.396 (37,0) | |
| Obesidad grado 1 | 2.369 (19,9) | |
| Obesidad grado 2 | 729 (6,1) | |
| Obesidad grado 3 | 293 (2,5) | |
| HTA | Sí | 10.925 (92) |
| No | 955 (8,0) | |
| DM | Sí | 4.729 (39,8) |
| No | 7.151 (60,2) | |
| Tipo de DM | Tipo 1 | 35 (0,7) |
| Tipo 2 | 4.694 (99,3) | |
| Presión sistólica (mmHg). Promedio ± DE mín.-máx. | 128 ± 14,7 | 80-220 |
| Presión diastólica (mmHg). Promedio ± DE mín.-máx. | 75,5 ± 8,9 | 40-126 |
| HTA | Controlada | 9.401 (79,1) |
| No controlada | 2.479 (20,9) | |
| DM | Controlada | 7.450 (62,7) |
| No controlada | 4.430 (37,3) | |
| Hipertensos y diabéticos | Controlados | 5.815 (48,9) |
| No controlados | 6.065 (51,1) | |
| Colesterol total, mg/dl (n=11.841) | 171,2 ± 41,9 | 72,6-533,3 |
| Colesterol HDL, mg/dl (n=11.839) | 48,2 ± 13 | 13,2-112,2 |
| Triglicéridos, mg/dl | 155,5 ± 109,4 | 35,4-2.295,8 |
| Colesterol LDL, mg/dl (n=11.832) | 93,2 ± 35,1 | 4-303,2 |
| Hemoglobina glucosilada (HbA1c: %) (n=9.693) | 6,6 ± 1,4 | 3,8-18 |
| Hemoglobina glucosilada (HbA1c: %) categorizada (n=9.693) | ≤ 7 | 7.450 (76,9) |
| 7,1-8 | 1.226 (12,6) | |
| > 8 | 1.017 (10,5) | |
| Creatinina (mg/dl). Promedio ± DE mín.-máx. | 1 ± 0,5 | 0,4-13,5 |
| Tasa de filtración glomerular. Promedio ± DE mín.-máx. | 68,3 ± 30,6 | 3,8-285,9 |
| Clasificación de ERC (evaluada por la fórmula de CG) | G1 | 2.292 (19,3) |
| G2 | 4.103 (34,5) | |
| G3a | 3.032 (25,5) | |
| G3b | 1.895 (15,9) | |
| G4 | 497 (4,2) | |
| G5 | 61 (0,51) |
Características de la foto realizada con cámara de fondo de retina no midriática
| Características | Clasificación | Ojo derechon (%) | Ojo izquierdon (%) |
|---|---|---|---|
| Calidad de la imagen | Baja calidad | 923 (7,8) | 932 (7,9) |
| Aceptable | 10.957 (92,2) | 10.948 (92,1) | |
| Nervio óptico | Anormal | 2.079 (17,5) | 2.151 (18,1) |
| Normal | 9.801 (82,5) | 9.729 (81,9) | |
| Retinopatía diabética | Leve | 202 (1,7) | 225 (1,9) |
| Más que leve | 1.200 (10,1) | 1.139 (9,6) | |
| No aparente | 10.478 (88,2) | 10.524 (88,6) | |
| Grado de retinopatía hipertensiva, clasificación de SCHEIE | 0 | 3.778 (31,8) | 4.111 (34,6) |
| I | 6.522 (54,9) | 6.167 (51,9) | |
| II | 1.521 (12,8) | 1.544 (13,0) | |
| III | 59 (0,5) | 60 (0,5) | |
| Edema macular | Ausente | 10.000 (84,2) | 10.169 (85,6) |
| Presente | 1.880 (15,9) | 1.711 (14,4) | |
| Recomendación | Foto 1 año | 9.653 (81,3) | |
| Foto 6 meses | 158 (1,3) | ||
| Valoración especialista | 2.069 (17,4) | ||
| Resultado | Foto | 9.811 (82,6) | |
| Especialista | 2.069 (17,4) | ||
En la tabla 4 se presenta el análisis bivariado y logístico, mostrando que quienes presentaron mayor oportunidad de ser derivados al especialista fueron los hombres comparados con las mujeres (p=0,006) y los de edad ≥60años comparados con los <60años (p=0,000); el 52,6% del total de los derivados a oftalmología padecían DM, quienes tenían el 85% de mayor oportunidad de ser derivados en comparación con los no diabéticos.
Relaciones bivariadas prediciendo derivación a oftalmología
| Características | Foto en 6-12 meses (9.811) | Valoración oftalmología (2.069) | OR (crudo) | Intervalo de confianza al 95% | p | ||
|---|---|---|---|---|---|---|---|
| Sexo | Femenino | 6,871 (70) | 1,386 (67) | 1 | |||
| Masculino | 2,94 (30) | 683 (33) | 1,15 | 1,04 | 1,27 | 0,006 | |
| Edad agrupada | <60 | 2,421 (24,7) | 286 (13,8) | 1 | |||
| ≥60 | 7,39 (75,3) | 1,783 (86,2) | 2,04 | 1,79 | 2,33 | 0,000 | |
| IMC | Bajo peso | 184 (1,9) | 60 (2,9) | 1 | |||
| Peso normal | 3,086 (31,5) | 763 (36,9) | 0,76 | 0,56 | 1,03 | 0,072 | |
| Sobrepeso | 3,663 (37,3) | 733 (35,4) | 0,61 | 0,45 | 0,83 | 0,002 | |
| Obesidad grado 1 | 2,008 (20,5) | 361 (17,5) | 0,55 | 0,40 | 0,75 | 0,000 | |
| Obesidad grado 2 | 627 (6,4) | 102 (4,9) | 0,50 | 0,35 | 0,71 | 0,000 | |
| Obesidad grado 3 | 243 (2,5) | 50 (2,4) | 0,63 | 0,41 | 0,96 | 0,032 | |
| DM | No | 6,164 (62,8) | 987 (47,7) | 1 | |||
| Sí | 3,647 (37,2) | 1,082 (52,3) | 1,85 | 1,68 | 2,03 | 0,000 | |
| HTA | No | 848 (8,6) | 107 (5,2) | ||||
| Sí | 8,963 (91,4) | 1,962 (94,8) | 1,73 | 1,4 | 2,1 | 0,000 | |
| HbA1c | ≤7% | 6,211 (78,7) | 1,239 (68,8) | 1 | |||
| 7,1%-8% | 917 (11,6) | 309 (17,2) | 1,68 | 1,46 | 1,95 | 0,000 | |
| >8% | 765 (9,7) | 252 (14) | 1,65 | 1,41 | 1,93 | 0,000 | |
| Función renal | G1a | 2,04 (20,8) | 252 (12,2) | 1 | |||
| G2 | 3,474 (35,4) | 629 (30,4) | 1,47 | 1,25 | 1,71 | 0,000 | |
| G3a | 2,472 (25,2) | 560 (27,1) | 1,83 | 1,56 | 2,15 | 0,000 | |
| G3b | 1,437 (14,7) | 458 (22,1) | 2,58 | 2,18 | 3,05 | 0,000 | |
| G4 | 351 (3,6) | 146 (7,1) | 3,37 | 2,67 | 4,25 | 0,000 | |
| G5 | 37 (0,4) | 24 (1,2) | 5,25 | 3,09 | 8,92 | 0,000 | |
| RAC | A1a | 7,313 (74,5) | 1,262 (61) | 1 | |||
| A2 | 1,947 (19,9) | 573 (27,7) | 1,71 | 1,5 | 1,9 | 0,000 | |
| A3 | 551 (5,6) | 234 (11,3) | 2,46 | 2,1 | 2,9 | 0,000 | |
| Presión arterial | Normal | 7,069 (72,1) | 1,411 (68,2) | 1 | |||
| Normal alta | 882 (9) | 198 (9,6) | 1,12 | 0,95 | 1,33 | 0,161 | |
| Grado 1 | 1,431 (14,6) | 351 (17) | 1,23 | 1,08 | 1,40 | 0,002 | |
| Grado 2 | 429 (4,4) | 109 (5,3) | 1,27 | 1,02 | 1,58 | 0,030 | |
| HTA | Controlada | 1,997 (20,4) | 482 (23,3) | 1 | |||
| No controlada | 7,814 (79,7) | 1,587 (76,7) | 1,19 | 1,06 | 1,33 | 0,003 | |
| DM | Controlada | 3,6 (36,7) | 830 (40,1) | 1 | |||
| No controlada | 6,211 (63,3) | 1,239 (59,9) | 1,16 | 1,05 | 1,27 | 0,003 | |
| HTA y HbA1c | Controlada | 4,931 (50,3) | 1,134 (54,8) | 1 | |||
| No controlada | 4,88 (49,7) | 935 (45,2) | 1,2 | 1,09 | 1,32 | 0000 | |
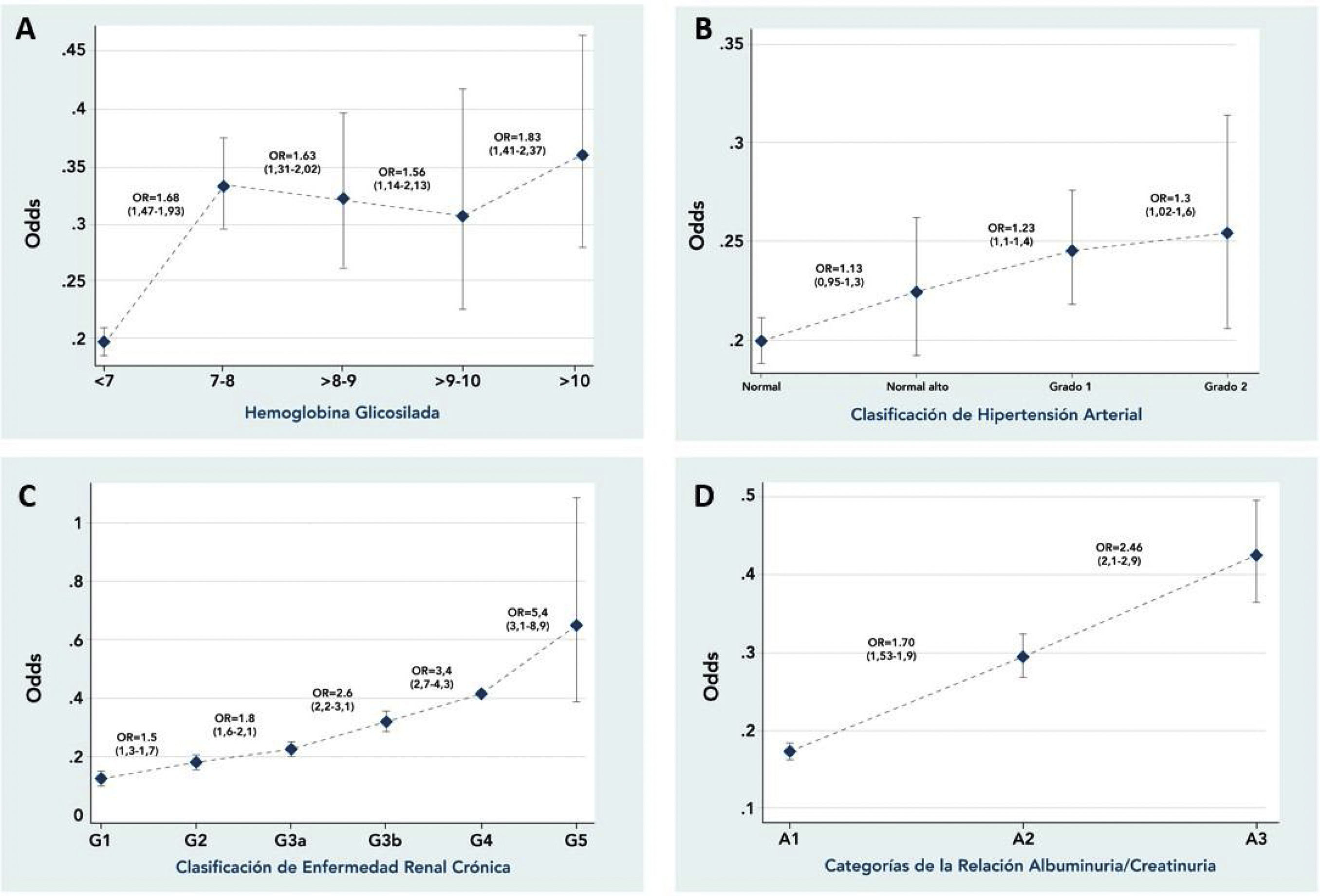
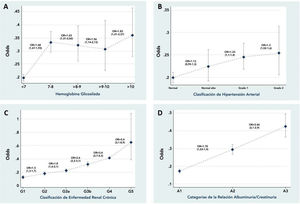
Los pacientes que tenían una HbA1c no controlada tenían el 16% de mayor oportunidad de derivación a oftalmología comparados con los que tenían una HbA1c controlada, lo cual era mayor a medida que se incrementa sus niveles (fig. 2A).
Los pacientes con HTA que tenían una presión arterial sistólica mayor o igual a 140mmHg (HTA no controlada) presentaban una mayor oportunidad de derivación a oftalmología (tabla 4). Además, la oportunidad de ser derivado a oftalmología se incrementaba un 23% y un 30% en los pacientes hipertensos con función renal G1 y G2, respectivamente, comparado con los pacientes que tenían una presión arterial normal (fig. 2B). En suma, todos aquellos pacientes que no tenían un adecuado control de sus condiciones crónicas (HTA y DM) presentaban mayor oportunidad de derivación (OR: 1,2; IC95%: 1,09-1,32).
Los pacientes con reducción de la eTFG presentaban una mayor frecuencia de derivación a oftalmología, observándose una relación lineal. Así mismo, los pacientes con ERC G5 presentaban 4,3 veces mayor oportunidad de ser derivados a oftalmología comparado con los que no tenían daño renal (categoría G1) (fig. 2C); lo anterior no cambia al clasificar el daño renal por la RAC, A3 un 146% y A2 un 30% de mayor oportunidad, respectivamente, de ser derivados a oftalmología, comparado los pacientes con RAC normal (categoría A1) (fig. 2D).
Al final, se construyó un modelo de regresión logística múltiple con las variables que fueron significativas del bivariado. Teniendo en cuenta que las variables DM y HbA1c tenían una alta correlación, se realizaron dos análisis por separado, donde se incluyeron las variables sexo, edad agrupada, IMC agrupado, DM, HTA, RAC y eTFG, documentando que una edad mayor a 60años asociado con HTA, DM y una RAC A2 o A3 fueron los factores relacionados con una mayor oportunidad para derivación a oftalmología (tabla 5).
Relaciones multivariadas prediciendo derivación a oftalmología
| Características | Foto en 6-12 meses (9.811) | Valoración oftalmología (2.069) | OR (crudo) | Intervalo de confianza al 95% | p | OR (ajustado) | Intervalo de confianza al 95% | p | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Edad agrupada | ||||||||||
| <60 | 2,421 (24,7) | 286 (13,8) | 1 | 1 | ||||||
| ≥60 | 7,39 (75,3) | 1,783 (86,2) | 2,04 | 1,79 | 2,33 | 0,000 | 1,634 | 1,39 | 1,91 | 0,000 |
| IMC | ||||||||||
| Bajo peso | 184 (1,9) | 60 (2,9) | 1 | 1 | ||||||
| Peso normal | 3,086 (31,5) | 763 (36,9) | 0,76 | 0,56 | 1,03 | 0,072 | 0,808 | 0,59 | 1,10 | 0,181 |
| Sobrepeso | 3,663 (37,3) | 733 (35,4) | 0,61 | 0,45 | 0,83 | 0,002 | 0,695 | 0,51 | 0,96 | 0,025 |
| Obesidad grado 1 | 2,008 (20,5) | 361 (17,5) | 0,55 | 0,40 | 0,75 | 0,000 | 0,694 | 0,50 | 0,97 | 0,032 |
| Obesidad grado 2 | 627 (6,4) | 102 (4,9) | 0,50 | 0,35 | 0,71 | 0,000 | 0,733 | 0,50 | 1,08 | 0,115 |
| Obesidad grado 3 | 243 (2,5) | 50 (2,4) | 0,63 | 0,41 | 0,96 | 0,032 | 0,876 | 0,56 | 1,38 | 0,566 |
| DM | ||||||||||
| No | 3,6 (36,7) | 830 (40,1) | 1 | 1 | ||||||
| Sí | 6,211 (63,3) | 1,239 (59,9) | 1,85 | 1,68 | 2,03 | 0,000 | 1,920 | 1,73 | 2,13 | 0,000 |
| HTA | ||||||||||
| No | 1,997 (20,4) | 482 (23,3) | ||||||||
| Sí | 7,814 (79,7) | 1,587 (76,7) | 1,73 | 1,4 | 2,1 | 0,000 | 1,26 | 1,01 | 1,57 | 0,038 |
| RAC | ||||||||||
| A1a | 7,313 (74,5) | 1,262 (61) | 1 | 1 | ||||||
| A2 | 1,947 (19,9) | 573 (27,7) | 1,71 | 1,5 | 1,9 | 0,000 | 1,34 | 1,19 | 1,51 | 0,000 |
| A3 | 551 (5,6) | 234 (11,3) | 2,46 | 2,1 | 2,9 | 0,000 | 1,71 | 1,43 | 2,05 | 0,000 |
| Función renal | ||||||||||
| G1a | 2,04 (20,8) | 252 (12,2) | 1 | 1 | ||||||
| G2 | 3,474 (35,4) | 629 (30,4) | 1,47 | 1,25 | 1,71 | 0,000 | 1,22 | 1,02 | 1,46 | 0,031 |
| G3a | 2,472 (25,2) | 560 (27,1) | 1,83 | 1,56 | 2,15 | 0,000 | 1,44 | 1,18 | 1,76 | 0,000 |
| G3b | 1,437 (14,7) | 458 (22,1) | 2,58 | 2,18 | 3,05 | 0,000 | 1,86 | 1,50 | 2,31 | 0,000 |
| G4 | 351 (3,6) | 146 (7,1) | 3,37 | 2,67 | 4,25 | 0,000 | 2,04 | 1,54 | 2,70 | 0,000 |
| G5 | 37 (0,4) | 24 (1,2) | 5,25 | 3,09 | 8,92 | 0,000 | 2,74 | 1,55 | 4,82 | 0,000 |
En esta investigación se identificaron las principales alteraciones retinianas relacionadas con la derivación a oftalmología en una población de alto riesgo cardiovascular, identificada por screening con CFRNM. Dentro de los principales hallazgos se encontró que el sexo masculino, la edad ≥60años, tener HTA y DM, una HbA1c fuera de metas y una ERC moderada a severa con una RAC elevada fueron los factores que se relacionaron con mayor oportunidad de derivación a oftalmología.
En nuestro estudio encontramos una prevalencia de RD del 30%, similar a prevalencias reportadas en diferentes estudios de América Latina y de España (12%), las cuales pueden variar entre el 14% y el 48%21. Sin embargo, en nuestro estudio existió una mayor prevalencia de población con RH (74%), situación que se correlaciona con lo reportado por Adar et al.22 (62%), y que probablemente podría ser explicado por la mayor cantidad de personas con diagnóstico confirmado de HTA entre los pacientes con screening.
Por otra parte, se identificó de manera llamativa una alta prevalencia de edema macular (39%) para la población con DM, superior a la encontrada por Vivas-Giraldo et al.23 en Medellín (Colombia), del 5%, e incluso a la reportada en Estados Unidos (4%)24. Teniendo en cuenta que esta condición representa una de las principales causas de ceguera en población diabética y que tiene una relación significativa con el mayor tiempo de evolución de la DM, consideramos que este estudio deja una importante pauta que debe ser tomada en cuenta en futuros estudios y políticas públicas de screening para estos pacientes.
En cuanto a la HbA1c, encontramos que cuando esta se encuentra fuera de metas no solo guarda una relación lineal con la derivación a oftalmología, sino que además se relaciona con el desarrollo de complicaciones como el edema macular y la ceguera, las cuales se ocasionan por el daño microangiopático y la lesión directa de la barrera hematorretiniana a que están expuestos estos pacientes por el mayor tiempo de evolución de la DM y la carga elevada de glucotoxicidad; situación que puede ser controlada con un manejo estricto de sus niveles, impactando tanto en la incidencia de RD (76%) como en su progresión (54%), respectivamente, según datos extraídos de estudios como el Diabetes Control and Complications Trial25 y el United Kingdom Prospective Diabetes Study26.
Encontramos que la mitad de la población tenía coexistencia de HTA y DM, siendo las ECNT más prevalentes en Colombia; su coexistencia se ha asociado con un incremento del riesgo para desarrollar enfermedad microvascular y macrovascular, factores que han sido motivo de estudios como el ADVANCE27, en donde se demostró que la variabilidad de la presión arterial puede ser predictora de complicaciones microvasculares, independientemente de la presión arterial media, y en cuya evidencia los beneficios de un control estricto sobre la progresión de retinopatía es insuficiente para su prevención, diferente a lo encontrado con un control estricto de la HbA1c.
Finalmente, más del 50% de los pacientes tenían ERC avanzada evaluada tanto por eTFG como por RAC. Fue interesante que la RAC presentara una relación lineal con la derivación a oftalmología (fig. 2D); de igual manera, el deterioro progresivo de la eTFG presentó una relación exponencial y significativa con la derivación de pacientes con DM e HTA a oftalmología (fig. 2C). Dichos hallazgos se explican desde la fisiopatología, puesto que las lesiones microvasculares progresan de manera paralela tanto en el riñón como en la retina, y adicionalmente permiten inferir que los pacientes de este estudio tenían un grado avanzado de dichas condiciones crónicas para el momento del screening. Estos hallazgos son similares a los del estudio de Rodríguez-Poncelas et al.28, en donde se describe que la probabilidad de tener una enfermedad renal diabética manifiesta se incrementa hasta dos veces más cuando un paciente diabético tiene RD comparado con los que no (2,11; IC95%: 1,04-4,26), e incluso con el desarrollo de RD proliferativa y un mayor riesgo de eventos coronarios29, por lo que es necesario no solo un control y un seguimiento dirigidos de estas condiciones, sino que además es necesario un estricto screening de la salud visual y renal, y del riesgo cardiovascular.
Dentro de las fortalezas, se tiene como una de las primeras investigaciones con una muestra grande para screening de retina en Colombia y en Latinoamérica, la cual logró caracterizar bien la población con riesgo de patología ocular utilizando herramientas tecnológicas a la vanguardia y recomendadas dentro de la literatura, las cuales resultan ser no solo innovadoras, sino también coste-efectivas, teniendo en cuenta la creciente prevalencia de ECNT y de sus complicaciones visuales, sobre todo en áreas donde no hay una adecuada cobertura de la atención primaria en salud y que no cuentan con servicios de oftalmología. También es importante resaltar que al momento de evaluar la calidad de la imagen de las fotografías de retina el 92% de estas fueron aceptables, lo que permitió asegurar la validez interna de la investigación.
Dentro de las limitaciones del estudio se encuentran el no haber podido realizar una clasificación de la RD según lo estandarizado en la literatura y no haber podido tener la fecha exacta del diagnóstico de las ECNT (HTA y DM), con lo cual hubiera sido posible conocer su tiempo de evolución y la relación con el tiempo de desarrollo de la RD y la RH.
Se recomiendan, por tanto, estudios multicéntricos en diferentes regiones del país para determinar la prevalencia de las retinopatías en pacientes con estas condiciones crónicas e identificar los principales factores de riesgo que permitan la formulación de políticas de salud pública que impacten directamente en la discapacidad visual prevenible.
ConclusiónEste estudio permitió determinar la importancia que tiene el screening con cámara retinal no midriática en pacientes de alto riesgo cardiovascular para detectar los principales factores de riesgo asociados con alteraciones retinianas que requieren derivación a oftalmología. El hecho de documentar tempranamente el compromiso ocular en estos pacientes podría prevenir y evitar la discapacidad visual y la ceguera.
Consideraciones éticasEl protocolo de estudio fue aceptado por el comité de investigaciones de salud de la Universidad Libre de Cali, Colombia, con acta No. 001 del año 2022, identificado como una investigación de bajo riesgo por resolución 8430 de 1993, del Ministerio de Salud de Colombia. Ajustado a las consideraciones éticas estipuladas en la declaración de Helsinki promulgada en 1975. Además, fue aprobado para su ejecución por el Comité de investigaciones de la unidad de atención primaria de Gesencro en septiembre de 2021. Todos los pacientes fueron informados de las características y propósitos de la investigación, y aceptaron participar en ella.
FinanciaciónLa presente investigación no ha recibido ayudas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflictos de intereses que se relacionen directamente con el manuscrito actual.