El cáncer de mama es una enfermedad prevalente con implicaciones en todas las esferas de la vida de las pacientes, por lo que el médico de familia debe conocer en profundidad esta patología, para optimizar la atención con los mejores recursos disponibles.
Los cinco artículos que componen esta revisión ofrecen un resumen de la literatura sobre el cáncer de mama publicada en los últimos diez años. En esta tercera parte, se recordarán el contexto clínico, estadiaje y los factores pronósticos de la enfermedad.
Esta revisión pretende ofrecer una visión global, actualizada y práctica sobre la enfermedad que permita resolver los interrogantes que se presentan en la consulta de Atención Primaria, facilitar respuestas a las mujeres que lo soliciten y, en definitiva, permanecer al lado de las pacientes a lo largo de su enfermedad con la tranquilidad del conocimiento.
Breast cancer is a prevalent disease with implications in all aspects of patients¿ life, therefore, family doctors must know this pathology in depth, in order to optimize the health care provided to these patients with the best available resources.
This series of five articles on breast cancer is based on a review of the scientific literature of the last ten years. This third article will review the clinical context and the staging and prognostic factors of the disease.
This summary report aims to provide a global, current and practical review about this problem, providing answers to family doctors and helping them to be by the patients for their benefit throughout their illness.
Las consultas sobre enfermedad mamaria son frecuentes en el ámbito de Atención Primaria, generando ansiedad en la mujer ante el miedo a padecer esta enfermedad1. El médico de familia ha de conocer los nuevos procedimientos diagnósticos, colaborar en la realización y elaboración de los programas de cribado poblacional, y derivar a atención especializada a las pacientes con enfermedad mamaria indicativa de malignidad2. Asimismo, ha de ofrecer consejo terapéutico y soporte emocional a las pacientes con el fin de mitigar el sufrimiento y la incertidumbre que esta enfermedad produce.
El cáncer de mama en estadios precoces no suele causar síntomas. Cuando se diagnostica en estadios iniciales suele ser fruto de la participación en programas de cribado, por la realización de una mamografía de control o como seguimiento de otra enfermedad mamaria3,4.
Aunque la mayoría de los síntomas mamarios no están relacionados con el cáncer, su presencia lo hace más probable. Por ello, cualquier síntoma mamario debe ser investigado5. Los síntomas más frecuentes de tumor mamario por los que la mujer acude a consulta son: aparición de un nódulo que previamente no existía, cambios en el tamaño y morfología mamaria, retracción, hundimiento del pezón o lesiones eccematosas del mismo (que pueden indicar enfermedad de Paget), telorrea, irregularidades en el contorno de la mama, aparición de adenopatía axilar, menor movilidad de una de las mamas al levantar los brazos, alteraciones de la piel (úlceras, descamación, enrojecimiento, cambios de color o aparición de piel de naranja) o mastodinia (síntoma menos frecuente). En fases más avanzadas de la enfermedad pueden aparecer síntomas relacionados con la progresión del tumor, tales como dolor óseo, linfedema en el brazo, astenia, anorexia, fiebre, disnea por derrame pleural, etc.6,7.
Actualmente no se dispone de ningún sistema de prevención primaria para la población general, por lo que resulta fundamental la prevención secundaria mediante los programas de cribado. La mamografía ha demostrado ser el método de elección en el diagnóstico precoz del cáncer de mama8.
En Estados Unidos la FDA ha aprobado tanto tamoxifeno como raloxifeno como medicaciones «quimiopreventivas» para el cáncer de mama. En Europa, dado su escaso margen de riesgo-beneficio, no están aprobados. Estos fármacos serían la única alternativa de prevención primaria para población general.
Entre las recomendaciones de los diferentes organismos internacionales para el cáncer de mama, la autoexploración mamaria no ha demostrado utilidad en el descenso de la mortalidad9. La realización de una mamografía bienal para mujeres entre los 50 y los 69 años es lo más aconsejado, y en el caso de las mujeres entre 40-50 años, recomiendan individualizar la realización de pruebas de cribado valorando los antecedentes oncológicos, las preferencias de la paciente y el balance riesgo/beneficio (evidencia grado C)10–14. Entre los 70-74 años no existe suficiente evidencia que avale ninguna recomendación, aunque la tendencia actual es continuar con el cribado bienal.
El diagnóstico de cáncer de mama se realiza mediante técnicas de imagen, fundamentalmente mamografía, y por el análisis del tejido afectado (diagnóstico histológico y molecular). Es necesaria también la determinación de afectación locorregional ganglionar y el estudio de extensión a distancia.
Diagnóstico por imagen del cáncer de mamaActualmente, el diagnóstico de presunción de cáncer de mama realizado por mamografía y otras técnicas de imagen requiere una confirmación histológica para el diagnóstico definitivo.
Una correcta historia clínica y una exploración física exhaustiva han de acompañar siempre cualquier prueba diagnóstica.
El diagnóstico por imagen de este tumor ha evolucionado en los últimos años. En mamografía, se han incorporado las técnicas digitales, los aparatos de ultrasonidos son de mejor calidad, y la resonancia magnética (RM) ha adquirido mayor protagonismo en los algoritmos diagnósticos. No obstante, la mamografía sigue representando el «gold standard» para el diagnóstico por imagen en el cáncer de mama en población general15.
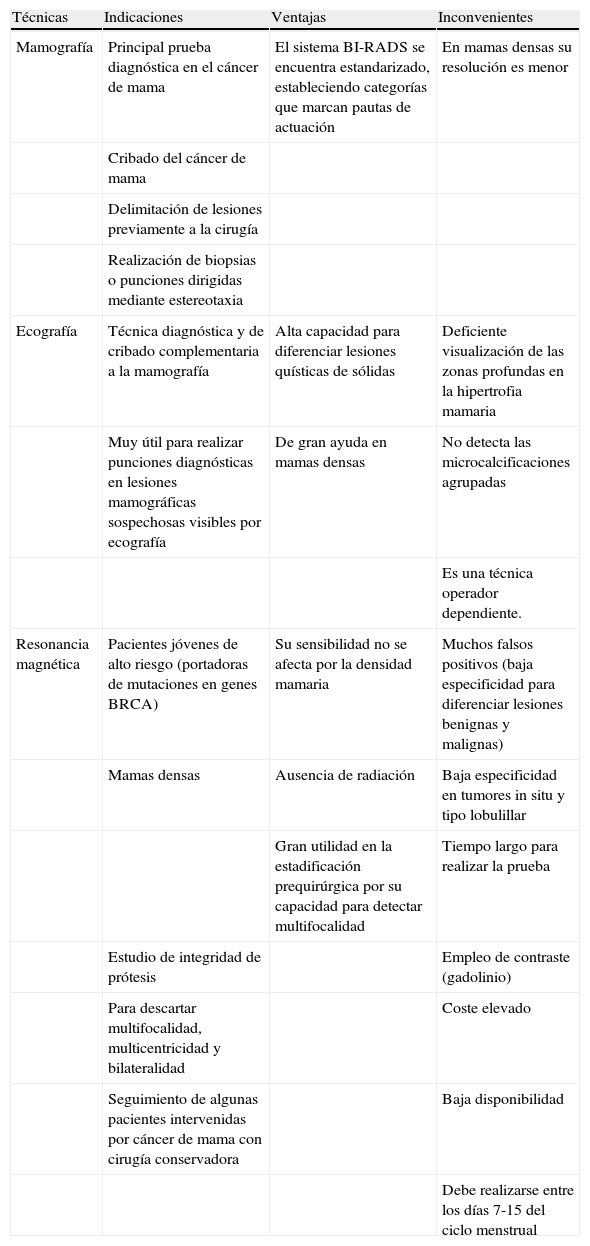
En la tabla 1 se resumen las indicaciones, ventajas e inconvenientes de las principales técnicas de diagnóstico por imagen en el cáncer de mama.
Indicaciones, ventajas e inconvenientes de las técnicas de imagen en el cáncer de mama
| Técnicas | Indicaciones | Ventajas | Inconvenientes |
| Mamografía | Principal prueba diagnóstica en el cáncer de mama | El sistema BI-RADS se encuentra estandarizado, estableciendo categorías que marcan pautas de actuación | En mamas densas su resolución es menor |
| Cribado del cáncer de mama | |||
| Delimitación de lesiones previamente a la cirugía | |||
| Realización de biopsias o punciones dirigidas mediante estereotaxia | |||
| Ecografía | Técnica diagnóstica y de cribado complementaria a la mamografía | Alta capacidad para diferenciar lesiones quísticas de sólidas | Deficiente visualización de las zonas profundas en la hipertrofia mamaria |
| Muy útil para realizar punciones diagnósticas en lesiones mamográficas sospechosas visibles por ecografía | De gran ayuda en mamas densas | No detecta las microcalcificaciones agrupadas | |
| Es una técnica operador dependiente. | |||
| Resonancia magnética | Pacientes jóvenes de alto riesgo (portadoras de mutaciones en genes BRCA) | Su sensibilidad no se afecta por la densidad mamaria | Muchos falsos positivos (baja especificidad para diferenciar lesiones benignas y malignas) |
| Mamas densas | Ausencia de radiación | Baja especificidad en tumores in situ y tipo lobulillar | |
| Gran utilidad en la estadificación prequirúrgica por su capacidad para detectar multifocalidad | Tiempo largo para realizar la prueba | ||
| Estudio de integridad de prótesis | Empleo de contraste (gadolinio) | ||
| Para descartar multifocalidad, multicentricidad y bilateralidad | Coste elevado | ||
| Seguimiento de algunas pacientes intervenidas por cáncer de mama con cirugía conservadora | Baja disponibilidad | ||
| Debe realizarse entre los días 7-15 del ciclo menstrual |
Fuente: elaboración propia.
La mamografía es la principal prueba diagnóstica en el cáncer de mama. Es una técnica radiológica con doble proyección (craneocaudal y mediolateral oblicua), que puede ser analógica o digital. Se emplea tanto en el cribado como en el estudio de lesiones en la mama, y también como guía para la delimitación de las zonas sospechosas, previamente a la cirugía, o para dirigir biopsias o punciones mediante estereotaxia15. Su sensibilidad es elevada en mamas poco densas.
El cáncer de mama puede presentarse en la mamografía como una agrupación de microcalcificaciones (alta sospecha si son heterogéneas, lineales o ramificadas), un nódulo o masa (indicativo de malignidad si es espiculado o irregular, con márgenes mal definidos y densidad igual o superior al parénquima circundante), distorsión de la arquitectura, retracción o densidad focal asimétrica8.
Con el fin de unificar criterios, la American College of Radiology creó el llamado léxico BI-RADS, de Breast Imaging Reporting and Data System, para estandarizar el informe mamográfico, estableciendo 6 categorías que marcan unas pautas de actuación y que aparecen resumidas en la tabla 2.
Código BI-RADS y recomendaciones
| BI-RADS | Definición | Actitud | Seguimiento |
| 0 | Necesita imágenes adicionales para evaluación y/o mamografías anteriores para comparar | Realización de pruebas complementarias si procede, o comparación con previas | Según resultado de pruebas complementarias |
| 1 | Sin hallazgos | Mamografías de control según protocolo | Según protocolo |
| 2 | Hallazgos benignos | Mamografías de control según protocolo | Según protocolo |
| 3 | Hallazgos probablemente benignos (<2% de malignidad) | Comparar con mamografías previas o realizar ecografía. Nunca cribado | A los 6 meses. Si permanece estable, anual durante 2-3 años |
| 4 | Hallazgos sospechosos de malignidad (4-95% de malignidad) | Recomendar biopsia | Según biopsia |
| 4A | Poca sospecha | Recomendar biopsia | Si biopsia benigna: control en 6 meses o control de rutina |
| 4B | Sospecha moderada | Recomendar biopsia | Si biopsia benigna: depende de la concordancia con sospecha clínica |
| 4C | Alta sospecha | Recomendar biopsia | Si biopsia benigna: repetir biopsia o biopsia excisional |
| 5 | Hallazgos muy sospechosos de malignidad (95% de malignidad) | Hacer biopsia percutánea antes de tratamiento quirúrgico | Según biopsia |
| 6 | Biopsia conocida de malignidad comprobada | Completar estudio | Según diagnóstico y extensión tumoral |
Fuente: elaboración propia con datos de http://www.acr.org/∼/media/ACR/Documents/PDF/QualitySafety/Resources/BIRADS/MammoAssessmentCategories.pdf [consultado 16 Sep 2013].
Código BI-RADS: Harris et al.7 y Agency for Healthcare Research and Quality14.
La base de la ecografía son los ultrasonidos, ondas de alta frecuencia emitidas por un transductor, que tras chocar con los diferentes tejidos son reflejadas, captadas de nuevo por el transductor y transformadas en imágenes.
La ecografía mamaria es una técnica con alta capacidad para diferenciar las lesiones quísticas de las sólidas (cercana al 100%). Los nódulos benignos están bien delimitados, son redondos u ovales, homogéneos y de paredes lisas. Los malignos se visualizan irregulares, heterogéneos, lobulados y con sombra acústica7,15.
La ecografía mamaria se considera una técnica diagnóstica y de cribado complementaria a la mamografía, teniendo como inconveniente principal respecto a esta la deficiente visualización de las zonas profundas en mamas hipertróficas, así como de las microcalcificaciones agrupadas. Otro problema que presenta es su carácter dependiente del operador.
Sus ventajas principales son la diferenciación entre lesiones quísticas y sólidas, y la valoración de mamas muy densas, donde la mamografía puede no detectar determinadas lesiones15. La ecografía mamaria también se emplea para valorar la axila en casos de sospecha, previamente a la cirugía y como técnica complementaria para punción o biopsia de nódulos sospechosos en la mamografía. Además, no produce radiación y es una técnica segura en mujeres jóvenes y embarazadas.
Resonancia magnética de la mamaEn los últimos años, la RM se ha ido posicionando como una técnica muy útil en el diagnóstico de lesiones sospechosas, sobre todo en pacientes jóvenes de alto riesgo (portadoras de mutaciones en genes BRCA). También es útil en ciertas pacientes con mamas densas, para evaluar la integridad de prótesis mamarias y para descartar multifocalidad (varios focos tumorales en el mismo cuadrante), multicentricidad (varios focos tumorales en distintos cuadrantes) y bilateralidad, así como en el seguimiento de ciertas pacientes intervenidas por cáncer de mama con cirugía conservadora.
Su sensibilidad no se afecta por la densidad mamaria, aunque tiene una baja especificidad fundamentalmente en tumores in situ y de tipo lobulillar. Precisa el uso de contraste intravenoso (gadolinio), ya que los tumores mamarios captan de forma intensa y precoz esta sustancia. Resulta de gran utilidad en la estadificación prequirúrgica por su capacidad para detectar multifocalidad.
Entre sus inconvenientes se encuentran su elevado coste, su todavía baja disponibilidad, su límite de resolución (entre 3-4mm) y su tasa de falsos negativos (baja en carcinomas invasivos, pero algo mayor en los casos de carcinomas no invasivos)3,4,7,15. El tiempo empleado en la realización de la prueba, mayor que el de otras técnicas, es otro de sus inconvenientes. La RM en mujeres en edad fértil debe llevarse a cabo entre los días 7 y 15 del ciclo menstrual para reducir la tasa de falsos positivos por estimulación hormonal.
La no utilización de rayos X es una ventaja de cara al cribado en poblaciones de alto riesgo, donde las exploraciones deben realizarse desde edades más tempranas y con una periodicidad mayor.
La RM ofrece una baja especificidad para la distinción entre lesiones benignas y malignas, lo que lleva a menudo a biopsias innecesarias.
GalactografíaConsiste en la visualización mamográfica de los conductos galactóforos tras su canalización e inyección de contraste.
La mayoría de las secreciones del pezón están producidas por diferentes causas fisiológicas o medicamentosas, y solo en raras ocasiones (1-15%) se deben a un tumor mamario. Pese a ello, este diagnóstico puede ser más probable si la secreción es unilateral, espontánea, por un solo conducto y de carácter serosanguinolento o sanguinolento. En estos casos, la galactografía puede ser de utilidad previamente a la toma de decisiones quirúrgicas16.
La causa más frecuente de secreción tumoral por el pezón es el papiloma intraductal.
Diagnóstico histológico del cáncer de mamaExisten varios modos de obtener muestras de tejido para el análisis histológico de la mama. Los más comunes son la punción-aspiración con aguja fina (PAAF), la biopsia por punción con aguja gruesa (BAG) y la biopsia quirúrgica. Cada tipo de biopsia tiene sus indicaciones, ventajas e inconvenientes.
La primera de las 3 es una técnica segura para descartar malignidad en lesiones de baja sospecha3,4,7,15. Para lesiones catalogadas como BI-RADS 4 y 5 debe realizarse BAG, ya que el cilindro extraído va a facilitar el diagnóstico de malignidad, el tipo histológico, las características inmunohistoquímicas, la presencia o ausencia de infiltración, además de permitir el estudio de factores pronósticos y predictivos7,14.
Punción-aspiración con aguja finaEn la PAAF se usa una aguja acoplada a una jeringa, que permite extraer una pequeña cantidad de tejido para su análisis microscópico. Aporta una sensibilidad del 70-90% y una especificidad alta, aunque la mayoría de los cirujanos no toman decisiones basadas en la malignidad de la PAAF sin realizar una biopsia preoperatoria.
La aguja puede ser guiada mediante palpación de la zona sospechosa o mediante la ayuda de técnicas de imagen, fundamentalmente ecografía. Puede usarse o no anestesia local.
Es la forma más sencilla y menos invasiva de obtener una muestra de tejido, pero también cuenta con muchas desventajas, entre ellas, los falsos negativos. Tampoco es posible con la PAAF determinar si el cáncer es invasivo; solo en ocasiones se podrán determinar los receptores hormonales y la expresión de HER2/neu. Tiene escasa utilidad en casos de microcalcificaciones o alteración de la arquitectura mamaria. Por todo ello, la PAAF ha quedado relegada a la evacuación de quistes palpables, y sobre todo al estudio citológico de áreas palpables y para la punción de adenopatías axilares15.
Biopsia por punción con aguja gruesaEn la biopsia por BAG se utiliza una aguja más grande de tipo tru-cut. Se usa anestesia local y se extraen pequeñas muestras cilíndricas de tejido. Los falsos negativos son menores que con la PAAF y permite diferenciar el carcinoma intraductal del infiltrante en la mayoría de los casos.
Esta técnica se ha ido consolidando como la de elección en el diagnóstico histológico de lesiones mamarias palpables y no palpables15 por su elevada rentabilidad diagnóstica, seguridad y bajo coste, y está indicada en cualquier lesión palpable o no palpable con sospecha intermedia o alta de cáncer (categorías 4 y 5 de BI-RADS).
Existen diferentes técnicas que pueden usarse para guiar la biopsia, entre las que se encuentran la estereotaxia y la ecografía.
Se conoce como biopsia estereotáxica el empleo de la mamografía con diferentes proyecciones para determinar las coordenadas exactas de la lesión previamente a la biopsia. En algunos centros también puede ser guiada por RM.
Otro sistema de localización de lesiones menos utilizado es la técnica radioguided occult lesion localization, que consiste en la inyección guiada con técnicas de imagen de un radiotrazador en el lecho de biopsia, para localizar la lesión con sondas gammagráficas16.
Las técnicas de biopsia mediante dispositivos de localización tienen un porcentaje de fallos entre el 2-18% para lesiones no palpables.
Biopsia asistida por vacíoLa biopsia asistida por vacío pretende conseguir muestras de tejido más abundantes que con la BAG y disminuir los errores diagnósticos. Se puede hacer con sistemas como el Mammotome® o el ATEC®, de Automated Tissue Excision and Collection. Para este procedimiento, se hace una pequeña incisión en la piel, por donde se inserta una sonda hueca en el área del tejido anormal. Se puede guiar la sonda mediante estereotaxia (la más recomendada hoy en día), ecografía o RM. Entonces se succiona y se corta un cilindro de tejido mediante un bisturí que rota dentro de la sonda. Se pueden tomar varias muestras de la misma incisión.
Una de las principales ventajas de esta técnica es su potencial capacidad de extirpación completa de la lesión (alternativa terapéutica en la categoría BI-RADS 3). En previsión de una extirpación quirúrgica posterior, en lesiones BIRADS 4-5 y otras lesiones sospechosas es necesario a veces la colocación de marcadores metálicos no ferromagnéticos para la identificación del lecho de biopsia.
Biopsia quirúrgica (abierta)Por lo general, el cáncer de mama se puede diagnosticar mediante las técnicas previamente descritas. En pocas ocasiones es precisa la cirugía con fines diagnósticos. Se denomina biopsia excisional la extirpación completa de la lesión, así como el margen circundante que tiene apariencia normal. Si la masa es demasiado grande como para ser extirpada fácilmente, se puede extirpar solo una parte. Este procedimiento se llama biopsia incisional.
Este tipo de biopsias necesitan, en ocasiones, una guía estereotáxica o ecográfica para su mejor localización. También se puede utilizar una aguja arpón. Esta última técnica consiste en la inserción de una aguja hueca desde la piel hasta la lesión, guiada por mamografía o ecografía. Se hace pasar un alambre muy delgado con un arpón en su porción distal que se ancla en la zona sospechosa. Posteriormente se extrae la aguja, quedando el alambre como guía para localizar el punto exacto para la biopsia17.
Clasificación histológica del cáncer de mamaCuando el patólogo recibe tejido mamario procedente de una PAAF para su estudio citológico realiza una primera valoración y lo etiqueta de: «inadecuado», «benigno», «atípico», «sospechoso» o «maligno». El diagnóstico definitivo suele precisar confirmación histológica en una muestra de tejido mayor, ante la sospecha de malignidad o dudas diagnósticas. Además del tipo histológico, es importante la determinación del grado histológico (atipia nuclear, número de mitosis, semejanza con estructuras tubulares o glandulares originales), la presencia de necrosis, el grado de infiltración del tumor y las características inmunohistoquímicas del mismo (presencia de receptores hormonales, amplificación de HER2/neu e índices de proliferación).
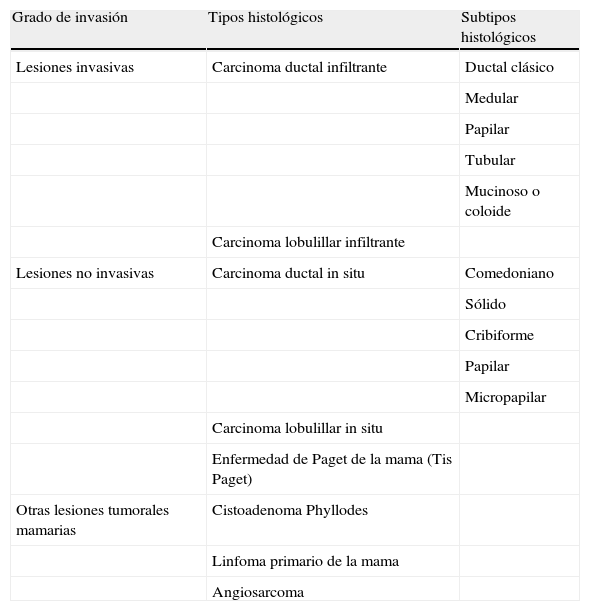
En la tabla 3 se resumen los tipos histológicos de cáncer de mama. El tipo histológico más frecuente es el carcinoma ductal infiltrante (70-85% de los casos).
Tipos histológicos de cáncer de mama y grado de invasión
| Grado de invasión | Tipos histológicos | Subtipos histológicos |
| Lesiones invasivas | Carcinoma ductal infiltrante | Ductal clásico |
| Medular | ||
| Papilar | ||
| Tubular | ||
| Mucinoso o coloide | ||
| Carcinoma lobulillar infiltrante | ||
| Lesiones no invasivas | Carcinoma ductal in situ | Comedoniano |
| Sólido | ||
| Cribiforme | ||
| Papilar | ||
| Micropapilar | ||
| Carcinoma lobulillar in situ | ||
| Enfermedad de Paget de la mama (Tis Paget) | ||
| Otras lesiones tumorales mamarias | Cistoadenoma Phyllodes | |
| Linfoma primario de la mama | ||
| Angiosarcoma |
Fuente: elaboración propia.
El carcinoma ductal in situ (DCIS) puede evolucionar hasta cáncer invasivo, aunque la posibilidad de que esto suceda varía según distintas series publicadas. La frecuencia del diagnóstico de DCIS ha aumentado desde la realización de pruebas de cribado mamográfico. La mayoría (80%) no se manifiestan clínicamente, y se diagnostican mediante mamografía. Existen diferentes subtipos histológicos. Entre ellos, el tipo comedo parece tener la probabilidad más alta de convertirse en invasivo.
La importancia principal del carcinoma lobulillar in situ es que se trata de un marcador de riesgo para cáncer de mama invasivo, más que un verdadero cáncer, que se mantiene durante décadas (algunos autores han planteado cambiarle el nombre). Con elevada frecuencia, el carcinoma lobulillar in situ es multicéntrico y bilateral.
Estudio de extensión tumoral en el cáncer de mamaUna vez confirmado el diagnóstico histológico de cáncer de mama, es necesario un estudio de extensión tumoral. En todas las pacientes se debe realizar radiografía de tórax y analítica completa con función hepática y renal. En caso de alteración de estas pruebas o en tumores avanzados se valorará la realización de tomografía computarizada toracoabdominal, ecografía abdominal y gammagrafía ósea, con el fin de completar el estudio, establecer el estadio tumoral (tablas 4 y 5), calcular factores pronósticos y planificar una estrategia individualizada de tratamiento18.
Clasificación TNM del cáncer de mama
| Tumor primario (T) |
| TX No se puede evaluar el tumor primario |
| T0 No existe prueba de tumor primario |
| Tis carcinoma in situ |
| Tis carcinoma ductal in situ |
| Tis carcinoma lobulillar in situ |
| Tis enfermedad de Paget del pezón que NO está relacionada con el carcinoma invasivo o carcinoma in situ (CDIS o CLIS) en el parénquima mamario subyacente. Los carcinomas del parénquima mamario relacionados con enfermedad de Paget se clasifican sobre la base del tamaño y las características de la enfermedad parenquimal, aunque la presencia de la enfermedad de Paget aún se debería señalar |
| T1 El tumor mide≤20mm en su diámetro mayor |
| T1mi El tumor mide≤1mm en su diámetro mayor |
| T1a El tumor mide>1mm pero≤5mm en su diámetro mayor |
| T1b El tumor mide>5mm pero≤10mm en su diámetro mayor |
| T1c El tumor mide>10mm pero≤20mm en su diámetro mayor |
| T2 El tumor mide>20mm pero≤50mm en su diámetro mayor |
| T3 El tumor mide>50mm en su diámetro mayor |
| T4 Cualquier tamaño con extensión directa a pared costal o a piel (ulceración o nódulos cutáneos) |
| T4a Extensión a la pared torácica que no solo incluye adherencia o invasión a los músculos pectorales |
| T4b Ulceración o nódulos satélites ipsilaterales o edema (incluyendo la piel de naranja), los cuales no satisfacen el criterio de carcinoma inflamatorio |
| T4c Ambos, T4a y T4b |
| T4d Carcinoma inflamatorio |
| Ganglios linfáticos regionales (N) |
| Clasificación clínica (cN) |
| Nx No se pueden valorar los gg regionales |
| N0 Ausencia de metástasis linfática regional |
| N1 Metástasis ipsilateral axilar movible |
| N2 |
| N2a Metástasis ipsilaterales niveles i y ii axilares fijos |
| N2b Afectación mamaria interna sin gg axilares |
| N3 |
| N3a Metástasis axilares infraclaviculares (grado iii) ipsilaterales |
| N3b Metástasis en gg mamaria interna ipsilaterales y axilares |
| N3c Metástasis ipsilaterales supraclaviculares |
| Clasificación patológica (pN) |
| pNx No se pueden evaluar los gg linfáticos regionales |
| pN0 Sin evidencia histológica de metástasis en gg linfáticos regionales |
| pN0 (i−) Sin evidencia histológica e inmunohistoquímica (IHC) |
| pN0 (i+) Presencia de células tumorales≤0,2mm mediante H-E o IHC |
| pN0 (mol−) Ausencia histológica y molecular de metástasis |
| pN0 (mol+) Ausencia histológica e IHC negativa con hallazgos moleculares positivos |
| pN1 Micrometástasis |
| pN1mi Micrometástasis (>0,2mm y/o más de 200 células, pero<2,0mm) |
| pN1a Metástasis en 1-3 gg axilares y al menos una de ellas>2mm |
| pN1b Metástasis en gg mamarios internos con afectación micrometastásica-macrometastásica del ganglio centinela sin detección clínica |
| pN1c Metástasis en 1-3 gg axilares y mamarios internos con afectación micrometastásica-macrometastásica del ganglio centinela sin detección clínica |
| pN2 Metástasis en 4-9 gg axilares o afectación mamaria interna clínicamente sin afectación axilar |
| pN2a Metástasis en 4-9 gg axilares (al menos uno>2mm) |
| pN2b Metástasis en gg linfáticos de mamaria interna detectados clínicamente sin afectación gg axilares |
| pN3 |
| pN3a Metástasis en≥10 gg axilares (al menos uno>2mm) o metástasis en gg infraclaviculares (ganglio axilar de grado iii) |
| pN3b Metástasis en>3 gg axilares y mamarios internos detectados clínicamente, o>3 gg axilares o afectación de cadena mamaria interna (micrometástasis-macrometástasis ganglio centinela) sin detección clínica |
| pN3c Metástasis linfática supraclavicular ipsilateral |
| Metástasis a distancia (M) |
| Mx No evaluadas. |
| M0 No existen pruebas clínicas o radiológicas de metástasis a distancia |
| cM0 (+) No existen pruebas clínicas o radiológicas de metástasis a distancia, aunque sí hay evidencia de células tumorales en sangre circulante, médula ósea o tejidos gg no regionales (≤0,2mm) |
| M1 Metástasis a distancia detectada clínica o radiológicamente o por medios histológicos>0,2mm |
Fuente: adaptada de AJCC Cancer Staging Manual, 7.a edición, 2010.
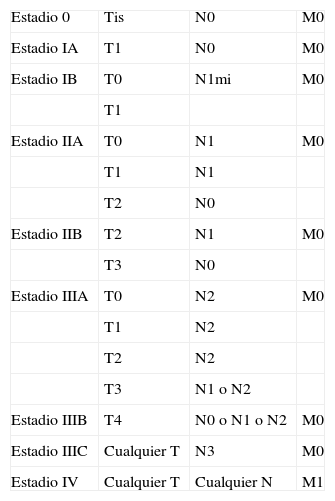
Estadificación del cáncer de mama según la clasificación TNM
| Estadio 0 | Tis | N0 | M0 |
| Estadio IA | T1 | N0 | M0 |
| Estadio IB | T0 | N1mi | M0 |
| T1 | |||
| Estadio IIA | T0 | N1 | M0 |
| T1 | N1 | ||
| T2 | N0 | ||
| Estadio IIB | T2 | N1 | M0 |
| T3 | N0 | ||
| Estadio IIIA | T0 | N2 | M0 |
| T1 | N2 | ||
| T2 | N2 | ||
| T3 | N1 o N2 | ||
| Estadio IIIB | T4 | N0 o N1 o N2 | M0 |
| Estadio IIIC | Cualquier T | N3 | M0 |
| Estadio IV | Cualquier T | Cualquier N | M1 |
Fuente: adaptada de AJCC. Breast. En: Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, et al., editores. AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010. p. 347-76.
Los marcadores tumorales no están indicados en la evaluación inicial, sino en la monitorización de la respuesta a metástasis junto a pruebas de imagen.
En el caso de la gammagrafía ósea, estudios recientes19 indican que es innecesaria al inicio, en lesiones menores de 2cm y en estadio clínico iiA o inferior, siendo necesaria su realización en el resto de los casos.
La tomografía por emisión de positrones asociada a tomografía computarizada se puede emplear también en el seguimiento de esta enfermedad cuando existen datos de recurrencia y para el control de la respuesta al tratamiento20.
Como norma general no está indicada la realización de pruebas de imagen en el seguimiento del cáncer de mama (salvo mamografía anual) si no hay sospecha de recurrencia.
Afectación ganglionar. Técnica del ganglio centinelaLa biopsia de ganglio centinela (SLNB) (Cabanas, 1977) se aplicó al cáncer de mama en los años 9021. La SLNB se basa en el estado del primer ganglio de drenaje del tumor, y es fiable para predecir la afectación del resto de los ganglios axilares. Puede haber uno o más ganglios centinela.
Consiste en la inyección de azul de metileno o una sustancia radioactiva (llamada marcador) en el tumor o la zona peritumoral. Los primeros ganglios linfáticos que se tiñen de azul o retienen el marcador se denominan ganglios linfáticos centinela. Una vez localizado/s, se extirpa/n durante la cirugía para ser analizado/s en ese instante.
Si no presentan afectación tumoral, no sería necesaria la disección ganglionar axilar. Si se encuentran células cancerosas en estos primeros ganglios, se deben extirpar más ganglios linfáticos. Algunos estudios plantean que si la afectación ganglionar es de escasa cuantía, podría evitarse la linfadenectomía.
Existen 3 niveles de ganglios linfáticos axilares:
- -
El nivel 1 es el nivel más bajo y cercano a la mama.
- -
El nivel 2 se encuentra en la zona inmediatamente superior, debajo del músculo pectoral mayor.
- -
El nivel 3 incluye los ganglios linfáticos más altos, situados por encima de este músculo.
En la disección linfática axilar (ALND) estándar se incluyen habitualmente los niveles 1 y 2.
La SLNB en el cáncer de mama es una técnica bien establecida que ha sido validada en numerosos estudios. Muestra gran fiabilidad, al identificar el 98% de los ganglios centinela. Es una técnica segura, con una incidencia de reacciones alérgicas menor del 1% y del 1,25% de necrosis de la piel22,23.
Esta técnica permite una actitud menos invasiva y, por tanto, presenta menor morbilidad comparándola con la disección linfática axilar. Diversos estudios obtienen resultados de menor dolor, parestesias, alteración de la movilidad del brazo y linfedema.
La recidiva axilar en pacientes sometidas a esta técnica es menor del 1% y similar a la de las pacientes tratadas con ALND. Los fracasos de la técnica se relacionan con factores que dependen del paciente (obesidad, edad avanzada), del cirujano y de las características tumorales (tumores en cuadrantes altos, etc.).
La SLNB está considerada hoy en día como el estándar en el abordaje de la axila24 clínicamente negativa (ausencia de ganglios palpables), pero hay que tener en cuenta situaciones especiales en las que no se realiza de rutina, como la enfermedad localmente avanzada, el cáncer inflamatorio, el embarazo, el DCIS, el cáncer de mama en el varón, enfermedad multicéntrica y cirugía previa axilar.
El cáncer inflamatorio es una contraindicación relativa para esta técnica, porque la invasión linfática subdérmica puede bloquear el paso del contraste. Además, es un tipo de cáncer que presenta una afectación ganglionar clínica en el 55-85% de los casos, y un 18-25% de falsos negativos, detectados en varios estudios incluso tras quimioterapia en neoadyuvancia25,26, motivo por el que no se recomienda la SLNB.
La Asociación Americana de Oncología Clínica no recomienda esta técnica en la enfermedad localmente avanzada (T4a-c N2-3 M0)27. No todas las sociedades están de acuerdo, considerando necesaria la realización de más estudios.
Al igual que en el cáncer inflamatorio, el tratamiento de la enfermedad localmente avanzada se basa en quimioterapia neoadyuvante seguida de la cirugía del tumor, realizándose disección axilar si hay respuesta del tumor completa o casi completa.
Durante el embarazo está contraindicada la realización de esta prueba con los contrastes habituales, pero se pueden sustituir por sulfuro coloide28.
En el DCIS no sería necesaria la realización de SLNB a menos que se plantease una mastectomía o el tumor fuese de alto grado, o de gran tamaño.
En el cáncer de mama en el varón no se recomienda, ya que, debido a su rareza, no hay estudios al respecto29.
En casos de cirugía axilar o mamaria previas (incluida la cirugía de reducción o de aumento de la mama) no parece claro el papel de la SLNB. La Asociación Americana de Oncología Clínica no la recomienda claramente si ha habido cirugía axilar, sin embargo, algún estudio apoya la SLNB en estos casos30.
En enfermedad multicéntrica, algunos estudios detectan el mismo porcentaje de falsos negativos con la técnica SLNB que con ALND. Sin embargo, otros trabajos contradicen esto.
Ganglio centinela positivoEs relativamente frecuente que a pesar de que exista un ganglio centinela positivo, el resto de la axila esté libre de enfermedad (52% de los casos, que se incrementa al 82% en caso de afectación micrometastásica). Esto ha llevado a una mayor precisión en el análisis anatomopatológico, utilizando secciones más finas, técnicas de inmunohistoquímica, y reacción en cadena de la polimerasa con transcriptasa inversa. La aplicación de estas nuevas técnicas permite identificar enfermedad micrometastásica (0,2-2mm y/o más de 200 células afectadas dentro del ganglio) o células tumorales aisladas (<0,2mm), quedando esto reflejado en la nueva clasificación de la estadificación TNM, subclasificando la afectación ganglionar (7.a edición del American Joint Committee on Cancer, ver tablas 4 y 5).
A pesar de estas nuevas evidencias, muchos profesionales siguen realizando vaciamiento axilar cuando el ganglio centinela es positivo, aunque existe una tendencia progresiva a evitar la linfadenectomía axilar cuando la afectación es escasa.
Las mejores evidencias muestran que no existen ventajas entre las 2 técnicas, SLNB y ALND, en cuanto a supervivencia, recurrencia axilar en pacientes con estadios 1 y 2, y uno o 2 ganglios centinela positivos, aunque estos datos deben ser interpretados con cautela debido al tiempo corto de seguimiento de los estudios, la baja afectación axilar en los mismos y otras limitaciones.
Desde el conocimiento de los marcadores moleculares (receptores hormonales: de estrógenos [ER] y progesterona [PR] y receptor HER2/neu), la afectación axilar como determinante en el pronóstico de la enfermedad ha perdido peso, por lo que es posible que la linfadenectomía axilar deje de utilizarse como técnica de estadificación.
Clasificación molecular del cáncer de mamaEl cáncer de mama es una compleja enfermedad que incluye distintas entidades morfológicas, clínicas y moleculares. Esta heterogeneidad no puede ser explicada solo por parámetros clínicos y anatomopatológicos clásicos, como el tamaño tumoral, la invasión ganglionar o el subtipo histológico, sino que también influyen la presencia en el tumor de ER, PR y receptor HER2/neu.
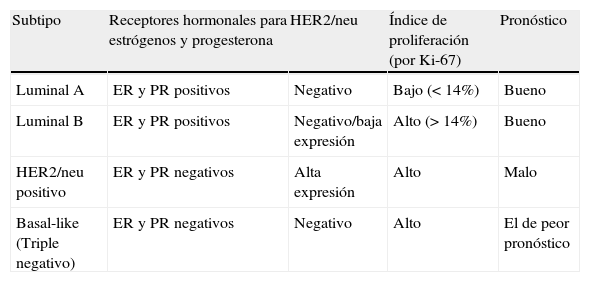
Puesto que tumores semejantes y homogéneos tienen distintos comportamientos biológicos, cabe suponer que la diferencia se encuentra a nivel molecular y se expresa en distintos genes, lo que les otorga distinta respuesta a los tratamientos. Utilizando técnicas de micromatrices del ADN y analizando cientos de genes en series de carcinomas mamarios, se han obtenido los perfiles moleculares de cada tumor y un agrupamiento de los mismos en pocas categorías denominadas Luminal A, Luminal B, HER2-enriched, Basal-like o Triple negativo, Normal breast y Claudin-low. Los subtipos más importantes desde el punto de vista clínico se recogen en la tabla 6. Dado que los 2 últimos subtipos están todavía mal caracterizados y no aportan información relevante a efectos de decisión terapéutica, no aparecen reflejados en dicha tabla.
Clasificación del cáncer de mama en función de su perfil molecular
| Subtipo | Receptores hormonales para estrógenos y progesterona | HER2/neu | Índice de proliferación (por Ki-67) | Pronóstico |
| Luminal A | ER y PR positivos | Negativo | Bajo (<14%) | Bueno |
| Luminal B | ER y PR positivos | Negativo/baja expresión | Alto (>14%) | Bueno |
| HER2/neu positivo | ER y PR negativos | Alta expresión | Alto | Malo |
| Basal-like (Triple negativo) | ER y PR negativos | Negativo | Alto | El de peor pronóstico |
Fuente: elaboración propia con datos de García Toro32.
Durante la pasada década, la investigación se ha centrado en profundizar en el conocimiento de la biología molecular de los tumores, y los avances técnicos han permitido conocer varias vías de señalización molecular, que junto al ambiente celular y las características del paciente influyen en la fisiopatología y respuesta al tratamiento. De estos hallazgos se puede deducir que no hay una sola enfermedad, sino muchas, y que el tratamiento personalizado podría jugar un papel crucial.
Perfiles de expresión genéticaEn el año 2000, Perou publicó por primera vez una clasificación del cáncer de mama en subtipos basada en expresión genética, y posteriormente hubo muchas contribuciones de diferentes autores que han cambiado la manera de entender, clasificar y estudiar el cáncer de mama.
Aunque los programas de detección precoz y los tratamientos han reducido la mortalidad por esta enfermedad, todavía hay un 20-30% de pacientes que desarrollan metástasis con una media de supervivencia de 2-4 años desde la recidiva, en dependencia del subtipo.
Aunque la clasificación por perfiles de expresión genética (tabla 6) ha sido validada por diferentes grupos, recientemente se han añadido más subtipos, permaneciendo abiertas las posibilidades de mejora y estandarización de dicha clasificación basándose en nuevos descubrimientos31,32.
El subtipo Luminal A es el más común (50-60% del total). Los tumores luminales pueden ser ductales infiltrantes o lobulillares. Su inmunohistoquímica se caracteriza, además, por la expresión de algunos genes, como bcl2 y PGR, y citoqueratinas 8 y 18. Su grado histológico es bajo. Presentan receptores hormonales positivos y HER2/neu negativo.
Las recaídas son predominantemente a nivel óseo, aunque también en el sistema nervioso central, hígado y pulmón, con una supervivencia tras la recaída larga (mediana en torno a los 3 años). Un tratamiento particularmente útil en estas pacientes son los inhibidores de la aromatasa en pacientes posmenopáusicas, y los moduladores del ER como tamoxifeno en premenopáusicas.
El subtipo Luminal B supone el 10-20% de todos los tumores mamarios. Tienen un fenotipo más agresivo que los A, con grado histológico más alto. El patrón de recidiva es algo diferente, pero el hueso sigue siendo la localización más frecuente, seguido por el hígado. La supervivencia tras la recaída es menor (1,6 años). Se está realizando un esfuerzo por encontrar otros biomarcadores que los distingan del A. Aunque también expresan receptores hormonales (ER y PR), se diferencian del anterior en un mayor índice proliferativo y posibilidad de HER2/neu positivo.
Tienen peor respuesta a tamoxifeno, pero responden mejor a quimioterapia. Aún quedan muchas preguntas sin contestar para este subtipo.
El subtipo HER2-enriched supone un 15-20% de los tumores mamarios. No expresa receptores hormonales. El 75% tiene un grado histológico alto y más del 40% tienen mutación en p53. Su perfil genético y el inmunohistoquímico pueden no coincidir. Desde el punto de vista clínico, tradicionalmente el HER2 tenía peor pronóstico, aunque en la última década los tratamientos anti-HER2 han mejorado sustancialmente la supervivencia. Tienen alta quimiosensibilidad y mejores respuestas que el Luminal B.
El subtipo Basal-like o Triple negativo representa el 10-20% de los cánceres de mama. La ausencia de los 2 receptores hormonales y de HER2/neu caracterizan este subtipo. Expresan genes normales de las células epiteliales, incluyendo citoqueratinas de alto peso molecular (CK5, CK17, P-cadherin y EGFR) y genes característicos del epitelio luminal (CK8/18 y Kit), pero con niveles más bajos que los luminales. Suelen aparecer en edades tempranas, son de gran tamaño al diagnóstico, con frecuente afectación linfática y alto grado histológico. Generalmente son ductales infiltrantes, con necrosis tumoral y respuesta linfática estromal. Son tumores quimiosensibles. El patrón de recaída es diferente al de los tumores con receptores hormonales, presentando mayor riesgo en los 3 primeros años. Predominan las metástasis viscerales y cerebrales. Habitualmente se equiparan los términos Basal-like y Triple negativo, pero existen discordancias. Cinco marcadores (ER, PR, HER2, EGFR y CK5/6) definen el Triple negativo por inmunohistoquímica, con una especificidad del 100% y una sensibilidad del 76%. La mutación de la p53 es frecuente y explica la agresividad y el peor pronóstico. La mayoría de los cánceres de mama en mujeres portadoras de BRCA1 son de este subtipo.
El subtipo Normal breast podría representar el 5-10% de los tumores mamarios. Está mal caracterizado. Existen dudas sobre la existencia de este subtipo, considerando algunos investigadores que se trata de un artefacto o contaminación con tejido sano.
El subtipo Claudin-low fue identificado en 2007 y se diferencia del Basal-like en que expresa 40 genes relacionados con respuesta inmune celular. Clínicamente corresponden a ductales de alto grado. Alrededor del 20% presentan ER positivos.
Basándose en esta nueva clasificación, St. Gallen en 201133 establece 5 subtipos: Luminal A, Luminal B, Luminal B HER2+, HER2-enriched y Triple negativo, que son los utilizados en la práctica clínica para la toma de decisiones terapéuticas.
Sin embargo, la guía internacional National Comprehensive Cancer Network de 2011 todavía no incorpora esta nueva clasificación.
Las pruebas que analizan los genes de un tumor mediante micromatrices se están desarrollando en diferentes tipos de cáncer y ayudan a predecir el riesgo de recidivas y la necesidad de tratamientos más intensivos. Habitualmente se realizan después de la determinación del estadio. En el caso del cáncer de mama existen sistemas patentados que identifican estos genes:
- 1.
Oncotype Dx® evalúa 21 genes y calcula el riesgo de recurrencia a distancia a los 10 años en mujeres con cáncer de mama con ER positivos, en estadios i o ii, con resultado ganglionar negativo y que reciben exclusivamente terapia hormonal. Permite ayudar en la toma de decisiones sobre el empleo de quimioterapia.
- 2.
MammaPrint® utiliza el análisis de 70 genes del tumor para predecir el riesgo de recidiva de cáncer de mama en mujeres menores de 61 años, con estadios i o ii, tamaño tumoral menor de 5cm y sin afectación ganglionar. Estudios recientes consideran que MammaPrint® podría ser un mejor predictor pronóstico de recidiva a distancia que otras características tumorales o sistemas pronósticos de base clínica clásicamente empleados34.
Últimamente han aparecido 2 nuevos sistemas denominados Prosigna® y EndoPredict®.
Estadios del cáncer de mamaEl sistema TNM de estadificación del American Joint Committee on Cancer proporciona una estrategia para agrupar a las pacientes según el pronóstico.
En las tablas 4 y 5 se muestra la clasificación TNM de cáncer de mama y la estadificación de esta enfermedad sobre la base de dicha clasificación.
Factores pronósticos en cáncer de mamaEn pacientes con cáncer de mama se utilizan diferentes aspectos clínicos y patológicos con carácter pronóstico, y en función de algunos de estos factores se han elaborado índices para categorizar el riesgo35.
Recientemente, las técnicas moleculares, en especial los perfiles de expresión genética, han ayudado a redefinir la clasificación del cáncer de mama, establecer el pronóstico y seleccionar las terapias más adecuadas.
A continuación, se resumen los factores pronósticos más importantes36–38.
- 1.
Edad. Las mujeres menores de 30 años suelen tener menor supervivencia al presentar tumores más grandes, con más afectación ganglionar (a veces por diagnósticos más tardíos) y tener, con más frecuencia, receptores hormonales negativos, HER2/neu positivo y mutación en p53 en el primer caso. Las mujeres de mayor edad suelen tener receptores hormonales positivos, pero también mas comorbilidades que pueden limitar las posibilidades de tratamiento.
- 2.
Tamaño tumoral. Es un fuerte indicador pronóstico que también se relaciona con afectación linfática. Los tumores de 2-5cm frente a los de 1cm tienen una disminución del 79% de supervivencia a los 10 años, sin tener en cuenta la afectación ganglionar. Es un factor independiente.
- 3.
Grado histológico. Sobre este punto hay varias clasificaciones y algunas han sido validadas: Nottingham Combined Histologic Grade, Fisher Grading Nuclear System, y Richardson. Los tumores de alto grado tienen peor pronóstico, dependiendo también de la afectación ganglionar y el tamaño (30% de supervivencia los de alto grado frente a 90% los de bajo grado).
- 4.
Afectación ganglionar. Es un indicador independiente de supervivencia. La afectación linfática incrementa entre 4 y 8 veces la mortalidad.
A mayor número de ganglios afectados, peor pronóstico. La presencia de 10 o más ganglios confiere un exceso de mortalidad a los 10 años del 70%, frente a los que tienen afectados 1-3 ganglios.
Si los ganglios son palpables o están adheridos, el pronóstico es peor.
Metástasis ganglionares en mamaria interna y hueco supraclavicular empeoran el pronóstico, especialmente si afectan a cuadrante interno. La invasión del hueco supraclavicular, la afectación extranodal y la de los ganglios del tercer nivel ensombrecen también el pronóstico.
- 5.
Invasión linfovascular y marcadores de angiogénesis tumoral. Hay un aumento de mortalidad del 60% cuando existe invasión vascular. Algunos autores mantienen que la asociación de afectación linfovascular y presencia de receptores para factores de crecimiento endotelial tiene carácter pronóstico, aunque faltan más estudios que lo corroboren.
- 6.
Receptores hormonales. La presencia de estos receptores (ER positivos) conlleva un mejor pronóstico en los primeros años, pero no a largo plazo en los tumores operables.
- 7.
Oncogenes y genes supresores. La positividad del oncogén HER2/neu tradicionalmente empeoraba el pronóstico. Los tumores HER2 positivos pueden presentar mutaciones en p53, suelen ser, además, ER negativos, tener un alto grado mitótico e infiltración linfática. Los tumores HER2 positivos suelen responder al tratamiento con trastuzumab, lo que ha mejorado su pronóstico.
Las mutaciones en línea germinal en los genes BRCA1 y BRCA2 constituyen un factor de riesgo para el padecimiento de cáncer de mama. Sin embargo, su papel en la supervivencia no ha sido establecido.
La mutación p53 se suele asociar a un peor pronóstico y a tumores Triple negativo, como también los altos niveles de activador de plasminógeno, tanto si hay afectación ganglionar como si no la hay.
Existen diferentes líneas de investigación en genética del cáncer que identifican genes intrínsecos de los tumores que podrían correlacionarse con metástasis a distancia.
- 8.
El índice mitótico es indicador de proliferación tumoral. Tumores sin afectación ganglionar, índice mitótico mayor de 10 y menores de 5cm tienen un 80% de supervivencia a los 10 años comparado con el 90% si el índice mitótico es menor de 10.
La Ki-67 es una proteína nuclear que se detecta en células en diferentes fases del ciclo celular (G1, S, G2 y M), pero está ausente en células en fase G0. Su detección en el tejido indica la existencia de células tumorales en proliferación.
Captesina D, ploidías y porcentaje de células en fase S se han planteado como factores pronósticos, aunque los estudios resultan controvertidos.
- 9.
El pronóstico en función del tipo histológico resulta controvertido en la actualidad, no siendo considerado un factor pronóstico independiente. Es excelente en los casos de cáncer invasivo cribiforme, tubular, tubulolobular y mucinoso, con una supervivencia mayor del 80% a 10 años.
El cáncer de mama inflamatorio presenta, en general, mal pronóstico, con un 28% de supervivencia a los 10 años.
- 10.
Otros factores que influyen en el pronóstico
La presencia de metástasis, recaída antes de los 5 años, localización visceral de esta y la aparición de un segundo tumor empeoran el pronóstico.
La enfermedad cardiovascular y la diabetes son, entre las comorbilidades, las que más impacto pueden tener en la supervivencia de estas pacientes.
El diagnóstico precoz y la correcta estadificación son aspectos importantes. Es un hecho constatado en países industrializados, para todos los grupos de edad y características tumorales, que la supervivencia mejora cuando se facilita el acceso a los procedimientos diagnósticos y terapéuticos.
Aspectos como el estatus socioeconómico y la raza también se han visto relacionados con el pronóstico. La disminución de la supervivencia en mujeres de estatus social más bajo podría explicarse por retrasos diagnósticos, tumores más agresivos y recibir peores tratamientos. Las mujeres de raza negra presentan un exceso de mortalidad por todas las causas y una supervivencia a los 10 años tras el diagnóstico del 58% frente al 66% en las mujeres blancas. En esto también podrían contribuir factores relacionados con el estilo de vida, las comorbilidades y la variación genética.
Existen factores que tienen que ver con el estilo de vida, como la obesidad, el ejercicio físico y las dietas.
La obesidad parece relacionarse con un aumento de riesgo de cáncer de mama contralateral en la posmenopausia y con un aumento de riesgo de padecer segundos tumores.
Las mujeres que realizan ejercicio físico tienen un 40% menos de riesgo de morir por todas las causas, y estudios de controvertido diseño muestran beneficios con dietas ricas en frutas, verduras, legumbres y pescado.
Algunos estudios muestran que la obesidad, el alcohol y un primer embarazo a una edad avanzada aumentan el riesgo de desarrollar tumores ER positivos.
Algunos de los factores pronósticos presentados se han agrupado en índices como Nottingham Prognostic Index, que incluye tamaño tumoral, grado histológico y afectación linfática, y TNM (tamaño del tumor primario, afectación ganglionar y presencia de metástasis a distancia).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo está dedicado a todas las mujeres y sus familiares que luchan cada día contra el cáncer de mama, lo harán en un futuro o lo hicieron en el pasado. En especial a ti, Paloma. También a los profesionales y asociaciones que contribuyen con su trabajo y dedicación a la mejora de la salud y calidad de vida de estas pacientes.