Se trata de determinar la enfermedad renal crónica (ERC) oculta y su relación con la aparición de los eventos cardiovasculares (ECV) y mortalidad. Además, se pretende identificar los factores de riesgo cardiovascular (FRCV) y calcular el grado de control de diabetes mellitus (DM) tipo 2 y dislipidemia (DLP) previa al ECV.
Material y métodosConsiste en un estudio de cohortes retrospectivo realizado en las zonas básicas de salud (ZBS) de San Agustín (33.321 usuarios), que consta de los centros de salud San Agustín, Illes Columbretes y los consultorios auxiliares de Borriol y Raval; y por otra parte la ZBS de Almassora (25.831 usuarios), basándose en analíticas entre enero de 2015 y diciembre de 2018. Las principales variables fueron ERC, ECV, mortalidad y los FRCV.
ResultadosMuestra final de 243 pacientes de 2 cohortes de 135 sin ERC y 99 con ERC (36,4% ERC oculta). El HR de desarrollar ECV era de 4,28 y la mortalidad del 12,3 en el grupo con ERC respecto con el grupo sin ERC. En cuanto a la relación de los FRCV previos a la aparición de ECV, en la cohorte con ERC la hipertensión, la DLP y la DM tipo 2 tuvieron resultados significativos respecto a la cohorte sin ERC. Asimismo, en la cohorte con ERC el porcentaje de control de la DLP fue inferior al 50% y mayor del 66,66% en la DM tipo 2.
ConclusionesSe objetiva que un tercio de los pacientes no están diagnosticados de ERC, lo cual tienen una probabilidad elevada de desarrollar ECV o muerte. Dada la falta de diagnóstico las intervenciones en el control de la DLP y DM tipo 2 son más bajas.
The aim is to determine hidden chronic kidney disease (CKD) and its relationship with the appearance of cardiovascular events (CVD) and mortality. Furthermore, the aim is to identify cardiovascular risk factors (CVRF) and calculate the degree of control of diabetes mellitus (DM) type 2 and dyslipidemia (DLP) prior to CVD.
Material and methodsIt consists of a retrospective cohort study carried out in the Basic Health Zones (BHZ) of San Agustín, (population of 33,321 users) which consists of the health centers San Agustín, Illes Columbretes, and the auxiliary clinics of Borriol and Raval; and on the other hand, the BHZ of Almassora (25,831 users), calculated in analysis between January 2015 and December 2018. The main variables were CKD, CVD, mortality and CVRFs.
ResultsFinal sample of 243 patients from two cohorts of 135 without CKD and 99 with CKD (36.4% occult CKD). The HR of developing CVD was 4.28 and mortality was 12.3 in the group with CKD compared to the group without CKD. Regarding the relationship of CVRFs prior to the appearance of CVD, in the cohort with CKD, hypertension (HTA), DLP, and type 2 DM had significant results, compared to the cohort without CKD. Likewise, in the CKD cohort the percentage of DLP control was less than 50.0%, and greater than 66.66% in DM type 2.
ConclusionsIt is observed that a third of patients are not diagnosed with CKD, which has a high probability of developing CVD or death. Given the lack of diagnosis, interventions in the control of DLP and DM type 2 are lower.
La enfermedad renal crónica (ERC) es un importante problema de salud pública a nivel mundial ya que en diferentes estudios se ha observado que puede llegar a afectar al 10-20% de la población adulta según las estimaciones de su prevalencia realizadas en diferentes países1–8. La presencia de ERC está incluida como un factor de riesgo independiente y es causa de morbilidad de la enfermedad cardiovascular o eventos cardiovasculares (ECV) y mortalidad, independientemente del estadio de ERC1,6–17.
Se define a la ERC como la presencia de proteinuria (en la actualidad se prefiere utilizar la proporción albúmina-creatinina en orina o CAC) y/o función renal reducida (TFGe) por debajo de 60 ml/min/1,73m2 mantenido en un intervalo de 3 meses, pudiéndose confirmar por biopsia renal con o sin disminución de la TFGe o albuminuria1–6,11–18. Con base en la definición anterior, su falta de diagnóstico se considera ERC oculta.
El estado patológico subyacente es causado por una interacción compleja de factores de riesgo tradicionales (edad, sexo, diabetes mellitus [DM] o DM tipo 2, hipertensión [HTA]) y no tradicionales (sobrecarga de volumen, metabolismo óseo-mineral, toxinas urémicas, anemia, estrés oxidativo). Así mismo, a medida que la población envejece aumenta la incidencia y la probabilidad de presentar ERC1,2,7,9,11,12,15–22.
Por tanto, se trataría de personas con un riesgo cardiovascular (RCV) alto o muy alto que precisan de un control tensional y de lípidos ajustado a las de su RCV ajustado a las tablas SCORE o bien a sus comorbilidades basales1,13,23,27.
Dada la prevalencia y la importancia de las implicaciones terapéuticas y pronósticas que comporta una detección de la ERC en fases precoces, es importante determinar la ERC oculta. Las etapas más tempranas de la ERC a menudo son asintomáticas y suelen detectar durante la evaluación de condiciones comórbidas que pueden ser reversibles. La mayoría de ERC evolucionan durante décadas y algunos pacientes no progresan durante muchos años de seguimiento3,10,11,13,14,18,19,22–27.
ObjetivosObjetivo principal: objetivar la ERC oculta
Objetivos secundarios: determinar la relación entre ERC y la aparición de los ECV y mortalidad en estadios G3 y G4 en nuestra zona de actuación, así como describir los factores de riesgo cardiovascular (FRCV) y el grado de control de DM tipo 2 y dislipidemia (DLP).
Material y métodosDiseño y emplazamiento: estudio de cohortes, es decir un estudio descriptivo, observacional, longitudinal retrospectivo. El estudio se realizó sobre la población asignada a las zonas básicas de salud (ZBS) San Agustín (33.321 usuarios), que consta de los centros de salud San Agustín, Illes Columbretes y los consultorios auxiliares de Borriol y Raval; y por otra parte la ZBS de Almassora (25.831 usuarios), pertenecientes al Hospital General Universitario de Castelló (HGUCS).
La búsqueda de la ERC oculta se realizó mediante la observación de las analíticas realizadas en el laboratorio de referencia del HGUCS en el periodo de enero de 2015 a diciembre de 2018.
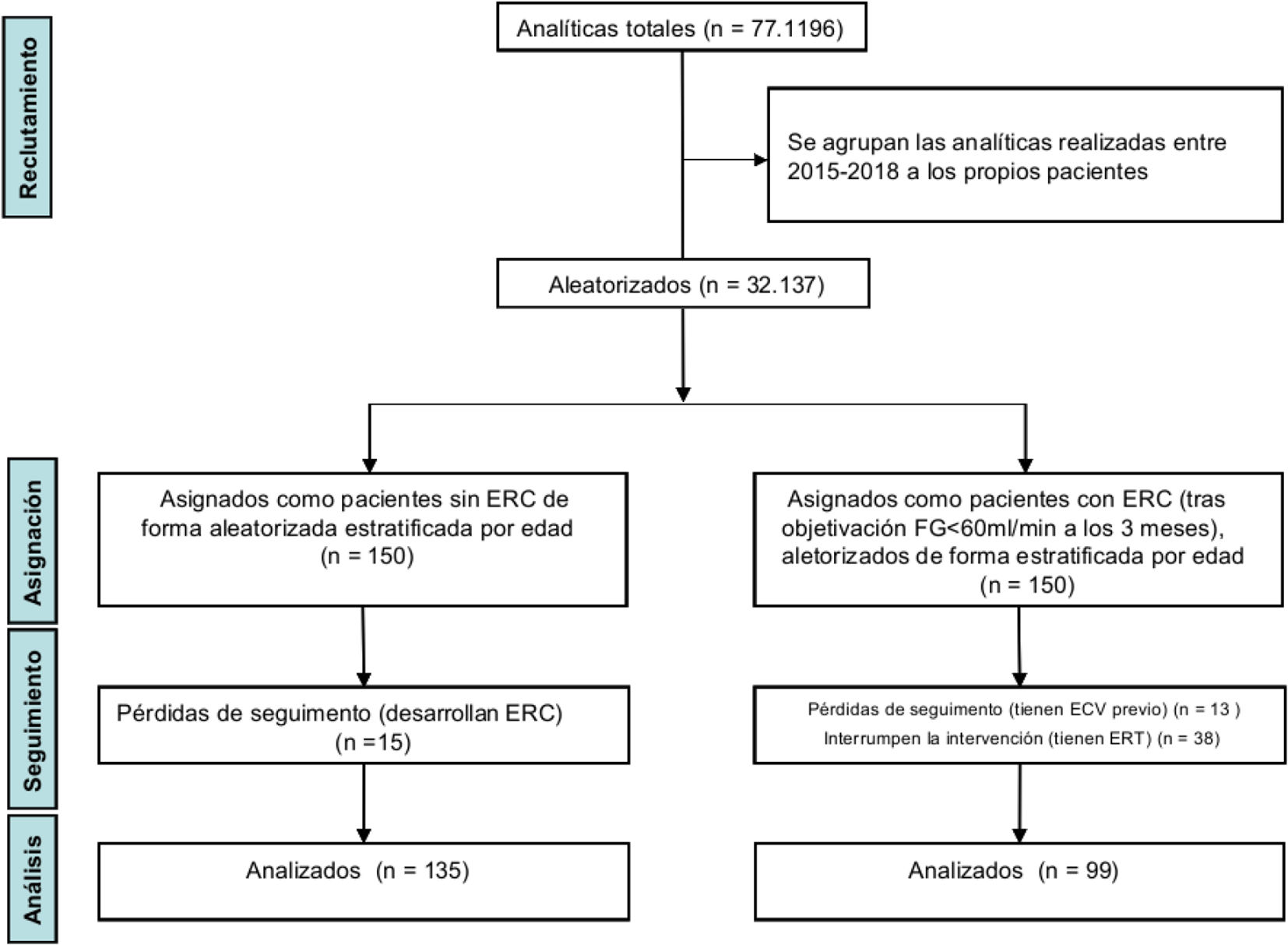
Criterios de inclusión y exclusión: analíticas realizadas desde enero 2015 a diciembre 2018 (77.196) de pacientes mayores de 18 años de las ZBS del estudio, excluyendo los que presentaron enfermedad renal terminal (ERT). Eso permitió que de las 77.196 analíticas analizadas de pacientes mayores de 18 años, realizadas a los pacientes de las ZBS del estudio, se pudiera seguir a 2 cohortes de 150 pacientes, una vez excluidos los que presentaron enfermedad renal terminal (ERT).
Selección de pacientes: se asignaron en 2 cohortes de 150 pacientes que se purificaron descartándose en la cohorte sin ERC los pacientes habían desarrollado en el tiempo del estudio ERC; y en la cohorte con ERC los que desarrollaron ERT o que hubieran tenido previamente ECV. Por ello, finalmente, la muestra final fue de 135 en la cohorte sin ERC y de 99 en la cohorte con ERC (fig. 1).
Los pacientes estaban estratificados en función de la asignación de ZBS y edad, resultando: 80 de ZBS Almassora y 154 de la ZBS San Agustín; y por edad, 83 entre 45 y 64 años, 72 entre 65 y 79 años y, 79 de 80 y más años.
Estrategia de análisis: los resultados primarios de interés incluyeron muerte por cualquier causa y ECV hasta finales de 2019. Las variables del estudio fueron edad, sexo, exceso de peso (diferenciando entre sobrepeso y obesidad), consumo de alcohol, consumo de tabaco, diagnósticos de HTA, DLP y cifras de LDL, DM tipo 2 y cifras de HbA1c, hiperuricemia o gota, ERC, TFGe, CAC, ECV y tipo de ECV.
Los datos de los sujetos fueron seudoanonimizados para su análisis. Los resultados primarios de interés incluyeron muerte por cualquier causa, eventos cardiovasculares hasta el 31 de diciembre de 2019. Un evento cardiovascular se definió como enfermedad coronaria (EC), accidente cerebrovascular (ACV) o enfermedad arterial periférica (EAP) según los códigos CIE-9.
Análisis de datos: se realizó el calculó del hazard ratio (HR) con un intervalo de confianza (IC) del 95% y un valor p <0,05 para considerarse un resultado estadísticamente significativo en los diferentes análisis, para el estudio de la asociación entre FRCV y ECV en los pacientes con ERC. También se valoraron los resultados analíticos y su periodicidad de LDL y HbA1c, para determinar el control. Además, a los sujetos con ERC que presentaron ECV y/o muerte se les realizó un análisis de Kaplan-Meyer, desde la última determinación de TFGe.
Para la inclusión de las variables relativas a los factores de riesgo tradicionales, se utilizaron las fechas anteriores al desarrollo de ECV, y en algunos casos se revisaron los resultados de los laboratorios para comprobar si había falta de registros diagnósticos.
Además, a los sujetos con ERC que presentaron ECV y/o muerte por cualquier causa se les realizó un análisis de Kaplan-Meyer, tras calcular desde la última determinación de TFGe el tiempo trascurrido hasta la aparición de evento.
Aspectos éticos y legales: todos los procedimientos se realización bajo los estándares éticos del Comité de Ética de la Investigación con Medicamentos, CEIM 663 (HGUCS) del departamento de Castelló, aprobado en diciembre de 2019, y bajo la declaración de Helsinki de 1964 y sus enmiendas posteriores o normas éticas comparables. Todos los nombres e identificadores se eliminaron antes de que se analizaran los datos, de acuerdo con los procedimientos aprobados por la ley de protección de datos.
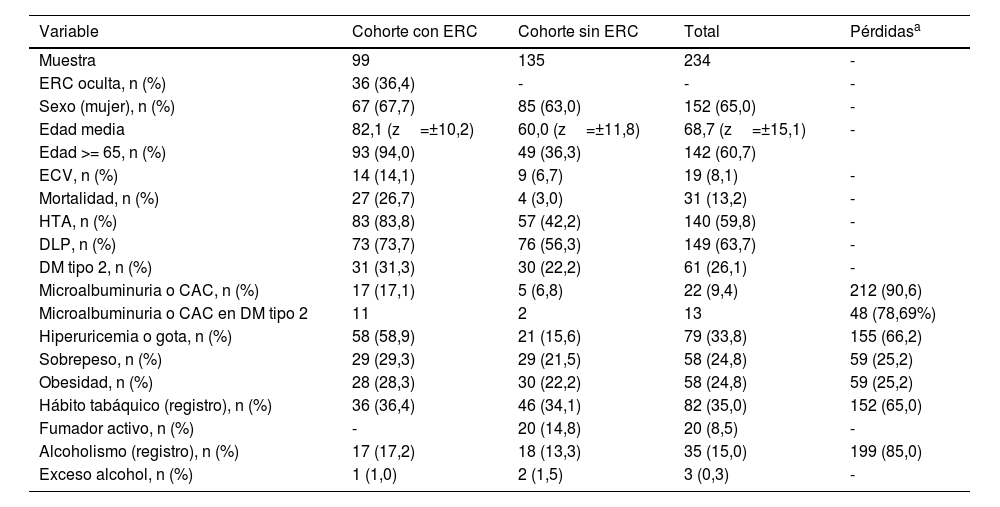
ResultadosLa media de edad del total de integrantes (n=234) fue de 68,72 (z= ±15,10), mayoritariamente femeninos (65%). Además, en la tabla 1 se pueden observar los datos relativos a la cohorte con ERC y la cohorte sin ERC. Se objetivó un 36,4% de ERC oculta.
Descripción general de las cohortes
| Variable | Cohorte con ERC | Cohorte sin ERC | Total | Pérdidasa |
|---|---|---|---|---|
| Muestra | 99 | 135 | 234 | - |
| ERC oculta, n (%) | 36 (36,4) | - | - | - |
| Sexo (mujer), n (%) | 67 (67,7) | 85 (63,0) | 152 (65,0) | - |
| Edad media | 82,1 (z=±10,2) | 60,0 (z=±11,8) | 68,7 (z=±15,1) | - |
| Edad >= 65, n (%) | 93 (94,0) | 49 (36,3) | 142 (60,7) | |
| ECV, n (%) | 14 (14,1) | 9 (6,7) | 19 (8,1) | - |
| Mortalidad, n (%) | 27 (26,7) | 4 (3,0) | 31 (13,2) | - |
| HTA, n (%) | 83 (83,8) | 57 (42,2) | 140 (59,8) | - |
| DLP, n (%) | 73 (73,7) | 76 (56,3) | 149 (63,7) | - |
| DM tipo 2, n (%) | 31 (31,3) | 30 (22,2) | 61 (26,1) | - |
| Microalbuminuria o CAC, n (%) | 17 (17,1) | 5 (6,8) | 22 (9,4) | 212 (90,6) |
| Microalbuminuria o CAC en DM tipo 2 | 11 | 2 | 13 | 48 (78,69%) |
| Hiperuricemia o gota, n (%) | 58 (58,9) | 21 (15,6) | 79 (33,8) | 155 (66,2) |
| Sobrepeso, n (%) | 29 (29,3) | 29 (21,5) | 58 (24,8) | 59 (25,2) |
| Obesidad, n (%) | 28 (28,3) | 30 (22,2) | 58 (24,8) | 59 (25,2) |
| Hábito tabáquico (registro), n (%) | 36 (36,4) | 46 (34,1) | 82 (35,0) | 152 (65,0) |
| Fumador activo, n (%) | - | 20 (14,8) | 20 (8,5) | - |
| Alcoholismo (registro), n (%) | 17 (17,2) | 18 (13,3) | 35 (15,0) | 199 (85,0) |
| Exceso alcohol, n (%) | 1 (1,0) | 2 (1,5) | 3 (0,3) | - |
La media de la TFGe de los pacientes con ERC era de 45,4 (z=±11,2) de la misma manera que los que además tuvieron ECV fue de 46,0 (z=±12,4), es decir una clasificación G3A.
Los ECV fueron un total de 19: 10 ACV, 6 EC y 3 EAP. El HR resultante entre la cohorte con ERC que desarrolló ECV respecto a la cohorte sin ERC fue de 4,3. En la cohorte con ERC hubo 14 ECV: 6 G3A, 7 G3B y 1 G4. Además, 4 eran del grupo de ERC oculta, 3 G3A y 1 G3B.
El tiempo medio hasta la aparición de ECV de la cohorte con ERC fue de 492,1 días (IC al 95% de 305,4-678,8). Detalladamente, la media de días en G3A era de 587,2 (IC al 95% de 208,3-966) y en G3B de 412,0 (IC al 95% de 213,4-610,7). Observando la mortalidad, el tiempo medio de los pacientes que tenían ERC fue de 697,6 días (IC al 95% de 528,7-866,5).
Por lo que respecta a la mortalidad, el HR entre la cohorte con ERC y la sin ERC fue de 12,3. De la totalidad de 31, pertenecían al grupo de ERC oculta 11 pacientes.
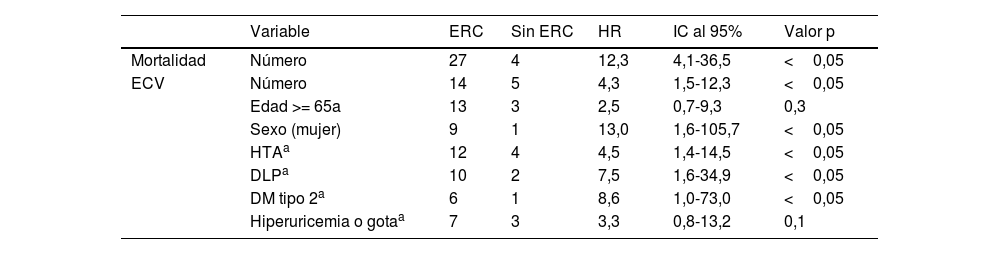
En cuanto a la relación de los FRCV evaluados y su influencia en el desarrollo de ECV en la cohorte con ERC, se observó que tenían una relación significativa la HTA, DLP y DM tipo 2 (tabla 2). Sin embargo, la asociación de dichos FRCV no dio resultados significativos.
Comparación de las cohortes y hazard ratio en el desarrollo de Enfermedad Cardiovascular
| Variable | ERC | Sin ERC | HR | IC al 95% | Valor p | |
|---|---|---|---|---|---|---|
| Mortalidad | Número | 27 | 4 | 12,3 | 4,1-36,5 | <0,05 |
| ECV | Número | 14 | 5 | 4,3 | 1,5-12,3 | <0,05 |
| Edad >= 65a | 13 | 3 | 2,5 | 0,7-9,3 | 0,3 | |
| Sexo (mujer) | 9 | 1 | 13,0 | 1,6-105,7 | <0,05 | |
| HTAa | 12 | 4 | 4,5 | 1,4-14,5 | <0,05 | |
| DLPa | 10 | 2 | 7,5 | 1,6-34,9 | <0,05 | |
| DM tipo 2a | 6 | 1 | 8,6 | 1,0-73,0 | <0,05 | |
| Hiperuricemia o gotaa | 7 | 3 | 3,3 | 0,8-13,2 | 0,1 |
DLP: dislipidemia; DM: diabetes mellitus; ECV: eventos caridovasculares; ERC: enfermedad renal crónica: HTA: presión arterial alta.
En el caso de ser mujer se observó un HR de presentar ECV del 13,0 (IC al 95% de 1,6-105,7) con respecto a los hombres en la cohorte con ERC. En cuanto a la edad, aquellos que tenían 65 o más años, estos tuvieron 17 ECV, pero el valor de p no fue significativo.
Se intentó realizar una asociación con los FR estudiados en relación con la ERC y la ECV, pero dados los datos escasos no se consiguieron resultados significativos a favor de la aparición de ECV.
Por último, el porcentaje de control de la DLP de todos los pacientes que desarrollaron ECV fue de 44,56% en función del RCV, de los cuales en la cohorte con ERC el valor fue del 29,76%. En el caso de la DM tipo 2, los pacientes que no desarrollaron ECV tenían un porcentaje de control adecuado en función a sus objetivos de HbA1c del 83,43%, mientras que en la cohorte con ERC era del 66,66%.
DiscusiónLa realización de este estudio reafirma la idea que la ERC representa un problema de salud importante por diferentes motivos, ya que hay un infradiagnóstico importante de la enfermedad (en este caso, más de un tercio de los pacientes); y además, conlleva el desarrollo de ECV de cualquier tipo (14,1%) o muerte (26,7%)4,5,12,14,16,18,20,22.
Es importante resaltar que en su mayoría los ECV que se han producido han sido en pacientes con RCV alto, definido como pacientes con ERC con G323. La obtención de un 11,3% de ECV en la cohorte con ERC con G3, son resultados ya observados en otros estudios similares, aunque sin diferenciar si el estadio es G3A o G3B9,25.
De la misma manera también se observa que la mortalidad, es mayor en los estadios G39, aunque en otros es más común en G416. La proporción de sujetos que ha sufrido ECV es considerable por tener ERC (casi un 15%), con estadios G3A y G3B, así como una mortalidad elevada (un 27%) con estadios tempranos y no únicamente en estadios más avanzados12,16,18–20,25.
La prevención precoz es posible, siendo más exigentes en los objetivos a alcanzar de control de los FRCV. Al observar los datos obtenidos se objetiva que el grado de control no se acerca a números óptimos, sobre todo en la cohorte con ERC a nivel de DLP (29,76%)23,24.
En el análisis de los datos, la relación entre ser mujer y ERC aumenta el riesgo de padecer ECV3, a diferencia de otros estudios donde son los hombres7,16.
Fortalezas y limitacionesComo novedad se partió desde las analíticas realizadas para poder analizar si aquellos pacientes que tenían TFGe alterada estaban o no diagnosticados (por tanto, se catalogaron de ERC oculta, al observarse en el tiempo el mantenimiento de la ERC) en el sistema de la historia clínica electrónica para su inclusión en el estudio. Además, la medición de la TFG se realizó en el mismo laboratorio de una forma estandarizada con la fórmula CKD-EPI.
Pueden existir sesgos en el análisis de datos derivados de la falta de registros en un periodo de 3 años, sobre todo con HTA y DM que pueden ser causa tanto de ERC como de ECV. Además, dado que el porcentaje de mujeres es superior podría sesgar la muestra y no ser representativa en vida real en cuanto a los resultados obtenidos sobre el sexo; al igual que la edad media entre los grupos puede influir en explicar también la mayor mortalidad y ECV por la propia edad, que también es en sí misma un agravante de la función renal.
ConclusionesLa elevada prevalencia de la ERC, su infradiagnóstico (33% aproximadamente) y su carácter progresivo y modificable, hace aconsejable diseñar a nivel nacional un programa que por un lado facilite la detección de la enfermedad renal en estadios muy tempranos, con el fin de evitar el desarrollo de las complicaciones cardiovasculares asociadas, la progresión de la enfermedad renal, la inadecuada prescripción de medicamentos; y por otro lado, permitir la remisión a consulta de nefrología en estadios más precoces que eviten al paciente con suficiente antelación entrar en los programas de técnicas de sustitución de la función renal o de trasplante renal9,11,18,19.
Respecto a la relación a la ERC es muy importante el desarrollo de un programa de salud renal por varias razones: es una enfermedad frecuente y muy dañina, pero a pesar de ello es desconocida, progresiva y muy costosa de tratar en estadios avanzados, por lo que, debe diagnosticarse mediante la utilización de 2 pruebas sencillas y baratas: estudio de la función renal o TFGe y/o análisis de la excreción de proteínas (incluso se plantea la realización de tiras reactivas de orina)10,13,14,16,18,19,21,22.
En resumen, se ha podido observar que la disminución de la TFGe es un factor de riesgo independiente para los resultados de ECV y la mortalidad por todas las causas las zonas básicas de Salud de San Agustín, pertenecientes al HGUCS similares a los estudios consultados, pero destaca que la mayor parte de los mismos se relacionan con estadios incipientes de ERC G3A y G3B.
Responsabilidades éticasEl desarrollo del trabajo siguió las normas éticas de investigación y fue valorado por el CEIm del HGUCS (663). No se precisó del consentimiento informado porque se obtuvo la exención de la Declaración de Helsinki.
Se autoriza el libre acceso por parte de los autores en caso de aceptación.
FinanciaciónLos autores declaran que no hay medios de financiación.
AutoríaSe declara de forma explícita por parte de los autores su participación activa, significativa y relevante en el diseño, elaboración, interpretación de datos, revisión de borradores y contenido final del trabajo.
Se acepta de forma explícita por parte de los autores la redacción definitiva del trabajo remitido.
Conflicto de interesesNo hay conflictos de intereses en el estudio.
Publicaciones previasSe declara que el trabajo no ha sido hecho público con anterioridad ni de forma oral ni escrita en ningún medio científico; del mismo modo que no ha sido enviado ni total ni parcialmente de forma simultánea a otra revista para su evaluación.
AgradecimientosA todo el personal de la UDMAFYC de Castelló en el año que se empezó este trabajo, y en concreto a los asesores metodológicos del estudio Àngel Masoliver Forés y Antonio Lorenzo Piqueres; así como los compañeros del Servicio de Análisis clínicos José Antonio Ferrero Vega y Daniel García Ferrer. También realizar una mención especial a nuestros tutores de la residencia, con la ilusión de promover la investigación y la MBE, así como el interés en la atención a la cronicidad.