Werner y Bell sintetizaron la metformina en 1922. En 2006, la Federación Internacional de Diabetes reconoció a la metformina como el fármaco de primera línea en el tratamiento de la diabetes tipo 2. La presente revisión actualiza las propiedades farmacológicas, efectos adversos y pleiotropismo terapéutico de la metformina aplicada al tratamiento y prevención de diabetes mellitus, diabetes gestacional, síndrome de ovario poliquístico, regulación del apetito, disbiosis de la flora intestinal, protección cardiovascular y renal, tratamiento de la fibrosis pulmonar idiopática, disminución del riesgo y mortalidad por diversas neoplasias, y prolongación de la supervivencia.
Werner and Bell synthesized metformin in 1922. In 2006, the International Diabetes Federation recognized metformin as the first-line drug for the treatment of type 2 diabetes. This review updates the pharmacological properties, adverse effects and therapeutic pleiotropism of metformin applied to the treatment of diabetes mellitus, gestational diabetes, polycystic ovary syndrome, appetite regulation, intestinal flora dysbiosis, cardiovascular and renal protection, treatment of idiopathic pulmonary fibrosis, reduction of risk and mortality from various neoplasms, and prolongation of lifespan.
El enciclopédico herbolario de Culpeper reveló que la Galega officinalis ya se utilizaba en la Edad Media para el tratamiento de la poliuria. En 1861, Strecker aisló guanidina a partir de la galega. En 1918, Watanabe demostró experimentalmente la actividad hipoglucemiante de la guanidina. Werner y Bell sintetizaron la metformina (dimetil-biguanida) en 19221. En 1926, Frank introdujo el derivado guanidínico sintalina como primer antidiabético oral.
En 1956, Sterne realizó los primeros ensayos clínicos con metformina (MET), descubriendo que permitía reducir las dosis diarias de insulina en sujetos con diabetes juvenil y reemplazar a la insulina en pacientes con diabetes de la edad adulta sin riesgo de hipoglucemia2-5. En Inglaterra se prescribió MET para el tratamiento de la diabetes a partir de 1958 y en Canadá a partir de 1972. En EE. UU., se retrasó su introducción en la clínica hasta 19946. En 2006, la Federación Internacional de Diabetes (IDF) reconoció a la MET como fármaco de primera línea en el tratamiento de la diabetes tipo 2 (DM2)7. En 2011, la OMS incluyó a la MET en la lista de medicamentos esenciales8.
Metformina: acciones sobre el metabolismo intermediarioLa biodisponibilidad de MET es del orden del 50%; la vida media en plasma, 6-7 h; se elimina intacta por la orina mediante filtración glomerular (20%) y secreción tubular (80%). Su acción más reconocida consiste en disminuir la resistencia a la insulina (RI). Reduce la producción hepática de glucosa (gluconeogénesis), contrarrestando la acción del glucagón, y aumenta la captación de glucosa por el músculo esquelético mediante los transportadores GLUT1 y GLUT4. Al ingresar en la célula aceptora, MET inhibe el complejo enzimático mitocondrial 1, la transferencia de electrones (cadena respiratoria) y la síntesis de ATP, aumentando los niveles celulares de ADP y AMP y la actividad enzimática AMP cinasa (AMPK), sensor clave del estado energético9. Por acción directa sobre las células L intestinales, la MET aumenta la secreción del péptido similar al glucagón-110 (GLP-1). Mediante acción indirecta, inhibe la secreción hepática de ácidos biliares y su absorción ileal al facilitar el acoplamiento de la AMPK con el receptor FXR y su fosforilación, lo que puede influir en la reducción de los niveles de colesterol sérico.
Metformina: intervenciones terapéuticasMetformina y diabetes mellitus tipo 2La dispensación de fenformina en EE. UU. (única biguanida autorizada en 1973) se asoció a un aumento de casos de acidosis láctica, con muerte de 4pacientes por cada mil tratados. Por ello, la fenformina fue excluida del mercado farmacéutico por la FDA en 197711. Por el contrario, la incidencia de acidosis láctica bajo tratamiento con MET ha sido mínima, inferior a 3/100.000 pacientes-año. La mayor parte de casos publicados corresponde a pacientes con insuficiencia renal avanzada, asociada a procesos clínicos que elevan la producción de ácido láctico o la reducción de su aclaramiento (sepsis, hipoperfusión, cirrosis hepática)12.
La publicación en 1995 del Multicenter Metformin Study Group consolidó el uso clínico de MET en EE. UU.6. La glucemia media en ayunas se redujo en 52 (5) mg/dl (media [desviación estándar]) (p<0,001) y la hemoglobina glicosilada en 1,04 (0,1) % (media [desviación estándar]) (p <0,001).
Metformina y prediabetesEn el estudio «Programa de prevención de la diabetes», después de 2,8 años de seguimiento de 3.234 personas no diabéticas, la incidencia de diabetes se redujo en un 58% entre los participantes tratados con cambios saludables en el estilo de vida y en un 31% en el grupo tratado con MET13. La Asociación Médica Americana (AMA) recomienda el tratamiento con MET en personas con prediabetes para prevenir la progresión a DM2.
Metformina y diabetes gestacionalEn 2008, el Estudio MIG investigó el tratamiento aleatorizado con insulina frente a MET en 750 mujeres con diabetes gestacional (DG). La MET se mantuvo hasta el final del embarazo, aunque el 46,3% de las pacientes necesitaron insulina suplementaria14. Diez años más tarde, el mismo equipo amplió las consecuencias sobre el bienestar materno-fetal con el estudio MiG TOFU15. Ambos ensayos demostraron que la MET es segura y eficaz en el tratamiento de la DG. Un metaanálisis que incluyó 8ensayos clínicos confirmó un impacto glucémico similar de insulina y de MET en el control glucémico de 1.712 mujeres con DG16. Sin embargo, dado que la MET atraviesa la placenta se prefiere la insulina como más conveniente.
Metformina y síndrome de ovario poliquísticoAl disminuir la RI, la MET corrige la intolerancia a la glucosa, reduce los niveles de andrógenos circulantes y controla el ciclo menstrual en mujeres con síndrome de ovario poliquístico (SOP)17, ya sea sola o combinada con clomifeno18.
Tolerancia a la metformina: efectos secundarios adversosMetformina: intolerancia gastrointestinalEl efecto adverso más frecuente es la intolerancia gastrointestinal, principalmente en las primeras semanas. El abandono del tratamiento por este motivo no supera el 5% de los casos19.
Metformina: efectos sobre los niveles séricos de vitamina B12El tratamiento prolongado con MET puede condicionar niveles séricos disminuidos de vitamina B12, circunstancia que aumenta con la edad20,21. La Encuesta de Examen de Salud y Nutrición (NHANES: 1990-2006) estudió la prevalencia de la deficiencia de vitamina B12 en 1.621 adultos con DM-2 tratados con/sin metformina. La deficiencia se definió por niveles séricos inferiores a 148pmol/l y la deficiencia límite por niveles entre 148 y 221pmol/l. La deficiencia de vitamina B12 se detectó en el 5,8% de los pacientes tratados con MET y en el 2,4% que no lo tomaban. (ORa, 2,92; IC del 95%, 1,16-6,78). La deficiencia límite fue del 16,2% y el 8,8%, respectivamente22. La suplementación diaria oral de vitamina B12 recomendada por el Instituto de Medicina (2-4 μg) resultó marcadamente insuficiente en estos pacientes22.
El mecanismo más plausible para la inducción de la deficiencia de vitamina B12 por MET es la inhibición de la absorción dependiente de calcio del complejo factor intrínseco-vitamina B12 en el íleon terminal. A nivel celular, la vitamina B12 sirve como cofactor de la enzima metionina sintetasa que cataliza la transformación de la homocisteína en metionina (con la colaboración del ácido 5-metil-tetrahidrofólico que dona el grupo metilo a la homocisteína). La vitamina B12 también es un cofactor de la enzima metilmalonil-CoA mutasa que cataliza la conversión a succinil-CoA en la mitocondria. Por ello, su deficiencia genera acumulación de ácido metilmalónico (AMA) y homocisteína (HCIS) que contribuyen a la degeneración de la mielina y desarrollo de neuropatía autonómica y periférica, que puede erróneamente interpretarse como neuropatía diabética. Niveles séricos de AMA inferiores a 0,28μmol/l y de HCIS a 15μmol/l descartan la deficiencia de vitamina B12. Las manifestaciones clínicas de la deficiencia de vitamina B12 incluyen: fatiga, taquicardia, palidez cutánea, anemia megaloblástica, pancitopenia, glositis, infertilidad, sordera y degeneración macular de retina. La deficiencia no tratada progresa a daño neurológico periférico y central (manifestaciones neurocognitivas con alteraciones de la memoria, demencia, delirio y psicosis)23.
El tratamiento de la deficiencia de vitamina B12 inducida por MET requiere una suplementación capaz de corregir la deficiencia y prevenir el riesgo de lesión neural y complicaciones hematológicas. Como la MET interfiere con la absorción intestinal de vitamina B12, las vías de administración sublingual o intramuscular parecen las más efectivas. Los pacientes con manifestaciones neurológicas pueden beneficiarse de inyecciones intramusculares mensuales de 1000μg de vitamina B12. También son eficaces dosis sublinguales diarias de metilcobalamina (1.000-2.000μg)24.
Metformina: efectos adversos sobre el sistema reproductor masculino y anomalías congénitas neonatales en varones expuestosExiste evidencia de que la exposición in útero a la MET induce alteraciones reproductivas en células testiculares fetales humanas y de ratón25. Un estudio nacional danés ha demostrado entre más de 1.100.000 niños investigados que los nacidos varones de padres tratados con MET (n=1.451) durante los 3 meses del periodo de preconcepción (tiempo necesario para completar la espermatogénesis y la maduración final de los espermatozoides en el epidídimo) presentaron una alta frecuencia de defectos genitales congénitos (ORa, 3,39; IC del 95%, 1,82-6,30)26. Una publicación reciente no ha confirmado los resultados del estudio danés27.
Metformina: nuevas investigaciones en curso y perspectivas de futuroMetformina: acciones sobre el apetitoLa N-lactoilfenilalanina (Lac-Phe) es un metabolito generado por la fusión de lactato y fenilalanina con la intervención de la carnosina dipeptidasa 2 (CNDP2). Investigaciones recientes han reconocido que la secreción de Lac-Phe es inducible por el ejercicio intenso, suprime el hambre y puede contribuir a reducir el aumento ponderal28. Una colaboración entre investigadores del Trinity College de Dublin y la División de Endocrinología del Brigham and Women's Hospital, Universidad de Harvard, ha demostrado en estudios que involucran a un gran número de pacientes que los niveles plasmáticos de Lac-Phe aumentan en individuos con y sin DM2 tratados con MET. Los niveles plasmáticos de Lac-Phe se elevaron postingesta, contribuyendo a la saciedad. Además, la administración de MET con alimentación sólida sube los niveles de Lac-Phe, mientras que con bebidas azucaradas genera una respuesta mínima. Las concentraciones plasmáticas de Lac-Phe fueron 5,7 veces superiores en individuos obesos con DM2 en comparación con los voluntarios control, con/sin diabetes, y se observó una fuerte correlación entre los niveles séricos de Lac-Phe y de MET. Los autores demostraron en ratones knockout para CNDP2 que la MET inhibe el complejo mitocondrial I en las células intestinales y concluyeron que la elevación de las concentraciones séricas de Lac-Phe es específica del tratamiento con MET y no de la DM229 (tabla 1).
Metformina: usos clínicos y efectos adversos
| Uso clínico recomendado |
| Fármaco de primera línea en el tratamiento de pacientes con DM2 con peso normal, sobrepeso u obesidad moderada |
| Prevención de DM2 en personas con prediabetes acompañando al tratamiento dietético y práctica regular de ejercicio |
| Uso clínico beneficioso |
| Diabetes gestacional (en condiciones óptimas es preferible la insulinoterapia) |
| Síndrome de Ovario Poliquístico (asociada o no a clomifeno) |
| Prevención de complicaciones cardiovasculares y renoprotección en la DM2 |
| Tratamiento de la fibrosis pulmonar idiopática |
| Tratamiento complementario en determinadas neoplasias (cáncer hepático, colorrectal, carcinoma escamoso de cabeza y cuello) |
| Uso clínico potencial |
| Se investigan posibles beneficios en longevidad y prevención de ciertos procesos neurodegenerativos |
| Efectos adversos |
| Intolerancia gastrointestinal, principalmente al iniciar tratamiento (abandono terapéutico <5%) |
| Niveles séricos deficitarios de vitamina B12 (confirmación con niveles altos de homocisteína/ácido metilmalónico) |
| Contraindicación |
| Elevación de la lactacidemia en pacientes con insuficiencia renal avanzada, hepatopatía grave, hipoperfusión, sepsis. La incidencia de acidosis láctica en casos tratados con metformina es inferior a 3/100.000 pacientes año |
DM2: diabetes mellitus tipo 2.
La microbiota intestinal (MI) contiene en torno a 3,8×1013 microorganismos (bacterias, virus, hongos y protozoos) que habitan el tracto gastrointestinal en simbiosis con el huésped. En la mayoría de adultos sanos, el 90% de la población bacteriana de la MI está constituida por Bacteroidetes (gramnegativos) y Firmicutes (grampositivos) y el 10% restante por Proteobacterias, Actinobacterias, Fusobacterias y Verrucobacterias.
La modificación de la MI en la DM2 se caracteriza por: a) aumento de la relación Firmicutes/Bacteroidetes; b) liberación de liposacáridos con actividad inflamatoria que aumentan la permeabilidad de la pared intestinal, y c) reducción de las poblaciones bacterianas Akkermansia muciniphila y Bifidobacterium, productoras de ácidos grasos de cadena corta (AGCC), con lo que disminuye la actividad de las vías metabólicas reguladas por GLP-1 y por péptido YY, aumenta la RI y se altera la función pancreática endocrina.
La primera publicación que demostró efectos inmediatos de la MET sobre la MI en sujetos sanos fue un ensayo longitudinal con 18 voluntarios tratados diariamente con 1.700mg de MET durante una semana. Los resultados indicaron reducción de la diversidad de la MI en las primeras 24 h, asociación entre la gravedad de efectos adversos gastrointestinales de la MET y aumento en la abundancia del patógeno oportunista Escherichia-Shigella spp. Al finalizar el ensayo hubo reducción significativa de las familias Peptoestreptococcacea y Clostridiaceae-130.
La relación entre la MI y la tolerancia gastrointestinal a la MET en personas con DM-2 demostró variaciones del perfil microbiómico. El grupo caracterizado por buena tolerancia a la MET presentó mayor abundancia de Prevotella stercorea, Megamonas funiformis, Bacterides xylanisolvens y Blautia producto, en comparación con el grupo con intolerancia, en el que Subdoligranulum, Ruminococcus torques_1, Phascolarctobacterium faecium y Eubacterium ofrecieron mayor presencia31.
Una revisión sistemática reciente sobre los efectos de la MET sobre la MI (análisis de 13 estudios) propuso influencias del fármaco sobre la distribución de las poblaciones bacterianas; no obstante, las comparaciones entre los ensayos clínicos evidenciaron falta de consistencia y hallazgos conflictivos32. Estas contradicciones han sido corroboradas en otras publicaciones, indicando que solo empezamos a entender cómo actúa la MET sobre microorganismos específicos en el intestino33.
Metformina y protección cardiovascularMúltiples estudios clínicos sugieren la eficacia de la MET para reducir la progresión de la aterosclerosis en pacientes con DM2 y en sujetos sin diabetes.
El Estudio Prospectivo UKPDS asignó al azar a 1.704 pacientes con sobrepeso y DM2 recién diagnosticada para recibir tratamiento con dieta sola (control) o metformina, sulfonilurea o insulina. Tras un seguimiento medio de 10,7 años, el grupo MET experimentó una mortalidad por todas las causas inferior y un riesgo concurrente menor en la incidencia de infarto de miocardio34. Transcurrido otro periodo adicional de 10años, se corroboró el efecto protector de la MET con disminución del riesgo de infarto de miocardio asociada a cambios favorables de la hemoglobina glucosilada35. Un informe más reciente de dicho estudio ha confirmado que los beneficios cardiovasculares de la MET persisten durante muchos años a lo largo de la vida de pacientes con DM2, con reducción del 20% de la mortalidad por cualquier causa y del 31% por infarto de miocardio36. Se ha demostrado, adicionalmente, que la MET reduce el índice de masa del ventrículo izquierdo y la presión sistólica en pacientes no diabéticos con enfermedad coronaria y resistencia insulínica. La reducción observada del consumo de oxígeno sugiere una mayor eficiencia miocárdica.
En la actualidad, ensayos aleatorizados a gran escala intentan corroborar la eficacia protectora cardiovascular de la MET. VA-IMPACT es un proyecto coordinado por la Administración de Veteranos, EE. UU., programado para finalizar en 2029. El estudio recluta a 7.410 personas con Hb glucosilada entre un 5,7 y un 6,5% en un ensayo clínico prospectivo multicéntrico que intenta corroborar si el tratamiento con MET reduce la mortalidad y la morbilidad cardiovascular en personas con prediabetes y enfermedad cardiovascular establecida37.
Metformina: efecto renoprotector en pacientes con DM2Se considera a la MET como una opción segura en pacientes con enfermedad renal crónica. Estudios realizados con modelos animales y líneas celulares humanas han demostrado que el fármaco ejerce efectos protectores diversos: disminución del estrés oxidativo, reducción de la fibrosis tubulointersticial y de la glomeruloesclerosis, disminución de la pérdida de podocitos y de la albuminuria, prevención de la calcificación vascular. Se ha asociado la MET con un menor riesgo de deterioro de la función renal o muerte en comparación con las sulfonilureas y a una mayor probabilidad de supervivencia del injerto con reducción de la mortalidad en pacientes con trasplante de riñón38.
El efecto renoprotector de la MET en pacientes con DM2 fue investigado en un estudio de cohorte multicéntrico observacional y retrospectivo que incluyó 13.096 pacientes tratados y 13.096 pacientes no tratados con MET. Se investigaron la duplicación de la creatinina sérica, la tasa de filtración glomerular estimada (TFGe) <15ml/min/1,73 m2, y la enfermedad renal terminal (ERT). El grupo MET mostró mejores resultados renales, incluida una menor incidencia de duplicación de la creatinina sérica (HR, 0,71; IC del 95%, 0,65-0,77); menor reducción de la TFGe <15ml/min/1,73 m2 (HR 0,61; IC del 95%, 0,53-0,71) y menor incidencia de ERT (HR 0,55; IC del 95%, 0,47-0,66)39.
Metformina: cáncerLa National Institutes of Health (NIH) Clinical Trials homeweb recopila las estadísticas anuales de ensayos clínicos que investigan los beneficios potenciales de la MET en el tratamiento del cáncer desde 2001. Estudios retrospectivos han demostrado que las personas con DM2 tratadas con MET presentan un menor riesgo de cáncer que una población sana o pacientes con DM2 nunca tratados con MET40 y que el fármaco aumenta la sensibilidad de los tumores a la quimioterapia41 y a la radioterapia42,43.
Son varios los argumentos propuestos para apoyar efectos anticancerígenos de la MET; el fármaco inhibe el transporte de electrones por el complejo mitocondrial-1; la activación de la AMPK inhibe la vía mTOR, la síntesis de proteínas y la proliferación celular, y en paralelo, regula positivamente la actividad de la proteína p53, supresora del desarrollo tumoral.
Un metaanálisis de 8 estudios de cohortes iniciado en 2012 reveló una disminución de la mortalidad, general y específica, entre los pacientes con DM2 tratados con MET y diagnosticados de cáncer colorrectal (CCR), en comparación con los pacientes con CCR y DM2 que no recibieron MET44. Aún más, un conjunto de ensayos clínicos que incluyeron más de 1,5 millones de personas, demostró que el tratamiento con MET redujo la incidencia de cáncer hepático (–78%), de páncreas (–46%), de colon (–23%) y de mama (–6%), así como la mortalidad en carcinomas hepático y mamario45. Se ha propuesto que la RI influye principalmente en el aumento de incidencia de determinados tipos de cáncer, principalmente hígado y páncreas. En la población senescente, la MET parece reducir el riesgo de fibrosis ovárica, disminuyendo el riesgo de neoplasia46.
En pacientes con carcinoma escamoso de cabeza y cuello la MET aumenta la infiltración de células asesinas (natural killers) y la actividad citotóxica liberadora de perforina, proteína responsable de la generación de poros en las membranas de las células tumorales, proceso de citólisis independiente de la activación de la AMPK47.
Metformina y longevidadLa MET ha demostrado ser un agente prometedor en aumentar la esperanza de vida en nematodos, mosca de la fruta y roedores. Los efectos antienvejecimiento de la MET en primates no humanos ofrecen información crítica con valor potencial para extender la longevidad humana.
En un estudio longitudinal de 40 meses, de reciente publicación, se administró MET a macacos machos adultos sanos —Macaca fascicularis— (edad entre 13 y 16 años, equivalente a 40-50 años en humanos). La investigación incluyó transcriptómica pantisular, metilación del ADN, proteómica plasmática y metabolómica. Los resultados mostraron disminución de la atrofia cortical, mejoría de la función cognitiva, retraso de la pérdida ósea periodontal y de la edad metabólica de hígado, pulmones y corazón, equivalente a la reducción de 6años biológicos para estos primates (símil de 18 años en humanos)48.
Ensayos clínicos aleatorizados (ECA), revisiones sistemáticas y múltiples estudios observacionales han aportado, o intentan aportar, evidencias de que la MET puede retrasar el envejecimiento humano49.
El ensayo MILES (Metformin in Longevity Study) ha demostrado que el tratamiento con MET genera cambios transcriptómicos en las vías patogénicas asociadas al envejecimiento acelerado, enfermedad inflamatoria, degeneración neurológica y procesos de reparación del ADN. La inactivación de la vía mTOR influye favorablemente sobre estos procesos y la activación de la AMPK complementa dichas funciones, actuando como un sensor que coordina múltiples señales relacionadas con la producción de energía y el control asociado del metabolismo intermediario50.
El ensayo «Influencias de la metformina sobre la salud muscular en adultos de edad avanzada» investiga si la MET frena parámetros adversos del reposo prolongado en cama en personas ancianas: infiltración grasa, inflamación y pérdida de masa muscular. Resultados preliminares han confirmado que la MET disminuye la fibrosis y la deposición de colágeno en el músculo51,52.
El ensayo «Prevención de la fragilidad en personas ancianas de alto riesgo» estudia los efectos de la MET sobre el fenotipo frágil, caracterizado por 5criterios: pérdida de peso involuntaria, agotamiento, movilidad lenta, debilidad muscular y bajo nivel de actividad física53.
El ensayo TAME (Targeting Aging with Metformin), que se realiza en 14 centros de investigación de EE. UU., recluta a 3.000 personas sin diabetes con edades entre 65 y 79 años para un seguimiento de 6años con el objetivo de conocer si el tratamiento con MET retrasa la aparición de enfermedades relacionadas con el envejecimiento, el deterioro cognitivo y los biomarcadores de inflamación y senescencia. Los objetivos primarios incluyen: a) la reparación de alteraciones en la regulación de nutrientes; b) la inestabilidad genómica; c) la pérdida de proteostasis, y d) la alteración de la comunicación intercelular. Los objetivos secundarios añaden: 1) la reparación de la disfunción mitocondrial; 2) el rejuvenecimiento de las células madre; 3) la regulación transcripcional y epigenética; 4) la senescencia tisular, y 5) la rectificación del acortamiento progresivo de los telómeros54.
Metformina: fibrosis pulmonar idiopáticaLa fibrosis pulmonar idiopática (FPI) es una forma específica de fibrosis crónica, progresiva y de causa desconocida. Se presenta principalmente en adultos mayores, se limita a los pulmones y se define por el patrón histopatológico o radiológico de neumonía intersticial usual. Debe considerarse en todos los pacientes adultos con disnea crónica de esfuerzo inexplicable, tos, crepitaciones inspiratorias bibasales y/o hipocratismo digital, que se presentan sin síntomas constitucionales y otros que sugieran una enfermedad multisistémica. La guía clínica elaborada conjuntamente por The American Thoracic Society, European Respiratory Society, Japanese Respiratory Society y Asociación Latinoamericana de Tórax define la fibrosis pulmonar progresiva (FPP) como una entidad que incluye al menos 2de estos 3criterios: progresión de síntomas, alteraciones radiológicas y determinaciones fisiológicas a lo largo del año anterior55.
La incidencia de la FPI aumenta con la edad avanzada y el antecedente de tabaquismo. Hace 10años, se comercializaron 2fármacos antifibróticos: pirfenidona y nintedanib, que con el tiempo también han sido aceptados para el tratamiento de la FPP, basándose en el análisis estadístico de estudios observacionales poscomercialización sugerentes de prolongación de la supervivencia. Autores expertos en análisis estadístico han informado que dichos estudios adolecen de un sesgo temporal, que ponen en tela de juicio la afirmación de que dichos fármacos prolongan la vida de los pacientes con FPI56. La realidad es que tan solo un 25% de los pacientes diagnosticados en EE. UU. cumplen con el tratamiento. Recientemente, se ha demostrado que el nerandomilast, un inhibidor de la fosfodiesterasa 4B (PDEA), que ya demostró un efecto antifibrótico e inmunomodulador en estudios preclínicos, puede retardar el descenso de la capacidad vital forzada en pacientes con FPI y FPP57,58.
La efectividad cuestionable de los antifibróticos plantea la urgente necesidad de acceder a otros medicamentos más útiles para aumentar la supervivencia y bienestar. En este sentido, conviene resaltar los resultados prometedores ofrecidos por la administración de MET tanto en estudios preclínicos como clínicos. La MET ralentiza la progresión de la fibrosis en un modelo de fibrosis pulmonar inducida por bleomicina en ratones, según Rangarajan et al., afirmativo de que el fármaco facilita la resolución de la fibrosis establecida, en mayor medida, por su efecto activador de la AMPK, en asociación a otros factores adicionales antifibróticos al inhibir la producción de transforming growth factor-beta-1 (TGF-β1), proteína homodimérica implicada en el control de múltiples procesos biológicos tales como angiogénesis, proliferación, y diferenciación. En un modelo experimental de silicosis la MET redujo significativamente la inflamación pulmonar y la fibrosis en ratones a los que se les instiló SiO2 en etapas fibróticas temprana y tardía59.
Aunque un estudio publicado por Spagnolo et al.60 en 2018 no logró demostrar resultados beneficiosos de la MET, un análisis post hoc, elaborado por los editores de la propia revista, de los datos registrados de pacientes que habían recibido placebo en los ensayos clínicos (CAPACITY —2 ensayos— y ASCEND), puntualizaron que el estudio presentaba inconvenientes importantes que impedían la generalización de los resultados a la población general de enfermos con FPI.
Teague et al. publicaron en 2022 un estudio de cohorte, liderado por la Division of Pulmonary and Critical Care Medicine, Mayo Clinic, Rochester, Minnesota, que incluyó 3.599 adultos con FPI y DM2. El ensayo reclutó 1.110 pacientes tratados con MET y 1.100 pacientes emparejados no tratados con el fármaco. El grupo tratado con MET mostró una reducción significativa (53%) de mortalidad por todas las causas (p <0,001) y también de hospitalización (p=0,003). Aunque no se han dilucidado las razones de estos datos, podrían explicarse por combinación de efectos protectores de la MET: a) sobre la enfermedad cardiovascular; b) sobre las complicaciones respiratorias de la fibrosis pulmonar; c) sobre la salud general del paciente, y d) por una interacción positiva entre la MET y el fármaco antifibrótico que simultáneamente realizaban el 23% de los pacientes61.
La iniciativa del tratamiento de la FPI con MET culmina la investigación de su pleiotropía terapéutica62 (tabla 2).
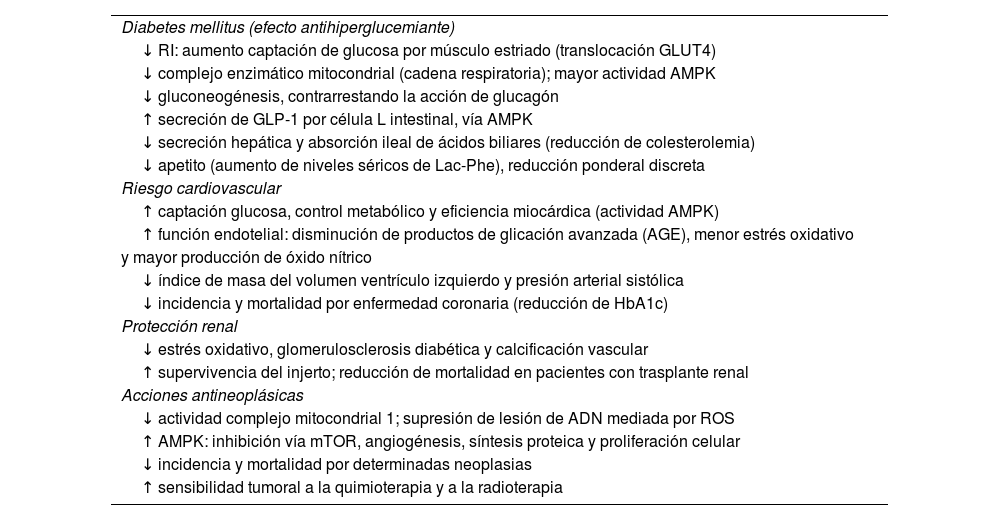
Metformina: principales acciones, mecanismos y beneficios clínicos
| Diabetes mellitus (efecto antihiperglucemiante) |
| ↓ RI: aumento captación de glucosa por músculo estriado (translocación GLUT4) |
| ↓ complejo enzimático mitocondrial (cadena respiratoria); mayor actividad AMPK |
| ↓ gluconeogénesis, contrarrestando la acción de glucagón |
| ↑ secreción de GLP-1 por célula L intestinal, vía AMPK |
| ↓ secreción hepática y absorción ileal de ácidos biliares (reducción de colesterolemia) |
| ↓ apetito (aumento de niveles séricos de Lac-Phe), reducción ponderal discreta |
| Riesgo cardiovascular |
| ↑ captación glucosa, control metabólico y eficiencia miocárdica (actividad AMPK) |
| ↑ función endotelial: disminución de productos de glicación avanzada (AGE), menor estrés oxidativo |
| y mayor producción de óxido nítrico |
| ↓ índice de masa del volumen ventrículo izquierdo y presión arterial sistólica |
| ↓ incidencia y mortalidad por enfermedad coronaria (reducción de HbA1c) |
| Protección renal |
| ↓ estrés oxidativo, glomerulosclerosis diabética y calcificación vascular |
| ↑ supervivencia del injerto; reducción de mortalidad en pacientes con trasplante renal |
| Acciones antineoplásicas |
| ↓ actividad complejo mitocondrial 1; supresión de lesión de ADN mediada por ROS |
| ↑ AMPK: inhibición vía mTOR, angiogénesis, síntesis proteica y proliferación celular |
| ↓ incidencia y mortalidad por determinadas neoplasias |
| ↑ sensibilidad tumoral a la quimioterapia y a la radioterapia |
ROS: especies reactivas de oxígeno.
La MET se mantiene en primera línea del tratamiento inicial de la DM2. Activa la captación de glucosa por el tejido muscular y adiposo, aumentando la sensibilidad a la insulina, principalmente por la activación del enzima AMPK, sensor clave del estado energético. La señalización inactivada de la proteína cinasa A(PKA) inhibe la gluconeogénesis y activa la glucólisis y oxidación de ácidos grasos. La MET retrasa/previene la transición prediabetes-DM2; su utilización aumenta en diabetes gestacional y SOPQ. La MET no induce, en sí misma, acidosis láctica.
Investigaciones recientes reconocen el intestino como diana fundamental de las acciones de la MET, aumentando la secreción de GLP-1 por las células L, y disminuyendo la absorción de ácidos biliares, lo que contribuye a la reducción de la colesterolemia. La relación entre la MET y la microbiota intestinal representa un tópico de creciente interés. Lac-Phe, metabolito inducible por la MET suprime el apetito, aumenta la saciedad y facilita la reducción ponderal, lo que puede contribuir al desarrollo de nuevos fármacos para el tratamiento de la obesidad.
Múltiples publicaciones han demostrado el pleiotropismo terapéutico de la MET, más allá de sus beneficios sobre el metabolismo intermediario, vía mecanismos dependientes e independientes de la acción de la AMPK. Ensayos clínicos prospectivos han corroborado acciones protectoras de la MET de índole cardiovascular y renal. Revisiones sistemáticas y metaanálisis han evidenciado su efecto beneficioso sobre incidencia, morbimortalidad de diversas neoplasias y prolongación de la esperanza de vida. Un importante estudio de cohortes recomienda la MET en el tratamiento de la fibrosis pulmonar, enfermedad muy grave sin solución farmacológica convincente hasta la fecha.
En suma, la MET, sintetizada hace más de 100 años, significa un medicamento efectivo, seguro y muy económico, merecedor de proyectos de investigación innovadores.
Consideraciones éticasLos autores manifiestan la originalidad del manuscrito, con la debida citación de fuentes y ausencia de plagios. Ambos autores han compartido en régimen de igualdad el diseño, búsqueda bibliográfica, redacción, revisión del manuscrito y aprobación del texto final
FinanciaciónNinguna.
Conflicto de interesesDeclaramos ningún conflicto de interés.