En las últimas décadas, la implementación de sistemas de información como soporte a la asistencia clínica ha conllevado la recopilación masiva de información1. Su mera disponibilidad representa oportunidades de análisis y generación de información de soporte para la toma de decisiones de gestión. A estos datos, de naturaleza observacional, se les ha denominado datos de vida real (DVR) o Real World Data y, atendiendo a su uso potencial, se ha propuesto definirlos como “los datos usados para la toma de decisiones que no son recogidos a través de los ensayos clínicos”2.
Por su parte, en el ámbito del medicamento, la intensa innovación terapéutica de los últimos años se ha acompañado de una creciente incertidumbre sobre la eficacia y seguridad de los nuevos medicamentos en la vida real3. La medicina de precisión ha condicionado que la población expuesta al nuevo medicamento, en el momento de la autorización, a menudo sea menor de la habitual, además, la autorización acelerada o condicional de productos que no han completado su desarrollo, determina la necesidad de confirmar su balance beneficio/riesgo tras la comercialización4. El valor de estas novedades se define como los resultados en salud alcanzados por los costes generados, por lo tanto, es necesario que los sistemas sanitarios midan los resultados en salud que los nuevos medicamentos están aportando en términos de efectividad y seguridad, y confirmen que se obtiene la mejoría prevista en la salud del conjunto de pacientes, para guiar la inversión de recursos que la sociedad está aportando a este fin5.
Los DVR recogidos en la práctica clínica habitual, a partir de aplicativos asistenciales o mediante bases de datos ad hoc, permiten describir patrones de uso, la efectividad y la seguridad de las intervenciones terapéuticas durante su uso clínico. Por ello, potencialmente, pueden ser útiles para completar la información sobre los medicamentos recién comercializados, y como herramienta de retroalimentación en la toma de decisiones, siempre que la información sea exhaustiva y homogénea, y se obtenga de un registro clínico o repositorio de datos estructurado que permita responder a la finalidad y objetivos predefinidos2,5–7. La estructura de un registro debe estar determinada por las preguntas que intenta responder y para garantizar su idoneidad son clave las fases de diseño, implementación, explotación y mantenimiento del registro. En todas ellas es conveniente una colaboración multidisciplinar entre profesionales clínicos asistenciales, especialistas en sistemas de información y responsables de la gestión administrativa, así como contar con experiencia epidemiológica y estadística e implicación gerencial8.
Sin embargo, los resultados en la práctica clínica dependen en buena parte del tipo de utilización que se hace de los medicamentos y de su indicación preferente en unos u otros colectivos, de modo que cualquier estimación de efectividad procedente de datos observacionales es vulnerable a múltiples sesgos en ausencia de diseños experimentales. A pesar de que existen diversas metodologías de ajuste para controlar estos sesgos, la información disponible para ello se limita a aquellos parámetros recogidos en las bases de datos, de modo que la capacidad de ajuste de los modelos puede no ser suficiente para garantizar una conclusión robusta y libre de sesgos7,9. Aun así, el análisis de los DVR tiene como ventaja principal la obtención de información de poblaciones más amplias y heterogéneas, ofrece oportunidades para completar lagunas de información de productos autorizados en base a desarrollos no convencionales, e informan de una manera pragmática de la efectividad final de los tratamientos en nuestro entorno clínico real.
La utilidad de los registros y bases de datos administrativas como herramientas de soporte a la toma de decisiones en la gestión de sistemas sanitarios está bien establecida y descrita, y existen revisiones y recomendaciones sobre los requisitos de los datos para esta finalidad10. No obstante, las referencias a la aplicación de los registros sanitarios como herramientas de gestión en el control de prestaciones farmacéuticas y como herramienta de soporte a acciones de fomento del uso racional son escasas y poco concretas10,11. Una de las pocas experiencias reportada en este sentido es la de la Agencia Italiana de Medicamentos (AIFA), que utiliza los registros de fármacos para la gestión del acceso a la innovación9,12–14. A nivel nacional, también la Comunidad Valenciana cuenta con un sistema de recogida de datos clínicos vinculado a la prescripción de determinados medicamentos de alto impacto, en consonancia con los protocolos farmacoterapéuticos que la comunidad aprueba. Por otro lado, el Ministerio de Sanidad, Consumo y Bienestar Social creó en 2015 un registro específico de enfermedad “Sistema de Información de monitorización Terapéutica de pacientes con Hepatitis C crónica” (SITHepaC)15 y, actualmente, está diseñando el “Sistema de información para determinar el valor terapéutico en la práctica clínica real de los medicamentos de alto impacto sanitario y económico en el Sistema Nacional de Salud” (VALTERMED)16; en ambos casos, incluyen la recogida de datos clínicos vinculados al uso de medicamentos en todo el territorio nacional. En Cataluña, se ha apostado en la última década por la utilización de registros en la gestión de medicamentos, considerando que representa una oportunidad para generar y compartir información entre los agentes implicados en la utilización de medicamentos (médicos, farmacéuticos, instituciones, reguladores, agencias de evaluación, industria y pacientes), y que permite avanzar para conocer el verdadero valor de las innovaciones a través de la estimación de resultados y costes, así como, para integrar la información en la toma de decisiones. En el presente artículo recogemos esta experiencia del Servei Català de la Salut (CatSalut).
Gestión de la prestación farmacéutica en CataluñaEn Cataluña, el sistema de salud cuenta con centros de titularidad pública y concertados, que constituyen una red de hospitales de utilización pública enmarcada en el Sistema Sanitari Integral d’Utilizació Pública de Catalunya (SISCAT)17. El CatSalut es el ente que gestiona las prestaciones del sistema público de salud en Cataluña a través de la contratación de servicios sanitarios a las entidades proveedoras con criterios de equidad, calidad y sostenibilidad, adaptando la oferta a las necesidades de la población18. Estos contratos incluyen la contraprestación por resultados, un sistema de retribución variable condicionado a la consecución de unos resultados organizativos, clínicos y de salud relacionados con los ejes del Pla de Salut de Catalunya, concretados en objetivos anuales19. Para evaluar su consecución, es necesario contar con sistemas de información adecuados para objetivar las evaluaciones propuestas y sistemas de gestión comunes en todo el territorio.
La prestación farmacéutica representa una proporción elevada del presupuesto en salud (más del 24% en el año 2017)20, por lo que la utilización racional de medicamentos forma parte de los objetivos contractuales. Los estándares de uso racional y sistemas de gestión de la prestación farmacéutica se generan en el Programa de Armonización Farmacoterapéutica (PHF, por sus siglas en catalán) que se inició en 2008 centrado en medicamentos de alta complejidad y que, progresivamente, se ha ido consolidando y ampliando para integrar la evaluación de todos los medicamentos innovadores21.
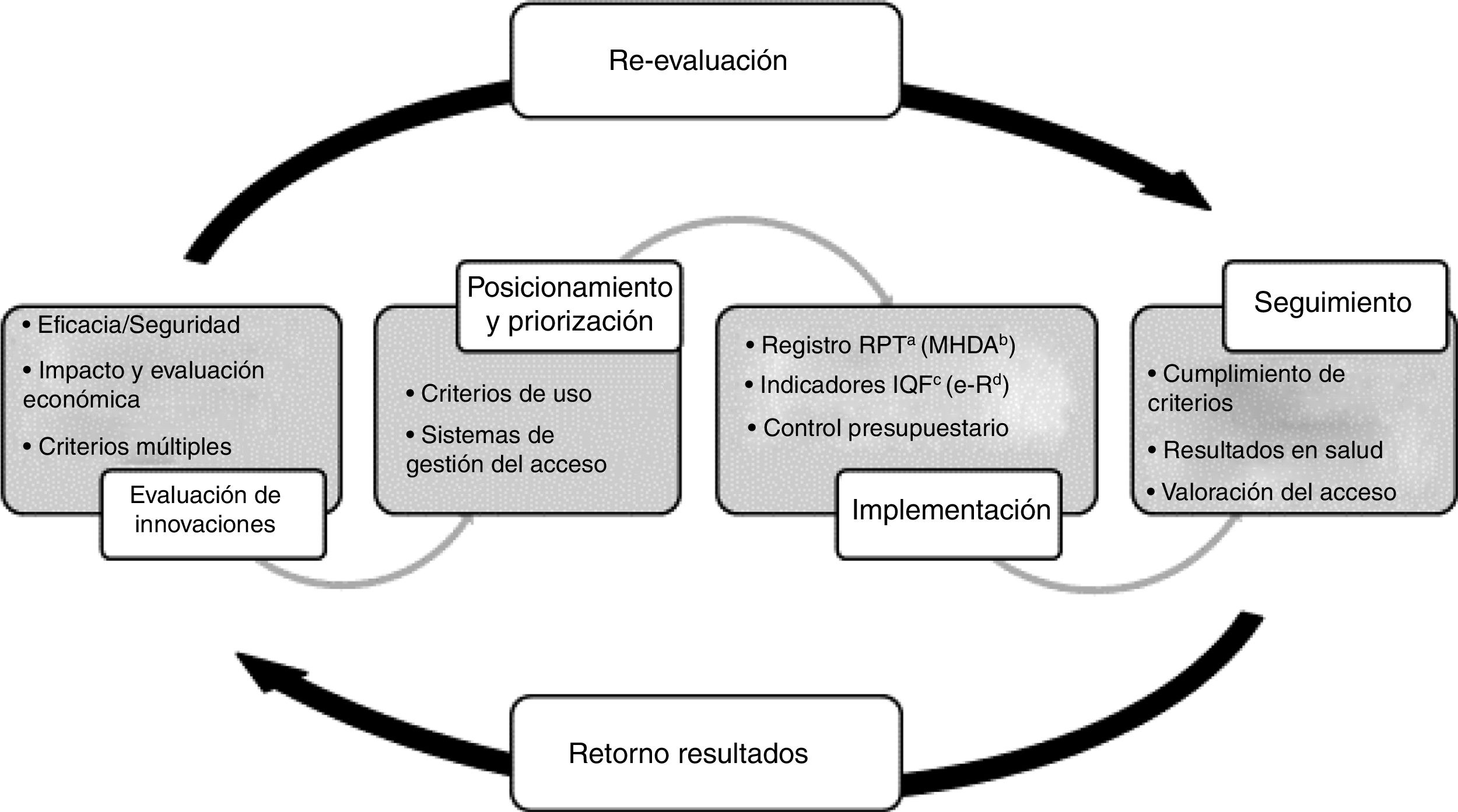
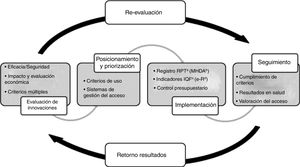
La finalidad del PHF es garantizar la equidad en el acceso a los medicamentos innovadores de acuerdo con los principios de uso racional, y teniendo en cuenta el marco de disponibilidad y la necesaria optimización de los recursos. Se evalúa el valor añadido de los medicamentos respecto de las alternativas disponibles, las incertidumbres existentes sobre las evidencias de eficacia y seguridad del medicamento y el impacto potencial en términos clínicos y económicos y, en base a ello, se definen unos criterios de uso, acceso y provisión según su posicionamiento y priorización terapéutica. Estos criterios van asociados a unas medidas de implementación y a la recogida de la información necesaria para su seguimiento. Finalmente, la información generada se utiliza para evaluar la implementación de los criterios, los resultados en salud obtenidos y el impacto presupuestario real, y así retroalimentar la toma de decisiones (fig. 1). Para los medicamentos hospitalarios de dispensación ambulatoria (MHDA), el procedimiento de evaluación por el procedimiento de armonización se concreta en tres posibles categorías: uso según criterios clínicos, autorización individual o uso excepcional21,22.
Procedimiento del Programa de armonización farmacoterapéutica del Sistema Sanitari Integral d’Utilizació Pública de Catalunya (SISCAT).
aRegistro de Pacientes y Tratamientos; bMedicación Hospitalaria de Dispensación Ambulatoria; cÍndex de qualitat de la prescripció farmacéutica (índice de calidad de la prescripción médica); dReceta electrónica.
Los MHDA, a diferencia de la medicación en receta, se adquiere y dispensa en los centros hospitalarios, y se factura al CatSalut mensualmente y de manera detallada para cada paciente. Como herramienta de gestión de la prestación, pero también de implementación y seguimiento de los criterios definidos para cada medicamento evaluado por el PHF, se creó un registro específico, el Registro de Pacientes y Tratamientos MHDA22.
Creación del registro de pacientes y tratamientosDesde el inicio del PHF, hace más de una década, se objetivó la necesidad de disponer de información sobre la utilización en la práctica clínica real de los MHDA, para cuantificar y cualificar su uso, y así retroalimentar la planificación y la gestión del acceso a estos medicamentos. A diferencia del sistema de prescripción en receta electrónica, que cuenta con un sistema de información único e integrado para todo el SISCAT, para la MHDA en la red de hospitales del SISCAT existe una gran diversidad de sistemas de prescripción, de información y de recogida de datos, que dificulta la obtención de información homogénea.
Al crear el PHF, en 2008, y debido a la variabilidad de sistemas, se decidió crear un registro específico, el Registro de Pacientes, que pilotó una recogida de información básica sobre la indicación clínica y la duración del tratamiento de 30 medicamentos destinados a indicaciones oncohematológicas. Esta primera experiencia, de carácter voluntario para los centros, permitió obtener por primera vez datos sobre la utilización de estos medicamentos y realizar comparaciones entre hospitales, y sentó las bases para el desarrollo posterior de un registro más amplio.
Durante el año 2011 se diseñó el actual Registro de Pacientes y Tratamientos MHDA (RPT-MHDA), un único registro específico y centralizado para todos los hospitales del SISCAT, con el objetivo de recoger, de forma sistemática, información sobre utilización, efectividad y seguridad de los MHDA en condiciones de práctica clínica habitual, así como el grado de adherencia a los criterios definidos por el PHF22. El despliegue del registro se inició en diciembre de 2011, con diversas sesiones de formación teórico-prácticas que se desarrollaron durante 4 meses dirigidas a representantes de los servicios de farmacia hospitalaria, servicios clínicos y direcciones médicas de los hospitales del SISCAT, con la participación de más de un centenar de profesionales. Se realizó una fase de pruebas del nuevo registro entre abril y mayo de 2012, para validar el diseño del registro y la adecuación del funcionamiento en el ámbito asistencial y en la práctica clínica habitual; como consecuencia, se realizaron diversas mejoras en el sistema de recogida de información. En la creación del RPT-MHDA, se previó que, para los productos armonizados, la correcta cumplimentación del registro fuese obligatoria para poder facturar esta medicación. No obstante, la vinculación entre el registro y la facturación se fue implementando de manera paulatina y consensuada con los hospitales, y no fue requerida de manera general hasta el año 2014.
El registro ha incluido anualmente de manera progresiva nuevos fármacos e indicaciones, el año con más novedades fue el 2014 (n=123 indicaciones), seguido por los años 2012, 2013, 2015 con alrededor de 90 novedades por año. Durante el año 2015 se superaron las previsiones de volumen realizadas en el momento del diseño y se asoció a problemas de rendimiento del aplicativo. Por este motivo, y con la finalidad de mejorar el rendimiento, en 2016 se realizó un rediseño interno de la aplicación que fraccionó el acceso a los datos en bloques (subregistros por enfermedad); una experiencia similar se ha referido en el registro de la AIFA9.
Características operativas y funcionales del Registro de Pacientes y TratamientosEl RPT-MHDA se creó en el entorno de la plataforma estándar de registros sanitarios que integra diversos registros del Departament de Salut en un entorno seguro y apto como repositorio de datos de alta sensibilidad.
La introducción de datos al RPT-MHDA puede ser en línea, a través del sistema WebService o mediante el envío de ficheros estructurados. Para cualquier modalidad, el acceso al RPT-MHDA es unipersonal, con privilegios de acceso restringidos a la información registrada en el ámbito del usuario y se obtiene por autorización centralizada y explícita del responsable del RPT-MHDA del CatSalut. Actualmente, la mayoría de los centros hacen el envío de datos a través de WebService.
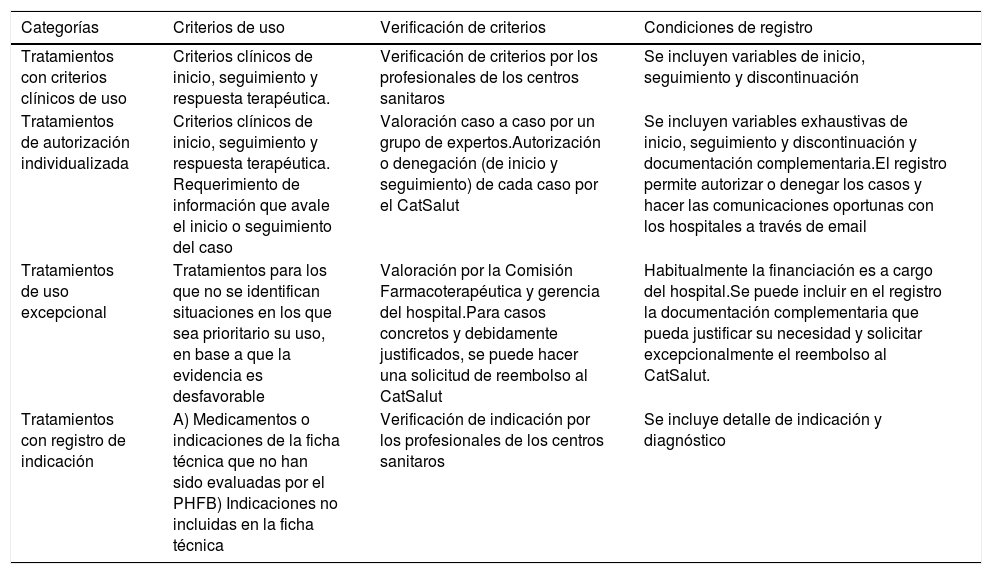
En cumplimiento de la Instrucción 01/2011 del CatSalut22 se establece la vinculación entre los criterios de uso de los medicamentos armonizados y las condiciones del registro (tabla 1).
Categorías y condiciones del registro de tratamientosa
| Categorías | Criterios de uso | Verificación de criterios | Condiciones de registro |
|---|---|---|---|
| Tratamientos con criterios clínicos de uso | Criterios clínicos de inicio, seguimiento y respuesta terapéutica. | Verificación de criterios por los profesionales de los centros sanitaros | Se incluyen variables de inicio, seguimiento y discontinuación |
| Tratamientos de autorización individualizada | Criterios clínicos de inicio, seguimiento y respuesta terapéutica. Requerimiento de información que avale el inicio o seguimiento del caso | Valoración caso a caso por un grupo de expertos.Autorización o denegación (de inicio y seguimiento) de cada caso por el CatSalut | Se incluyen variables exhaustivas de inicio, seguimiento y discontinuación y documentación complementaria.El registro permite autorizar o denegar los casos y hacer las comunicaciones oportunas con los hospitales a través de email |
| Tratamientos de uso excepcional | Tratamientos para los que no se identifican situaciones en los que sea prioritario su uso, en base a que la evidencia es desfavorable | Valoración por la Comisión Farmacoterapéutica y gerencia del hospital.Para casos concretos y debidamente justificados, se puede hacer una solicitud de reembolso al CatSalut | Habitualmente la financiación es a cargo del hospital.Se puede incluir en el registro la documentación complementaria que pueda justificar su necesidad y solicitar excepcionalmente el reembolso al CatSalut. |
| Tratamientos con registro de indicación | A) Medicamentos o indicaciones de la ficha técnica que no han sido evaluadas por el PHFB) Indicaciones no incluidas en la ficha técnica | Verificación de indicación por los profesionales de los centros sanitaros | Se incluye detalle de indicación y diagnóstico |
PHF: Programa de Armonización Farmacoterapéutica (PHF, por sus siglas en catalán).
Como estructura general, el registro consta de tres niveles de información:
- Nivel tratamiento: incluye los datos básicos del paciente (vinculados al Registro Central de Personas Aseguradas del CatSalut23), la identificación del tratamiento (fármaco, fecha de inicio y finalización del tratamiento, indicación terapéutica y diagnóstico relacionado mediante CIE-10) e identificación del origen de la prescripción (hospital y médico prescriptor).
- Nivel inicio: incluye las variables clínicas que son requeridas al iniciar un tratamiento y, si es requerido, pueden adjuntarse documentos clínicos.
- Nivel seguimiento: incluye las variables clínicas que son requeridas durante el seguimiento del tratamiento (según la periodicidad establecida) y las variables de discontinuación al finalizar el tratamiento. Si es requerido, pueden incluirse documentos clínicos.
El nivel tratamiento es obligatorio para todos los medicamentos. El nivel inicio o seguimiento solo es obligatorio para los fármacos armonizados por el PHF.
El registro incluye un control de duplicidad básico, que bloquea la creación de registros con el mismo tratamiento (fármaco e indicación) para un mismo paciente durante el mismo periodo temporal. Por otra parte, para permitir la facturación, comprueba que el tratamiento esté correctamente registrado (nivel inicio y variables obligatorias, si procede) y activo en el período temporal.
Mensualmente se introducen los nuevos MHDA y las nuevas indicaciones que se incluyen en la prestación farmacéutica del Sistema Nacional de Salud de los grupos terapéuticos seleccionados con criterio de relevancia tanto clínica como económica. Por otro lado, y condicionado a la actividad del PHF, se calendariza el diseño y la incorporación de las variables para los medicamentos evaluados. Las variables incluidas en cada fármaco se definen y consensuan como parte del proceso de armonización, con la participación de expertos clínicos en la enfermedad y en el tratamiento evaluado. Para cada caso, se optimiza el número de variables a registrar, incluyendo el número mínimo de variables que proporcione la información necesaria para: i) verificar el cumplimento de los criterios del PHF, y ii) realizar una valoración de efectividad y seguridad. En su mayoría, son obligatorias y con valores cerrados predeterminados (sí/no, selección simple o selección múltiple). También se establece la periodicidad de los seguimientos, bajo el principio de adaptar todos los criterios a la práctica clínica habitual, en la medida de lo posible. Las variables y su periodicidad se publican en la web del PHF. En general, las variables se parametrizan y comunican a los centros, con un periodo de carencia para la vinculación a facturación pactado con los hospitales para permitir su implantación, y que considera la frecuencia habitual de las visitas asistenciales.
Como soporte al RPT-MHDA, se dispone de manuales de usuario y de especificaciones técnicas, y una dirección de correo electrónico destinado a consultas o incidencias que se revisa y responde diariamente.
Análisis de datos y evaluación de resultadosCon fecha 31 de diciembre 2018, el registro incluye información sobre 587 indicaciones que corresponden a un total de 180 fármacos diferentes. El 60% son tratamientos con registro únicamente de indicación, el 34% de criterios clínicos, el 3% de autorización individualizada y el 3% de uso excepcional.
El registro incluye 234.416 tratamientos registrados para 148.184 pacientes, prescritos por un total de 3.481 facultativos en 61 hospitales. La edad de los pacientes al iniciar cada tratamiento, media (desviación estándar [DE]) es de 51,84 (17,29) años y el 58,36% son hombres. La franja de edad, por quindenio, en la que se han iniciado más tratamientos es de 45-59 años, para ambos sexos.
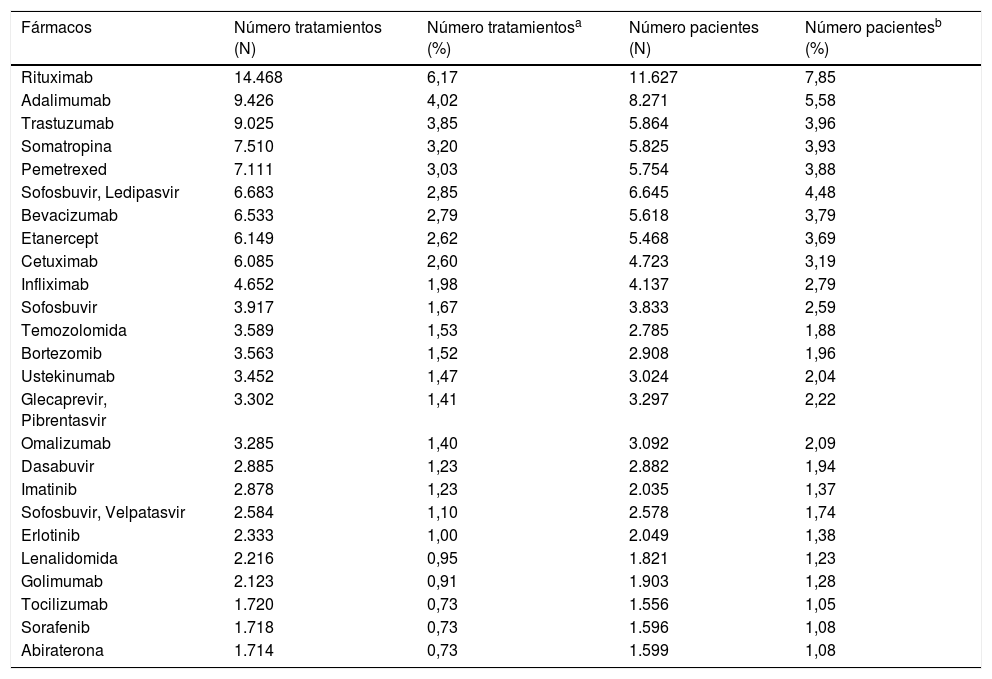
Los fármacos con mayor número de tratamientos registrados son rituximab, adalimumab, trastuzumab, somatropina y pemetrexed; los fármacos con mayor número de pacientes registrados son rituximab, adalimumab, sofosbuvir-ledipasvir, trastuzumab y somatropina (tabla 2).
Número de tratamientos y pacientes de los 25 fármacos más registrados
| Fármacos | Número tratamientos (N) | Número tratamientosa (%) | Número pacientes (N) | Número pacientesb (%) |
|---|---|---|---|---|
| Rituximab | 14.468 | 6,17 | 11.627 | 7,85 |
| Adalimumab | 9.426 | 4,02 | 8.271 | 5,58 |
| Trastuzumab | 9.025 | 3,85 | 5.864 | 3,96 |
| Somatropina | 7.510 | 3,20 | 5.825 | 3,93 |
| Pemetrexed | 7.111 | 3,03 | 5.754 | 3,88 |
| Sofosbuvir, Ledipasvir | 6.683 | 2,85 | 6.645 | 4,48 |
| Bevacizumab | 6.533 | 2,79 | 5.618 | 3,79 |
| Etanercept | 6.149 | 2,62 | 5.468 | 3,69 |
| Cetuximab | 6.085 | 2,60 | 4.723 | 3,19 |
| Infliximab | 4.652 | 1,98 | 4.137 | 2,79 |
| Sofosbuvir | 3.917 | 1,67 | 3.833 | 2,59 |
| Temozolomida | 3.589 | 1,53 | 2.785 | 1,88 |
| Bortezomib | 3.563 | 1,52 | 2.908 | 1,96 |
| Ustekinumab | 3.452 | 1,47 | 3.024 | 2,04 |
| Glecaprevir, Pibrentasvir | 3.302 | 1,41 | 3.297 | 2,22 |
| Omalizumab | 3.285 | 1,40 | 3.092 | 2,09 |
| Dasabuvir | 2.885 | 1,23 | 2.882 | 1,94 |
| Imatinib | 2.878 | 1,23 | 2.035 | 1,37 |
| Sofosbuvir, Velpatasvir | 2.584 | 1,10 | 2.578 | 1,74 |
| Erlotinib | 2.333 | 1,00 | 2.049 | 1,38 |
| Lenalidomida | 2.216 | 0,95 | 1.821 | 1,23 |
| Golimumab | 2.123 | 0,91 | 1.903 | 1,28 |
| Tocilizumab | 1.720 | 0,73 | 1.556 | 1,05 |
| Sorafenib | 1.718 | 0,73 | 1.596 | 1,08 |
| Abiraterona | 1.714 | 0,73 | 1.599 | 1,08 |
Quedan excluidos del análisis los tratamientos para VIH, registrados con una estructura de información excepcional.
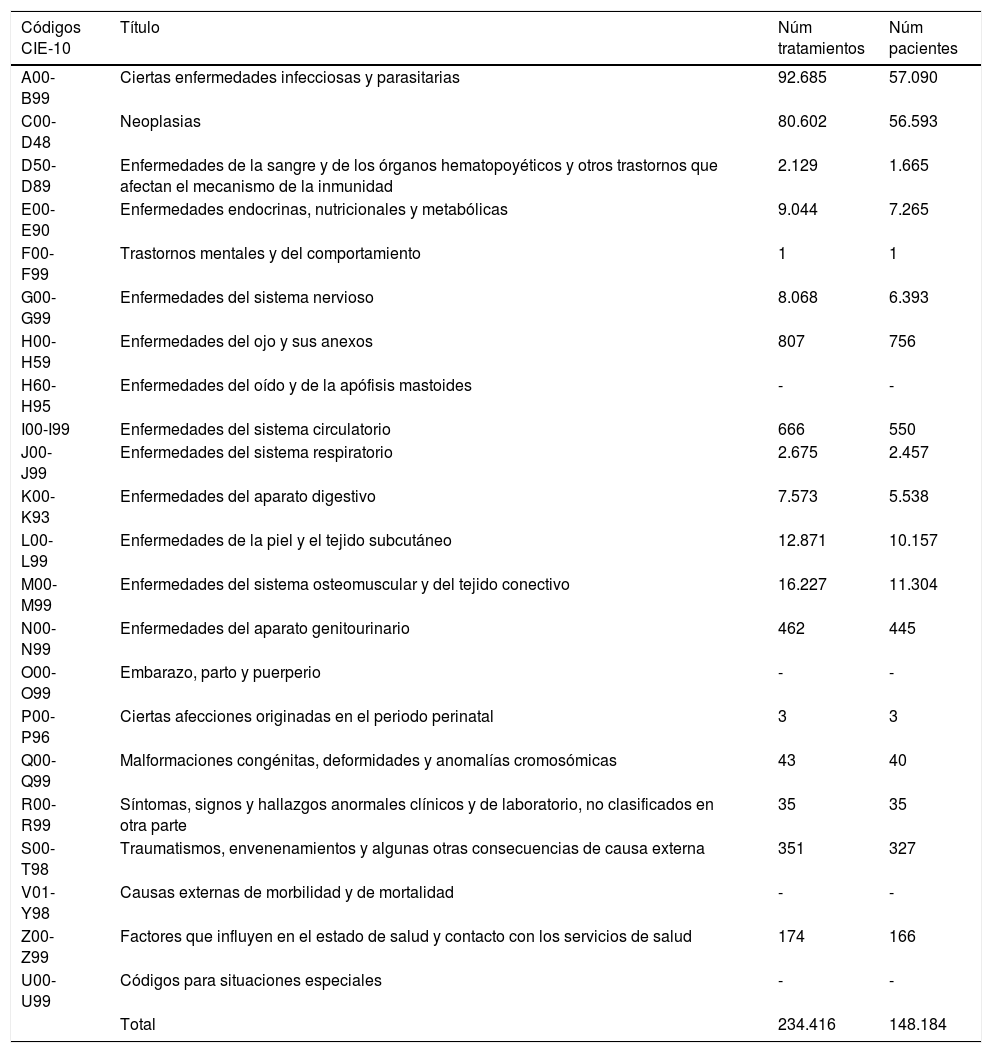
Los diagnósticos, clasificados según Clasificación Internacional de Enfermedades 10.ª revisión (CIE-10), con mayor número de tratamientos y pacientes corresponden a enfermedades infecciosas y parasitarias (que incluyen los tratamientos para el VIH y hepatitis), seguido por el conjunto de neoplasias (tabla 3).
Número de tratamientos y pacientes según la clasificación diagnóstica CIE-10a
| Códigos CIE-10 | Título | Núm tratamientos | Núm pacientes |
|---|---|---|---|
| A00-B99 | Ciertas enfermedades infecciosas y parasitarias | 92.685 | 57.090 |
| C00-D48 | Neoplasias | 80.602 | 56.593 |
| D50-D89 | Enfermedades de la sangre y de los órganos hematopoyéticos y otros trastornos que afectan el mecanismo de la inmunidad | 2.129 | 1.665 |
| E00-E90 | Enfermedades endocrinas, nutricionales y metabólicas | 9.044 | 7.265 |
| F00-F99 | Trastornos mentales y del comportamiento | 1 | 1 |
| G00-G99 | Enfermedades del sistema nervioso | 8.068 | 6.393 |
| H00-H59 | Enfermedades del ojo y sus anexos | 807 | 756 |
| H60-H95 | Enfermedades del oído y de la apófisis mastoides | - | - |
| I00-I99 | Enfermedades del sistema circulatorio | 666 | 550 |
| J00-J99 | Enfermedades del sistema respiratorio | 2.675 | 2.457 |
| K00-K93 | Enfermedades del aparato digestivo | 7.573 | 5.538 |
| L00-L99 | Enfermedades de la piel y el tejido subcutáneo | 12.871 | 10.157 |
| M00-M99 | Enfermedades del sistema osteomuscular y del tejido conectivo | 16.227 | 11.304 |
| N00-N99 | Enfermedades del aparato genitourinario | 462 | 445 |
| O00-O99 | Embarazo, parto y puerperio | - | - |
| P00-P96 | Ciertas afecciones originadas en el periodo perinatal | 3 | 3 |
| Q00-Q99 | Malformaciones congénitas, deformidades y anomalías cromosómicas | 43 | 40 |
| R00-R99 | Síntomas, signos y hallazgos anormales clínicos y de laboratorio, no clasificados en otra parte | 35 | 35 |
| S00-T98 | Traumatismos, envenenamientos y algunas otras consecuencias de causa externa | 351 | 327 |
| V01-Y98 | Causas externas de morbilidad y de mortalidad | - | - |
| Z00-Z99 | Factores que influyen en el estado de salud y contacto con los servicios de salud | 174 | 166 |
| U00-U99 | Códigos para situaciones especiales | - | - |
| Total | 234.416 | 148.184 |
En 2016 se inició el análisis de los datos registrados, que ha constado de dos fases: 1) informes de evaluación de resultados por fármaco o enfermedad y 2) definición y análisis de indicadores de contraprestación por resultados basados en resultados de efectividad de 5 grupos de medicamentos.
Inicialmente se realizaron informes de análisis de datos destinados a valorar la efectividad de los tratamientos antivirales para el virus de la hepatitis C (VHC) y el virus de la inmunodeficiencia humana y de la primera indicación de medicamentos biológicos para pacientes con artritis reumatoide (AR). De estos, se derivaron los primeros indicadores de uso racional de MHDA incluidos en los objetivos de contraprestación por resultados. Las extracciones de datos se trataron de manera descriptiva y se discutieron con los expertos clínicos del PHF, para cada área terapéutica, previamente a su presentación en los comités del PHF.
En el 2017 se inició una actividad más estructurada, con elaboración de protocolos de análisis y formatos estandarizados destinados a difusión pública. Así, los informes de evaluación de resultados actuales incluyen antecedentes, metodología, descripción de la población tratada, grado de cumplimiento del acuerdo, efectividad, duración del tratamiento y motivo de discontinuación, los costes e impacto presupuestario, la comparación con la evidencia utilizada en la armonización, análisis de la heterogeneidad en el uso a nivel territorial y conclusiones. Se han publicado 7 informes en la página web del PHF (VHC, AR, hipercolesterolemia primaria o dislipidemia mixta, enfermedades minoritarias y 3 de indicaciones oncohematológicas)24.
También se han elaborado informes sobre tratamientos de alta complejidad y autorización individualizada, destinados a enfermedades minoritarias (hemoglobinuria paroxística nocturna, enfermedad de Fabry y enfermedad de Gaucher tipo I y III); para evitar la posible identificación de casos, que serían potencialmente trazables debido a los pocos pacientes analizados, no se publican en la web del CatSalut. Para estos informes se hace la difusión exclusiva a los comités de expertos del PHF y a los profesionales responsables de los casos.
Otra de las áreas para la gestión del acceso a medicamentos innovadores, que se ha potenciado en los últimos años desde el CatSalut, han sido los acuerdos de riesgo compartido o pago por resultados para los medicamentos con incertidumbre en criterios de efectividad, seguridad o impacto presupuestario. Para la gestión de estos acuerdos, es clave e imprescindible disponer de la información clínica que permita el análisis de los resultados y condicionantes establecidos, por lo tanto, disponer del RPT-MHDA ha sido determinante para poder implementarlos en todos los hospitales del SISCAT25,26.
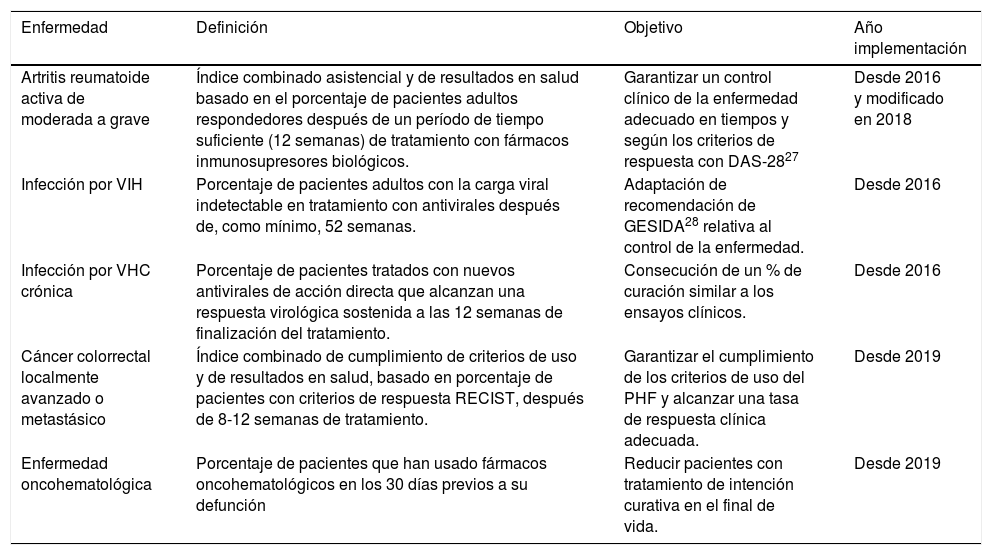
Por otro lado, en el marco de las contraprestaciones contractuales a los hospitales, se han desarrollado indicadores de uso racional para MHDA basados en resultados de efectividad, que se utilizan para el seguimiento de la actividad y calidad en la contratación de servicios sanitarios (tabla 4).
Indicadores de contraprestación por resultados basados en la efectividad
| Enfermedad | Definición | Objetivo | Año implementación |
|---|---|---|---|
| Artritis reumatoide activa de moderada a grave | Índice combinado asistencial y de resultados en salud basado en el porcentaje de pacientes adultos respondedores después de un período de tiempo suficiente (12 semanas) de tratamiento con fármacos inmunosupresores biológicos. | Garantizar un control clínico de la enfermedad adecuado en tiempos y según los criterios de respuesta con DAS-2827 | Desde 2016 y modificado en 2018 |
| Infección por VIH | Porcentaje de pacientes adultos con la carga viral indetectable en tratamiento con antivirales después de, como mínimo, 52 semanas. | Adaptación de recomendación de GESIDA28 relativa al control de la enfermedad. | Desde 2016 |
| Infección por VHC crónica | Porcentaje de pacientes tratados con nuevos antivirales de acción directa que alcanzan una respuesta virológica sostenida a las 12 semanas de finalización del tratamiento. | Consecución de un % de curación similar a los ensayos clínicos. | Desde 2016 |
| Cáncer colorrectal localmente avanzado o metastásico | Índice combinado de cumplimiento de criterios de uso y de resultados en salud, basado en porcentaje de pacientes con criterios de respuesta RECIST, después de 8-12 semanas de tratamiento. | Garantizar el cumplimiento de los criterios de uso del PHF y alcanzar una tasa de respuesta clínica adecuada. | Desde 2019 |
| Enfermedad oncohematológica | Porcentaje de pacientes que han usado fármacos oncohematológicos en los 30 días previos a su defunción | Reducir pacientes con tratamiento de intención curativa en el final de vida. | Desde 2019 |
DAS-28: Disease Activity Score; GESIDA: Grupo de Estudio del Síndrome de la Inmunodeficiencia Adquirida de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica; PHF: Programa de Armonización Farmacoterapéutica (PHF, por sus siglas en catalán); RECIST: Response Evaluation Criteria in Solid Tumors; VHC: virus hepatitis C; VIH: virus inmunodeficiencia humana.
Para cada indicador se ha establecido el objetivo numérico a alcanzar, según la efectividad prevista, las recomendaciones de las evaluaciones del PHF y el porcentaje basal de los objetivos.
Los resultados de los indicadores son informados a cada hospital trimestralmente y desde 2017 se publican los resultados del cierre de año de todos los hospitales en la Central de Resultats de l’Agència de Qualitat i Avaluació Sanitàries de Catalunya29.
Calidad del registroEn relación con la creciente utilización de los datos en análisis destinados a la gestión de los medicamentos innovadores, se consideró necesario realizar una comprobación de la fiabilidad de la información del registro. Así, el último semestre de 2018 se realizó una validación de datos por parte de una empresa externa a 7 hospitales, seleccionados según su grado de complejidad y sistema de envío de información al RPT-MHDA, incluyendo 9 bloques de enfermedades diferentes. Esta validación consistió en la comprobación de los datos registrados en el RPT-MHDA con los datos de la historia clínica u otras fuentes de información disponibles en el hospital.
Se analizaron 613 pacientes, con un total de 16.750 observaciones que se clasificaron como dato correcto (un 84,69% de las analizadas), incorrecto (8,56%) o ausente (6,75%). No obstante, solo el 7% de los pacientes tenían todas sus observaciones correctas. El bloque de enfermedad con más observaciones correctas fue el de los tratamientos para VIH (94%) y el peor, el de hematología (51%). Las conclusiones principales fueron que el registro es razonablemente fiable, aunque podían mejorarse el nivel de seguimiento, en especial la información sobre la discontinuación y duraciones de tratamiento. No se observaron diferencias sustanciales entre hospitales ni entre distintos sistemas de registro, a pesar de que la muestra fue pequeña. Como medida de continuidad se ha previsto iniciar un plan de calidad que permitirá garantizar una mejora continuada de los procesos de gobernanza, calidad de los datos e información, análisis e utilización de los datos de gestión, y seguridad y privacidad.
Áreas de mejora y retos de futuroDurante estos años, el registro ha alcanzado una importante dimensión, no solo por el propio volumen de datos que almacena, sino también por el elevado esfuerzo y dedicación de recursos de todos los agentes implicados. El registro requiere garantizar un adecuado entrenamiento a los profesionales en el correcto registro de casos en forma y tiempo, adaptar las constantes novedades terapéuticas que mensualmente se van introduciendo, la gestión de posibles errores que dificultan la facturación de los fármacos, etc. En muchos centros la recogida de datos estructurados que se requiere se ha organizado en repositorios ad-hoc, en ocasiones (pero no siempre) precargados con datos ya disponibles en otras fuentes de información de los hospitales como analíticas o pruebas diagnósticas, curso clínico, tratamientos previos, etc., pero que a menudo no están integrados en las estaciones clínicas.
Desde su creación y hasta 2017, los hospitales y el CatSalut han estado centrando sus esfuerzos en mejorar el registro como herramienta, mejorando rendimiento, planificación y calidad, con la finalidad de minimizar el impacto en los profesionales y poder obtener una información robusta para poder ser analizada e integrada en la toma de decisiones. Solo cuando la información se ha considerado suficientemente consolidada se ha procedido a la publicación de resultados.
Las áreas de mejora y los retos de futuro se basan en 4 líneas estratégicas:
- Mejorar la usabilidad y la calidad del RPT-MHDA, reduciendo la interferencia del registro de información durante el acto asistencial. Obtener la mayor parte de la información directamente de la historia clínica de cada hospital u otras fuentes internas, sin necesidad de una entrada de datos ad hoc ajena a la estación clínica de trabajo, representa un reto tecnológico y funcional, pero podría evitar duplicidades en la recogida de información y, por tanto, sobrecargas administrativas a los profesionales y riesgo de errores en la transcripción de datos. Asimismo, el plan de calidad permitirá la mejora continua de la calidad y fiabilidad de la información obtenida.
- Consolidar y ampliar el análisis sistemático de los resultados, garantizando un retorno de información a los clínicos sobre la efectividad de su práctica terapéutica de forma conjunta e individual, permitiendo la comparación de los resultados esperados y obtenidos, y compartir experiencias entre centros en caso de heterogeneidad. Asimismo, a inicios de 2018 se vinculó el RPT-MHDA al entorno Datamart, una herramienta de consulta que facilita la explotación y análisis de los datos y permite integrar la información con otras bases de datos del CatSalut.
- Integrar los resultados de salud en el procedimiento de evaluación del PHF, para utilizar resultados en DVR que permitan retroalimentar la toma de decisiones sobre el uso de estos medicamentos y adecuar, si es necesario, los criterios de uso, acceso y provisión de los fármacos evaluados, con objeto de obtener el mayor beneficio esperable de las inversiones en salud.
- Incluir estándares y métodos uniformes de medición de resultados, nacionales e internacionales, para una comparación de resultados consistente30, fomentando la integración de medidas de resultados informadas por los pacientes (Patient Reported Outcome Measures)31 como punto clave en el análisis del valor que aportan las novedades terapéuticas en nuestro entorno.
En resumen, Cataluña dispone de un registro de pacientes y tratamientos de medicación hospitalaria de dispensación ambulatoria que ha alcanzado una fase de madurez tras la experiencia de más de 10 años. Abarca actualmente casi 600 indicaciones de alto impacto clínico y económico, recoge de forma sistemática la información de uso de estos medicamentos y, en casos seleccionados, permite obtener datos sobre resultados en salud como soporte a la gestión de las prestaciones farmacéuticas. Avanzar a medio plazo en las líneas estratégicas previstas es un reto que requiere continuidad en la participación y dedicación de los agentes implicados, para trabajar conjuntamente en un modelo de acceso a la innovación terapéutica de mayor valor real fundamentado en evidencias y criterios de uso racional.
Conflicto de interesesMR, MAP y CP son empleadas del Servei Català de la Salut. MQG es empleada de un hospital público del SISCAT.
El registro existe y ha sido posible gracias a las incontables horas de dedicación y esfuerzo por parte de los profesionales sanitarios y los técnicos de soporte al registro en los distintos hospitales del SISCAT, así como gracias a la visión de futuro de los creadores conceptuales del registro, Antoni Gilabert, Josep María Borràs, Josep Alfons Espinàs y Ana Clopés. La contribución diaria a la mejora continua del registro y a la solución de problemas de los técnicos de la Gerencia de Sistemas de Información del CatSalut, en especial, Jaume Clapés, y de los técnicos de la Gerencia de Armonización, Gerencia de Prestaciones Farmacéuticas y Acceso al Medicamento y División de Acción Territorial del Medicamento del CatSalut, que permiten la continuidad y desarrollo futuro del proyecto.