Fig. 1. Vías de señalización del interferón (IFN). Los IFN se unen a receptores celulares específicos y desencadenan respuestas antivíricas, antiproliferativas e inmunorreguladoras (IFN tipo I, que incluye el IFN-* y el IFN-ß) o proinflamatorias y también antivíricas (IFN tipo II o IFN-*). El IFN-* se une a un receptor de la membrana celular compuesto por 2 subunidades: IFNAR1 e IFNAR2. La traducción de la señal del IFN-* está mediada por la cinasa Janus tipo 1 (Jak1) y por la cinasa asociada al receptor del IFN tipo 2 (Tyk2), las cuales fosforilan y activan las proteínas STAT1, STAT2 y STAT3 (transductoras de señal y activadoras de la transcripción). Tras la fosforilación STAT1 y STAT2 forman un heterodímero que estimula la expresión de genes que inhiben la síntesis de las proteínas víricas y celulares. STAT1 y STAT3 pueden formar homodímeros o heterodímeros STAT1-STAT3, que también se translocan al núcleo para modular la expresión de genes. El IFN tipo II, tras unirse a un receptor específico, activa STAT1 a través de Jak1 y Jak2, lo que se sigue de la homodimerización de STAT1 y de la translocación nuclear del homodímero. IFNGR: receptor del IFN-*; P: fosfato; ISG: genes estimulados por IFN; VHC: virus de la hepatitis C.
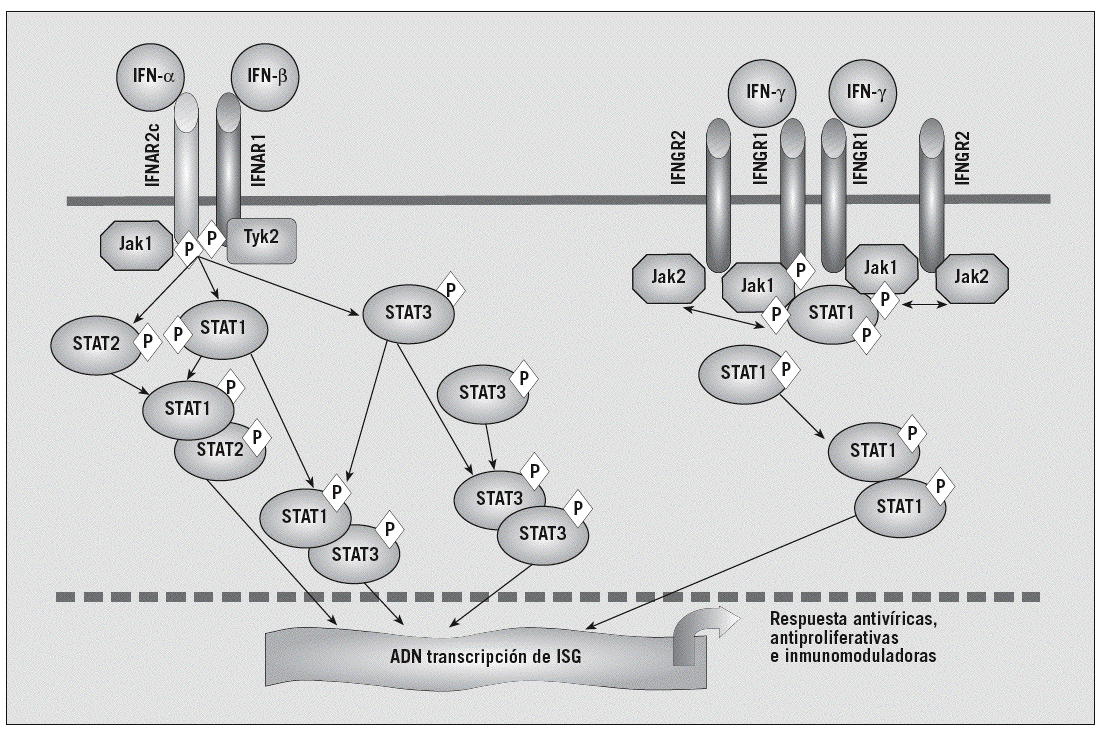
Fig. 2. Mecanismos por los cuales el virus de la hepatitis C (VHC) escapa a la respuesta inmunitaria y posibles estrategias inmunoterapéuticas. A: la infección de las células dendríticas (CD) por el VHC impide su maduración y consiguiente activación para la correcta estimulación de los linfocitos T (LT). Esto hace, por un lado, que los LT CD4+ adquieran un fenotipo de LT reguladores (Treg), con efecto inmunodepresor y capaces de producir citocinas antiinflamatorias, y por otro lado impide la activación de los LT citotóxicos, que deberían producir citocinas proinflamatorias y lisar las células infectadas como los hepatocitos. B: las estrategias inmunoterapéuticas para el tratamiento de la infección por el VHC deberían activar las CD a través de estímulos alternativos, o bien bloquear los efectos inmunomoduladores de las proteínas víricas dentro de estas células, lo que permitiría una correcta activación de los LT. Además, el bloqueo de las citocinas antiinflamatorias producidas por los Treg permitiría potenciar la respuesta, lo que finalmente podría llevar al aclaramiento vírico.
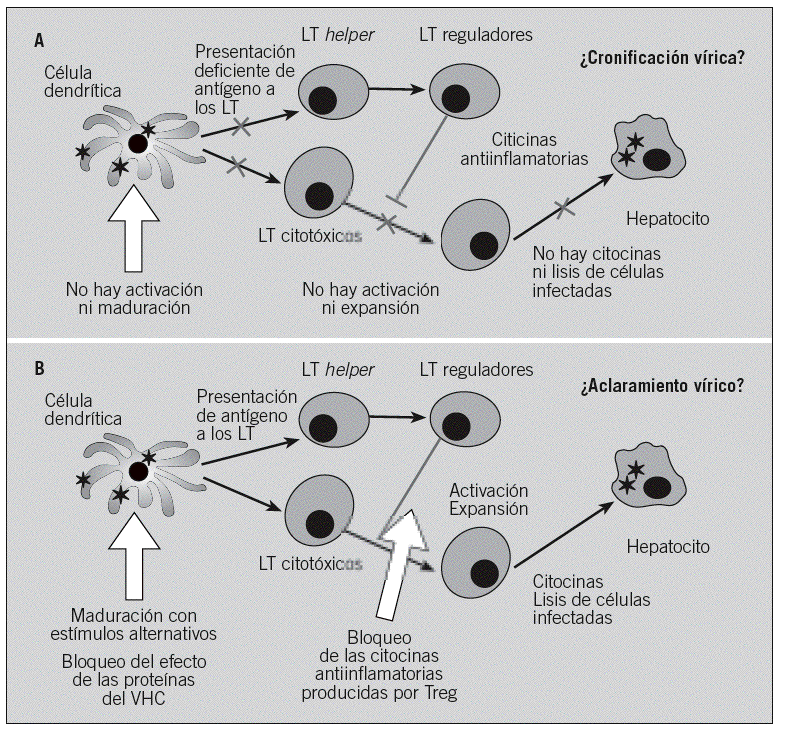
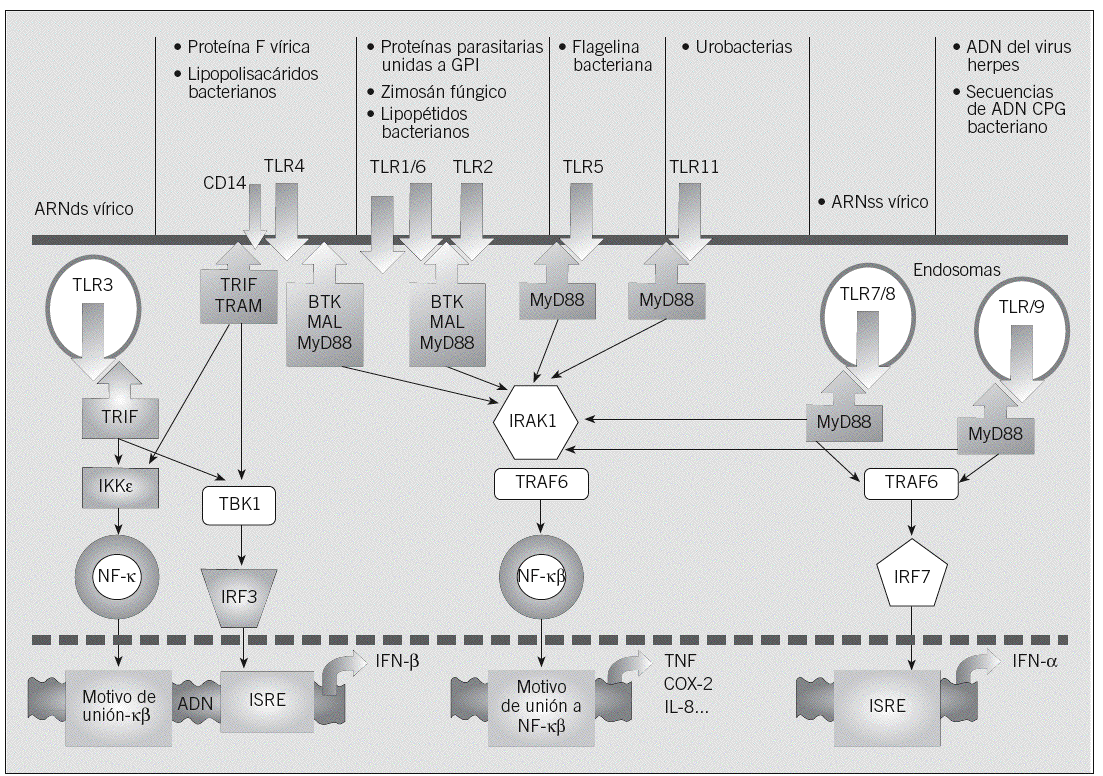
Fig. 3. La familia de los receptores tipo Toll (TLR). Los TLR reconocen productos microbianos y activan vías de señalización que promueven la expresión de genes de la respuesta inmunitaria e inflamatoria, por lo que constituyen la primera línea de la respuesta innata frente a patógenos. Los TLR más específicamente antivíricos (TLR3 y TLR7-9) reconocen ácidos nucleicos y señalizan desde endosomas, mientras que el resto (TLR1, 2, 10 y 11, y TLR4-6) se sitúan en la membrana celular y detectan lípidos y proteínas. La vía activada por la mayoría de los TLR desemboca en la activación del factor de transcripción nuclear kappa-beta (NF-*ß), con lo que se producen citocinas esenciales para la defensa antimicrobiana como el factor de necrosis tumoral (TNF), la ciclooxigenasa 2 (COX-2) o la interleucina (IL) 18. TLR3 y TLR4 activan una vía alternativa que actúa tanto sobre NF-*ß como sobre el factor regulador 3 del inferferón (IRF3), lo que permite la expresión de productos antivíricos adicionales como el interferón (IFN) beta. MAP: proteína activada por mitógenos; ARNds: ARN bicatenario; ARNss: ARN monocatenario; VRS: virus respiratorio sincitial; GPI: glucosilfosfatidilimositol; CP6: finucleótido citosinaguanosina no metilado; TRIF: receptor [TOIll] interleucina-1; TRAM: adaptador que contiene el dominio Tir; MAL: proteína semejante al adaptador M y D88; M y D88: adaptador del factor de diferenciación mieloide 88; IKK: complejo cinasa cinasa I*ß; TBK: cinasa de fijación TANK activadora de NF- *ß asociada a la familia TRAF, IRAK: cinasa asociada a la interleucina-1R; TRAF: receptor del factor de necrosis tumoral; ISRE: elemento regulador estimulado por el IFN.