Editado por: Silvia Pellitero-Rodríguez - University Hospital Germans Trias i Pujol Badalona
Federico Vázquez Sanmiguel - University Hospital Germans Trias i Pujol Badalona
Última actualización: Octubre 2025
Más datosLa molécula del péptido análogo al glucagón tipo1 (GLP-1) ha emergido, merced a la bioingeniería bioquímica, como un elemento esencial en el desarrollo de agonistas y multiagonistas basados en su estructura para el tratamiento de la obesidad. Estos nuevos fármacos llegan a alcanzar valores medios de pérdida de peso del 24%, lo que contribuye a su eficacia sobre las complicaciones de la obesidad. Sus efectos sobre las alteraciones en la regulación de la ingesta, disfunción adipocitaria, resistencia a la insulina, producción de adipoquinas, inflamación, disfunción endotelial, metabolismo lipídico y estrés oxidativo posibilitan el control de numerosas complicaciones como la diabetes, la enfermedad hepática metabólica, la insuficiencia cardiaca y la arteriosclerosis, entre otras. La potenciación y complementación de los efectos de GLP-1 que ofrece la coestimulación de receptores de GIP (polipéptido insulinotrópico dependiente de la glucosa), glucagón y amilina, promueven importantes beneficios adicionales, abriendo alentadores horizontes de individualización terapéutica para las personas que viven con obesidad.
Thanks to biochemical engineering, the glucagon-like peptide-1 (GLP-1) molecule has emerged as an essential element in the development of diverse agonists and multiagonists, based in the GLP-1 structure for obesity treatment. These new antiobesity medications can reach up to 24% weight loss, which makes possible an effective management of obesity and its complications. GLP-1 agonists affect diverse obesity etiopathogenic processes such as abnormal food intake regulation, adipocyte dysfunction, insulin resistance, adipokine production, inflammation, endothelial dysfunction, lipid metabolism, and oxidative stress. All these factors are significantly involved in the pathophysiology of multiple obesity-related complications, including diabetes mellitus, metabolic dysfunction-associated steatotic liver disease, heart failure, and atherosclerosis, among others. Potentiation and complementation of GLP-1 effects by co-stimulation of GIP (glucose-dependent insulinotropic peptide), glucagon, or amylin and other receptors contribute to additional benefits, opening new horizons in the therapeutic individualization for persons living with obesity.
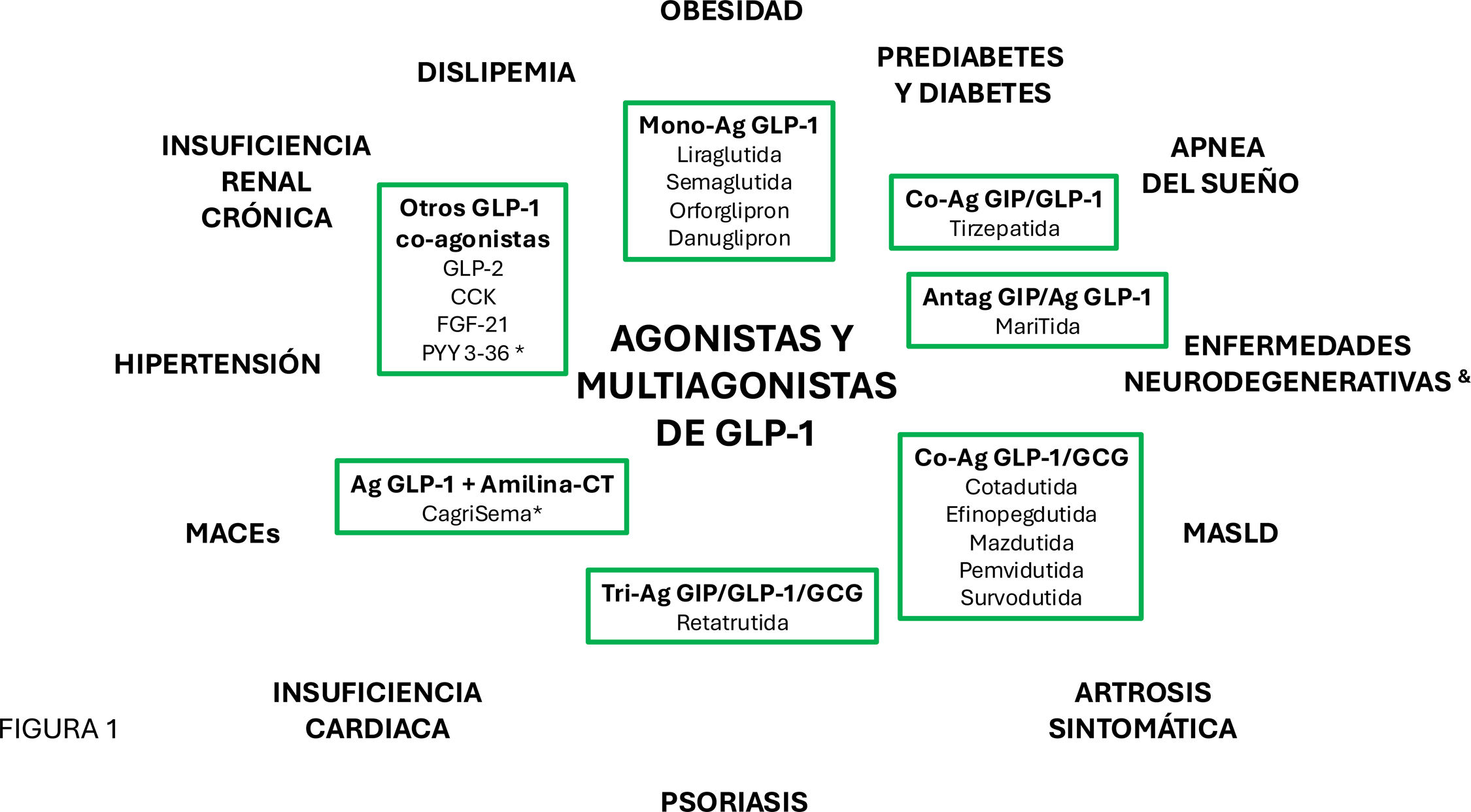
Las evidencias acumuladas en las últimas décadas respecto a la eficacia de los nuevos tratamientos farmacológicos de la obesidad han convertido a la molécula del péptido análogo al glucagón tipo1 (GLP-1) en un componente clave, ya sea en forma de monoagonistas, multiagonistas unimoleculares o combinaciones con efectos sobre diversos receptores1. Estos fármacos han permitido alcanzar objetivos previamente impensables sobre el exceso de peso y el control de diversas comorbilidades asociadas a la obesidad (fig. 1), lo que los ha llevado a ocupar un protagonismo prioritario en los avances presentes y futuros en el tratamiento de la obesidad.
Agonistas y multiagonistas del receptor de GLP-1 y otros receptores de estructura unimolecular o en combinación y las enfermedades sobre las que han mostrado eficacia en modelos clínicos o preclínicos.
CT: calcitonina; CCK: colecistoquinina; FGF-21: factor de crecimiento fibroblástico-21; GLP-2: péptido análogo al glucagón tipo2. MACEs: eventos adversos cardiovasculares mayores; MASLD: disfunción metabólica asociada a enfermedad hepática esteatósica; PYY 3-36: péptido tirosina-tirosina 3-36.
* Combinaciones de agonistas.
& Los agonistas de receptor de GLP-1 han mostrado efectos beneficiosos en modelos preclínicos de enfermedades neurodegenerativas, aunque el establecimiento de su eficacia clínica en la prevención y tratamiento requiere estudios adicionales.
GLP-1 7-36 es un péptido de 30 aminoácidos derivado de la molécula de proglucagón que se sintetiza en las célulasL intestinales, así como en las células alfa del páncreas y en grupos neuronales del sistema nervioso central (SNC)2. Es un péptido de vida media corta (2-3minutos), determinada por la rápida eliminación renal y por el efecto de la enzima dipeptidil peptidasa-4 (DPP-4), que degrada GLP-1 dando lugar a GLP-19-36, que no interacciona con el receptor de GLP-11.
El receptor de GLP-1 (GLP-1R) pertenece a la familia de receptores de glucagón acoplados a proteínaG de claseB2,3. La activación de la subunidad alfa (Gαs) se sigue de estimulación de adenilcilasa, síntesis de AMP cíclico, movilización de calcio intracelular y liberación de insulina por la célula beta pancreática de forma glucosa-dependiente2,3. La señalización intracelular incluye, adicionalmente, diversas vías, como el reclutamiento de beta arrestina-1, que modula la internalización del receptor y su desensibilización, así como los efectos de algunos agonistas del GLP-1R3,4. Dependiendo de la estructura del ligando, se modulan las vías de señalización intracelular hacia la generación de AMP cíclico, cascada de activación de quinasas (ERK) y reclutamiento de beta arrestina-1 que condiciona el efecto biológico y la desensibilización del receptor de GLP-14. Algunos agonistas de GLP-1R muestran un efecto sesgado relacionado con mayor priorización de la activación intracelular de AMP cíclico y menor reclutamiento de beta arrestina, que conducen a menor desensibilización del GLP-1R, resultando en una acción biológica más prolongada (tabla 1).
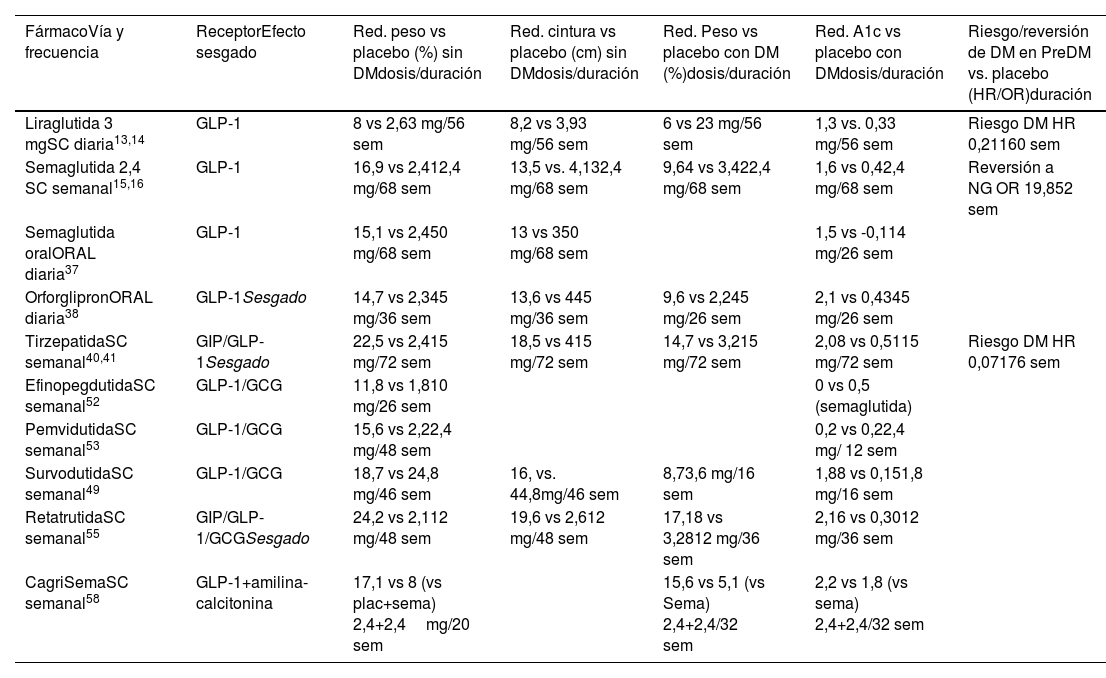
Vía de administración, periodicidad, efecto sesgado sobre el receptor de GLP-1 y acciones de fármacos basados en GLP-1 sobre reducción de peso, perímetro de cintura, HbA1c y riesgo/reversión de diabetes
| FármacoVía y frecuencia | ReceptorEfecto sesgado | Red. peso vs placebo (%) sin DMdosis/duración | Red. cintura vs placebo (cm) sin DMdosis/duración | Red. Peso vs placebo con DM (%)dosis/duración | Red. A1c vs placebo con DMdosis/duración | Riesgo/reversión de DM en PreDM vs. placebo (HR/OR)duración |
|---|---|---|---|---|---|---|
| Liraglutida 3 mgSC diaria13,14 | GLP-1 | 8 vs 2,63 mg/56 sem | 8,2 vs 3,93 mg/56 sem | 6 vs 23 mg/56 sem | 1,3 vs. 0,33 mg/56 sem | Riesgo DM HR 0,21160 sem |
| Semaglutida 2,4 SC semanal15,16 | GLP-1 | 16,9 vs 2,412,4 mg/68 sem | 13,5 vs. 4,132,4 mg/68 sem | 9,64 vs 3,422,4 mg/68 sem | 1,6 vs 0,42,4 mg/68 sem | Reversión a NG OR 19,852 sem |
| Semaglutida oralORAL diaria37 | GLP-1 | 15,1 vs 2,450 mg/68 sem | 13 vs 350 mg/68 sem | 1,5 vs -0,114 mg/26 sem | ||
| OrforglipronORAL diaria38 | GLP-1Sesgado | 14,7 vs 2,345 mg/36 sem | 13,6 vs 445 mg/36 sem | 9,6 vs 2,245 mg/26 sem | 2,1 vs 0,4345 mg/26 sem | |
| TirzepatidaSC semanal40,41 | GIP/GLP-1Sesgado | 22,5 vs 2,415 mg/72 sem | 18,5 vs 415 mg/72 sem | 14,7 vs 3,215 mg/72 sem | 2,08 vs 0,5115 mg/72 sem | Riesgo DM HR 0,07176 sem |
| EfinopegdutidaSC semanal52 | GLP-1/GCG | 11,8 vs 1,810 mg/26 sem | 0 vs 0,5 (semaglutida) | |||
| PemvidutidaSC semanal53 | GLP-1/GCG | 15,6 vs 2,22,4 mg/48 sem | 0,2 vs 0,22,4 mg/ 12 sem | |||
| SurvodutidaSC semanal49 | GLP-1/GCG | 18,7 vs 24,8 mg/46 sem | 16, vs. 44,8mg/46 sem | 8,73,6 mg/16 sem | 1,88 vs 0,151,8 mg/16 sem | |
| RetatrutidaSC semanal55 | GIP/GLP-1/GCGSesgado | 24,2 vs 2,112 mg/48 sem | 19,6 vs 2,612 mg/48 sem | 17,18 vs 3,2812 mg/36 sem | 2,16 vs 0,3012 mg/36 sem | |
| CagriSemaSC semanal58 | GLP-1+amilina-calcitonina | 17,1 vs 8 (vs plac+sema) 2,4+2,4mg/20 sem | 15,6 vs 5,1 (vs Sema) 2,4+2,4/32 sem | 2,2 vs 1,8 (vs sema) 2,4+2,4/32 sem |
DM: diabetes; HR: hazard ratio; OR: odds ratio; PreDM: prediabetes; Red: reducción. SC: subcutánea; sem: semanas; Sesgado: efecto sesgado sobre receptor de GLP-1 en la señalización intracelular.
Los GLP-1R se expresan a nivel de páncreas, linfocitos intraepiteliales intestinales, miocardio, tejido adiposo, riñón, hígado, vasos sanguíneos, pulmones y en el SNC2,3.
Aunque GLP-1 es conocido por su efecto incretínico, que comparte con el péptido insulinotrópico dependiente de la glucosa (GIP), la acción reguladora de la ingesta, esencial para su eficacia frente a la obesidad, tiene lugar merced a su interacción con receptores localizados en el SNC1,5. El péptido GLP-1 puede alcanzar el SNC a través de aferencias vagales periféricas que conducen su acción a través del ganglio nodoso al núcleo del tracto solitario (NTS). Por otra parte, el GLP-1 circulante penetra en áreas circunventriculares del SNC como el órgano subfornical, órgano vasculosum de la lámina terminalis, la eminencia media próxima al núcleo arcuato y el área postrema, merced a la permeabilidad parcial de la barrera hematoencefálica2,3,6. Además, las neuronas del NTS, que recogen aferencias de origen periférico, sintetizan pre-proglucagón y son fuente de GLP-1 en el propio SNC, que alcanza mediante vías neuronales receptores específicos localizados en estructuras clave en el control de la ingesta, como el núcleo paraventricular, el septo lateral, el núcleo accumbens y el núcleo parabraquial lateral2,3,6. Adicionalmente, favorece respuestas aversivas, inhibidoras de la neuroinflamación y del vaciamiento gástrico, así como estimuladoras del tono simpático y la termogénesis en modelo experimental2,4,6. La activación de GLP-1R localizados en neuronas del núcleo arcuato estimula la producción de pro-opiomelanocortina (POMC), que induce la inhibición de las neuronas productoras de neuropéptidoY (NPY), generando una respuesta inhibidora de la ingesta2. Se ha descrito la producción de GLP-1 en el bulbo olfatorio de significado incierto2,6.
Se han identificado GLP-1R en el nódulo sinoauricular, miocitos auriculares y ventriculares y endotelio vascular, cuya activación genera efectos antiinflamatorios, reductores del estrés oxidativo y antiaterogénicos, que sustentan los efectos cardioprotectores y nefroprotectores de los agonistas de GLP-1 (fig. 2)2,7,8. La representación de receptores de GLP-1 a nivel hepático es testimonial2, aunque existe un subconjunto de células γδT a nivel endotelial e intrahepático que expresan GLP-1R, cuya activación traduce un efecto antiinflamatorio9. La expresión de GLP-1R en tejido adiposo subcutáneo, visceral y epicárdico es conocida, aunque es controvertida a nivel de los adipocitos2,3.
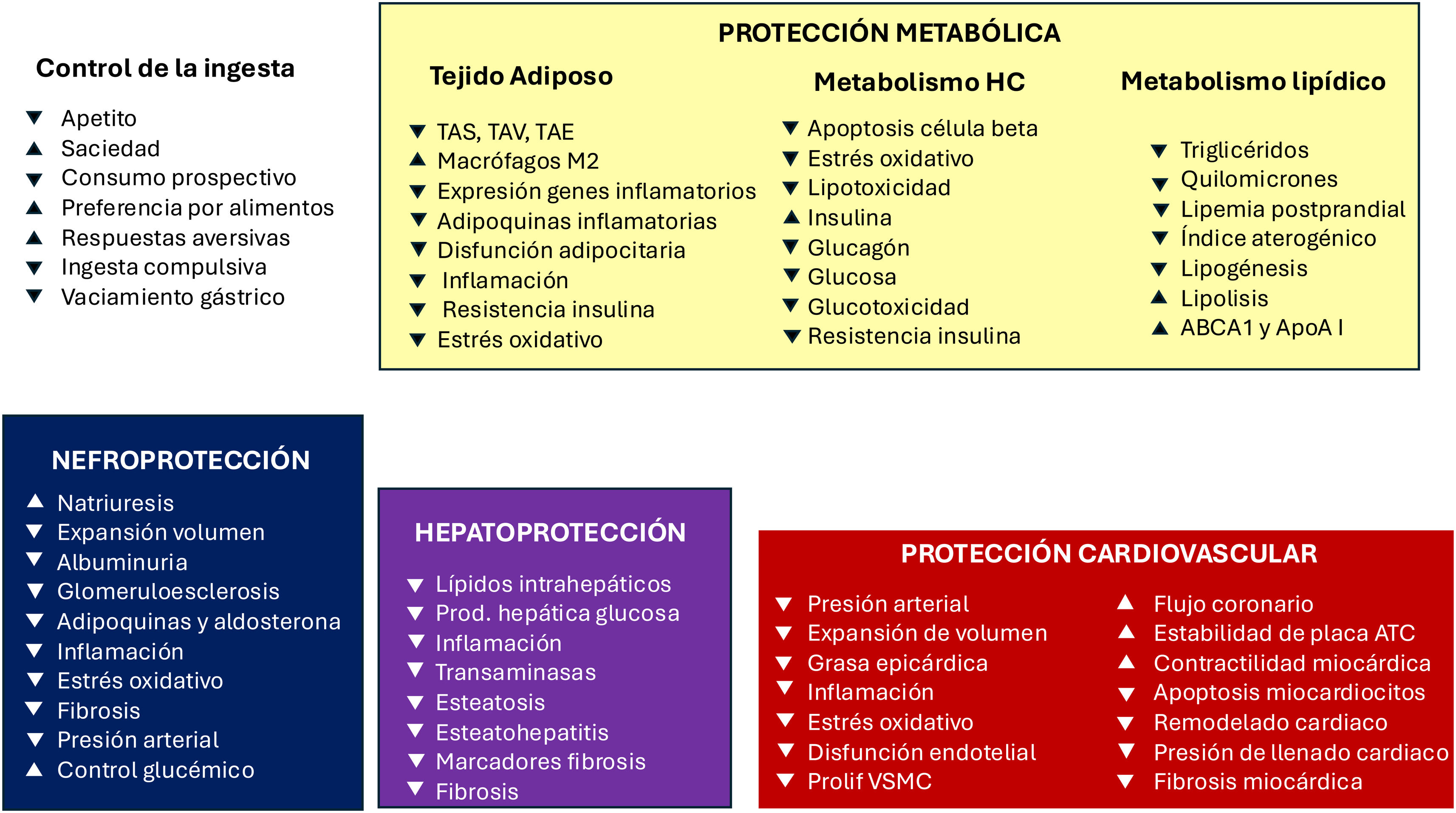
Mecanismos implicados en el control de la ingesta, protección metabólica, cardiovascular, hepatoprotección y nefroprotección de los agonistas del receptor de GLP-1. Las flechas indican incremento o disminución del efecto biológico.
ABCA1: proteína implicada en el transporte reverso de colesterol; ApoA1: apolipoproteína A1; Placa ATC: placa aterosclerótica; Prolif. VSMC: proliferación de células de músculo liso vascular; TAE: tejido adiposo epicárdico; TAS: tejido adiposo subcutáneo; TAV: tejido adiposo visceral.
La corta vida media del GLP-1 nativo y la ingeniería bioquímica propiciaron el desarrollo de agonistas del receptor de GLP-1 (AgGLP-1). La introducción de cambios en la cadena peptídica para reducir la degradación por DPP-4, junto a la acilación que facilita su unión no-covalente con la albúmina, resultó en formulaciones de acción prolongada, posibilitando su aplicación a la práctica clínica3,5. Inicialmente, se comercializaron monoagonistas de GLP-1R que tuvieron como objetivo el tratamiento de la diabetes tipo2, explotando el efecto incretínico y su carácter glucosa-dependiente, a lo que se añadió la acción reductora del peso corporal y sus efectos sobre comorbilidades asociadas1,3,5. Posteriormente, la investigación puso el foco sobre la obesidad, empleando dosis más elevadas que las empleadas para la diabetes3,5. Seguidamente, se diseñaron estructuras unimoleculares de efecto multirreceptor como los coagonistas GIP/GLP-1, GLP-1/glucagón (GCG) y triagonistas GIP/GLP-1/GCG, generándose también formulaciones de administración oral1,3,5.
Monoagonistas del receptor de GLP-1 para el tratamiento de la obesidad: liraglutida y semaglutidaLa primera molécula que se comercializó para el tratamiento de la obesidad fue liraglutida (LIRA), de administración subcutánea diaria, que alcanzó el mercado en 2014. Posteriormente, semaglutida (SEMA), un AgGLP-1 de inyección semanal, se comercializó en 20211,3.
Estructura y mecanismo de acciónTanto LIRA como SEMA son AgGLP-1 de administración subcutánea que mantienen una homología del 97% y del 94%, respectivamente, en relación con la molécula nativa de GLP-1. Su vida media alcanza 13horas (LIRA) y 7días (SEMA), posibilitando la administración subcutánea diaria y semanal, respectivamente, merced a las modificaciones estructurales indicadas5,10.
Efectos sobre la obesidad y el control glucémicoTanto LIRA 3mg como SEMA 2,4mg han demostrado un potente efecto inhibidor del apetito y estimulador de la saciedad, así como retardador del vaciamiento gástrico11,12. El programa SCALE puso de manifiesto la eficacia de LIRA 3mg en la reducción ponderal y del perímetro de cintura13, confirmándose la disminución de HbA1c en personas con diabetes y la reducción de la transición de prediabetes a diabetes tras tres años de tratamiento14 (tabla 1). El programa STEP demostró pérdida ponderal de hasta el 16,9% en un año de tratamiento con SEMA 2,4mg a expensas predominantemente de masa grasa (diferencia frente a placebo masa grasa: −3,29%; masa magra +2,94%)15 con clara superioridad de SEMA 2,4mg respecto a LIRA 3mg (15,8 frente a 6,4%) en el estudio STEP816.
La probabilidad de revertir la diabetes por SEMA 2,4mg se mostró claramente superior a placebo en el estudio STEP1017 (tabla 1).
Los mecanismos que median en la inhibición de la ingesta se relacionan con las vías neuronales que regulan su control a nivel del SNC. La administración periférica de LIRA se sigue de su localización a nivel de los órganos circunventriculares y el núcleo arcuato hipotalámico, donde favorece la activación de vías anorexigénicas e inhibición de las orexigénicas, merced a la estimulación de neuronas productoras de Pro-opiomelanocortina/Transcripto cocaína-anfetamina (POMC/CART) y la inhibición indirecta del eje orexiante NeuropéptidoY/Proteína relacionada con Agouti (NPY/AgRP) a través de mecanismos gabaérgicos18. La parcial permeabilidad de la barrera hematoencefálica en estructuras circunventriculares y núcleo arcuato, junto a la potencial participación GLP-1R dependiente de los tanicitos, permite el acceso de LIRA y SEMA a estructuras esenciales en el control de la ingesta.
El mapa de distribución de SEMA en el SNC revela mayor representación en los núcleos septales respecto a LIRA19. Además de reducir la ingesta, se muestra eficaz en modular la preferencia por tipos de alimento12 en relación con activación dopaminérgica del área ventral tegmental y reducción del tono endocannabinoide19. La activación secundaria del núcleo parabraquial y de otros circuitos neuronales relacionados con las vías de control hedónico de la ingesta puede ser propia de SEMA y contribuir a explicar las diferencias con LIRA19.
Los mecanismos implicados en la mejoría del control glucémico por LIRA 3mg y SEMA 2,4mg se relacionan con sus efectos incretínicos y glucagonostáticos propios del agonismo de GLP-13 y los derivados de la reducción ponderal, de masa grasa y sus consecuencias20.
Efectos sobre otras comorbilidades.El programa SCALE demuestra el descenso en el índice apnea-hipopnea en casos de síndrome de apnea del sueño por parte de LIRA frente a placebo (12,2 vs. 6,1. p=0,015)21. La participación de la pérdida de peso en los efectos del tratamiento con LIRA en el programa SCALE es variable, encontrándose en torno al 100% en resultados sobre fracciones lipídicas, presión arterial e índice apnea-hipopnea y alrededor del 30% en los efectos sobre el metabolismo hidrocarbonado, en probable relación con el efecto incretínico del fármaco20.
La potencialidad demostrada por SEMA de reducir la acumulación adiposa a nivel lingual puede representar un mecanismo adicional a la pérdida de peso para mejorar el control de la apnea del sueño22.
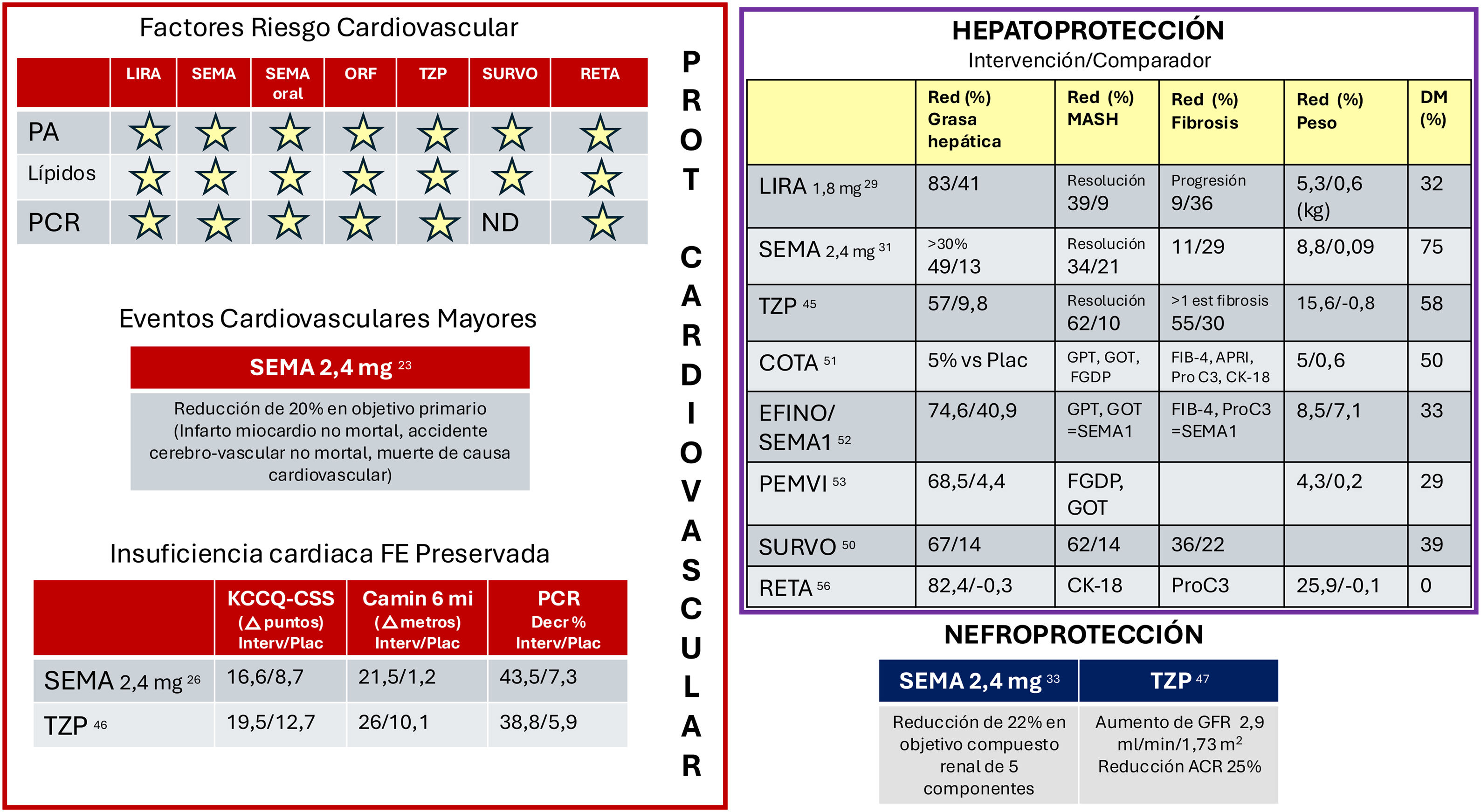
El programa SCALE también puso de manifiesto la capacidad de LIRA 3mg de mejorar los factores de riesgo cardiovascular (FRCV), incluyendo la presión arterial, el perfil lipídico y los marcadores de inflamación13.
Los efectos sobre control glucémico y FRCV asociados a SEMA 2,4mg en el programa STEP son cualitativamente similares, pero cuantitativamente superiores a los observados con LIRA 3mg, en posible relación con la diferente pérdida ponderal16.
El estudio SELECT, realizado con SEMA 2,4mg, mostró coherentemente una reducción de eventos cardiovasculares adversos mayores (major adverse cardiac events [MACE]) de triple objetivo compuesto (infarto de miocardio no mortal, accidente cerebrovascular no mortal, mortalidad cardiovascular) del 20% respecto a placebo en una población con enfermedad cardiovascular establecida e IMC superior a 27kg/m2 sin diabetes tras 39,8meses de seguimiento23.
Aun cuando no puede descartarse una participación directa de SEMA, la influencia de la reducción adiposa y la mejoría de la disfunción adipocitaria contribuyen probablemente al perfil evolutivo de los factores de riesgo cardiovascular.
Sin embargo, la pérdida de peso en el estudio SELECT alcanzó un 9,4%, inferior a la observada en estudios previos del programa STEP23. El diseño del estudio, no orientado al tratamiento de la obesidad, pudo influir en la reducción ponderal inferior a lo esperado, que no mostró paralelismo con la evolución de la reducción de MACE. La precocidad de la separación de las curvas de aparición de MACE entre los brazos de SEMA y placebo23 sugiere una potencial participación directa de SEMA en los resultados del estudio SELECT, a través de efectos promotores de angiogénesis y reducción de estrés oxidativo e inflamación, en el contexto de acciones antiaterogénicas derivadas de la activación del GLP-1R que favorecen la función endotelial y la supervivencia celular7 (fig. 2). Tampoco los cambios en HbA1c a lo largo del estudio se asociaron con la reducción de MACE24.
Adicionalmente, los múltiples efectos pleiotrópicos de SEMA sobre la función metabólica, hepática y renal pueden contribuir de forma indirecta a la protección cardiovascular25.
El programa HFpEF muestra mejoría sintomática significativa de los síntomas de insuficiencia cardiaca con fracción de eyección preservada (ICFEp) en pacientes con obesidad tratados con SEMA 2,4mg26 (fig. 3). Además de la pérdida ponderal significativa, se observaron descensos del marcador inflamatorio proteína C reactiva y del marcador NT-proBNP26.
Efectos clínicos implicados en la protección cardiovascular, hepática y renal de los agonistas de GLP-1, coagonistas GIP/GLP-1 y GLP-1/glucagón y triagonistas GIP/GLP-1/glucagón. La estrella indica reducción de factores de riesgo cardiovascular.
ACR: cociente albúmina/creatinina; APRI: fracción GOT/plaquetas; Camin 6min: variación en distancia recorrida en 6minutos; CK-18: citoqueratina 18; COTA: cotadutida; DM: diabetes mellitus; EFINO: efinopegdutida; FE: fracción de eyección; FGDP: fracción de grasa por densidad protónica en resonancia magnética; FIB-4: índice de fibrosis; KCCQ-CSS: variación de la puntuación clínica del cuestionario de cardiomiopatía Kansas City; LIRA: liraglutida; ND: no disponible; ORF: orforglipron; PA: presión arterial; PCR: proteína C reactiva; PEMVI: pemvidutida; Pro C3: marcador de síntesis de colágenoIII. RETA: retatrutida; SEMA: semaglutida subcutánea semanal 2,4mg; SEMA oral: semaglutida oral diaria; SEMA1: semaglutida semanal 1mg; SURVO: survodutida; TZP: tirzepatida.
Entre los mecanismos operativos, se postulan efectos protectores de SEMA sobre el remodelado cardiaco con disminución de la hipertrofia y la fibrosis con mejoría de la función mitocondrial, de la función microvascular y la reducción de apoptosis demostrados tanto en modelo experimental como clínico27,28, así como otros efectos metabólicos relacionados con la reducción de masa grasa (fig. 2).
LIRA a dosis de 1,8mg diarios induce mejoría de la enfermedad esteatósica hepática asociada a disfunción metabólica (MASLD) con resolución de esteatohepatitis en el 39% de los casos, mientras que la fibrosis progresó en el 9% de los pacientes, frente al 36% tratados con placebo29 (fig. 3).
Los estudios de SEMA en la enfermedad hepática metabólica mostraron mejoría de la esteatohepatitis en administración diaria, pero no tan satisfactorios respecto a la mejoría de fibrosis en estadio F2-F3 o F430 o con dosis semanal de 2,4mg durante 72semanas31. Son muy esperados los resultados del nuevo ensayo ESSENCE, en faseIII, con SEMA 2,4mg durante 240semanas.
Los mecanismos implicados en las acciones beneficiosas de los agonistas del receptor de GLP-1 sobre MASLD son indirectos, dada la práctica ausencia de GLP-1R en los hepatocitos, salvo los correspondientes a las células γδT que se asocian con efecto antiinflamatorio9. Incluyen la reducción de masa grasa, el aumento en la sensibilidad hepática a la insulina, la reducción de la lipotoxicidad tisular, el efecto antiinflamatorio y la mejoría de la función mitocondrial32 (fig. 2).
SEMA, como tratamiento de la obesidad, ha mostrado efectos nefroprotectores con disminución del 22% del objetivo renal compuesto en el estudio SELECT33 en pacientes sin diabetes, abogando por la utilidad de SEMA en el tratamiento del síndrome cardio-reno-metabólico. Tanto LIRA como SEMA han demostrado efectos nefroprotectores en personas con diabetes, sugiriendo que la presión sistólica y el valor de HbA1c, y no tanto el peso, son los mediadores más influyentes, si bien otros elementos también juegan un papel (fig. 2).
Algunos datos sugieren posibles efectos neuroprotectores de LIRA Y SEMA en enfermedades neurodegenerativas34 a través de diversos mecanismos potenciales relacionados con la insulinosensibilidad, antiinflamación e inhibición del estrés oxidativo mediados por GLP-1R presentes también en astrocitos y microglía. Estos hallazgos pueden sustentar futuras aplicaciones en el tratamiento de demencias y otras enfermedades neurodegenerativas.
Los efectos de los AgGLP-1 sobre la obesidad, la resistencia insulínica, la inflamación, la apnea del sueño y otros FRCV posicionan favorablemente a este grupo de fármacos para el tratamiento del síndrome del ovario poliquístico y de la infertilidad asociada a obesidad35.
SEMA 2,4mg se ha mostrado eficaz en reducir los síntomas de artrosis de rodilla en personas con obesidad tras 68semanas de tratamiento, en probable relación con la reducción ponderal, de la disfunción adipocitaria y del efecto antiinflamatorio de la molécula36.
También se han descrito efectos favorables de SEMA en pacientes con hidradenitis supurativa y en afectados de psoriasis, en probable relación con su efecto antiinflamatorio.
Monoagonistas del receptor de GLP-1 orales: semaglutida, orforglipron y danuglipronSemaglutida oral se formula en una tableta con un incrementador de absorción que facilita su paso a través de la mucosa gástrica. Se encuentra disponible para el tratamiento de la diabetes tipo2. En personas con obesidad, a dosis de 50mg diarios, se alcanza una reducción del 17,4% de peso a lo largo de 68semanas de tratamiento en el estudio OASIS137 (tabla 1) en relación con su efecto supresor del apetito y estimulador de la saciedad. Simultáneamente, se muestra eficaz en la reducción de FRCV y PCR, confirmando un efecto antiinflamatorio de la molécula37.
Orforglipron y danuglipron son agonistas sesgados del receptor de GLP-1 de estructura no peptídica y pequeño tamaño de administración oral diaria. Generan una señalización intracelular que restringe el reclutamiento de beta arrestina-1, dando lugar a menor desensibilización del receptor de GLP-1 y mayor producción de AMP cíclico4. En contraste con SEMA oral, orforglipron no requiere condiciones especiales previas a su administración. La reducción ponderal es dosis-dependiente y alcanza el 15,4% a 36semanas (tabla 1) sin evidencia de meseta, que se acompaña de reducción de FRCV38 (fig. 3).
Coagonistas GIP/GLP-1: tirzepatidaEstructura y mecanismo de acciónTirzepatida (TZP) es el único fármaco comercializado de estas características. Se trata de una formulación unimolecular basada en la estructura de GIP con modificaciones estructurales de la cadena peptídica que permite la interacción con receptores de GLP-1 y GIP39. La acción biológica sobre el receptor de GIP es superior a la correspondiente sobre el receptor de GLP-1, en razón 5/139.
Efectos sobre la pérdida de peso, composición corporal y prevención de diabetesEl programa SURMOUNT muestra que TZP reduce el peso de forma dosis-dependiente, alcanzando un 22,5% de reducción ponderal con la dosis máxima semanal de 15mg40 (tabla 1). Se acompaña de reducción de tejido adiposo visceral y grasa hepática con leve aumento proporcional de tejido adiposo subcutáneo en pacientes con obesidad y diabetes, sugiriendo cierta selectividad compartimental. Adicionalmente, induce un efecto muy favorable sobre la prevención de diabetes en personas con prediabetes (HR: 0,07 respecto a placebo)41 (tabla 1).
El agonismo GIP potencia el efecto incretínico y anorexiante de GLP-1 a nivel central, reduciendo el desarrollo de náuseas (tabla 2)1,3,5. El efecto sobre el receptor de GLP-1 resulta sesgado debido a la estructura de TZP con menor reclutamiento de beta arrestina-142, contribuyendo a una mayor potencia del efecto biológico.
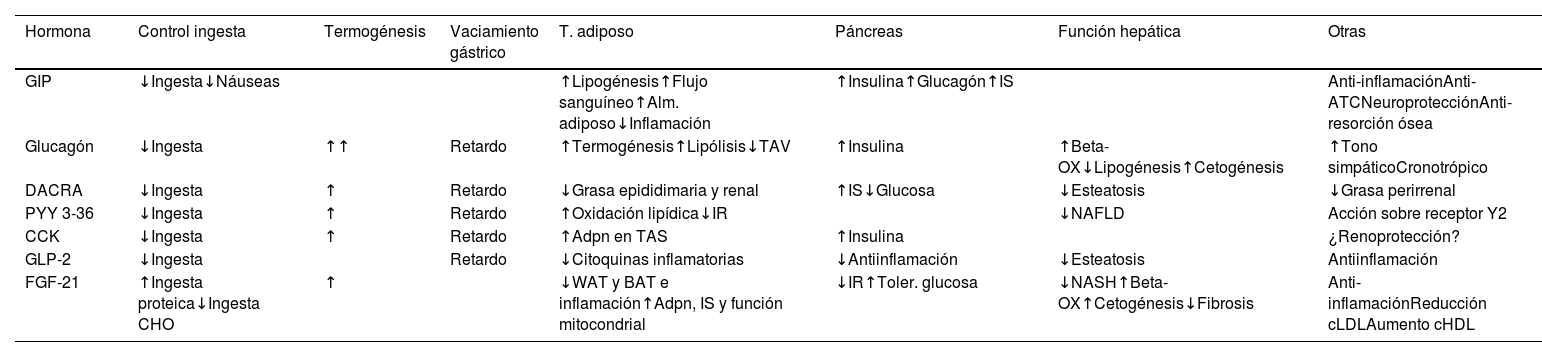
Efectos de los actuales y potenciales componentes asociados a GLP-1 en el contexto de fármacos multiagonistas y combinaciones
| Hormona | Control ingesta | Termogénesis | Vaciamiento gástrico | T. adiposo | Páncreas | Función hepática | Otras |
|---|---|---|---|---|---|---|---|
| GIP | ↓Ingesta↓Náuseas | ↑Lipogénesis↑Flujo sanguíneo↑Alm. adiposo↓Inflamación | ↑Insulina↑Glucagón↑IS | Anti-inflamaciónAnti-ATCNeuroprotecciónAnti-resorción ósea | |||
| Glucagón | ↓Ingesta | ↑↑ | Retardo | ↑Termogénesis↑Lipólisis↓TAV | ↑Insulina | ↑Beta-OX↓Lipogénesis↑Cetogénesis | ↑Tono simpáticoCronotrópico |
| DACRA | ↓Ingesta | ↑ | Retardo | ↓Grasa epididimaria y renal | ↑IS↓Glucosa | ↓Esteatosis | ↓Grasa perirrenal |
| PYY 3-36 | ↓Ingesta | ↑ | Retardo | ↑Oxidación lipídica↓IR | ↓NAFLD | Acción sobre receptor Y2 | |
| CCK | ↓Ingesta | ↑ | Retardo | ↑Adpn en TAS | ↑Insulina | ¿Renoprotección? | |
| GLP-2 | ↓Ingesta | Retardo | ↓Citoquinas inflamatorias | ↓Antiinflamación | ↓Esteatosis | Antiinflamación | |
| FGF-21 | ↑Ingesta proteica↓Ingesta CHO | ↑ | ↓WAT y BAT e inflamación↑Adpn, IS y función mitocondrial | ↓IR↑Toler. glucosa | ↓NASH↑Beta-OX↑Cetogénesis↓Fibrosis | Anti-inflamaciónReducción cLDLAumento cHDL |
Adpn: adiponectina; BAT: tejido adiposo marrón; Beta OX: beta oxidación de ácidos grasos; CCK: colecistoquinina; DACRAs: agonistas duales amilina/calcitonina; FGF 21: factor de crecimiento fibroblástico 21; GCG: glucagón; GIP: polipéptido insulinotrópico dependiente de la glucosa; GLP-2: péptido análogo al glucagón tipo2; IR: resistencia insulínica; IS: sensibilidad insulínica; NAFLD: enfermedad hepática grasa no alcohólica; NASH: esteatohepatitis no alcohólica; PYY 3-36: péptido tirosina-tirosina; TAV: tejido adiposo visceral; WAT: tejido adiposo blanco.
Las flechas indican aumento o disminución.
A nivel de tejido adiposo, la contribución del agonismo GIP y GLP-1 reduce la infiltración de macrófagos M1 y de citoquinas proinflamatorias como leptina, aumenta la adiponectina e incrementa la insulinosensibilidad, mejorando la disfunción adipocitaria39. GIP añade mayor capacidad de almacenamiento a nivel del tejido adiposo, que disminuye la probabilidad de que se produzcan depósitos adiposos ectópicos, reduciendo la magnitud de grasa visceral1,5,39. Adicionalmente, ha demostrado efectos neuroprotectores y promotores de la osteoformación1 (tabla 2).
Efectos sobre otras comorbilidadesEl tratamiento con TZP se acompaña de reducción de FRCV (fig. 3) y aumento de calidad de vida40. A falta de los resultados de los estudios de seguridad cardiovascular en obesidad (SURMOUNT MMO) y diabetes (SURPASS-CVOT), TZP ha mostrado en el ensayo SURMOUNT-1 una reducción de la predicción a 10 años de riesgo en pacientes con obesidad y riesgo inicial intermedio-alto de enfermedad cardiovascular43.
El tratamiento con TZP es eficaz en la reducción del índice apnea-hipopnea de hasta 23 eventos por hora, así como de la presión arterial, proteína C reactiva y sintomatología relacionada con la mala calidad del sueño (escalas PROMIS Sleep), en probable relación con la pérdida de peso y la mejoría de la disfunción adipocitaria44. Por otra parte, TZP induce remisión de la esteatohepatitis asociada a disfunción metabólica (MASH) confirmada histológicamente de forma dosis-dependiente (44-62% de casos, según dosis) y mejoría de al menos un estadio de fibrosis hepática en el 51-55% de los casos, cifras superiores a placebo45 (fig. 3). Además de la reducción ponderal, que pudiera aumentar con la duración del tratamiento, la participación del agonismo GIP puede potenciar la sensibilidad insulínica, el flujo sanguíneo y la capacidad de almacenamiento adiposo32 (tabla 2). El estudio SUMMIT revela que el tratamiento con TZP mejora la sintomatología y reduce en un 38% el objetivo combinado de mortalidad cardiovascular y evento de empeoramiento de insuficiencia cardiaca en pacientes con ICFEp46 (fig. 3). A 52semanas se observa reducción del volumen circulante y de la presión arterial, en relación con la reducción de adipoquinas y aldosterona, acompañado de disminución de albuminuria y aumento de filtrado glomerular respecto a placebo, sugiriendo beneficio renal añadido47.
Antagonista GIP - agonista GLP-1: MariTidaEste fármaco (Maridebart-cafraglutida o AMG133), que es un conjugado de un anticuerpo monoclonal frente al receptor de GIP y dos moléculas de agonista del receptor de GLP-1, es eficaz en reducir el peso corporal en ratones y monos cinomolgus con obesidad. Los resultados del estudio en fase1 en humanos muestran pérdidas de peso del 14% en 30días con descensos en glucosa, glucagón y proteína C reactiva y un perfil de seguridad aceptable48. Permite administración subcutánea mensual. Aunque el mecanismo de acción no es completamente conocido, pudiendo verse implicados mecanismos relacionados con los receptores de GLP-1 y GIP, los resultados iniciales muestran perspectivas alentadoras en el tratamiento de la obesidad.
Coagonistas GLP-1/glucagónEl desarrollo de estas formulaciones unimoleculares con efecto sobre los receptores de GLP-1 y glucagón aporta potenciación del efecto anorexiante de GLP-1, efecto lipolítico e inhibidor de la lipogénesis (tabla 2), particularmente a nivel hepático, y acción termogénica, facilitando la reducción ponderal y el tratamiento de MASLD1,5,35.
Survodutida genera reducción ponderal dosis-dependiente de hasta el 14,9% en 46semanas49. Se muestra eficaz en la reducción de grasa hepática y mejoría de MASH hasta en el 62% de los participantes tratados con inyección semanal de 4,8mg. La mejoría de al menos un estadio en la fibrosis hepática se puso de manifiesto hasta en el 36% de los pacientes50.
Cotadutida es un coagonista GLP-1/GCG equilibrado derivado de oxintomodulina de administración diaria que ha demostrado un moderado efecto reductor de peso en pacientes con diabetes y obesidad, con capacidad de disminuir la fracción hepática de grasa evaluada mediante densidad protónica por resonancia magnética, así como marcadores de daño hepático y fibrosis51.
Entre otros fármacos se encuentran efinopegdutida, un péptido derivado de la oxintomodulina conjugado con fragmento Fc de IgG4 humana de administración mensual, pemvidutida y mazdutida, que poseen efectos reductores de peso (tabla 1) y de grasa hepática (fig. 3)52,53.
Triagonistas GIP/GLP-1/glucagón: retatrutidaRetatrutida es el triagonista GLP-1-GIP-GCG más estudiado en el momento actual. Se deriva de la molécula de GIP sobre la que se han realizado modificaciones en la cadena peptídica que aportan capacidad de interacción con los receptores de GIP, GLP-1 y GCG. Posee efecto sesgado sobre la interacción de GLP-1R54.
Su mecanismo de acción y efectos se derivan de la potenciación del efecto anorexiante de sus tres componentes, manteniendo el retraso en el vaciamiento gástrico, a lo que añade el efecto incretínico, insulinosensibilizador, de acumulación en tejido adiposo subcutáneo de GIP y la capacidad termogénica y lipolítica de GCG (tabla 2)54. Su estructura resiste la degradación por DPP-4 y permite el enlace con la albúmina, así como una vida media de 6días, lo que posibilita su administración semanal por vía subcutánea. El efecto de la interacción con el receptor de GIP es superior al que resulta de las correspondientes a GLP-1 y GCG con sus receptores.
Hoy en día es el fármaco que en faseII induce mayor reducción de peso, con un 24% (28,5% en mujeres) tras 48semanas con una dosis semanal de 12mg55 (tabla 1), alcanzando importantes beneficios en el control de FRCV y en la reducción de MASLD56 (fig. 3). Se asocia con descensos del 82,4% de grasa hepática con normalización en el 86% con dosis semanal de 12mg en 24semanas, en relación con la reducción de tejido adiposo visceral, mejoría de insulinosensibilidad, reducción de leptina, aumento de adiponectina y evolución favorable de parámetros del metabolismo lipídico y marcadores de fibrosis como Pro-C356.
Análogos de amilina en combinación con agonistas de receptor de GLP-1: CagriSemaLa amilina es un péptido de 37 aminoácidos que se co-secreta con insulina por las células beta pancreáticas57. Posee comunidad estructural con los péptidos de la familia de calcitonina. Ejerce un efecto saciante mediado por receptores que se expresan en el área postrema y que envían señales a otras estructuras relacionadas con el control de la ingesta, como el núcleo del tracto solitario, el núcleo lateral parabraquial, el área tegmental ventral y el núcleo arcuato en el hipotálamo57. Parte de las acciones de la amilina son mediadas por interacción con receptores del péptido relacionado con el gen de calcitonina (CGRP), por lo que se considera un agonista dual amilina-calcitonina (DACRA)57.
Cagrilintida es un DACRA de larga duración que ha sido evaluado en monoterapia y combinado con semaglutida (CagriSema) en el control del peso corporal en personas con sobrepeso u obesidad, alcanzando a dosis máximas de ambos péptidos (2,4mg semanales) una reducción de peso del 17,1% en 20semanas58. También se ha demostrado eficaz en personas con obesidad y diabetes tipo2, con reducción ponderal inferior.
Amicretina es una formulación unimolecular de administración oral que interacciona con receptores de amilina y GLP-1 que se encuentra en fase de desarrollo.
La combinación de acciones de agonistas GLP-1, GIP y/o GCG con amilina mediante la incorporación de cagrisemaglutida o amicretina permite vislumbrar el desarrollo de nuevos multiagonistas como tratamientos para la obesidad, la diabetes tipo2 y posiblemente otras enfermedades crónicas.
Otros fármacos en desarrolloOtros multiagonistas basados en GLP-1 con otros péptidos, como GIP, GCG, PYY, secretina, GLP-2, así como nuevos triagonistas y tetraagonistas (añadiendo agonismo DACRA), se encuentran en fases iniciales de su desarrollo1,59 (tabla 2). Estas moléculas potencian y complementan los efectos de GLP-1, mostrando perspectivas alentadoras que deberán confirmarse a lo largo de su desarrollo.
Perspectivas futurasHoy en día, el arsenal farmacológico disponible contempla el abordaje de nuevas patologías, como la enfermedad arterial periférica o las afecciones neurodegenerativas, lo que refrenda el papel de las enfermedades metabólicas en la fisiopatología de diversos trastornos con un profundo impacto en la calidad y la expectativa de vida de la población60.
Los avances en el conocimiento y en la ingeniería bioquímica anticipan la actuación a diferentes niveles sobre la prevención y el tratamiento de diversas complicaciones, y favorecen la individualización terapéutica. Estos progresos pueden cambiar la historia natural de muchas enfermedades tal y como las conocemos y, ayudados de la tecnología, dar un gran paso hacia una nueva era en la medicina de precisión.
FinanciaciónEl presente artículo no recibió financiación alguna para su desarrollo o elaboración.
Consideraciones éticasDado su carácter de revisión y la no participación de pacientes o procedimientos, no aplica la necesidad del consentimiento informado.
Conflicto de interesesParticipación en actividades docentes financiadas por Laboratorios Novo Nordisk, Laboratorios Lilly y Laboratorios Boehringer Ingelheim, llevadas a cabo como coordinador, ponente o moderador de reuniones científicas.