Fig. 1. La proteína HFE en su componente extracelular está compuesta por 3 dominios #*#, uno de los cuales (el #*##3#) se acopla a la ß#2#-microglobulina; también consta de una región transmembrana y una corta cola citoplasmática.
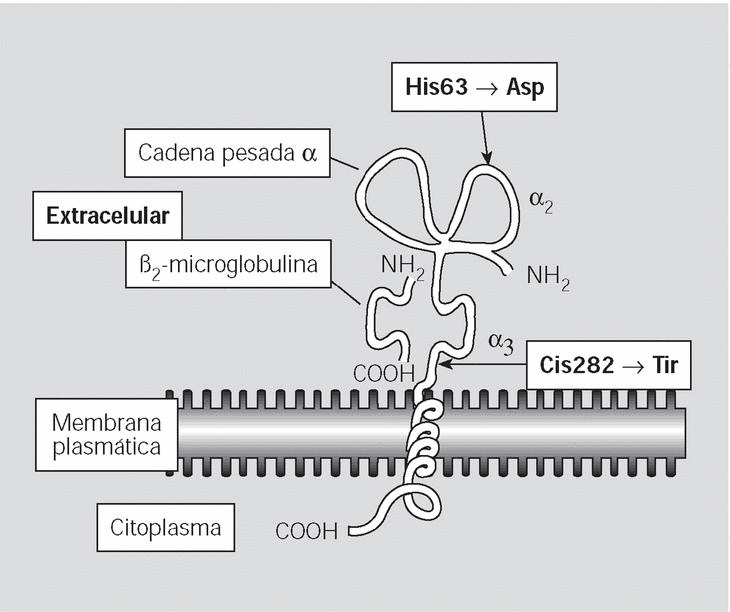
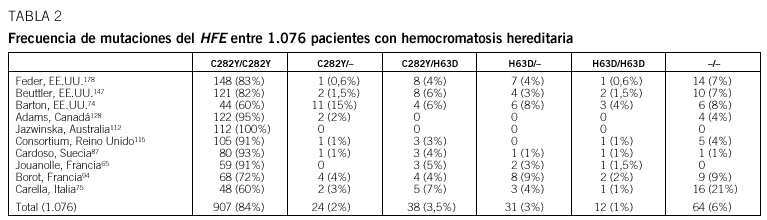
Fig. 2. El hierro férrico en la sangre se acopla a la transferrina (Tf). La transferrina con 2 moléculas de hierro (transferrina diférrica) se acopla al receptor de la transferrina (TfR) en la membrana plasmática celular siendo introducidas mediante vesículas endosómicas. Al acidificarse, los iones férricos son liberados del complejo TfR-transferrina. El hierro férrico es reducido a hierro ferroso y transportado al citoplasma por medio de un transportador de hierro DMT1 en la membrana endosómica. El hierro citoplasmático está disponible para los requerimientos metabólicos o para almacenarse en forma de ferritina. El TfR con la transferrina es reciclado a la membrana celular donde las moléculas de transferrina son liberadas a la circulación. (Modificado de Harford y Klausner#11#.)
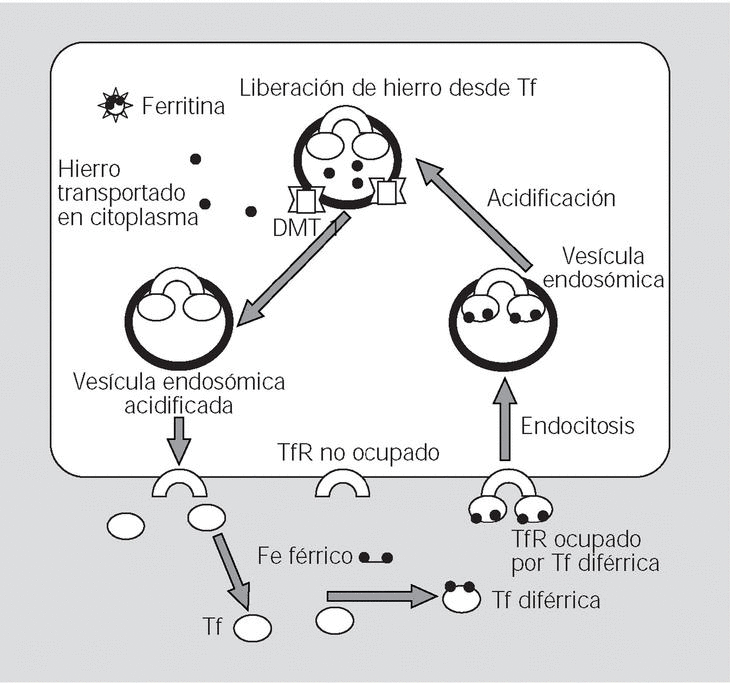
Fig. 3. En el intestino el hierro férrico es primero reducido a hierro ferroso por la ferrireductasa, tras lo cual es transportado por el gen DMT1 (transportador de metales divalentes) situado en la porción apical del enterocito; en el enterocito el hierro es oxidado a hierro férrico, y transportado a la circulación mediante un transportador de hierro denominado hephaestina (análogo de la ceruloplasmina y que se comporta como una ferroxidasa) situado en la membrana basolateral. En lo profundo de la cripta, el HFE ligado al TfR modula la captación de transferrina. Las concentraciones de hierro citoplásmico actúan a través del acoplamiento de iron regulatory protein (IRP) a iron responsive element (IRE) sobre la producción del ARN mensajero del transportador DMT1. (Modificado de Bacon et al#3# y Andrews#10#.)
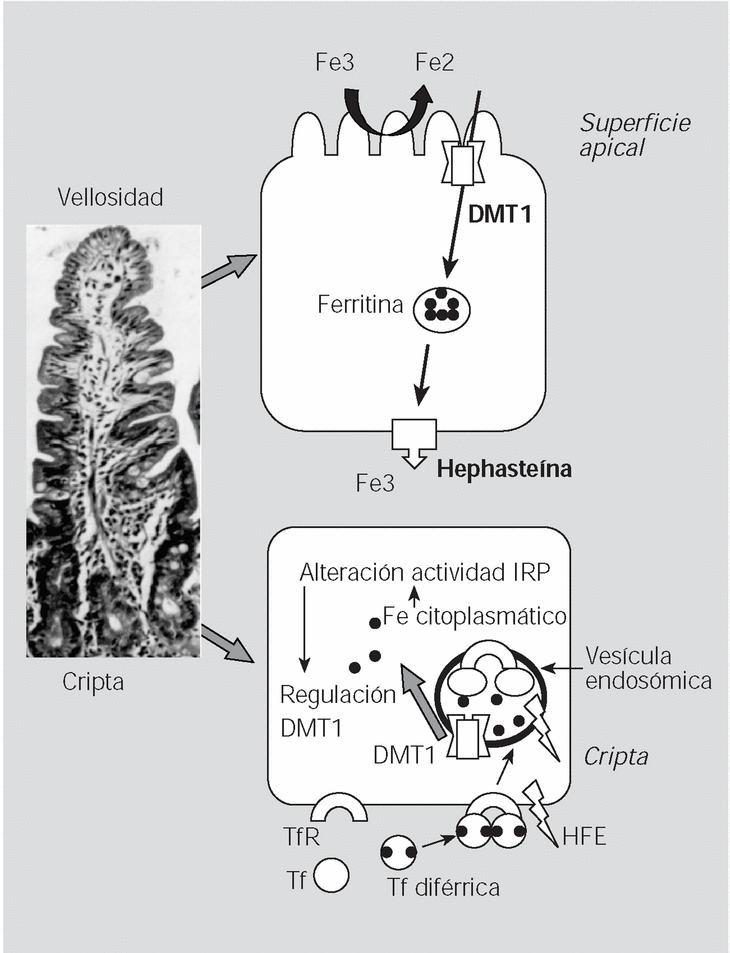
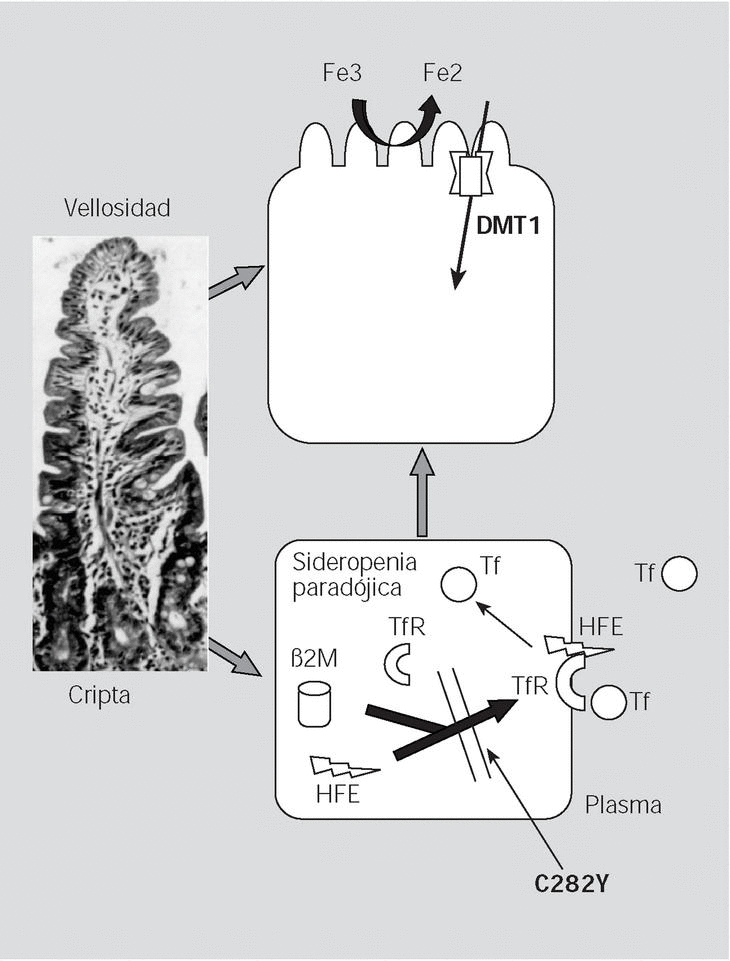
Fig. 4. La mutación C282Y, al impedir la unión de la beta-2-microglobulina a la proteína HFE, hace que ésta no pueda ser transferida a la membrana plasmática basolateral y se quede en el citosol, pudiendo impedir la captación de hierro mediada por el TfR en las células de las criptas, y así dar una falsa señal de que los depósitos de hierro en el enterocito están bajos (sideropenia paradójica); como resultado de los bajos valores de hierro intracelular, los enterocitos emigrando a lo alto de las vellosidades aumentarían la producción de DMT1 en los enterocitos maduros y en consecuencia captarían más hierro.
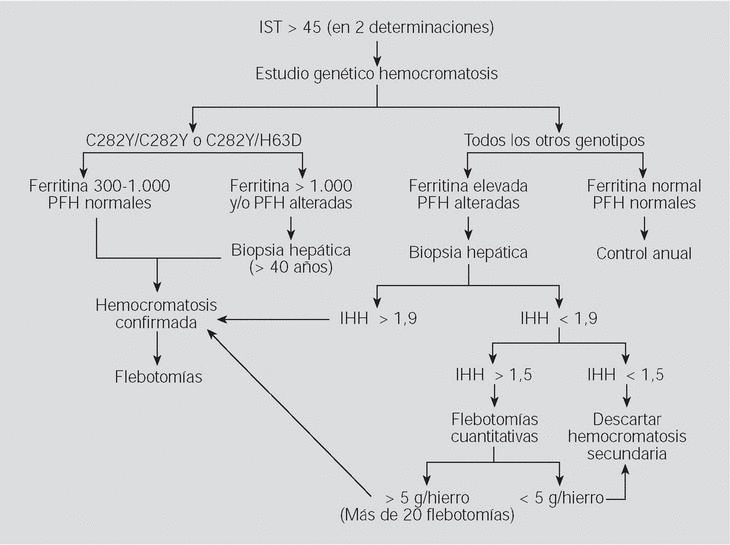
Fig. 5. Algoritmo para evaluar una posible hemocromatosis en una persona con historia familiar negativa. Pruebas funcionales hepáticas (PFH). Índice de hierro hepático (IHH).
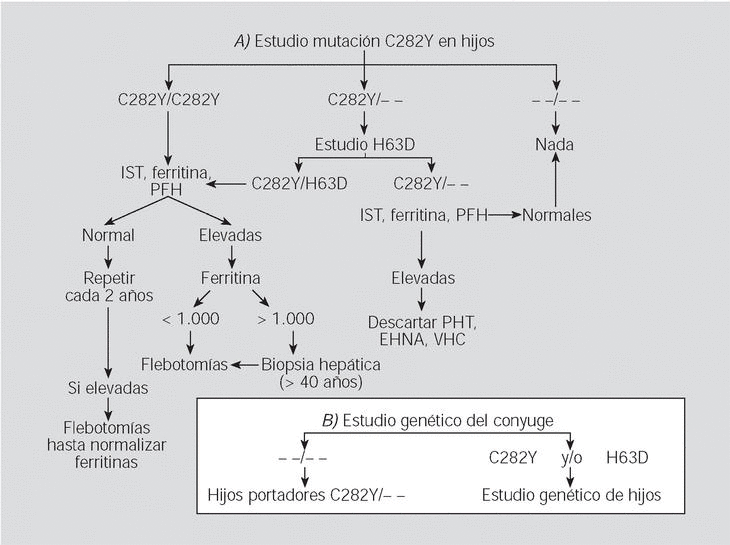
Fig. 6. Algoritmo del estudio familiar a partir de un homocigoto para la mutación C282Y. Pruebas funcionales hepáticas (PFH), porfiria hepatocutánea tarda (PHT), esteatohepatitis no alcohólica (EHNA), hepatopatías por virus C (HVC).