El Taller de Autoinmunidad de la Sociedad Española de Inmunológica (SEI) 2010 se celebró en San Sebastián el pasado 23 de junio de 2010 y sus objetivos se centraron en tres aspectos:
- 1.
El análisis de la variabilidad en la determinación de patrón y título de anticuerpos antinucleares y citoplasmáticos (ANA) determinados por inmunoflorescencia indirecta (IFI).
- 2.
El análisis de las especificidades de dichos ANA, agrupados bajo la denominación histórica de ENA, que agrupan antí- genos (Ag) como Ro/SS-A, La/SS-B, U1RNP, Sm y los anticuerpos anti-RNPribosomales, anti-dcDNA y antihistonas.
Los ANA, y entre ellos los agrupados bajo la denominación de ENA, antiribosomales, anti-DNA y antihistonas son muy útiles en el diagnóstico de enfermedades del tejido conectivo, entre ellas el lupus eritematoso sistémico (LES) y el síndrome de Sjogren (SS). Sin embargo, hay una gran variabilidad en los resultados en función de la técnica y del kit utilizado y también en la descripción del patrón de fluorescencia que proporcionan estos anticuerpos sobre distintos sustratos. Nuestro objetivo fue analizar el comportamiento de los ensayos para detectar estos anticuerpos mediante el análisis de la variabilidad de los resultados interlaboratorios e interensayo, comparándolos con un método de referencia definido en nuestro laboratorio.
Los antígenos Ro/SS-A y La/SS-B son complejos ribonu- cleoproteicos de pequeño tamaño que se localizan en el núcleo y en el citoplasma (sn/scRNP)1. Ambos antígenos proteicos se encuentran asociados a ácido ribonucleico (RNA) de pequeño tamaño denominados sn/scRNA entre los que se encuentran los hY-RNA 2,3. Los anticuerpos anti-Ro/SS-A precipitan específicamente los RNA hY1, hY2, hY3, hY4 y hY5 y pueden reconocer formas proteicas de Ro/SS-A de distinto peso molecular, Ro60 (60 Kda)4 y Ro52 (52 Kda)5,6. Los anticuerpos anti-La/SS-B también precipitan estos hY-RNA además de otros RNA transcritos por la RNA polimerasa III (precursores de tRNA, precursor del 5S rRNA y 7S RNA, entre otros) además de una proteína de 50kDa de peso molecular denominada La7,8. Los autoanticuerpos anti-Ro y anti-La llamados anti-SS-A y anti-SS-B, respectivamente, por su asociación al SS, son marcadores de enfermedad autoin- mune sistémica. También se asocian al LES, lupus cutáneo subagudo, lupus neonatal, artritis reumatoide y cuadros de conectivopatía mixta. Sin embargo, también se han descrito en la esclerosis sistémica y en la miositis.
Los antígenos Sm y U1RNP están compuestos por distintas moléculas de ribonucleoproteínas de pequeño tamaño localizadas en el núcleo celular (snRNP) que están implicadas en los fenómenos de procesamiento o splicing de los precursores del RNA mensajero2,3. Incluyen las partículas U1, U2, U4+U6 y U5 snRNP formadas por uno (U1, U2, U5) o dos (U4-U6) RNA y un conjunto de proteínas comunes a todas ellas (denominadas B/B', D, E, F, G) y otras proteínas propias o exclusivas de las distintas partículas snRNP, como por ejemplo las proteínas denominadas A, C y otra de 70kDa de peso molecular que son exclusivas de la partícula U1snRNP9. Los anticuerpos anti-Sm reconocen preferentemente epítopos presentes en las proteínas B/B' y D, por lo que precipitan todos los snRNA U1, U2, U4, U5 y U6 y, consecuentemente, todas las proteínas que forman parte de estas partículas de snRNP. Los anticuerpos anti-U1RNP reconocen epítopos en las proteínas A, C y de 70kDa y precipitan exclusivamente U1snRNA10. Los anticuerpos anti-Sm son específicos del LES y su presencia es un criterio diagnóstico. Los anticuerpos anti-U1RNP pueden encontrarse en pacientes con LES, SS, artritis reumatoide, polimiositis y esclerosis sistémica. Los métodos empleados para el estudio de estas especificidades de anticuerpos son múltiples, pero a día de hoy ninguno se ha estandarizado entre laboratorios.
Los antígenos contenidos en la denominación de anticuerpos antiribosomales2,11 incluyen preferentemente los dirigidos contra la proteína P0 de 38kDa y que forma parte de la molécula de ribonucleoproteína rRNP que incluye los rRNA y las proteínas P1 y P2 además de P0.
En último lugar, está el análisis de los resultados obtenidos en la determinación de anticuerpos antitiroideos: anticuerpos antiperoxidasa tiroidea (anticuerpos anti-TPO) y anticuerpos antitiroglobulina (anticuerpos anti-TG)12.
Para este cometido se distribuyeron para su análisis, junto con un breve resumen de la historia clínica, 8 sueros obtenidos tras consentimiento informado, de pacientes con distintas afecciones autoinmunes, 4 de los cuales se estudian en el Servicio de Reumatología del Hospital de la Santa Creu i Sant Pau y los 4 restantes en el Servicio de Endocrinología del mismo centro.
Historias clínicasSuero 1Mujer de 31 años, boliviana. Presenta poliartritis simétrica de 5 años de evolución, con predominio en manos y muñecas. Diagnosticada de artritis reumatoide. Refiere también sequedad de ojos. En tratamiento con Resochin y Dacortin. Orientación diagnóstica, SS secundario a artritis reumatoide.
Suero 2Varón de 67 años, con síntomas subjetivos y objetivos de sequedad ocular y bucal. En la exploración se observa una poliartritis no erosiva. En tratamiento con Dolquine. Orientación diagnóstica, SS.
Suero 3Mujer de 41 años, con poliartritis de predominio IFD desde hace 10 años. Diagnosticada de LES con anticuerpos antifosfolipídicos. En la última analítica se observa hipercalciuria. En tratamiento con Dolquine.
Suero 4Mujer de 42 años, colombiana, presenta hace 10 meses un cuadro de poliartritis y alopecia. Posible diagnóstico de LES o enfermedad mixta del tejido conectivo. Ha tenido neumonía con derrame pleural hace 2 meses, y ahora en estudio por pleuropericarditis bilateral. En tratamiento con Dolquine y azatioprina.
Suero 5Varón de 30 años de edad con trastorno esquizoafectivo, obesidad de grado II e hipotiroidismo autoinmune de 2 años de evolución. Tratamiento con 200mg/día de levotiroxina sódica.
Suero 6Mujer de 32 años con diabetes mellitus tipo 1 diagnosticada a los 16 años, e hipotiroidismo autoinmune de 2 años de evolución. Tratamiento con insulina (buen control glucémico) y 100mg/día de levotiroxina sódica.
Suero7Mujer de 31 años de edad, con diabetes mellitus tipo 1 desde los 20 años, e hipotiroidismo autoinmune desde los 26. Tratamiento con bomba de insulina (control glucémico insuficiente) y 100mg/día de levotiroxina sódica.
Suero 8Mujer de 57 años, con antecedentes de carcinoma de mama, en estudio por posible hipotiroidismo.
Método de evaluaciónEn el estudio de los ANA por IFI, se solicitó que se especificara patrón (moteado, homogéneo, nucleolar, citoplasmático y otros), título, sustrato empleado, casa comercial proveedora de reactivos o home made y analizador utilizado. En el análisis de resultados se valoró el porcentaje de participantes que describía un determinado patrón y la titulación asignada para cada uno de los sueros en estudio.
Además, se recogieron los resultados de las especificidades anticuerpos anti-U1RNP, anti-Sm, anti-La/SS-B, anti-Ro/SS-A, anti-Ro52, anti-Ro60, antiribosomal, anti-TG, anti-TPO, anti-dcDNA y antihistonas. Para cada una de estas especificidades, se solicitaron los datos siguientes: resultado cualitativo y cuantitativo, tipo de ensayo, kit comercial y analizador empleado.
En primer lugar se valoró la uniformidad de los resultados de los distintos anticuerpos para cada suero.
Para las especificidades de anticuerpos anti-U1RNP, anti-Sm, anti-La/SS-B, anti-Ro/SS-A y antiribosomal, se dispone de método de referencia que definimos como el resultado cualitativo que se considera cierto, que se obtuvo aplicando técnicas de inmunoprecipitación y análisis de RNA, IFI sobre tejido de rata y sobre células Hep-2, DotBlot y Western blot sobre proteínas recombinantes de distintos orígenes. Además, también se habían analizado sueros anteriores de los mismos pacientes por inmunoprecipitación de proteínas marcadas metabólicamente con metionina-35S y por contrainmunoelectroforesis (CIE) 2,13-15. Frente a este método de referencia comparamos los resultados recogidos en el Taller.
El análisis estadístico se realizó mediante tablas de contingencia, en las que se agruparon las especificidades según el tipo de ensayo empleado en 4 categorías: DotBlot, enzimoinmunoensayo (ELISA), fluorimetría e inmunoblot. En este punto se ha de aclarar que, debido a las disparidades a la hora de definir el ensayo por parte de los distintos participantes para un mismo kit comercial y analizador, se decidió hacer agrupaciones según el criterio del comité organizador. En el estudio de los datos obtenidos por ELISA, no se han podido tener en cuenta factores importantes en la elaboración de los resultados, como son por ejemplo el número de determinaciones por ensayo y distribución de los estándares en la placa para evitar o disminuir la desviación.
Además, se estudió el índice de concordancia de resultados observados frente a método de referencia en función del kit comercial empleado, y para evitar coincidencias debidas al azar, se realizó por cálculo del índice kappa cuya valoración es:
- —
< 0,2 fuerza de concordancia pobre.
- —
0,21-0,40 débil.
- —
0,41-0,60 moderada.
- —
0,61-0,80 buena.
- —
0,81-1,00 fuerza de concordancia muy buena.
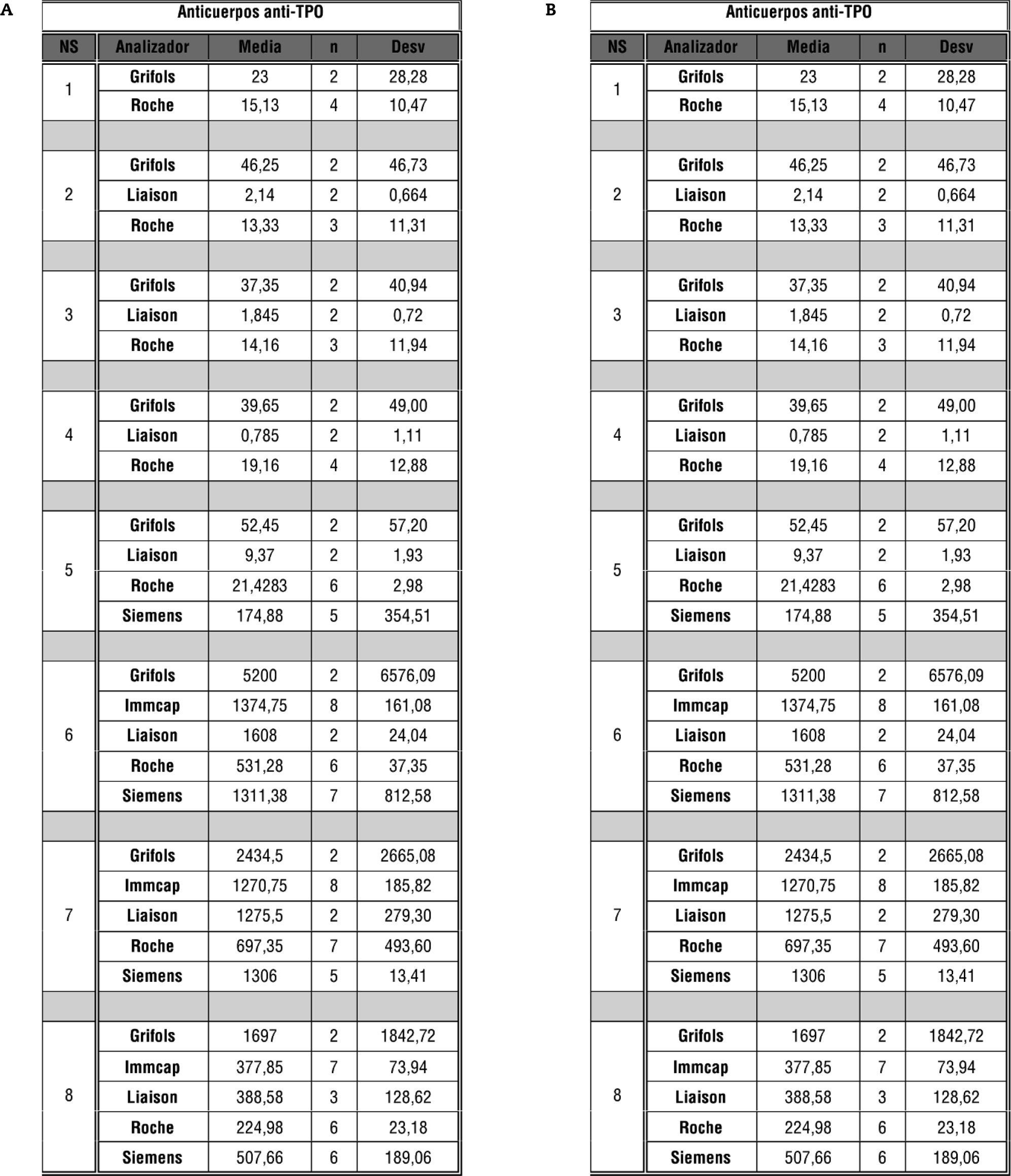
En cuanto a los anticuerpos antitiroideos se analizó, además del resultado cualitativo, el resultado cuantitativo con el cálculo de la media y la desviación típica para cada suero en función del analizador empleado.
Otras consideraciones sobre el método de referencia- 1.
Para determinar si un suero que precipita los snRNA (del inglés small nuclear RNA) Us contenidos en la molécula del antígeno Sm tiene además anticuerpos anti-U1snRNP, se emplearon técnicas de CIE, DotBlot y Western blot.
- 2.
Para determinar si un suero que precipita los scRNA (del inglés small cytoplasmic RNA) Ys contenidos en la molécula del antígeno Ro/SS-A tiene además anticuerpos anti-La/SS-B, analizamos la presencia del snRNA 4.5S propio del antígeno La/SS-B.
- 3.
Para determinar si un suero que precipita los RNA Ys, 4.5S y 7S propio del inmunoprecipitado del antígeno La/SS-B, tiene además anticuerpos anti-Ro/SS-A, se emplearon técnicas de CIE, DotBlot y Western blot.
- 4.
Se analizaron los distintos patrones de inmunofluorescencia sobre cortes criostáticos de tejidos de rata y sobre células Hep-2 en cultivo, teniendo en cuenta que el patrón de fluorescencia de los anticuerpos anti-La/SS-B en tejido y en células Hep-2 es moteado y nucleolar, dado que esta es la localización de la proteína antigénica7 y que el antígeno Ro/SS-A proporciona un patrón citoplasmático inapreciable en la mayoría de sustratos1,5 que puede llegar a ser nuclear sólo en estadios de activación de la células16,17, por lo que a los anticuerpos anti-Ro/SS-A no deben atribuirse los patrones nucleares que pueden acompañarlos.
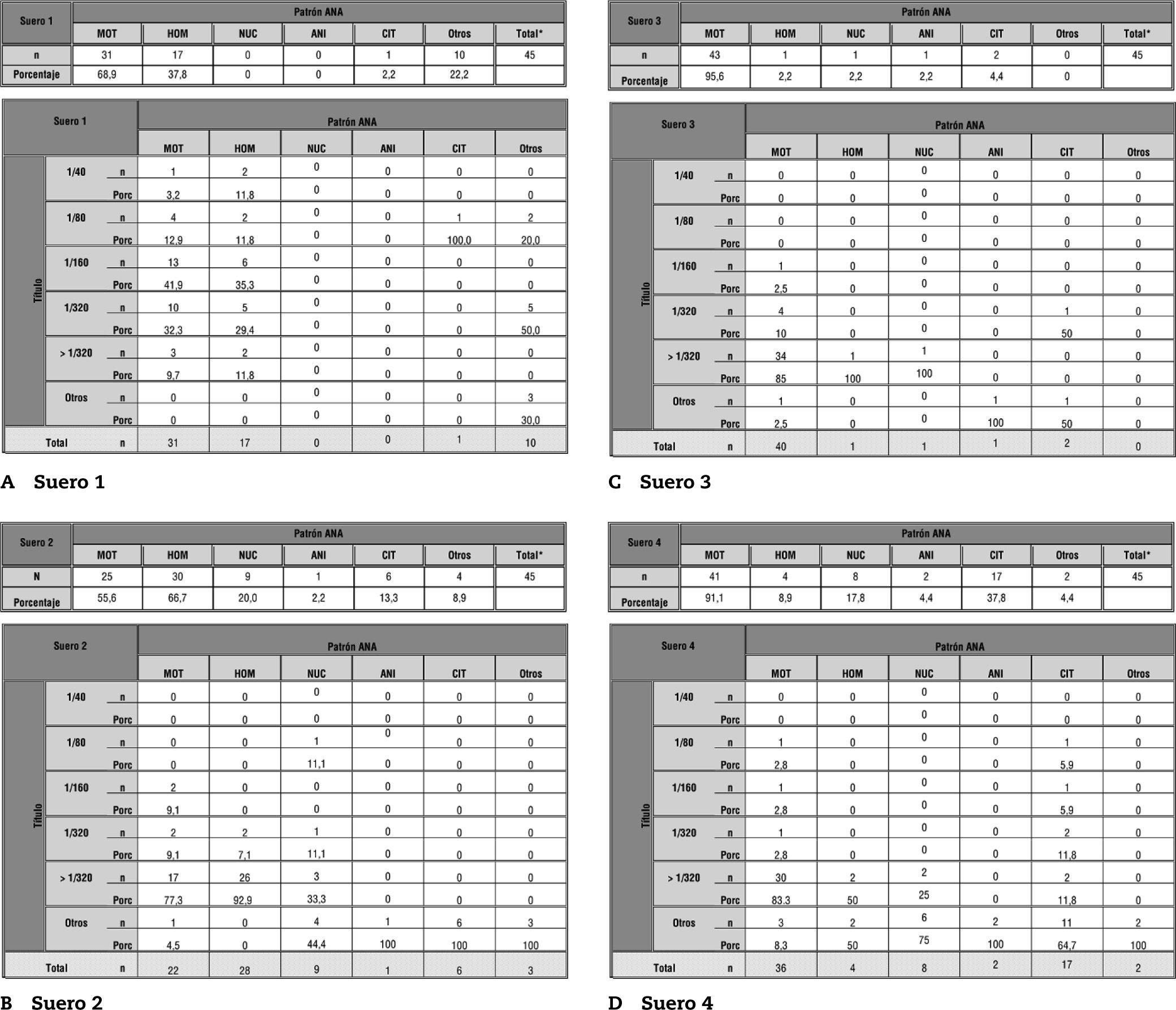
En la figura 1 se recogen los resultados de patrón y título de ANA obtenido por IFI de los sueros 1–8. Para cada suero se muestran dos tablas: a) en la superior se puede ver número absoluto y porcentaje respecto al total de participantes (45) que han reportado cada uno de los patrones: moteado, homogéneo, nucleolar, anillo, citoplasmático y otros, y b) en la inferior se muestra cada patrón desglosado en función del título.
Tablas resumen de los resultados de patrón de ANA por IFI (tabla superior) y título (tabla inferior) para cada uno de los sueros. 1 Total hace referencia al número de participantes en la parte "análisis de anticuerpos antinucleares y citoplasmáticos". El porcentaje esta referido a dicho total.
En el análisis individualizado de cada suero se observó que tanto en el 1 como en el 2 hay cierta discrepancia por parte de los participantes a nivel de título y patrón, mientras que en los sueros 3 y 4 hay homogeneidad de resultados en cuanto a título y patrón de florescencia nuclear. Además, hay que destacar que el 38 % de los participantes describió un patrón citoplasmático en el análisis del suero 4. En cuanto a los sueros 5 y 6, se reportó un porcentaje no despreciable de positivos con homogeneidad en el patrón, pero no así en el título. Por último, la gran mayoría describió los sueros 7 y 8 como negativos o, en su defecto, positivos a título bajo (no superior a 1/80 salvo un caso puntual en cada suero). Estos datos de IFI se analizarán conjuntamente con el análisis de las especificidades.
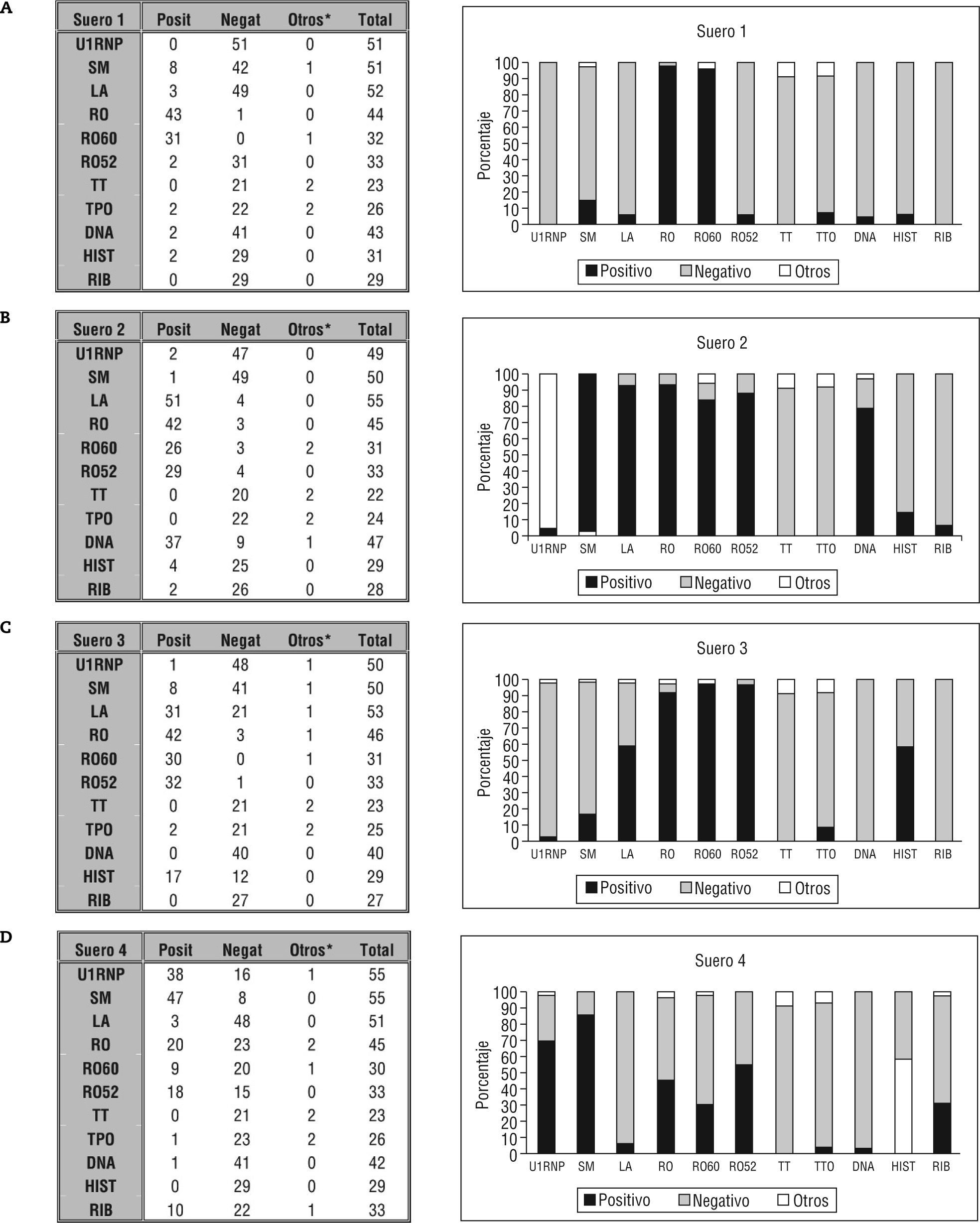
En la figura 2 se muestra el resumen de los resultados cualitativos recogidos para cada una de las especificidades, agrupados por suero. Como ya se comentó anteriormente en este apartado, disponemos de un método de referencia en el que apoyarnos. En el caso del suero 1, el método de referencia demostró la presencia de anticuerpos anti-Ro/SS-A y, entre los participantes en el Taller, el 97,73 % ha detectado dichos anticuerpos. Además, la mayoría los ha identificado con anticuerpos que reconocen la forma de 60kDa de la molécula (fig. 2a).
Análisis de las especificidades para cada suero en números absolutos (tabla de la izquierda) y porcentaje (diagrama de barras). Suero 1 (fig. 2a) gold standard positivo (GS+) para Ac. Anti-Ro/SS-A. Suero 2 (fig. 2b) GS+: Ac. Anti-Ro/SS-A y Ac. Anti-La/SS-B. Suero 3 (fig. 2c) GS+: Ac. Anti-Ro/SS-A. Suero 4 (fig. 2d) GS+: Ac. Anti-Ro/SS-A (débil), Ac. Anti-Sm, Ac. Anti-U1RNP y Ac. Anti-Ribosomal.
*En la columna otros se recogen valores que no se pueden englobar ni en positivos ni en negativos por razones varias: dudosos, resultado cuantitativo sin indicar intervalos de referencia, etc.
El suero 2 (fig. 2b) se definió por método de referencia como positivo para anticuerpos anti-Ro/SS-A, anticuerpos anti-La/SS-B, y para estos anticuerpos el porcentaje de positividad reportado ha sido del 93,33 y el 92,73 %, respectivamente. Además un 78,72 % detecta anticuerpos anti-DNA. Teniendo en cuenta estos datos, sería esperable un patrón de IFI moteado, nucleolar y homogéneo, pero los datos reportados muestran tan sólo un 20 % de participantes que describen un patrón nucleolar asociado al moteado y homogéneo; un 55,6 %, moteado, y un 66,7 %, homogéneo (fig. 1b).
En el estudio del suero 3 (método de referencia: anticuerpos anti-Ro/SS-A positivo), el 91,3 % reporta dicho resultado pero además el 58,49 % emite un resultado positivo para anticuerpos anti-La/SS-B (fig. 2c), difícil de considerar al no encontrarse en el inmunoprecipitado ningún RNA característico de esta partícula antigénica y la IFI no muestra ni trazas de tinción nucleolar.
Uno de los sueros en los que se observa mayor grado de discrepancia es el suero 4 (método de referencia anticuerpos anti-U1RNP, anticuerpos anti-SM y anticuerpos antiribosomal positivos y anticuerpos anti-Ro/SS-A positivo débil). Para estos anticuerpos, los resultados de positividad recogidos son: 69,09 % para anticuerpos anti-U1RNP; 85,45 % anticuerpos anti-SM; 44,44 % anticuerpos anti-Ro/SS-A, y tan sólo 30,30 % para anticuerpos antiribosomal. También destaca la heterogeneidad en el análisis de anticuerpos anti-RO52 y R060, en los que el porcentaje de positivos es del 54,55 y el 30 %, respectivamente (fig. 2d). Una vez más, con estos datos de método de referencia, esperaríamos en IFI un patrón moteado y citoplasmático; sin embargo, los datos recogidos son: 91,1 % patrón moteado y sólo un 37,8 % patrón citoplásmico (fig. 1d).
Los sueros 5, 6, 7, 8 (figs. 2e2f, 2g, 2h, respectivamente) son negativos para ENA, ribosomales, DNA e histonas.
Las especificidades tiroideas se analizarán en un apartado posterior, aunque en la figura 2 podemos ver porcentualmente los resultados de estas especificidades para cada uno de los sueros.
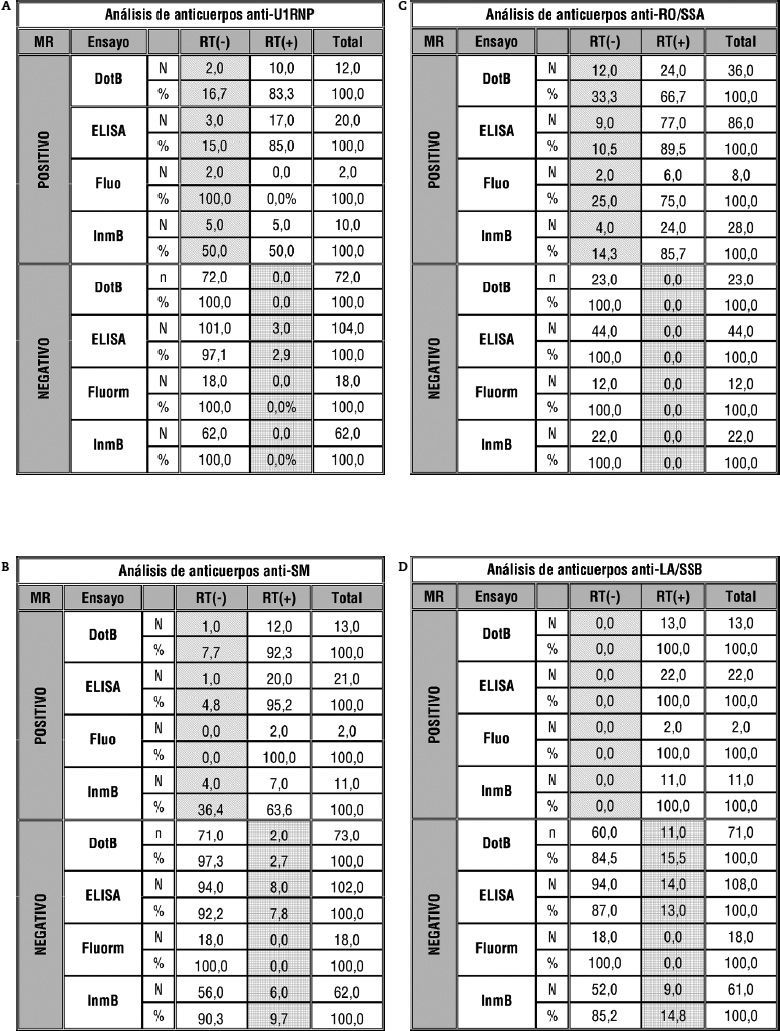
Puesto que disponemos de método de referencia, podemos hacer un estudio de los resultados obtenidos para cada especificidad, con el análisis de los resultados de los 8 sueros en conjunto (fig. 3), con lo que obtendremos el número de falsos positivos (FP) y falsos negativos (FN). Para que el análisis sea más informativo, se muestra desglosado según el tipo de ensayo empleado. De esta manera, la "n" total es menor y se pierde potencia en el test, por lo que los resultados en alguno de los casos tienen que interpretarse como orientativos.
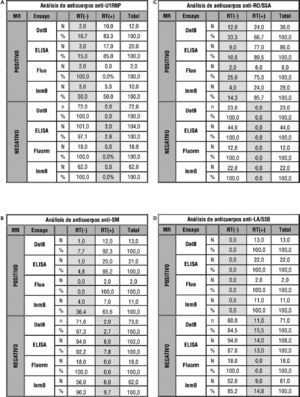
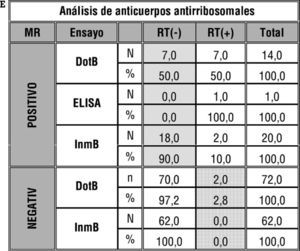
Análisis de los resultados esperados (gold standard "GS") frente a resultados recopilados (resultado Taller "RT" negativo o positivo) en función del ensayo empleado (dotblot "DotB", enzimoinmunoanálisis "ELISA", fluorimetría "Fluo" e inmunoblot "InmB"). Se muestra en rayado oblicuo los falsos negativos tanto en número absoluto (N) como en porcentaje (%) y en cuadriculado los falsos positivos tanto en número absoluto (N) como en porcentaje (%).
Para los anticuerpos anti-U1RNP (fig. 3a), se observan porcentajes variables (entre el 15 y el 50 %) de FN para los distintos ensayos estudiados mientras que el porcentaje de FP es prácticamente nulo.
Por otro lado, los resultados de anticuerpos anti-SM muestran valores inferiores al 10 %, tanto de FN como de FP para todos los ensayos, a excepción del 36,4 % de FN para el ensayo inmunoblot, pero en este dato debemos tener en cuenta que n=11 (4 FN+7 verdaderos negativos [VN]) (fig. 3b).
En el caso de anticuerpos anti-Ro/SS-A (fig. 3c), llama la atención los porcentajes de FN (entre el 10,5 y el 33 %) para los cuatro tipos de ensayo que pueden explicarse en su mayoría por los resultados reportados para el suero 4 definido por método de referencia como positivo débil y que un 51 % (fig. 2d) calificó de negativo.
En el análisis de anticuerpos anti-La/SS-B (fig. 3d), se ven resultados algo distintos al resto de especificidades, ya que en este caso el porcentaje de FN es 0, mientras que se recoge entre un 9 y un 15,5 % de FP. Este dato se justifica principalmente con los resultados correspondientes al suero 3 (fig. 2c), en la que un 58,5 % de los resultados reportados es positivo frente a un 39,6 % negativo, por lo que el método de referencia para esta muestra es negativo. De este 58,5 % de FP en el suero 3, un 61 % se obtuvo mediante ensayo DotBlot-inmunoblot; un 39 %, por ELISA, y un 0 %, por fluorimetría.
Al igual que ocurría con los anticuerpos anti-Ro/SS-A, existe un suero definido por método de referencia como anticuerpos antiribosomal positivo (suero 4), en el que un pequeño porcentaje de participantes lo reportó como tal (fig. 2d). Esto se ve reflejado en la figura 3e en forma de un alto porcentaje de FN.
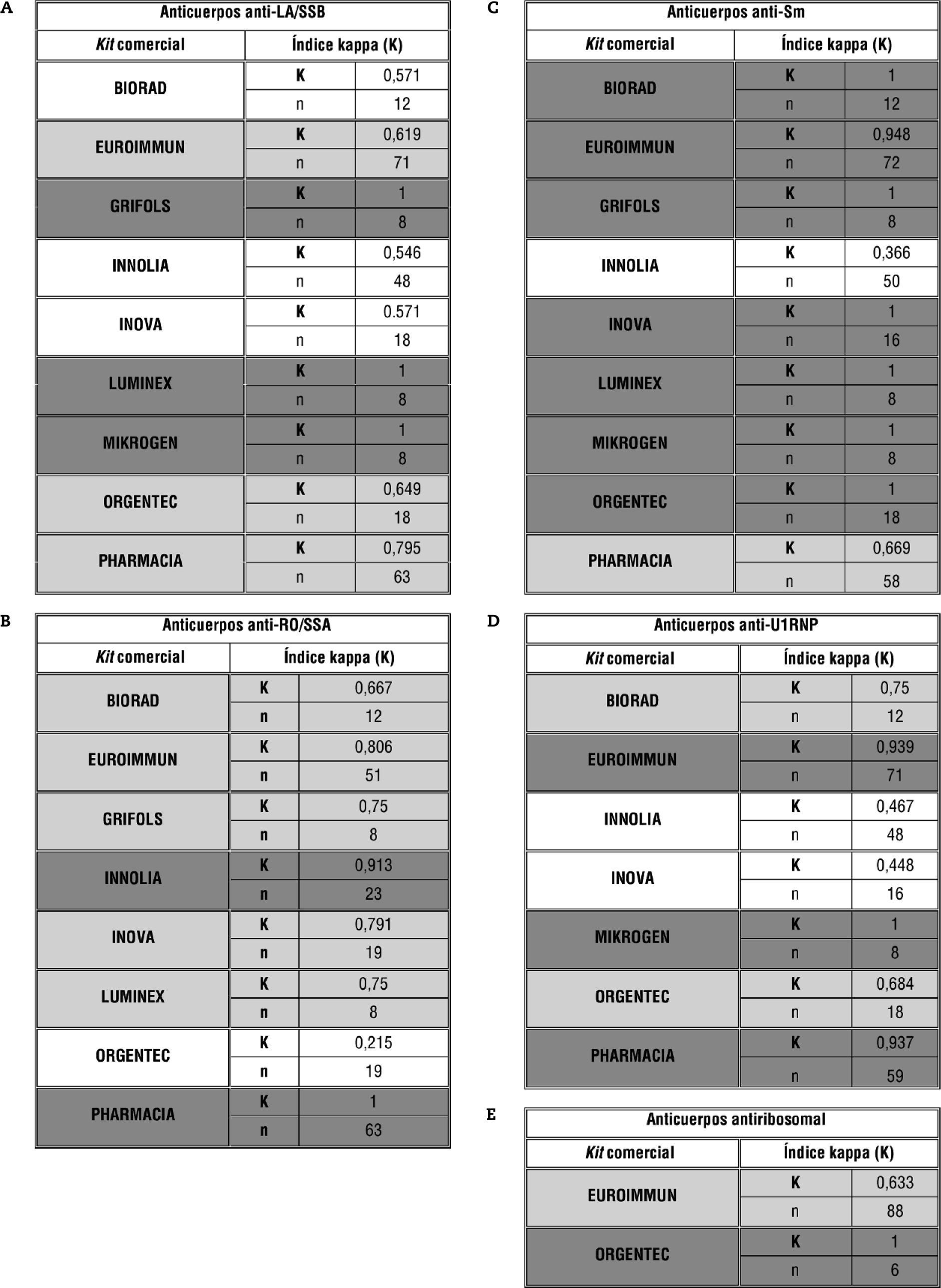
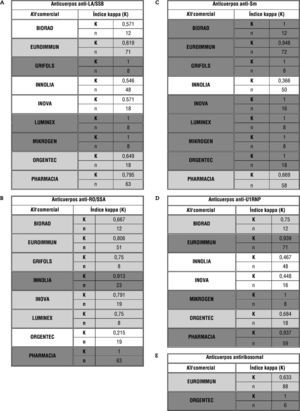
Otro posible estudio al disponer de método de referencia sería, en función del kit comercial empleado, ver la concordancia del resultado cualitativo (positivo/negativo) esperado (método de referencia) frente al reportado por los distintos participantes, analizando la totalidad de sueros, para cada una de las especificidades, mediante el índice de concordancia kappa (fig. 4). Se puede observar que, dependiendo de la especificidad que estemos estudiando, los kits comerciales analizados obtienen distinto resultado de índice kappa, siendo éste bueno en general (índice kappa entre 0,61 y 0,8 o 0,81 y 1 en la mayoría de los casos). Respecto al análisis comparativo entre kits, se ha de tener en cuenta otras fuentes de variabilidad en el propio ensayo distintas al kit, así como el número de determinaciones (en la tabla representado por n) que tampoco es constante.
Análisis de concordancia entre método de referencia y resultados obtenidos por los participantes en función del kit comercial empleado en el análisis. Se muestra sombreado en tonalidad gris claro los índices de kappa (K) definidos como "concordancia buena" (K: 0,61-0,8) y en gris oscuro los definidos como "concordancia muy buena" (K: 0,81-1).
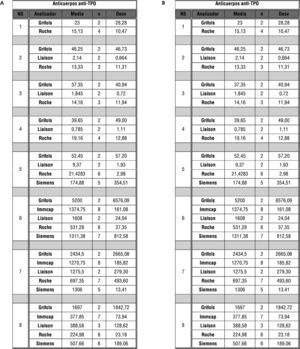
Por último, en el análisis de especificidades de anticuerpos antitiroideos, vemos que en los sueros 1–4 hay prácticamente unanimidad en dar resultado negativo tanto para anticuerpos anti-TPO, como para anticuerpos anti-TG (figs. 2a-2d, respectivamente) mientras que en el resto de muestras analizadas, al menos una de las especificidades antitiroideas se reporta como positiva por la mayoría de los participantes. Así, el suero 5 se dio positivo en un 88,89 % de los casos para anticuerpos anti-TG, mientras que sólo un 13 % para anticuerpos anti-TPO (fig. 2e). En el caso suero 6 se recogió como resultado positivo un 57,14 % de las determinaciones de anticuerpos anti-TG y un 92,11 % de las determinaciones de anticuerpos anti-TPO (fig. 2f). Para el suero 7 son del 71,43 y el 92 % (anticuerpos anti-TG y anti-TPO, respectivamente) (fig. 2g), y por último, en el suero 8 destaca un 92,11 % de determinaciones positivas para los anticuerpos anti-TPO (fig. 2h).
Puesto que se trata de variables cuantitativas, se procedió al análisis de los resultados cuantitativos de estas especificidades antitiroideas, calculando la media y la desviación típica para cada suero en función del analizador empleado (fig. 5). Estos resultados se han de interpretar con carácter meramente orientativo, ya que debido a la gran diversidad de analizadores empleados y el número de participantes en esta parte del taller, las "n" disponibles para el estudio no son suficientes para obtener resultados significativos, pero se ha creído necesaria su mención debido a la alta variabilidad de resultados observada.
Discusión y conclusionesANA y ENALa determinación de autoanticuerpos en suero es una importante aproximación diagnóstica en pacientes con enfermedades autoinmunes. Dentro de los autoanticuerpos, los ANA14 han resultado muy útiles durante años en el seguimiento de pacientes con enfermedades autoinmunes, sistémicas principalmente. Aunque incluimos en este término anticuerpos dirigidos no sólo a antígenos nucleares, sino también contra otras estructuras de la célula, y algunas pueden estar localizadas en el citoplasma. Los métodos de análisis de estos anticuerpos incluyen una gran variedad de tecnologías, entre las que destacan: la IFI, inmunodifusión, CIE, inmunoblotting, enzimoinmunoensayo (ELISA), inmunoprecipitación y, más recientemente, tecnología de arrays15,18. Entre los antígenos que se emplean para la determinación de autoanticuerpos también hay una gran heterogeneidad: desde tejidos humanos procedentes de extractos de tejidos o líneas celulares en cultivo, de distintas especies principalmente rata, ratón, ternera, conejo o, en casos excepcionales, de primates, hasta antígenos purificados o clonados. Dentro de las proteínas antigénicas recombinantes hay diferencias importantes, dependiendo de si se han expresado en células procariotas o eucariotas.
El propósito de un test diagnóstico es su implicación en el seguimiento clínico del paciente, por lo que el resultado deberá emitirse con prontitud, y tanto la nomenclatura, como los parámetros cuantitativos deberán seguir unos estándares y baremos internacionales que permitan la uniformidad en los resultados y minimizar la variabilidad intraensayo, interensayo e interlaboratorios. El uso de unidades internacionales y de consensos en la definición de estándares y nomenclatura es una necesidad en la autoinmunidad diagnóstica19.
El análisis de los resultados del Taller nos ha mostrado importante variabilidad, dependiente del tipo de ensayo empleado, de la procedencia del kit comercial, pero también diferencias entre la forma de expresar distintos laboratorios un mismo resultado.
Las conclusiones del análisis se resumen a continuación:
- −
La IFI es, junto con el diagnóstico que debe llegar siempre con la petición, la puerta de entrada de la analítica de autoinmunidad. Sin embargo, resulta preocupante la gran dispersión obtenida en los resultados de IFI, tanto en el título, como en los patrones. Como Sociedad de Inmunología, deberíamos consensuar una única forma de denominar a los distintos patrones, tomando en consideración la configuración molecular del antígeno y, por consiguiente, su localización en la célula.
- −
El estudio de las especificidades definidas en este Taller muestra excesiva variabilidad en los resultados. El análisis de la variabilidad entre las distintas técnicas empleadas puede deberse a: a) cut off, diferencias que deben atribuirse al límite de sensibilidad de la técnica; b) falta de reproducibilidad intraensayo y/o interensayo; c) tipo de antígeno. La representación de los epítopos antigénicos en los distintos kits comerciales será distinta en función de si el antígeno está en estado nativo (en tal caso, dependerá de su grado de purificación y del extracto tisular o de la línea celular que se haya empleado para su obtención y purificación), de que el antígeno sea una proteína recombinante obtenida en sistemas procariotas o eucariotas (sólo en este último caso la proteína puede expresar un plegamiento similar al nativo, ya que en un sistema eucariota pueden expresarse hidratos de carbono implicados en la estructura antigé- nica). Además, en el caso de las proteínas recombinantes, dependerá de si está expresada la totalidad de la proteína o la región que contenga mayor número de epítopos antigénicos conocidos. d) Algunas técnicas han resultado más subjetivas que otras en la valoración de los resultados. Un ejemplo lo tenemos en la valoración de las técnicas cualitativas de DotBlot.
- −
Finalmente, el papel del inmunólogo en la autoinmunidad es, entre otras funciones, el conocimiento de los autoantígenos implicados: su localización en células y tejidos, su estructura molecular, etc. Las situaciones en las que es conveniente acompañar el resultado de un breve informe son: aquéllas en las que se obtienen resultados contrapuestos con distintos métodos empleados, resultados con positividad débil en la determinación de anticuerpos diagnósticos o con significativa correlación en la clínica, y en el caso de hallazgo de un tipo de anticuerpo no solicitado por el clínico, pero que se obtiene durante el proceso de análisis.
Son los principales marcadores de enfermedad autoinmune del tiroides, especialmente en la enfermedad de Graves y la tiroiditis de Hashimoto. Esta última se caracteriza por una fase preclínica muy larga que puede durar décadas, con infiltración progresiva de la glándula y la presencia de anticuerpos anti-TPO y anti-TG20. La concentración de estos anticuerpos en sangre refleja la gravedad del infiltrado inflamatorio y la destrucción del tejido glandular que llevará al hipotiroidismo. En consecuencia, la presencia de estos autoanticuerpos puede ser el primer signo de enfermedad y los niveles o títulos de anticuerpos es un factor importante en su diagnóstico y seguimiento. Además de las enfermedades autoinmunes del tiroides, la determinación de anticuerpos anti-TG tiene gran importancia en pacientes con carcinoma tiroideo21 y los títulos de éstos son importantes, ya que podrían enmascarar errores en la determinación de tiroglobulina en sangre, parámetro esencial en el seguimiento de estos pacientes.
Es de crucial importancia el uso de unidades internacionales y el ajuste del cut off para cada tipo de ensayo y analizador con un panel de sueros normales.
Perspectiva de futuroTras el análisis de los resultados de este Taller 2010, algunas acciones futuras a considerar son:
En los resultados cualitativosEs recomendable realizar la determinación de ANA y citoplasmáticos por IFI y validar que el patrón obtenido esté de acuerdo con el resultado de la especificidad autoanticuerpo obtenida por técnicas específicas.
Sería deseable llegar a un consenso en la forma de describir los distintos patrones de fluorescencia.
Es recomendable emplear más de un tipo de ensayo para la determinación de anticuerpos que se encuentren próximos a la zona de corte.
Algunas técnicas han resultado más subjetivas que otras en la valoración de los resultados.
En los resultados cuantitativosEs aconsejable dar los resultados en unidades internacionales, siempre que sea posible.
Sería recomendable analizar entre los distintos laboratorios que realizan la determinación de anticuerpos antitiroideos un número estadísticamente significativo de sueros con historias clínicas conocidas para poder valorar con fidelidad los resultados obtenidos con distintos métodos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A todos los participantes en el Taller por el trabajo realizado, el apoyo que nos han proporcionado en todo momento y por la comprensión ante los errores que se hayan podido cometer. A los Servicios de Reumatología y Endocrinología del Hospital de la Santa Creu i Sant Pau de Barcelona por su colaboración en la aportación de las historias clínicas y por facilitar las muestras de suero tras el consentimiento informado de los pacientes, en especial a los Dres. Cesar Díaz-López, Carmen Geli y César Díaz-Torné del Servicio de Reumatología, y a la Dra. Rosa Corcoi del Servicio de Endocrinología. A los miembros del Comité de Ética a los que presentamos el proyecto de este estudio, sin cuyo consentimiento y colaboración no habría sido posible elaborar el Taller. A Menarini Diagnostics por su desinteresada ayuda en el envío de las muestras. A todos los compañeros del Servicio de Inmunología, adjuntos, ETL y administrativas por su valiosa colaboración, ayuda y estímulo.
1) Evaluación de las técnicas de determinación de Anticuerpos anti-Nucleares y citoplasmáticos (ANAs) anti-Antígenos extractables de Nucleo, anti-Ribosomales, anti-dcDNA y anti-Histonas; 2) Anticuerpos anti-Tiroideos con el análisis del comportamiento de los ensayos para detectar estos anticuerpos y la variabilidad de los resultados interlaboratorios e interensayo comparándolos con un método de referencia o gold standard definido en nuestro laboratorio. 3) El análisis de los resultados obtenidos en la determinación de anticuerpos antitiroideos: anticuerpos antiperoxidasa tiroidea (Ac anti-TPO) y anticuerpos antitiroglobulina (Ac anti-TG).