Durante la infección por el virus de la inmunodeficiencia humana tipo-1 (VIH-1) se presentan alteraciones en la frecuencia, el fenotipo y la función de las células NK, lo cual reduce su capacidad antiviral y se correlaciona con el incremento de la carga viral y la progresión a sida. Sin embargo, los estudios en individuos que presentan resistencia natural al VIH-1 han mostrado que estas células intervienen en el control de la replicación viral, con efectos antivirales directos y con la activación de células dendríticas, otro componente de la inmunidad innata. A pesar de que estos linfocitos no poseen receptores antigénicos específicos, recientemente se ha reportado su capacidad para responder a péptidos del VIH-1. Aunque el mecanismo no está completamente elucidado, es indudable que este hallazgo abre un nuevo panorama en el estudio de nuevas alternativas terapéuticas o preventivas contra la infección por VIH-1 que involucren a las células NK.
During human immunodeficiency virus type-1 (HIV-1) infection there are several changes in the frequency, phenotype and function of NK cells, altering their antiviral response. This is correlated with increased viral loads, and AIDS progression. However, studies in individuals with natural resistance to HIV-1 infection have shown that NK cells are very important in controlling viral replication, not only for their antiviral activity, but also because of their effects on the activity of other innate immune cells, such as dendritic cells. NK cells do not have antigen receptors, but it has been recently reported that they can specifically respond to HIV-1 peptides. Although the mechanism is not fully elucidated, this finding open more options in the study of new therapeutic or preventative strategies against HIV-1 infection.
Las células asesinas naturales (natural killer cells [NK]) son un tipo de linfocitos producidos en la médula ósea, cuya función efectora está mediada por la producción de citocinas y su actividad citotóxica. Se encuentran principalmente en los nódulos linfoides y la sangre, pero también están ampliamente distribuidas en la piel, el intestino, el hígado, los pulmones y el útero, entre otros tejidos1.
El papel fundamental que tienen estas células se ha hecho evidente en algunos individuos con deficiencias de células NK, quienes, a pesar de tener un adecuado número y función de linfocitos T y B, presentan infecciones virales recurrentes y tienden a desarrollar infecciones severas por los virus varicela zóster y citomegalovirus, entre otros2. En pacientes con cáncer de mama y cáncer colorrectal, se ha reportado que las alteraciones fenotípicas y funcionales en estas células se asocian a un mayor grado de progresión de la enfermedad3,4. De esta manera, las futuras investigaciones que involucren células NK podrían ayudar a clarificar su participación en procesos infecciosos, tumorales y abortos recurrentes, para definir su uso potencial en terapias inmunomoduladoras.
Receptores de las células natural killerLas células NK poseen diferentes receptores que les permiten interactuar con las diferentes subpoblaciones celulares, entre los cuales se incluyen: los receptores lectina tipo C, que incluyen: a) el heterodímero NKG2D/CD94 encargado del reconocimiento de la molécula no clásica del complejo mayor de histocompatibilidad, HLA-E5; b) los receptores de citotoxicidad natural (natural citotoxicity receptors [NCR]), incluyen los receptores activadores NKp30, NKp44 y NKp46, expresados exclusivamente por las células NK; c) los receptores de la familia de las inmunoglobulinas, llamados receptores killer inhibitory receptor (KIR), los cuales pueden ser activadores o inhibidores y reconocen la disminución en la expresión de las moléculas de HLA-I6, y d) finalmente, el receptor CD16, un receptor Fc del tipo FcγRIIIA de baja afinidad para la IgG, para el reconocimiento de células opsonizadas con anticuerpos IgG7.
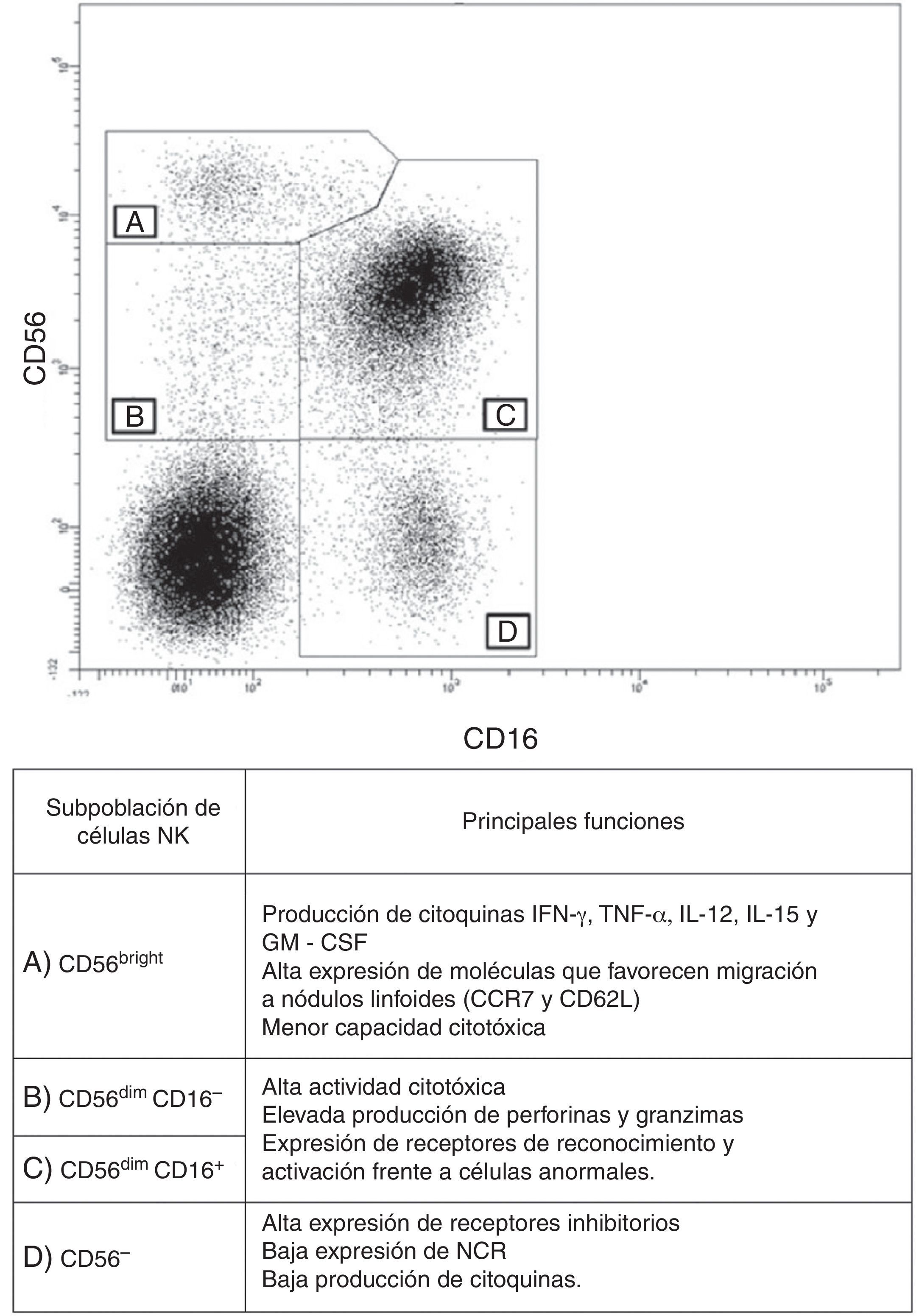
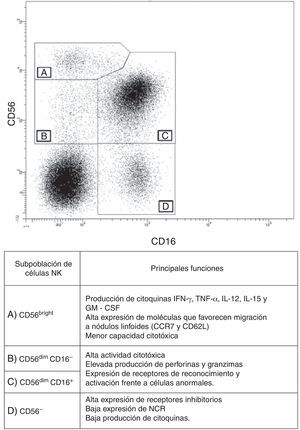
Subpoblaciones de células natural killer y sus diferencias funcionalesLas células NK constituyen entre el 7 al 15% del total de linfocitos en sangre periférica, en donde se han descrito cuatro subpoblaciones de células NK. Su morfología se define como linfocitos grandes granulares, los cuales no expresan el marcador CD3 y expresan las moléculas CD16 y/o CD56. La expresión de las moléculas CD16 y CD56 es variable entre las diferentes subpoblaciones de células NK y permite su clasificación. Basados en lo anterior, se han descrito las siguientes subpoblaciones de células NK8: a) CD56bright, las cuales no expresan CD16 y tienen baja expresión de receptores KIR (fig. 1 A); b) CD56dim, que comprende alrededor del 90% de las células NK, de las cuales una pequeña proporción son CD16− (fig. 1 B), pero en su mayoría expresan CD16 y receptores KIR (fig. 1 C), y c) CD56−, que expresan en alta densidad el CD16, pero que presentan alteraciones funcionales debido a su baja actividad citotóxica y de producción de citocinas (fig. 1 D). Vale la pena resaltar que existe una gran diversidad de alelos KIR que llevan a que la expresión de estos receptores sea bastante heterogénea en la población8. Además, como se mencionó, la expresión de estos receptores varía entre las subpoblaciones de células NK de un mismo individuo, lo cual se asocia a la actividad funcional de estas células8.
Subpoblaciones de células NK. Mediante citometría de flujo se pueden establecer las siguientes subpoblaciones de células NK en sangre periférica, en un gráfico de puntos y basándose en la expresión de CD56 y CD16 en células mononucleares CD3−. A) CD56bright. B) CD56dim CD16− C) CD56dim CD16+. D) CD56−.
En general, las células NK que expresan CD56dim tienen una alta actividad citotóxica y expresan altas cantidades de perforina; además, expresan en alta densidad receptores que potencian su capacidad de responder frente a células anormales. Las células NK CD56bright tienen mayor capacidad de producción de citocinas inmunomoduladores, como interferón (IFN)-γ, factor de necrosis tumoral (TNF)-α, IL-12, IL-15 y factor estimulante de colonias de granulocitos y monocitos y presentan una menor capacidad citotóxica9. Esta subpoblación tiene una mayor expresión de CCR7 y de CD62L, lo que les permite migrar con facilidad a nódulos linfoides. Algunos autores las han clasificado como células NK reguladoras, debido a su capacidad para potenciar la respuesta de células dendríticas (CD) y, de esta manera, favorecer la respuesta de los linfocitos T (LT)10.
Activación y mecanismos efectores de las células natural killerLa activación de estas células está regulada por un balance complejo de las señales recibidas a partir de los receptores que expresan.
En general, las células NK pueden ser activadas por:
- 1.
Disminución en la expresión de HLA-I en la superficie de la célula diana, lo que reduce las señales inhibitorias recibidas a través de los receptores KIR6.
- 2.
Moléculas expresadas en células anormales que son reconocidas por los NCR7.
- 3.
Células con anticuerpos IgG unidos a la membrana plasmática, mediante un mecanismo denominado citotoxicidad celular mediada por anticuerpos (antibody dependent cell mediated cytotoxicity [ADCC]). Este mecanismo se lleva a cabo principalmente por las células CD16bright7.
- 4.
Interacción con las CD, la cual consiste en una comunicación recíproca, debido a que las CD inducen en las células NK la producción de IFN-γ, IL-12 y TNF-α, las cuales a su vez potencian la maduración de las CD11. Esta interacción también puede ser dependiente de contacto, donde participan receptores como NKp30, TRAIL y CD94-NKG2A11,12.
Recientemente, se ha postulado que las células NK requieren de al menos 2 señales que induzcan su activación, provenientes de los diferentes receptores que expresan. Es decir, que no solo la disminución en la expresión de HLA-I induce la activación de estas células, sino que además requieren de señales activadoras proporcionadas por los demás receptores, los cuales participan en la sumatoria de señales que define la actividad de las células NK13.
Una vez activadas, las células NK citotóxicas liberan perforinas y granzimas, e inducen la lisis de la célula por un mecanismo similar a los LT CD8+. Las perforinas son proteínas que se integran a la membrana celular e inducen la formación de poros que provocan lisis osmótica de la célula blanco. Por su parte, las granzimas entran a la célula por medio de endocitosis e inducen apoptosis celular mediante la activación de caspasas. De otro lado, la activación de las células NK productoras de citocinas resulta en la secreción de IFN-γ, TNF-α, IL-17, IL-12, proteína inflamatoria de macrófagos (MIP-1)-α, MIP-1β e IL-1B, las cuales amplifican la respuesta inmunitaria, contribuyendo con el control de la replicación viral14. El IFN-γ es una de las citocinas más importantes producidas por las células NK, ya que activa los macrófagos, potencia la fagocitosis e induce la actividad microbicida. Además, las células NK potencian las respuestas tipo Th1 de los LT ayudadores, por la inducción de la producción de IL-12 por parte de los macrófagos y CD. Sin embargo, la activación de las células NK también puede tener como consecuencia la producción de IL-10, regulando negativamente la respuesta del sistema inmunitaria15. Aunque este tópico aún no ha sido bien estudiado, demuestra que las células NK tienen una gran influencia sobre la especialización de la respuesta del sistema inmunitario, tanto innata como adaptativa.
Infección por el virus de la inmunodeficiencia humana tipo-1: heterogeneidad de la progresión a sidaLa infección por el VIH-1 induce la eliminación masiva de LT CD4+ y alteraciones funcionales en varios componentes del sistema inmunológico. Un evento importante en la patogénesis del VIH-1 es la activación inmunológica excesiva, o hiperactivación inmunitaria, la cual induce apoptosis y agotamiento de una gran cantidad de subpoblaciones celulares, incluyendo las células NK16.
Sin embargo, la exposición al VIH-1 no siempre conduce a infección. Existen grupos de individuos que, a pesar de exponerse por diferentes vías y en múltiples ocasiones al virus, no presentan evidencia clínica ni serológica de la infección, conocidos como expuestos seronegativos (HIV exposed seronegative individuals [HESN])17. Entre los individuos que adquieren la infección, la evolución clínica en ausencia de terapia antirretroviral es variable; algunos individuos evolucionan de una forma típica o rápida a sida, mientras que otros, denominados progresores lentos (long term non-progresors [LTNP]) permanecen por más de 8-10 años sin un deterioro inmunológico evidente e incluso algunos de ellos nunca progresan a sida18. Así mismo, existen personas que controlan la replicación viral, al menos durante un año, presentando cargas virales indetectables o muy bajas (controladores élite o virémicos, respectivamente)18. Así, la existencia de individuos HESN, LTNP y de controladores hace evidente la existencia de mecanismos de resistencia a la infección y a la progresión a sida.
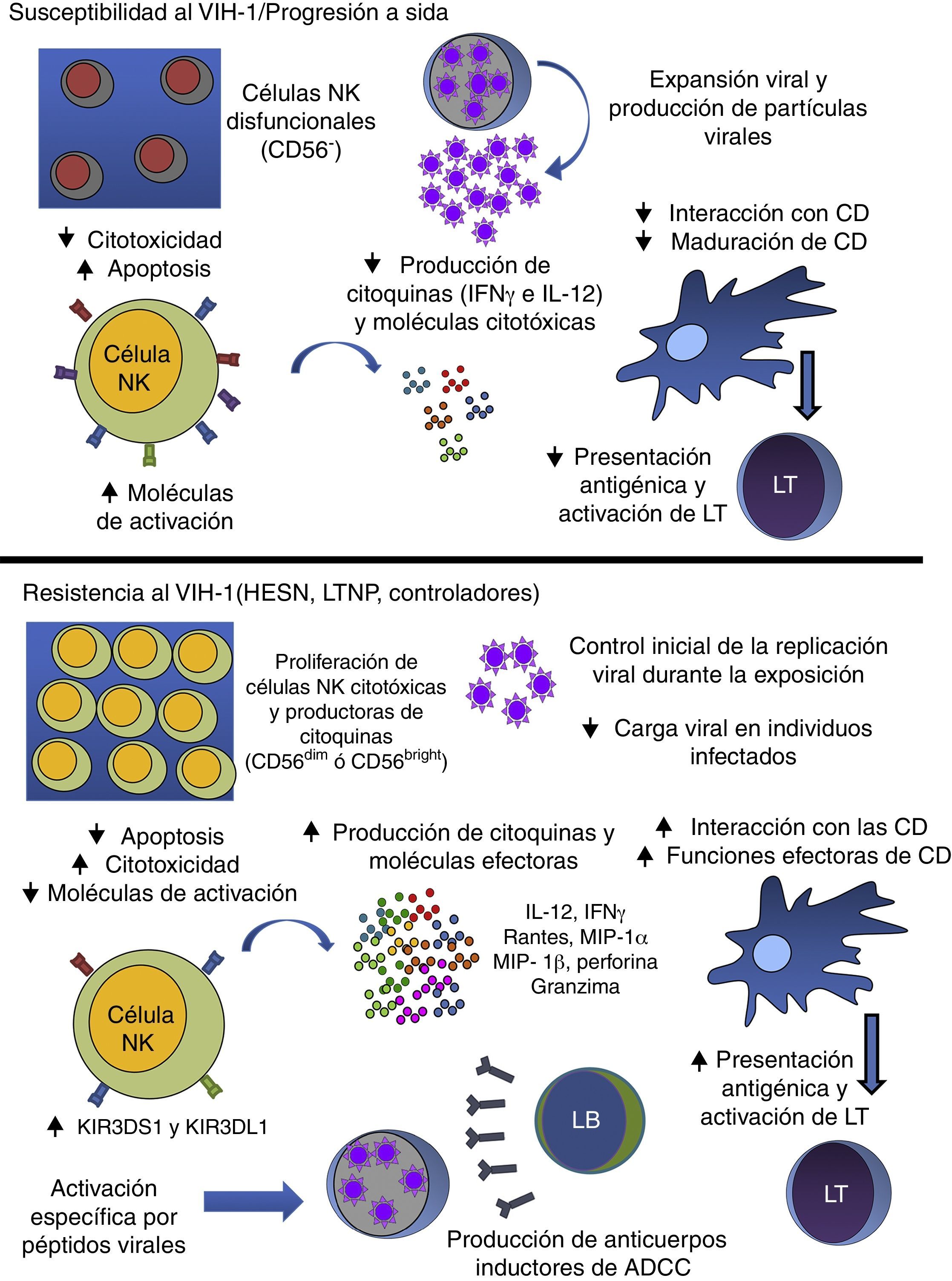
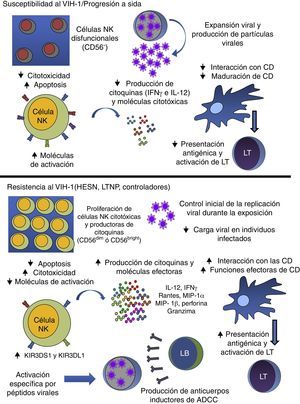
Alteraciones de las células natural killer durante la infección por el virus de la inmunodeficiencia humana tipo-1Durante la infección por el VIH-1, se observan diversas alteraciones en las diferentes poblaciones celulares del sistema inmunitario. Sin embargo, las alteraciones en las células NK, tanto en frecuencia como en su capacidad funcional (defectos mediados por la interacción de proteínas virales con receptores como el α4β7), son tan marcadas que incluso algunos estudios han propuesto emplearlas como marcador de progresión19. Los cambios en la frecuencia se deben a la apoptosis inducida por activación, por efecto de algunas proteínas virales como gp120 y por su susceptibilidad a la infección, ya que estas células pueden expresar los receptores y correceptores virales20.
Las alteraciones funcionales se dan en las diferentes subpoblaciones de células NK. La expansión de la subpoblación de células NK CD56− (células con baja capacidad citotóxica y de producción citocinas) es uno de los principales defectos que se presentan en los individuos infectados21; estas células se expanden como un mecanismo de compensación ante la disminución de la frecuencia de las demás subpoblaciones de células NK (fig. 2). Se ha postulado que las alteraciones funcionales de las células NK CD56− se deben a que estas células presentan una alta expresión de las formas inhibitorias de los receptores KIR22.
Papel de las células NK durante la infección por el VIH-1. Las células NK tienen un papel fundamental en la respuesta durante la infección por el VIH-1. Sin embargo, en los individuos susceptibles al VIH-1 y en aquellos que progresan rápidamente a sida, el virus altera la frecuencia y la función de las células NK, llevando a una baja respuesta antiviral, evidenciada por la baja producción de moléculas citotóxicas y citocinas, como IFNγ e IL-12, afectando a su interacción con las células dendríticas, y al favorecimiento de la replicación viral. En los casos en los que las células NK responden de una manera efectiva, se observa una baja susceptibilidad a la infección (individuos HESN) o un control de la replicación viral a largo plazo (individuos LTNP y controladores). Dicha respuesta antiviral incluye la producción de citocinas/quimiocinas y moléculas efectoras, como las perforinas y granzimas, así como una interacción efectiva con las células dendríticas, favoreciendo el establecimiento de una respuesta inmunitaria adaptativa que potencie los mecanismos de las células NK, como en el caso de la ADCC.
ADCC: citotoxicidad celular mediada por anticuerpos; CD: células dendríticas; HESN: expuestos seronegativos; IFN-γ: interferón gamma; IL-12: interleucina 12; LB: linfocitos B; LT: linfocitos T; LTNP: progresores lentos.
Varias proteínas del VIH-1 tienen un efecto directo sobre la actividad de las células NK. En este sentido, se demostró que las proteínas Vpu, Tat, Nef y gp120 alteran la expresión de los receptores asociados a activación de las células NK, disminuyen la actividad citotóxica, inducen apoptosis y afectan la interacción con otras células del sistema inmunitario, como las CD8. Adicionalmente, durante la infección por VIH-1 las células NK producen menor cantidad de IFN-γ e IL-12, comprometiendo la maduración de las CD (fig. 2)19. Las CD inmaduras tienen menor capacidad de presentar antígenos, afectando a la respuesta adaptativa pero también tienen una menor capacidad de transferir partículas virales a los LT, comparadas con las CD que se maduran por medio de la interacción con las células NK23.
Por otra parte, los estudios en pacientes infectados por el VIH-1 muestran que las células NK tienen una alta expresión de CD69 y HLA-DR, que están asociadas a activación celular. Sin embargo, estas células expresan niveles bajos del receptor activador NKp44 y de CD25, por lo que no se expanden ante la presencia de IL-2, indicando que tienen una activación incompleta. De esta manera, el incremento de CD69 y HLA-DR es solo una respuesta al estímulo constante, pero la alteración en su capacidad funcional no les permite responder adecuadamente y, por el contrario, sufren apoptosis inducida por activación24. De la misma manera, la ADCC se ve afectada durante la infección por el VIH-1 y, en general, se disminuyen todas las señales activadoras dependientes de los dominios ITAM, lo que reduce la respuesta de las células NK. Estas alteraciones se mantienen incluso en los pacientes con supresión de la replicación viral mediante la terapia antirretroviral de gran actividad (TARGA)25,26.
Frecuentemente, durante las infecciones virales se presenta una disminución en la expresión de las moléculas de HLA con el fin de reducir la presentación antigénica y, de esta manera, evadir la respuesta mediada por los LT. Esta disminución de HLA es uno de los principales estímulos para activar la respuesta de las células NK. Sin embargo, el VIH-1 tiene la capacidad de reducir selectivamente la expresión de algunas moléculas de HLA mediante la proteína Nef, la cual acelera la endocitosis o induce la retención en el aparato de Golgi de HLA-A y HLA-B, pero no de HLA-C27. Debido a que este último es un potente ligando para los receptores KIR inhibidores, no se induce la activación de las células NK. Adicionalmente, el virus también altera la expresión de los receptores NKp46, KIR2DS1 y KIR2DL1, lo cual se asocia a una baja actividad de estas células y a una alta viremia, efecto que permanece en individuos con TARGA supresor20,28. Además, en los pacientes infectados, las células NK podrían estar mediando un mecanismo de eliminación de linfocitos CD4+ mediado por NKp44. Los estudios han indicado que en las células CD4+ de los pacientes infectados se induce una alta expresión del ligando de NKp44 (NKp44L), lo que convierte a los linfocitos CD4+ en células altamente susceptibles a la lisis mediada por las células NK29. De esta manera, el virus logra alterar tanto la respuesta del sistema inmunitario innato, afectando al establecimiento de la inmunidad adaptativa y propiciando un ambiente favorable para su replicación y diseminación a diferentes órganos.
Estos hallazgos indican que en los individuos infectados por VIH-1 el virus altera los mecanismos citotóxicos de respuesta del sistema inmunitario para potenciar la patogénesis de la infección y que el tratamiento antirretroviral, aunque restablece parcialmente la actividad de las células NK, es incapaz de revertir los efectos deletéreos producidos por la replicación viral en las etapas temprana y crónica de la infección30.
Las células natural killer y la resistencia al virus de la inmunodeficiencia humana tipo-1Debido a las características de la infección por el VIH-1, las células con actividad citotóxica tienen una participación crucial en la respuesta inmunitaria contra el virus31. En este sentido, la respuesta de los linfocitos T CD8+ con capacidad citotóxica ha sido ampliamente estudiada como mecanismo de resistencia al VIH-1 y, de hecho, varias investigaciones han mostrado que estas células están involucradas en la disminución inicial de la viremia durante la infección aguda y limitan la replicación viral en estadios crónicos de la enfermedad32. Recientemente, los ensayos de vacunas en macacos han mostrado que en animales inmunizados e infectados por el virus de la inmunodeficiencia simiana, a pesar de que la vacuna no inhibe la infección, algunos animales logran controlar la carga viral por medio de la respuesta citotóxica de los linfocitos T CD8+ específicos del virus33. En forma similar, el efecto de las células NK en el control de la replicación del VIH-1 también ha sido evidenciado en diferentes estudios. De esta manera, cuando se evalúa el papel de estas células en los individuos que presentan resistencia natural a la infección o a la progresión, se han identificado varias diferencias cuando se comparan con los individuos que progresan a sida (fig. 2). En los HESN se ha demostrado que las células NK: a) presentan alta producción de citocinas, principalmente IFN-γ4,8,17; b) tienen un incremento en su capacidad para degranularse, asociada a su capacidad citotóxica28, y c) expresan alelos KIR y HLA asociados a alta actividad funcional34. De forma similar, los individuos que controlan la replicación viral y progresan de forma lenta a sida: a) expresan alelos de los KIR asociados a una respuesta más eficiente; b) mantienen niveles normales de células NK con perfil citotóxico y/o polifuncional, y baja frecuencia de las subpoblaciones de células NK disfuncionales, y c) presentan mayor actividad de ADCC35.
Los estudios recientes han hecho evidente el gran impacto que tiene en la actividad de las células NK la expresión de algunas combinaciones de alelos de HLA y KIR. Específicamente, los individuos infectados que expresan el alelo del KIR3DS1 (receptor activador) y alelos de HLA clase i que codifican una isoleucina en la posición 80 (HLA-Bw480I) exhiben una progresión lenta a sida. Cabe anotar que el HLA-Bw480I incluye alelos como HLA-B57 y HLA-27, los cuales han sido fuertemente asociados a resistencia a la progresión a sida36. Se ha observado que los individuos que expresan la combinación KIR3DS1/Bw4-80I tienen células NK con mayor capacidad citotóxica, de producción de IFN-γ y de suprimir la replicación viral37, indicando que a través de la actividad de las células NK es que logran el control de la replicación viral. La expresión de estos alelos también se ha encontrado presente en los controladores élite, sustentando aún más esta hipótesis38. Otro alelo de KIR que ha sido asociado a resistencia a la progresión es KIR3DL1 (receptor inhibidor), cuya frecuencia se encontró aumentada en individuos LTNP39. La expresión de este alelo en conjunto con HLA-Bw480I también ha mostrado un efecto protector en los individuos HESN40. Las células de los individuos que expresan esta combinación producen grandes cantidades de CD107a (marcador de degranulación), IFN-γ y TNF-α39. Una posible explicación para entender la participación de este receptor inhibidor en el control viral podría darse en el contexto de la maduración de las células NK en médula ósea, en donde estas células regulan positivamente la expresión de los KIR, se educan y se seleccionan sobre la base del nivel de expresión de HLA41. De esta manera, las células que salen a circulación expresando altas cantidades de estos KIR requieren alta expresión de HLA, por lo que pequeños cambios en el nivel de expresión de estas moléculas producidos por la infección por VIH-1 reducirían las señales inhibitorias, llevando a un fenotipo de activación de las células NK13.
Cuando se evalúan las subpoblaciones de células NK de LTNP, se puede observar que hay un incremento de las células citotóxicas CD56dim y que conservan bajos niveles de células CD56− (células disfuncionales), comparadas con los individuos progresores21 (fig. 2). En los individuos controladores, se demostró una baja expresión de Siglec-7, marcador temprano de hiperactivación. Además, estos individuos, a diferencia de los progresores, no presentan disminución en la expresión de NKp30 y NKp46, y su frecuencia y función son similares a las de los individuos sanos42.
También se ha visto que las subpoblaciones de células NK pueden tener un perfil polifuncional, ya que en pacientes controladores se ha visto un alto porcentaje de células CD56bright (57%), las cuales tienen una alta capacidad para degranularse, indicando que estas células tienen una plasticidad que les permite responder por diferentes mecanismos ante procesos infecciosos43.
Nuestros estudios en individuos controladores del VIH-1 han mostrado que, en algunos de ellos, las subpoblaciones de células NK están conformadas casi exclusivamente por células CD56bright o CD56dim CD16−, es decir, que presentan una muy baja o nula proporción de células que expresen el CD16, contrario a lo que hemos encontrado en individuos progresores. Aunque anteriormente se consideraba que estas subpoblaciones celulares eran principalmente productoras de citocinas, los reportes recientes han mostrado que también tienen potencial citotóxico, por lo que una combinación de estos 2 mecanismos efectores podría contribuir con el control de la replicación viral. Cabe anotar que en estos individuos hemos observado una frecuencia normal de células NK y una baja proporción de células NK disfuncionales del fenotipo CD56−, cuando se comparan con individuos sanos. Estos hallazgos indican que las células NK participan activamente en la respuesta contra el VIH-1 y que estas subpoblaciones celulares podrían estar contribuyendo con la inhibición de la replicación viral (datos sin publicar).
Finalmente, en cuanto a la producción de citocinas, los estudios muestran que las células NK de controladores élite producen niveles más altos de RANTES, MIP-1α y MIP-1β, comparados con los pacientes virémicos. Existe una correlación inversa entre la producción de estas quimiocinas y la carga viral. Vale la pena resaltar que un estudio mostró que tanto la capacidad citotóxica y de producción de quimiocinas es similar en las células NK y en los LT CD8+, indicando que las células NK tienen la capacidad de controlar la infección por el VIH-1 de una forma tan eficiente como lo hacen los LT44. Estos datos indican que las células de estos pacientes se preservan durante la infección y pueden contribuir con el control eficiente de la replicación viral.
Las células natural killer y su papel en tejido linfoide asociado a la mucosa gastrointestinal durante la infección por virus de la inmunodeficiencia humana tipo-1La infección por el VIH-1 tiene un impacto inicial mucho mayor sobre el tejido linfoide de la mucosa intestinal que sobre cualquier otro componente del sistema inmunitario. La destrucción de este tejido induce la pérdida de la integridad de esta mucosa y favorece la translocación de microorganismos de la luz intestinal a la circulación sistémica. Como resultado, se incrementa el número de células activadas susceptibles a la infección viral, la muerte celular inducida por activación y la anergia de células activadas, principalmente de LT CD4+16.
Las células NK de GALT residen principalmente en los espacios intraepiteliales del tracto gastrointestinal y en la lámina propia, donde predominan las de fenotipo CD56bright o CD56dim45. La frecuencia de las células NK intraepiteliales y de la lámina propia se reduce durante la infección por el VIH-146. Sin embargo, estas alteraciones están fuertemente correlacionadas con el nivel de replicación viral, ya que los pacientes tratados con TARGA que logran supresión de la carga viral muestran un incremento en las células NK intraepiteliales47. Así mismo, los estudios en macacos Rhesus (Macaca mulatta) han indicado que la actividad de estas células se altera, ya que la infección por el virus de la inmunodeficiencia simiana reduce la producción de citocinas y afecta a la migración de las células NK al tejido linfoide, debido a la disminución en la expresión de los receptores de homing CCR7 y CD62L45. Aunque son pocos los estudios que evalúan el papel de las células NK en GALT durante la infección por el VIH-1, se ha demostrado que en los LTNP que expresan la combinación KIR/HLA, asociada a resistencia (KIR3DS1-Bw4-80I o KIR3DL1-Bw4-80I), presentan una acumulación de células NK intraepiteliales que se correlacionan positivamente con el recuento de linfocitos T CD4+4.
En nuestra cohorte de individuos controladores del VIH-1 hemos observado una frecuencia más alta de células NK en GALT, comparado con los individuos progresores. Actualmente, estamos explorando si este hallazgo se correlaciona con una respuesta efectora eficiente por parte de estas células y si esto podría estar asociado a la baja carga viral que presentan estos individuos (datos sin publicar).
Todos estos hallazgos indican que las células NK podrían contribuir al mantenimiento de la estructura y la función del GALT, y de esta manera reducir los efectos producidos por las alteraciones en este tejido durante la infección por el VIH-1.
¿Las células natural killer pueden reconocer específicamente péptidos del virus de la inmunodeficiencia humana tipo-1?Los estudios más recientes indican que las células NK se activan de manera específica en respuesta a secuencias peptídicas y que incluso estas células podrían tener memoria inmunológica luego de la activación con citocinas48. En este sentido, los estudios realizados para determinar la importancia de los péptidos del VIH-1 en la activación de las células NK han mostrado que la naturaleza de los péptidos presentados afecta directamente a la activación de los mecanismos efectores de estas células, debido a que pueden afectar a la interacción entre los KIR y el HLA49. Inicialmente, se consideró que la respuesta a péptidos del VIH-1 podría deberse principalmente a la respuesta de los LT CD4+, que potencian la respuesta de las células NK. Sin embargo, a pesar de que existe una comunicación recíproca entre los LT CD4+ y las células NK, los ensayos in vitro realizados en células NK purificadas estimuladas con un pool de péptidos del VIH-1 mostraron que su activación no depende de la respuesta de los LT50. Cuando se evalúa su asociación a la resistencia al VIH-1, se observa que las células NK específicas del VIH-1 tienen una magnitud y frecuencia alta en individuos controladores y están asociadas a progresión lenta a sida, con una potente respuesta adaptativa y con protección de la infección por VIH-1 en niños nacidos de madres seropositivas50,51. Una posible explicación a este hallazgo es que existen péptidos que no permiten la interacción KIR/HLA, lo que reduce las señales inhibitorias y lleva a la degranulación de las células NK49. La asociación que existe entre la resistencia al VIH-1 y la presencia de KIR3DL1 y HLA-Bw4 podría estar mediada por la secuencia y la naturaleza de los péptidos presentados, principalmente en los aminoácidos de las posiciones 7 y 8, lo que tiene como consecuencia una débil interacción entre estas 2 moléculas, incrementando la lisis de las células infectadas52,53. Este hallazgo corrobora lo que se postuló previamente acerca de que los KIR no interactúan únicamente con la molécula de HLA, sino que existe una interacción que involucra la unión KIR/HLA/péptido y por esto la configuración del péptido cobra una gran importancia cuando se estudia la complejidad de la activación de las células NK. Otros autores han postulado que esta activación específica podría estar mediada por la presencia de anticuerpos, ya que los ensayos han mostrado que las células NK responden principalmente a péptidos de Env, pero que esta activación requiere la presencia de la IgG específica en plasma, sugiriendo que la eliminación que se observa de las células infectadas estaría mediada por ADCC51. Vale la pena aclarar que esta respuesta a péptidos del VIH-1 no se ha observado en individuos sanos, indicando que debe haber una exposición previa al virus in vivo para activar las células NK mediante la estimulación con péptidos51. El papel de la ADCC es el que actualmente se está estudiando con más profundidad, debido a que varios reportes apuntan a que este es el principal mecanismo de respuesta de las células NK activadas por péptidos del VIH-151. Sin embargo, aún no es claro el mecanismo de activación de las células NK estimuladas con péptidos del VIH-1, por lo que este tópico requiere estudios adicionales. Claramente en la respuesta a estos péptidos también intervienen en la actividad de los CTL y en el desarrollo de mutaciones virales (mutantes de escape), por lo que el papel de las células NK podría ir más allá de la respuesta innata del sistema inmunitario.
Las células natural killer en inmunoterapia y su uso potencial en la prevención y el tratamiento del virus de la inmunodeficiencia humana tipo-1El potencial terapéutico de las células NK es objeto de estudio principalmente en el tratamiento del cáncer. Sin embargo, debido a los hallazgos en el campo de la resistencia a la infección por VIH-1 y a la progresión a sida, cada vez se resalta la importancia de estudiar estas células como blanco potencial en el desarrollo de vacunas o inmunoterapia. En este sentido, se ha postulado, basado en hallazgos de reducción exitosa de procesos tumorales, que en los pacientes infectados por VIH-1 podría ser efectiva la administración de anticuerpos dirigidos contra el VIH-1 que tengan una región Fc con capacidad de potenciar la respuesta de ADCC mediada por las células NK54. Incluso se ha pensado que esta intervención podría ser evaluada en el desarrollo de vacunas preventivas. Así mismo, se ha postulado el uso de anticuerpos que inhiban la interacción entre los KIR inhibidores y las moléculas de HLA, con el fin de inducir la activación de las células NK. Además, debido a que los LTNP y los controladores presentan una frecuencia mayor de células NK, comparado con los progresores, la expansión in vitro de las células NK y su reinfusión también podría ser empleada en inmunoterapia. Este procedimiento ha sido bien tolerado en investigaciones en humanos, por lo que los estudios clínicos en este campo están cada vez más cerca55,56.
Por último, es importante resaltar que esta la respuesta de las células NK a péptidos específicos del VIH-1 tiene un enorme potencial en el desarrollo de vacunas. En el ensayo clínico RV144, uno de los que ha tenido mayor impacto hasta la fecha, se demostró que la vacuna candidata, que ofreció un 31% de protección, indujo la producción de altos niveles de anticuerpos IgG dirigidos contra la envoltura viral pero con poca capacidad neutralizante, indicando un importante papel de la ADCC en la protección observada57. Los estudios posteriores mostraron una correlación inversa entre la respuesta de ADCC y el riesgo de infección58, lo cual ha promovido el estudio del papel de la ADCC en el desarrollo de las vacunas contra el VIH-1 y ha hecho aún más evidente la importancia de la actividad de las células NK en el control de la replicación del virus y en el desarrollo de vacunas59. De hecho, una investigación que evaluó la respuesta de ADCC de las células NK frente a péptidos de VIH-1 unidos en la membrana celular reportó que estas células son altamente susceptibles a la acción citotóxica de las células NK60. Así mismo, cuando se evaluó la respuesta de las células NK en pacientes inmunizados con CD derivadas de monocitos pulsadas con virus autólogos, se encontró que en estos pacientes se incrementaron la respuesta inflamatoria y la capacidad citolítica de las células NK61.
Sin embargo, se requieren investigaciones más profundas en este campo y principalmente entender las interacciones e implicaciones que tienen las células NK en el sistema inmunitario adaptativo que permita el desarrollo de modelos terapéuticos y preventivos más eficaces.
ConclusionesLas células NK constituyen una población celular que se activa de forma compleja y que responde mediante diversos mecanismos, que no solo llevan a la eliminación de la célula anormal, sino que también influyen en la activación y la respuesta de otras células de la inmunidad innata y adaptativa. Durante la infección por el VIH-1, estas células exhiben severas alteraciones que reducen la posibilidad de eliminar las células infectadas y de controlar la diseminación del virus durante la fase aguda de la infección. Sin embargo, en los individuos HESN, LTNP y controladores, los estudios han indicado que la preservación de la frecuencia y la función de estas células está fuertemente asociada a la resistencia al VIH-1. Lo anterior, sumado a los hallazgos recientes que muestran que estas células pueden responder a péptidos del VIH-1, ha dado nuevas luces en la búsqueda de estrategias preventivas o terapéuticas que permitan disminuir la incidencia y la mortalidad por el VIH-1.
FinanciaciónCODI-Universidad de Antioquia, convocatoria mediana cuantía 2011; Estrategia para Sostenibilidad de Grupos 2013-2014 de la Universidad de Antioquia; Natalia Taborda recibió una beca de Colciencias «Convocatoria Nacional 511 para el estudio de Doctorado en Colombia año 2010».
Conflicto de interesesLos autores declaran que no tienen ningún conflicto comercial o de otro tipo.
CIHR IID&GH training Program of the University of Manitoba, Canadá.