La enfermedad cardiovascular (ECV) es la causa más frecuente de mortalidad en pacientes con diabetes tipo2 (DM2). En los últimos años, varios fármacos antihiperglucemiantes pertenecientes a dos familias terapéuticas, agonistas del receptor de GLP-1 (arGLP-1) e inhibidores del co-transportador sodio-glucosa tipo2 (iSGLT-2), han demostrado una reducción de la morbimortalidad cardiovascular (CV) en pacientes con DM2 y alto riesgo CV. Los iSGLT-2, a diferencia de los arGLP-1, también disminuyen el riesgo de hospitalización por insuficiencia cardiaca. Ambos grupos terapéuticos reducen la progresión de la enfermedad renal diabética (ERD). El mecanismo cardioprotector de los iSGLT-2 parece ser predominantemente hemodinámico y de aparición precoz, mientras que el de los arGLP-1 es fundamentalmente anti-aterosclerótico y de lenta instauración. En el momento actual diversas sociedades científicas recomiendan el uso preferente de arGLP-1 e iSGLT-2 con beneficio CV demostrado en los pacientes con DM2 y ECV o ERD.
Cardiovascular (CV) disease is the most common cause of mortality in patients with type2 diabetes (T2DM). In recent years, several glucose-lowering drugs from two therapeutic families, GLP-1 receptor agonists (GLP-1 RAs) and sodium-glucose co-transporter type 2 inhibitors (SGLT-2i), have shown a reduction in CV morbidity and mortality in patients with T2DM and high CV risk. SGLT-2i, unlike GLP-1 RAs, also reduce the risk of hospital admission due to heart failure. Both therapeutic groups reduce the progression of diabetic kidney disease (DKD). The cardioprotective mechanism of SGLT-2i appears to be predominantly haemodynamic and shows an early onset, while that of GLP-1 RAs is mostly anti-atherosclerotic with a slow and progressive onset. At present, several scientific societies recommend the preferential use of GLP-1 RAs and SGLT-2i, with demonstrated CV benefit in patients with T2DM and cardiovascular disease or DKD.
Los pacientes con diabetes mellitus tipo2 (DM2) tienen una reducción de la esperanza de vida en comparación con individuos sin diabetes. El 60% de la reducción de esperanza de vida en la población con DM2 es atribuible a causas cardiovasculares (CV). La DM2 es un factor de riesgo CV (FRCV) independiente y la mayoría de pacientes con DM2 tienen otros FRCV asociados, como hipertensión arterial (HTA), dislipemia, obesidad, sedentarismo, enfermedad renal crónica (ERC) o tabaquismo1. El Emerging Risk Factors Collaboration Study, un metaanálisis que combinó los datos de 820.900 personas de 97 estudios prospectivos, mostró que la razón de tasas (HR) ajustada de personas con DM2 fue un 80% mayor para la mortalidad de cualquier causa y un 132% mayor para mortalidad de causas vasculares en comparación con individuos sin diabetes2.
Además del aumento de riesgo de enfermedad cardiovascular (ECV) aterosclerótica (definida como enfermedad coronaria, enfermedad cerebrovascular o enfermedad arterial periférica), los pacientes con DM2 tienen un mayor riesgo de insuficiencia cardiaca (IC) y de ERC; en algunos estudios de seguridad CV los pacientes con estas comorbilidades se incluyen dentro de la cohorte de prevención secundaria, aunque no hayan sufrido previamente un evento CV. La prevalencia de IC en individuos con DM2 oscila entre el 10 y el 30% en estudios de intervención y afecta al 22% de pacientes mayores de 65años3. Se estima que entre el 12 y el 30% de pacientes con IC sintomática tienen un diagnóstico previo de DM4. La presencia de DM2 duplica las tasas de hospitalización por IC5 e incrementa el riesgo de mortalidad, tanto en pacientes con fracción de eyección preservada como en aquellos con fracción de eyección reducida6. El pronóstico CV también es peor en los pacientes con DM2 que asocian ERC, definida como albuminuria persistente, bajo filtrado glomerular estimado (FGe) o ambos, y que afecta aproximadamente al 35% de pacientes con DM27,8. Las tasas de enfermedad vascular aterosclerótica, IC, terapia de reemplazo renal y mortalidad se multiplican por 2-3 veces en pacientes con DM y ERC, y la supervivencia es inferior en individuos que presentan simultáneamente bajo FGe y albuminuria9.
La crisis del glucocentrismo, el precedente de la rosiglitazona y la nueva regulación de la FDAEl control glucémico intensivo reduce las complicaciones microvasculares de la DM2, por lo que, a pesar de no demostrar un claro efecto beneficioso sobre la morbimortalidad CV, la estrategia glucocéntrica se estableció hace varias décadas como el modelo terapéutico dominante en todos los consensos y recomendaciones para el tratamiento de esta enfermedad10,11. El periodo 2007-2008, sin embargo, marcó un hito histórico en el tratamiento farmacológico de la DM2, tras la aparición de varios estudios que han conducido a una revisión del modelo glucocéntrico intensivo y a un cambio en la normas regulatorias de los nuevos fármacos antihiperglucemiantes a lo largo de los últimos 10años. Por un lado, la rosiglitazona, un agonista del receptor PPARγ que había demostrado mayor durabilidad en el control glucémico que metformina o sulfonilureas en el estudio ADOPT12, parecía sin embargo incrementar en el famoso metaanálisis de Nissen el riesgo de infarto de miocardio (IAM) un 43% y mostraba una tendencia no significativa a aumentar un 64% el riesgo de mortalidad CV13, lo que disociaba los conceptos de control glucémico y protección CV. Por otro lado, en el estudio ACCORD el tratamiento antihiperglucemiante intensivo (cuyo objetivo era conseguir una HbA1c menor del 6%, frente al 7-7,9% en el grupo de tratamiento convencional) no solo no redujo la incidencia de morbimortalidad CV, sino que incrementó el riesgo de mortalidad por todas las causas en un 22%14. Varios metaanálisis posteriores sugirieron que el tratamiento intensivo de la hiperglucemia puede tener un efecto protector estadísticamente significativo, aunque modesto, sobre el IAM no mortal, pero sin efecto significativo sobre la mortalidad, el ictus o la IC15.
Hasta 2008, la aprobación de nuevos fármacos para tratar la diabetes se centró casi exclusivamente en la eficacia sobre la reducción de la HbA1c. Desde entonces, el panorama regulatorio ha cambiado considerablemente y las nuevas moléculas deben demostrar seguridad CV según los criterios establecidos por la Food and Drug Administration (FDA) en Estados Unidos y la European Medicines Agency (EMA) en Europa16. La FDA estableció en 2008 que la comercialización de un nuevo fármaco antihiperglucemiante requería un metaanálisis pre-aprobación de ensayos clínicos faseII/III en donde el límite superior del intervalo de confianza al 95% (IC95%) de la HR de morbimortalidad CV (definida como major cardiovascular events [MACE]) no podía ser >1,8, y preferiblemente debía ser <1,3. Si dicho límite superior se situaba entre 1,3 y 1,8, entonces se requería un estudio de seguridad CV post-aprobación17. En 2012, la EMA publicó nuevas recomendaciones que requerían la inclusión en el desarrollo clínico faseIII de una valoración de riesgo CV (bien con un metaanálisis de ensayos previos o bien con un ensayo clínico específico de 18-24meses de duración), pero no especificó límites numéricos para definir efectos CV adversos18. La mayoría de compañías han optado por llevar a cabo estudios de seguridad CV post-comercialización de no inferioridad (y en algunos casos con un objetivo de superioridad, es decir, límite superior del IC95% <1,0), incluso aunque se haya alcanzado el objetivo pre-comercialización del límite superior del IC95% <1,3. El comparador suele ser placebo (con algunas excepciones, como el estudio CAROLINA, que compara linagliptina frente a glimepirida, aún no finalizado); el objetivo compuesto, MACE 3 (muerte CV, IAM no mortal, ictus no mortal), aunque en algún estudio se ha expandido a un MACE de 4 componentes, y se busca un control glucémico similar entre las dos ramas del estudio, añadiendo si es preciso otros fármacos antihiperglucemiantes para lograr este objetivo. En la mayoría de estudios la hospitalización por IC o la progresión de enfermedad renal se han incluido como objetivos secundarios o de seguridad.
Estudios cardiovasculares previos al cambio regulatorio de 2008Los datos de seguridad CV en DM2 con fármacos antihiperglucemiantes antes de 2008 son limitados. Metformina mostró una reducción de morbimortalidad CV en un pequeño grupo de pacientes con DM2 de reciente diagnóstico, sobrepeso y bajo riesgo CV (n=342) en el estudio UKPDS frente a dieta, sulfonilureas o insulinas de primera generación19. La reducción de riesgo frente al tratamiento con dieta fue significativa para IAM (39%) y para mortalidad por todas las causas (36%) tras una mediana de seguimiento de 10,7años. Se observaron además mayores reducciones de riesgo de ictus y de mortalidad por todas las causas en pacientes tratados con metformina frente al tratamiento convencional, en comparación con las reducciones de riesgo logradas con sulfonilureas o insulina. Estos resultados hoy serían insuficientes para cualquier agencia reguladora por las propias limitaciones de diseño del estudio, tales como el tamaño muestral, la falta de enmascaramiento o la exclusión de pacientes con alto riesgo CV. De hecho, un reciente metaanálisis de ensayos aleatorizados que incluyó el UKPDS concluye que metformina tiene un efecto neutro sobre la incidencia de IAM y la morbimortalidad CV o por todas las causas20. En el ensayo clínico PROACTIVE (n=5.238, pacientes con ECV establecida), el agonista PPARγ pioglitazona 45mg/día indujo una reducción numérica pero no significativa frente a placebo en un resultado compuesto de mortalidad, IAM no mortal, ictus, síndrome coronario agudo (SCA), revascularización coronaria o de miembros inferiores y amputación por encima del tobillo en comparación con placebo (HR: 0,90; IC95%: 0,80-1,02; p=0,095)21. El objetivo compuesto secundario MACE 3 (mortalidad, IAM no mortal e ictus) se redujo significativamente un 16%, aunque hubo un aumento de la incidencia de IC.
Estudios cardiovasculares después de 2008 con resultado de no inferioridadTras el cambio regulatorio de 2008 comenzaron a publicarse los datos de múltiples estudios de seguridad CV con nuevos fármacos antihiperglucemiantes y también algunos con fármacos ya conocidos pero que se habían diseñado antes de la nueva normativa16. Paradójicamente, el estudio RECORD con rosiglitazona (n=4.447, población mayoritariamente en prevención primaria) no confirmó el aumento de riesgo CV sugerido tras el metaanálisis de Nissen, aunque sí mostró una duplicación en el riesgo de IC22. Este estudio no sirvió sin embargo para revertir la suspensión de comercialización de rosiglitazona en Europa. El estudio TOSCA-IT (n=3.028, población de bajo riesgo CV)23 comparó pioglitazona (dosis media 23mg/día) frente a sulfonilureas, sin mostrar superioridad de la pioglitazona en el MACE 4 (mortalidad total, IAM no mortal, ictus no mortal o revascularización coronaria), aunque tampoco se observó un mayor riesgo de IC. Se han publicado otros estudios de seguridad CV con pioglitazona (IRIS), nateglinida (NAVIGATOR) y acarbosa (STOP-NIDDM, ACE) pero en pacientes con intolerancia a la glucosa16, por lo que no serán incluidos en la presente revisión.
Dos insulinas tienen estudios de seguridad CV en pacientes con DM2: glargina U100 y degludec. En el estudio ORIGIN (n=12.537, población mixta en prevención primaria y secundaria), glargina U100 mostró no inferioridad en MACE3 o MACE5 (MACE 3+revascularización u hospitalización por IC) frente a tratamiento antihiperglucemiante convencional que no incluía inicialmente insulina, aunque incrementó el riesgo de hipoglucemias totales y graves24. En el estudio DEVOTE (n=7.237, población mixta en prevención primaria y secundaria) la insulina degludec mostró no inferioridad en MACE3 frente a glargina U100, pero redujo el riesgo de hipoglucemias graves un 40% y el de hipoglucemias graves nocturnas un 53%25.
Los cuatro estudios publicados con inhibidores de la dipeptidil-peptidasa 4 (iDPP-4), SAVOR-TIMI (saxagliptina, n=16.492, población mixta en prevención primaria y secundaria)26, EXAMINE (alogliptina, n=5.380, pacientes tras SCA)27, TECOS (sitagliptina, n=14.671, prevención secundaria)28 y CARMELINA (linagliptina, n=6.979, población mixta en prevención primaria y secundaria)29 no mostraron diferencias significativas frente a placebo en el objetivo primario (MACE), cumpliendo la no-inferioridad exigida por las agencias reguladoras. Otros resultados secundarios a resaltar en estos estudios fueron un incremento significativo del 27% en el riesgo de hospitalización por IC con saxagliptina (de causa aún no aclarada, aunque probablemente influyó un desequilibrio en factores basales de riesgo para IC en contra de saxagliptina) y una reducción del 14% en la progresión de albuminuria con linagliptina, aunque sin impacto sobre el objetivo compuesto renal.
En definitiva, los resultados neutros sucesivos de los estudios de seguridad CV referidos parecían confirmar la hipótesis de que los fármacos antihiperglucemiantes no tienen propiedades CV protectoras intrínsecas, hasta que todo cambió en el año 2015 con la publicación del estudio EMPA-REG OUTCOME.
La revolución de los fármacos antihiperglucemiantes tras 2015. Estudios de seguridad cardiovascular con inhibidores del co-transportador sodio-glucosa tipo 2 y agonistas del receptor de GLP-1En el año 2015 se publicaron los resultados del ensayo EMPA-REG OUTCOME, un estudio de 7.020 pacientes con DM2 en prevención secundaria en donde un inhibidor del co-transportador sodio-glucosa tipo 2 (iSGLT-2), empagliflozina 10 o 25mg/día, mostró una reducción significativa del 14% frente a placebo en el objetivo compuesto primario (MACE3), además de alcanzar reducciones significativas de la mortalidad CV, mortalidad por todas las causas, hospitalización por IC y progresión de la ERC30-32. El componente significativo del MACE3 fue la mortalidad CV; el IAM no mortal mostró una tendencia favorable no significativa, pero sin embargo el ictus mostró una tendencia desfavorable no significativa que se produjo en el periodo de seguimiento tras la suspensión del fármaco (tablas 1 y 2). Los resultados de morbimortalidad CV en EMPA-REG OUTCOME no pueden explicarse por las diferencias alcanzadas en diferentes FRCV y además se obtuvieron muy rápidamente (en los primeros 6meses tras la aleatorización), lo que desafiaba el concepto establecido de no beneficio CV con los fármacos antihiperglucemiantes. Posteriormente se han publicado otros dos estudios de seguridad CV con iSGLT-2: el programa CANVAS con canagliflozina (n=10.142, prevención primaria y secundaria) y el estudio DECLARE con dapagliflozina (n=17.160, prevención primaria y secundaria). En el programa CANVAS (en realidad el análisis agregado de dos estudios, CANVAS y CANVAS-R) canagliflozina 100 o 300mg consiguió una reducción significativa del MACE3, de la hospitalización por IC y de la progresión de la enfermedad renal frente a placebo33,34. Ninguno de los componentes del MACE3 alcanzó la significación estadística, pero todos ellos presentaban tendencia protectora. No se observó reducción significativa de la mortalidad CV o de la mortalidad por todas las causas (tablas 1 y 2). El estudio DECLARE con dapagliflozina 10mg mostró una reducción significativa vs placebo en el objetivo co-primario de muerte CV u hospitalización por IC, pero no en el objetivo co-primario MACE3, en donde solo alcanzó la no-inferioridad35. Tampoco se logró la superioridad en reducción de la mortalidad CV o de la mortalidad por todas las causas. (tablas 1 y 2). Conocemos a través de una nota de prensa el resultado positivo del estudio CREDENCE (canagliflozina 100mg vs placebo, n=4.401, pacientes con DM2 y ERC definida por FGe 30-90ml/min, albuminuria 300-5.000mg/g y tratamiento con bloqueantes del eje renina-angiotensina-aldosterona), cuyo objetivo era un compuesto de ERC terminal, duplicación de creatinina y muerte de causa renal o CV, que ha finalizado prematuramente por superioridad de canagliflozina36,37.
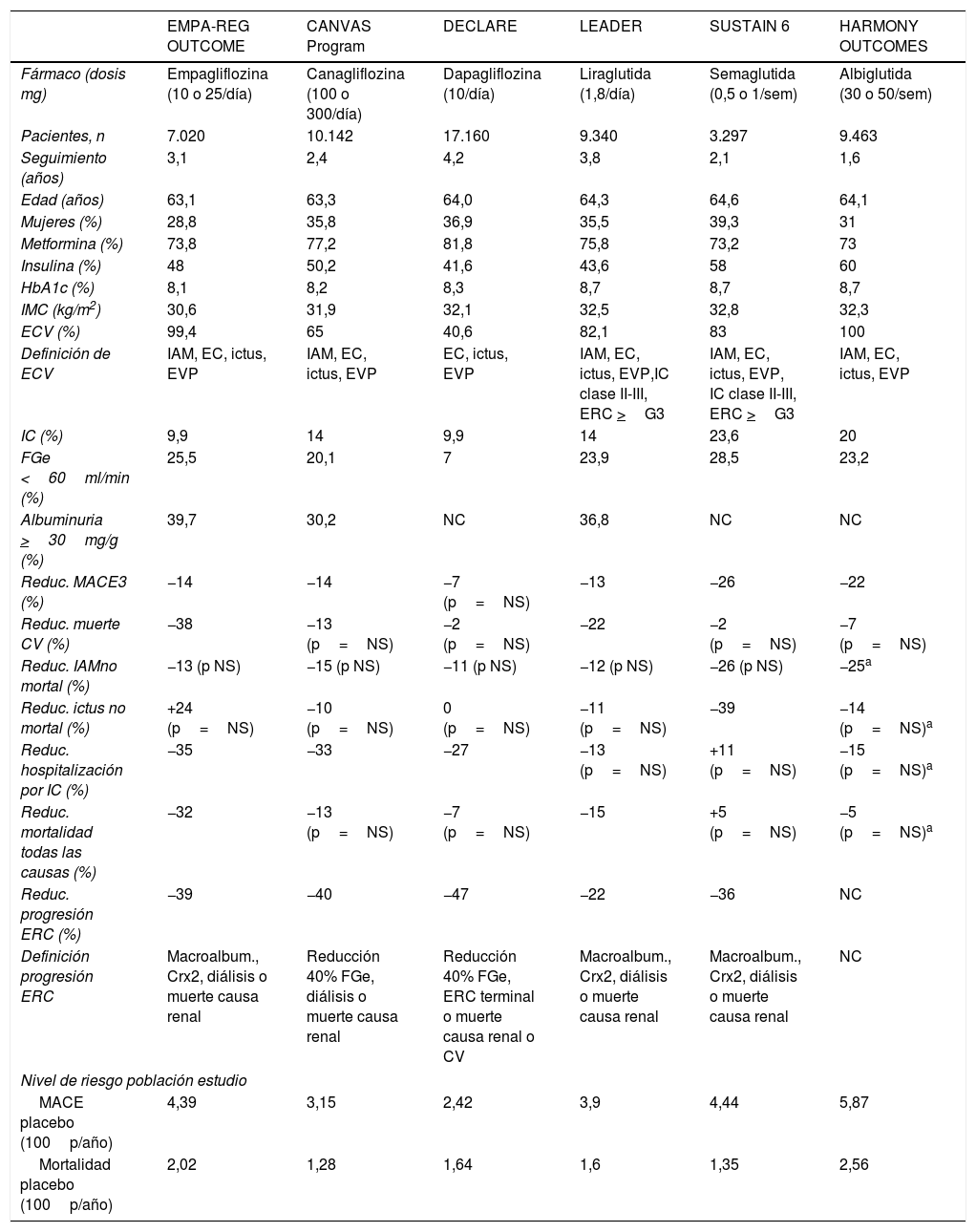
Resumen de las características basales y resultados primarios y secundarios de los estudios de seguridad CV con iSGLT-2 y arGLP-1 en donde se alcanza la superioridad estadística
| EMPA-REG OUTCOME | CANVAS Program | DECLARE | LEADER | SUSTAIN 6 | HARMONY OUTCOMES | |
|---|---|---|---|---|---|---|
| Fármaco (dosis mg) | Empagliflozina (10 o 25/día) | Canagliflozina (100 o 300/día) | Dapagliflozina (10/día) | Liraglutida (1,8/día) | Semaglutida (0,5 o 1/sem) | Albiglutida (30 o 50/sem) |
| Pacientes, n | 7.020 | 10.142 | 17.160 | 9.340 | 3.297 | 9.463 |
| Seguimiento (años) | 3,1 | 2,4 | 4,2 | 3,8 | 2,1 | 1,6 |
| Edad (años) | 63,1 | 63,3 | 64,0 | 64,3 | 64,6 | 64,1 |
| Mujeres (%) | 28,8 | 35,8 | 36,9 | 35,5 | 39,3 | 31 |
| Metformina (%) | 73,8 | 77,2 | 81,8 | 75,8 | 73,2 | 73 |
| Insulina (%) | 48 | 50,2 | 41,6 | 43,6 | 58 | 60 |
| HbA1c (%) | 8,1 | 8,2 | 8,3 | 8,7 | 8,7 | 8,7 |
| IMC (kg/m2) | 30,6 | 31,9 | 32,1 | 32,5 | 32,8 | 32,3 |
| ECV (%) | 99,4 | 65 | 40,6 | 82,1 | 83 | 100 |
| Definición de ECV | IAM, EC, ictus, EVP | IAM, EC, ictus, EVP | EC, ictus, EVP | IAM, EC, ictus, EVP,IC clase II-III, ERC >G3 | IAM, EC, ictus, EVP, IC clase II-III, ERC >G3 | IAM, EC, ictus, EVP |
| IC (%) | 9,9 | 14 | 9,9 | 14 | 23,6 | 20 |
| FGe <60ml/min (%) | 25,5 | 20,1 | 7 | 23,9 | 28,5 | 23,2 |
| Albuminuria >30mg/g (%) | 39,7 | 30,2 | NC | 36,8 | NC | NC |
| Reduc. MACE3 (%) | −14 | −14 | −7 (p=NS) | −13 | −26 | −22 |
| Reduc. muerte CV (%) | −38 | −13 (p=NS) | −2 (p=NS) | −22 | −2 (p=NS) | −7 (p=NS) |
| Reduc. IAMno mortal (%) | −13 (p NS) | −15 (p NS) | −11 (p NS) | −12 (p NS) | −26 (p NS) | −25a |
| Reduc. ictus no mortal (%) | +24 (p=NS) | −10 (p=NS) | 0 (p=NS) | −11 (p=NS) | −39 | −14 (p=NS)a |
| Reduc. hospitalización por IC (%) | −35 | −33 | −27 | −13 (p=NS) | +11 (p=NS) | −15 (p=NS)a |
| Reduc. mortalidad todas las causas (%) | −32 | −13 (p=NS) | −7 (p=NS) | −15 | +5 (p=NS) | −5 (p=NS)a |
| Reduc. progresión ERC (%) | −39 | −40 | −47 | −22 | −36 | NC |
| Definición progresión ERC | Macroalbum., Crx2, diálisis o muerte causa renal | Reducción 40% FGe, diálisis o muerte causa renal | Reducción 40% FGe, ERC terminal o muerte causa renal o CV | Macroalbum., Crx2, diálisis o muerte causa renal | Macroalbum., Crx2, diálisis o muerte causa renal | NC |
| Nivel de riesgo población estudio | ||||||
| MACE placebo (100p/año) | 4,39 | 3,15 | 2,42 | 3,9 | 4,44 | 5,87 |
| Mortalidad placebo (100p/año) | 2,02 | 1,28 | 1,64 | 1,6 | 1,35 | 2,56 |
EC: enfermedad coronaria; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; EVP: enfermedad vascular periférica; FGe: filtrado glomerular estimado; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; NC: no consta.
Todas las reducciones de riesgo son estadísticamente significativas salvo en aquellas con p=NS. Todas las comparaciones son frente a placebo.
En el estudio HARMONY el IAM y el ictus fueron definidos como mortales y no mortales, y la IC se midió como un objetivo compuesto de muerte CV u hospitalización por IC.
Fuente: referencias 30-35,38-41.
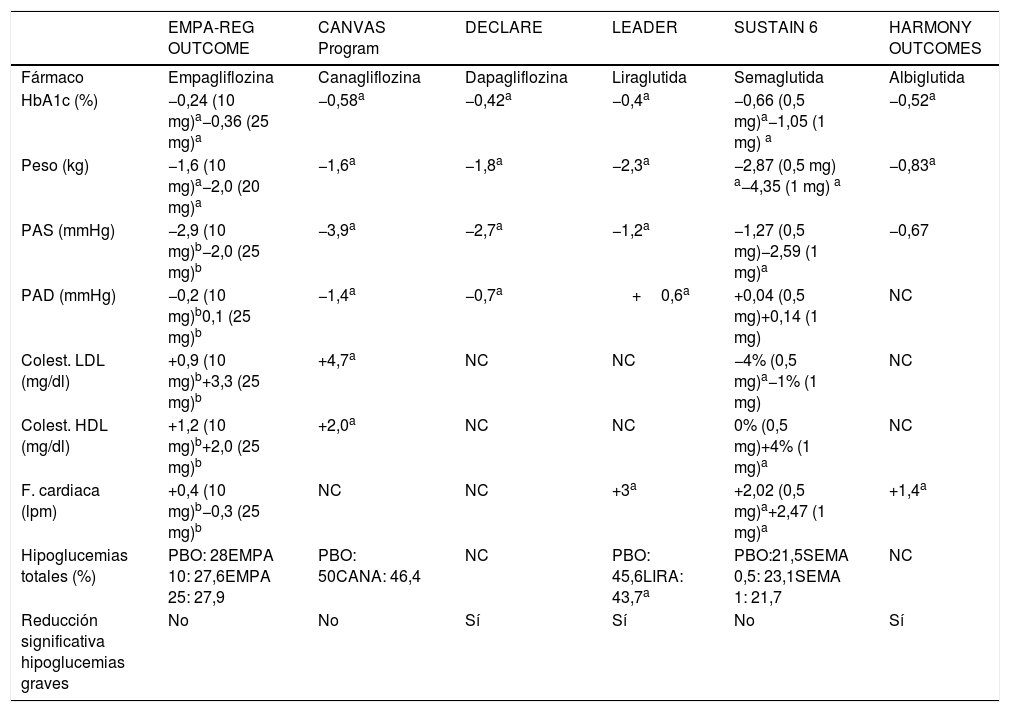
Diferencias finales de los grupos de tratamiento activo y placebo en factores de riesgo CV e hipoglucemias en los estudios de seguridad cardiovascular
| EMPA-REG OUTCOME | CANVAS Program | DECLARE | LEADER | SUSTAIN 6 | HARMONY OUTCOMES | |
|---|---|---|---|---|---|---|
| Fármaco | Empagliflozina | Canagliflozina | Dapagliflozina | Liraglutida | Semaglutida | Albiglutida |
| HbA1c (%) | −0,24 (10 mg)a−0,36 (25 mg)a | −0,58a | −0,42a | −0,4a | −0,66 (0,5 mg)a−1,05 (1 mg) a | −0,52a |
| Peso (kg) | −1,6 (10 mg)a−2,0 (20 mg)a | −1,6a | −1,8a | −2,3a | −2,87 (0,5 mg) a−4,35 (1 mg) a | −0,83a |
| PAS (mmHg) | −2,9 (10 mg)b−2,0 (25 mg)b | −3,9a | −2,7a | −1,2a | −1,27 (0,5 mg)−2,59 (1 mg)a | −0,67 |
| PAD (mmHg) | −0,2 (10 mg)b0,1 (25 mg)b | −1,4a | −0,7a | +0,6a | +0,04 (0,5 mg)+0,14 (1 mg) | NC |
| Colest. LDL (mg/dl) | +0,9 (10 mg)b+3,3 (25 mg)b | +4,7a | NC | NC | −4% (0,5 mg)a−1% (1 mg) | NC |
| Colest. HDL (mg/dl) | +1,2 (10 mg)b+2,0 (25 mg)b | +2,0a | NC | NC | 0% (0,5 mg)+4% (1 mg)a | NC |
| F. cardiaca (lpm) | +0,4 (10 mg)b−0,3 (25 mg)b | NC | NC | +3a | +2,02 (0,5 mg)a+2,47 (1 mg)a | +1,4a |
| Hipoglucemias totales (%) | PBO: 28EMPA 10: 27,6EMPA 25: 27,9 | PBO: 50CANA: 46,4 | NC | PBO: 45,6LIRA: 43,7a | PBO:21,5SEMA 0,5: 23,1SEMA 1: 21,7 | NC |
| Reducción significativa hipoglucemias graves | No | No | Sí | Sí | No | Sí |
lpm: latidos por minuto; NC: no constan datos; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
La segunda clase farmacológica que ha mostrado beneficios CV es la de los agonistas del receptor de GLP-1 (arGLP-1). Hasta la fecha se han publicado tres estudios con resultado de superioridad en el objetivo compuesto primario MACE 3: LEADER (liraglutida, n=9.340, prevención primaria y secundaria), SUSTAIN6 (semaglutida, n=3.297, estudio de no inferioridad pre-aprobación en prevención primaria y secundaria) y HARMONY OUTCOMES (albiglutida, n=9.463, prevención secundaria) (tablas 1 y 2). En el estudio LEADER liraglutida 1,8mg por vía subcutánea (s.c.) al día redujo de forma significativa frente a placebo el MACE3, la mortalidad CV, la mortalidad por todas las causas y la progresión de la ERC38,39. El componente significativo del MACE3 fue la mortalidad CV, y el resto mostraron tendencia protectora. No hubo reducción significativa en la hospitalización por IC. En el estudio SUSTAIN6 semaglutida 0,5-1mg s.c. a la semana, a pesar de estar diseñado para no-inferioridad, alcanzó la superioridad vs placebo en el MACE 3 y en la progresión de la enfermedad renal40. El componente significativo del MACE fue el ictus no mortal; hubo una tendencia protectora no significativa para el IAM no mortal. No se observó reducción significativa de la mortalidad CV, de la mortalidad por todas las causas ni de la hospitalización por IC. En el estudio HARMONY OUTCOMES albiglutida 30-50mg s.c. a la semana mostró superioridad en el MACE vs placebo, siendo el componente significativo el IAM no mortal; el ictus no mortal mostró una tendencia favorable no significativa41. No se observó reducción significativa de la mortalidad CV, de la mortalidad por todas las causas ni de la hospitalización por IC. Paradójicamente, albiglutida ha sido retirada del mercado por motivos comerciales. Se ha completado otro estudio de seguridad CV con superioridad en el objetivo primario (MACE3), el estudio REWIND (dulaglutida 1,5mg vs placebo, n=9.901, prevención primaria y secundaria), pero el resultado se ha comunicado hasta el momento solo en nota de prensa y sin indicarse la magnitud del beneficio42,43.
Sin embargo, otros cuatro estudios de seguridad CV con arGLP-1 vs placebo han resultado neutros en el objetivo primario MACE: dos publicados —el estudio ELIXA (lixisenatida 20μg s.c. al día, n=6.068, pacientes tras SCA, con un objetivo MACE4 que incluía MACE 3 +hospitalización por angina inestable)44 y el estudio EXSCEL (exenatida LAR 2mg s.c. a la semana, n=14.752, prevención primaria y secundaria)45— y dos no publicados —el estudio FREEDOM-CV (bomba de exenatida ITCA-650, n=4.156, estudio de no inferioridad pre-aprobación en prevención primaria y secundaria)46 y el estudio PIONEER6 (semaglutida oral 14mg/día vs placebo, n=3.183, estudio de no inferioridad pre-aprobación en prevención primaria y secundaria)47,48. En el caso del estudio EXSCEL se observó una reducción significativa de la mortalidad por todas las causas del 14%, pero no se alcanzó superioridad en MACE3, mortalidad CV u hospitalización por IC. El estudio PIONEER6, con poca potencia estadística para mostrar superioridad en MACE3, sin embargo, ha comunicado superioridad en los objetivos secundarios de mortalidad CV (−51%) y de mortalidad por todas las causas (−49%).
Tras estos resultados surgen dos preguntas lógicas. ¿Cuál es el mecanismo de protección CV y renal de iSGLT-2 y arGLP-1? ¿Existe un efecto de clase en las dos familias farmacológicas? Intentaré responder a estas cuestiones en las siguientes secciones.
ISGLT-2Mecanismo de acción de los ISGLT-2. Eficacia comparativaEn individuos sanos el riñón filtra aproximadamente 180g de glucosa al día, que es totalmente reabsorbida en los túbulos proximales. Normalmente un 90% de la glucosa filtrada es reabsorbida en el primer segmento (S1) del túbulo proximal por el transportador de alta capacidad y baja afinidad SGLT-2, difundiéndola posteriormente en la membrana basolateral a través del glucotransportador GLUT-2. El resto es reabsorbido en el segmento distal (S3) del túbulo proximal por el transportador de baja capacidad y alta afinidad SGLT-1, difundiendo la glucosa en la membrana basolateral a través del glucotransportador GLUT111. Los iSGLT-2 son un grupo de fármacos de administración oral que inducen la eliminación de 60-80g de glucosa al día por la orina, aunque con dosis altas de canagliflozina se observan glucosurias de hasta 120g/día11,49. A diferencia del resto de glucosúricos (muy específicos para SGLT-2), canagliflozina a la dosis de 300mg induce en el intestino una inhibición transitoria de SGLT-1 (responsable de la absorción de glucosa y galactosa), lo que reduce la glucemia posprandial y estimula la secreción distal de GLP-1 y PYY, probablemente como consecuencia del metabolismo de la glucosa por la microbiota a ácidos grasos de cadena corta y la estimulación de la célulaL intestinal50,51. Este efecto puede explicar las diferencias en eficacia (HbA1c, peso, presión arterial [PA]) entre canagliflozina 300mg y el resto de iSGLT-2.
La glucosuria origina un descenso de la glucemia basal, la glucemia posprandial y la HbA1c, así como una disminución de peso secundaria a la pérdida de calorías por la orina, que se acompaña de una reducción del perímetro de la cintura y de la masa grasa, especialmente de tejido adiposo visceral. La pérdida de glucosa por la orina desencadena mecanismos metabólicos compensadores, como un aumento transitorio de la secreción de glucagón y de la producción hepática de glucosa. Además, el organismo pasa a un estado de pseudo-ayuno, lo que implica un uso preferencial de la grasa como sustrato energético y la formación de cuerpos cetónicos en el hígado. El bloqueo de la reabsorción tubular de glucosa facilita su intercambio por ácido úrico a través de GLUT-9, induciendo uricosuria y reducción de la uricemia49. Además, se genera natriuresis y una leve diuresis osmótica de unos 300ml/día, lo que contribuye a un descenso significativo de la PA sistólica y diastólica. Los iSGLT-2 inducen un leve incremento de los niveles de colesterol LDL de probable causa multifactorial, implicándose diversos mecanismos como la utilización preferente de lípidos como sustrato metabólico, los cambios en la dieta secundarios a la pérdida calórica involuntaria o la hemoconcentración. La hemoconcentración también parece responsable del aumento del hematocrito, aunque se especula como factor causal adicional un aumento de eritropoyetina secundaria al incremento de la demanda medular renal de oxígeno.
En el momento de escribir este artículo están comercializados en España dapagliflozina (10mg/día), empagliflozina (10 y 25mg/día) y canagliflozina (100 y 300mg/día); ertugliflozina (5 y 15mg/día) previsiblemente estará disponible a lo largo de 2019. En ensayos clínicos con comparador activo los iSGLT-2 se han mostrado no inferiores o superiores a otros antihiperglucemiantes orales en el descenso de la HbA1c, siendo superiores en descenso de peso o de la PA (tabla 3)52-58. La eficacia sobre el control de la HbA1c es menor en pacientes con filtrado glomerular (FG) reducido, aunque sorprendentemente se mantienen el resto de beneficios metabólicos y CV en la insuficiencia renal. La incidencia de hipoglucemias es similar a la observada con placebo. No hay ensayos clínicos comparativos directos entre los diferentes iSGLT-2. Comparaciones indirectas a partir los ensayos clínicos fase3 de cada uno de los fármacos muestran que canagliflozina 300mg induce una mayor reducción de HbA1c, del peso y de la PA sistólica que dapagliflozina o empagliflozina, aunque las diferencias son modestas59.
Resultados de ensayos clínicos comparativos directos entre iSGLT-2 y otros antihiperglucemiantes orales
| Comparador | Dapagliflozina | Empagliflozina | Canagliflozina |
|---|---|---|---|
| Sulfonilureas | HbA1c superior a 208 semPeso y PA superior a 208 semHipoglucemias menor incidencia(Del Prato, 2015) | HbA1c superior a 104 semPeso y PA superior a 104 semHipoglucemias menor incidencia(Ridderstråle, 2014) | HbA1c superior a 104 semPeso y PA superior a 104 semHipoglucemias menor incidencia(Leiter, 2015) |
| iDPP-4 | HbA1c superior a 24 semPeso y PA superior a 24 sem(Rosenstock, 2018) | HbA1c no inferior a 24 semPeso y PA superior a 24 sem(Roden, 2013) | HbA1c (300 mg) superior a 52 semPeso y PA (300 mg) superior a 52 sem(Lavalle-González, 2013) |
| Metformina | HbA1c no inferior a 24 semPeso superior a 24 sem(Henry, 2012) | No datos | No datos |
Fuente: referencias 52-58.
Existen múltiples hipótesis que tratan de explicar la protección CV con iSGLT-2, aunque pueden resumirse en 3 clases de efectos60-62:
- -
Efectos metabólicos. Incluye la reducción de FRCV como la glucotoxicidad, la grasa perivisceral o el ácido úrico49,60. Aunque estos efectos individualmente son de pequeña magnitud (tabla 2), la mejoría conjunta de ellos puede tener un efecto protector aditivo. La cetogénesis también es un efecto metabólico, pero su papel protector será explicado dentro del apartado de efectos directos sobre el miocardio.
- -
Efectos hemodinámicos. La diuresis osmótica inducida por la glucosuria y la natriuresis reduce la precarga (volemia) y la poscarga (PA) y mejora el balance tubuloglomerular (ver más adelante), todo ello sin incrementar el tono simpático ni la estimulación del eje renina-aldosterona. Esto es debido a que, a diferencia de los diuréticos, los iSGLT-2 no disminuyen el volumen intravascular, probablemente por un efecto reductor del sodio corporal total61. La reducción de la precarga disminuye la tensión de la pared miocárdica y potencialmente puede contribuir a reducir el riesgo de arritmias ventriculares. Finalmente, la hemoconcentración aumenta el hematocrito (aunque parece existir un también un incremento de eritropoyetina), lo que puede facilitar la liberación de oxígeno a tejidos isquémicos. Aproximadamente el 50% del beneficio CV observado en el estudio EMPA-REG OUTCOME es atribuible a la hemoconcentración.
- -
Efectos directos sobre el miocardio. Los iSGLT-2 aumentan los niveles plasmáticos de beta-hidroxibutirato, una fuente de energía para el miocardio enfermo más eficiente que la glucosa o los ácidos grasos, ya que requiere menos aporte de oxígeno para producir la misma cantidad de ATP. Además, estos fármacos tienen un efecto inhibitorio directo sobre el intercambiador sodio-hidrógeno tipo1 (NHE-1) del miocardio, lo que reduce los niveles de sodio y calcio intracelular, mejora la entrada de calcio en la mitocondria y, por tanto, la función miocárdica61. También se han postulado otros efectos directos, como la inhibición de la fibrosis cardiaca y la reducción de adipocinas proinflamatorias derivadas de la grasa epicárdica y perivascular.
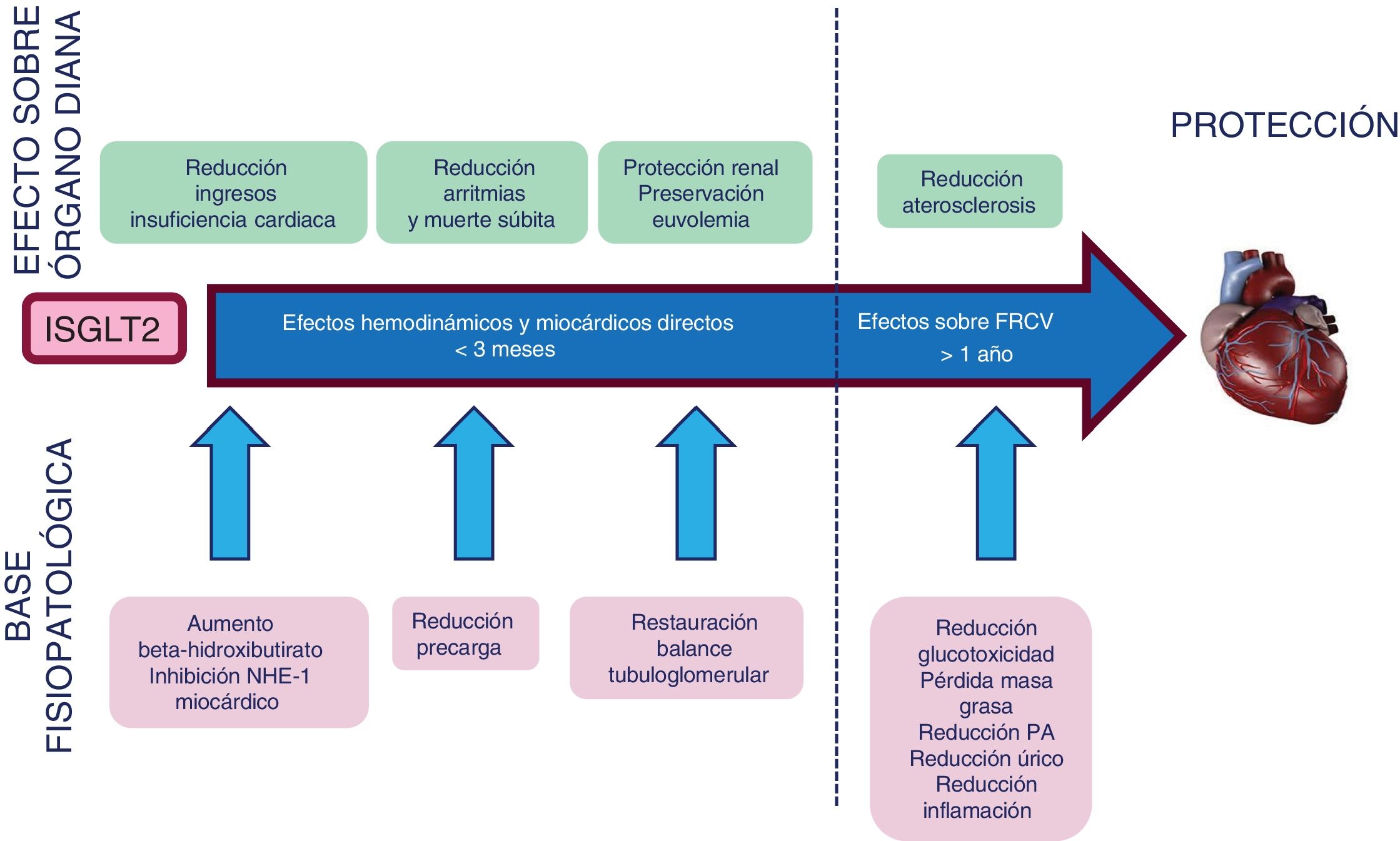
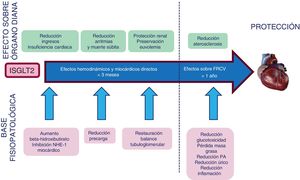
¿Todos estos factores actúan simultáneamente o de una forma secuencial? Lo cierto es que a fecha de hoy no tenemos respuesta, pero la rápida reducción del riesgo de morbimortalidad y de ingresos por IC sugiere que hay algunos mecanismos que actúan ya en las primeras semanas o meses. Una secuencia hipotética temporal de la protección CV con iSGLT-2 se muestra en la figura 1. En una fase precoz los efectos directos sobre el miocardio mejorarían la función cardiaca con la consiguiente reducción del riesgo de ingreso por IC. Posteriormente, la diuresis osmótica y la reducción de la precarga reducirían la tensión sobre la pared miocárdica y el riesgo de arritmias ventriculares graves y de muerte súbita. La restauración de la hemodinámica glomerular puede tener un efecto cardioprotector a través del mantenimiento de la euvolemia y la normotensión (hipótesis nefrocéntrica). Todo ello explicaría la rápida separación de curvas de riesgo en los estudios. Sin embargo, el mantenimiento a largo plazo en la separación de estas curvas puede ser atribuible, al menos parcialmente, a la mejoría de factores de riesgo de aterosclerosis, lo que reduciría la probabilidad de eventos CV.
Secuencia hipotética temporal de la protección cardiovascular observada con iSGLT-2 en los ensayos clínicos. Los efectos hemodinámicos aparecen precozmente (primeras semanas o meses) y reducen el riesgo de muerte súbita y hospitalización por insuficiencia cardiaca. Aproximadamente un año más tarde el control global de los factores de riesgo cardiovascular empieza a tener efecto sobre la placa de ateroma30-35.
De forma similar a lo comentado en el apartado anterior, parecen existir varios efectos protectores de los iSGLT-2 sobre la función renal49,63.
- -
Efectos metabólicos. La reducción de la glucotoxicidad y de la grasa perivisceral tiene un conocido efecto nefroprotector. Además, la disminución de reabsorción de sodio y glucosa en el túbulo proximal reduce las demandas de oxígeno de la cortical renal. Sin embargo, esto puede tener un efecto deletéreo sobre la medular renal, al incrementar el trabajo metabólico del túbulo distal. El aumento de los niveles de betahidroxibutirato, un sustrato con alta eficiencia energética para la nefrona distal, podría proteger a la médula renal de la hipoxia64.
- -
Efectos hemodinámicos sistémicos. Los iSGLT-2 reducen la PA sistólica que se transmite al riñón (tabla 2) y además reducen el uso de diuréticos de asa, evitando la depleción de volumen intravascular.
- -
Efectos hemodinámicos intrarrenales. La mácula densa del riñón del paciente con DM2 detecta una disminución en la llegada de sodio al túbulo distal, consecuencia de la reabsorción aumentada de sodio y glucosa en el túbulo proximal vía SGLT-2, que está hiperexpresado en el riñón diabético. Las células de la mácula densa reabsorben por tanto una escasa cantidad de sodio y la bomba Na-K no se activa. Esto genera una deficiencia de producción de adenosina a partir del ATP, y la adenosina es un vasoconstrictor potente de la arteriola aferente. En consecuencia, el riñón del paciente con DM2 presenta una vasodilatación de la arteriola aferente y, por tanto, hiperfiltración, potenciada además por la vasoconstricción de la arteriola eferente inducida por la activación del eje renina-angiotensina-aldosterona. Los iSGLT-2 restauran el llamado balance tubuloglomerular al proporcionar más sodio a la mácula densa, lo que normaliza el tono de la arteriola aferente. Este hecho causa una pequeña caída inicial del FG (4-6ml/min), pero la estabilización de este a largo plazo y la reducción de la albuminuria63.
- -
Efectos tubulointersticiales. La reducción de la glucotoxicidad y de la proteinuria y la activación de vías antiinflamatorias y antifibróticas pueden jugar un papel conjunto en la reducción del daño tubulointersticial del riñón diabético49.
Los iSGLT-2 son fármacos bien tolerados. La frecuencia de efectos adversos graves en los tres ensayos clínicos de seguridad CV fue inferior a la del grupo placebo30,33,35. El efecto adverso más frecuente fue la micosis genital, especialmente en mujeres; no hubo un incremento significativo de las infecciones del tracto urinario. Los episodios de depleción de volumen fueron más frecuentes con canagliflozina, pero no con dapagliflozina o empagliflozina. Este hecho podría explicar el aumento del 55% en fracturas observado con canagliflozina en el estudio CANVAS, dado que aparecieron precozmente en el ensayo, por lo que pueden ser atribuibles a un efecto hemodinámico por hipotensión ortostática y caídas. De hecho, la localización de estas fracturas no apunta a una causa osteoporótica. En el estudio CANVAS-R, iniciado después del CANVAS, no se observó aumento de fracturas, lo que hace suponer que el conocimiento por los investigadores de la posibilidad de depleción de volumen hizo establecer medidas preventivas para evitar las caídas.
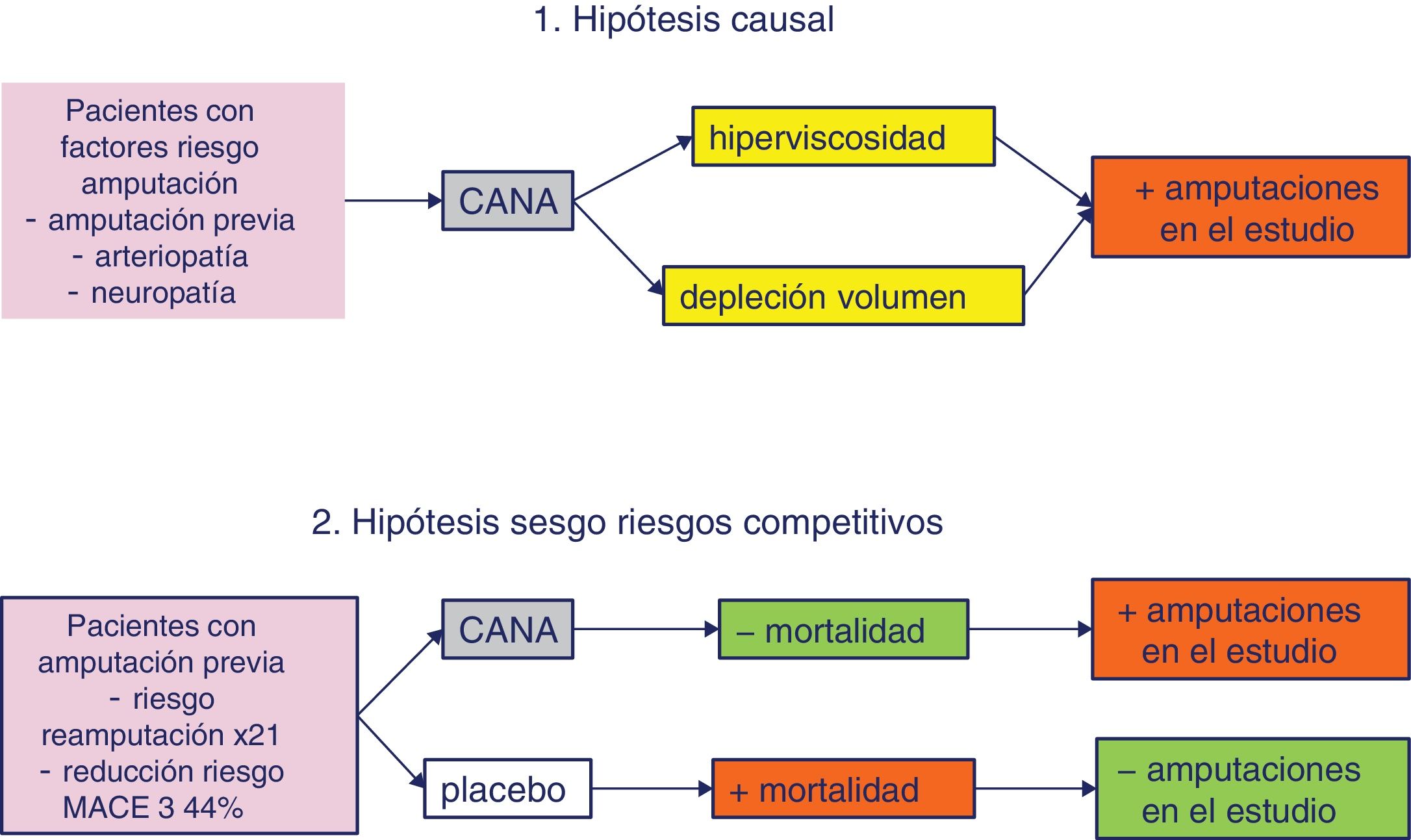
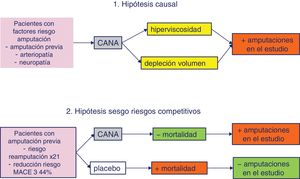
En el programa CANVAS hubo un aumento del 97% en la frecuencia de amputaciones, un 71% de las cuales fueron transfalángicas o transmetatarsianas. No se observó incremento de riesgo de amputaciones con empagliflozina o dapagliflozina. Los principales factores de riesgo para sufrir una amputación en el programa CANVAS fueron la existencia de una amputación previa o la enfermedad vascular periférica. Se han barajado dos posibles teorías para explicar el riesgo de amputaciones observado en el CANVAS (fig. 2). Una hipótesis causal implicaría a los mecanismos de depleción de volumen e hiperviscosidad como factores desencadenantes de isquemia en un lecho vascular ya comprometido. Sin embargo, hay datos que parecen cuestionar esta explicación. La curva de riesgo de amputaciones se separó lentamente (a diferencia de lo que ocurre con el riesgo de fracturas), por lo que un mecanismo hemodinámico parece poco plausible. No existió una relación dosis-respuesta; el grupo asignado a canagliflozina 100mg tuvo una incidencia de 6,2 casos/1.000 pacientes-año, frente a 5,5 casos/1.000 pacientes-año el grupo de canagliflozina 300mg y 2,8 casos/1.000 pacientes-año el grupo placebo. Finalmente, las curvas de mortalidad y amputaciones parecen especulares, lo que podría apuntar a un sesgo de riesgos competitivos, ya que los pacientes con amputación previa se benefician especialmente de la reducción de morbimortalidad CV en el análisis de subgrupos. Es decir, si un paciente con amputación previa es asignado a placebo, podría fallecer antes de desarrollar una nueva amputación, mientras que un paciente similar asignado a canagliflozina, al aumentar su supervivencia, tendría más riesgo de presentarla, lo que aparecería en el análisis como un efecto adverso del fármaco en lugar de una consecuencia de vivir más años. Esta hipótesis alternativa es puramente especulativa, ya que no disponemos de un subanálisis publicado sobre las amputaciones del CANVAS, y las curvas de mortalidad en función de las amputaciones previas tampoco han sido publicadas. Los ensayos clínicos fase3 y los estudios en vida real con canagliflozina confirman que en población de bajo riesgo CV no se observa aumento de riesgo de amputaciones, mientras que en poblaciones con alto riesgo CV existe un incremento de las amputaciones pero también una reducción de la mortalidad65,66.
Diferentes hipótesis pueden explicar el aumento de amputaciones con canagliflozina observado en el programa CANVAS. La hipótesis causal explica el incremento de riesgo por la depleción de volumen y la hemoconcentración en pacientes con arteriopatía periférica grave, que comprometerían el flujo vascular de un lecho isquémico. Por el contrario, la hipótesis del sesgo de riesgos competitivos explica el aparente aumento de riesgo por la reducción de mortalidad en pacientes con amputación previa tratados con canagliflozina. Una mayor supervivencia con canagliflozina permitiría, a diferencia del placebo, la aparición con el tiempo de nuevas amputaciones.
Finalmente, se apreció un incremento significativo de los casos de cetoacidosis diabética con dapagliflozina (no con empagliflozina ni canagliflozina), aunque el número de pacientes fue pequeño y en su mayoría estaban siendo tratados al inicio con insulina.
¿Hay un efecto de clase en los iSGLT-2?Existe un efecto de clase entre los iSGLT-2 en la reducción de riesgo de hospitalización por IC y en la progresión de ERC67. Sin embargo, el efecto sobre la ECV aterosclerótica es mucho más heterogéneo. En concreto, empagliflozina ha demostrado reducción de MACE3, mortalidad CV y por todas las causas en prevención secundaria, canagliflozina reducción de MACE3 pero no de mortalidad CV en prevención primaria y secundaria, y dapagliflozina no ha mostrado reducción de MACE3 ni de mortalidad CV en prevención primaria y secundaria (tabla 1). Si estas diferencias son resultado de los diferentes diseños de los estudios o consecuencia de características intrínsecas de las moléculas es una cuestión que aún debe ser dilucidada.
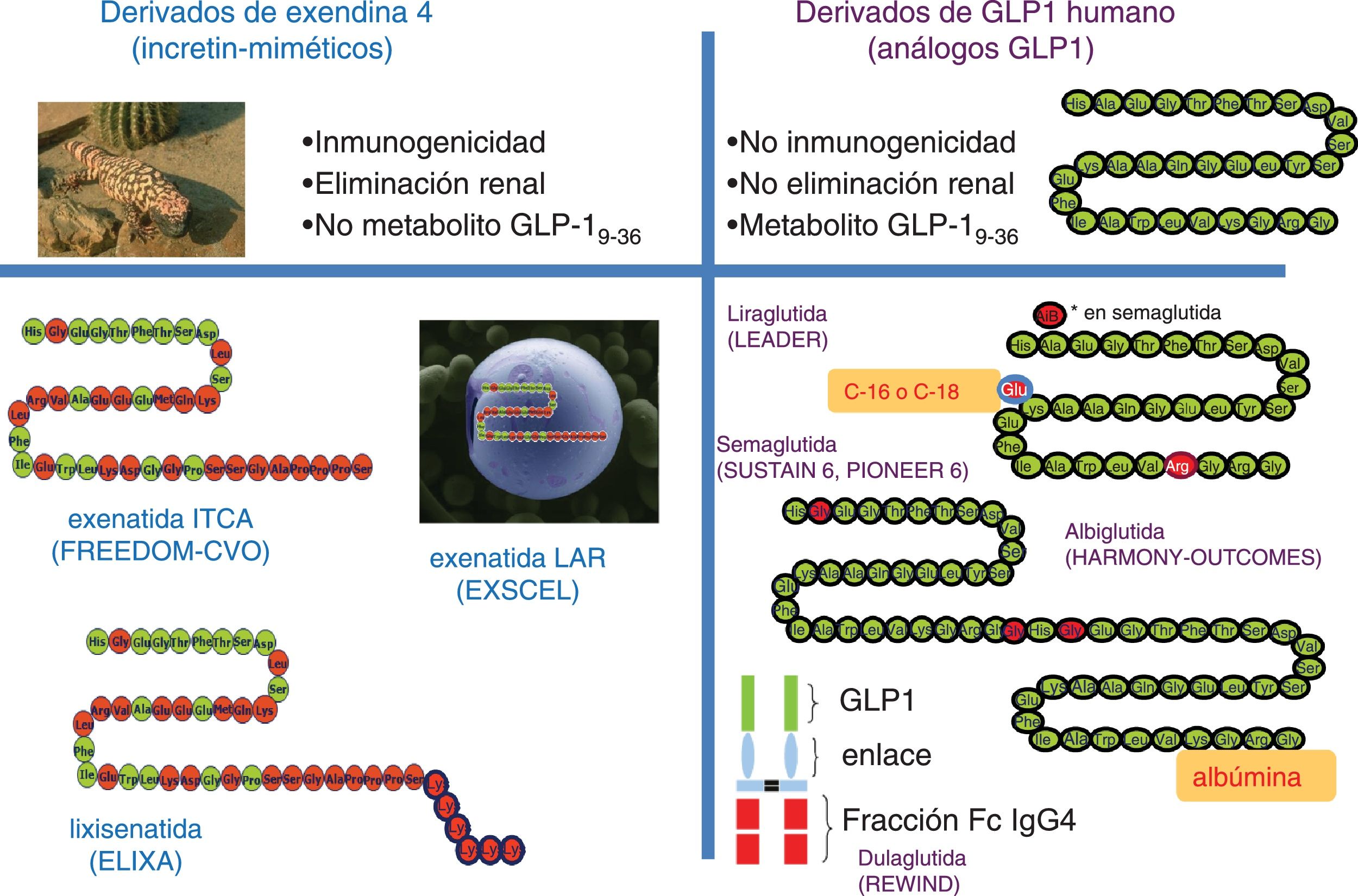
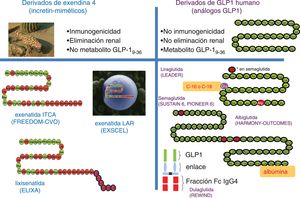
ArGLP-1Mecanismo de acción de los arGLP-1. Eficacia comparativaLos arGLP-1 son una familia farmacológica de péptidos de administración s.c. que estimulan el receptor del GLP-1 humano, aunque ya existen algunos de administración oral, como semaglutida, en desarrollo clínico11,68. Los arGLP-1 pueden clasificarse según diferentes características, como tamaño molecular, estructura química y duración de acción (tabla 4). Los arGLP-1 de gran tamaño, unidos a grandes proteínas, tienen dificultades para atravesar la barrera hematoencefálica y llegar a los centros de la saciedad, por lo que es esperable, como en el caso de la albiglutida, un menor efecto sobre el peso corporal, en comparación con los arGLP-1 de pequeño tamaño. En función de su estructura química, los arGLP-1 se dividen en dos grupos: incretín-miméticos (análogos de exendina 4) y análogos del GLP-1 humano. Los arGLP-1 incretín-miméticos derivan de la exendina4, péptido de 39 aminoácidos aislado en la saliva de Heloderma suspectum (monstruo de Gila) y que tiene una homología del 53% con el GLP-1 humano. La diferencia estructural con el GLP-1 humano confiere a exendina4 y, por extensión, a los incretín-miméticos, resistencia a la inactivación por DPP-4. En nuestro país están actualmente aprobados exenatida diaria, exenatida de liberación prolongada (LAR) y lixisenatida. Los fármacos incretín-miméticos se eliminan principalmente por filtración glomerular, reabsorción tubular y posterior degradación proteolítica, por lo que su aclaramiento se reduce en pacientes con insuficiencia renal. Al tratarse de péptidos con una homología parcial con el GLP-1 humano, estos fármacos pueden provocar la formación de anticuerpos; aproximadamente el 2-3% de los pacientes desarrollan anticuerpos inactivadores. Los análogos del GLP-1 humano tienen una homología estructural con el GLP-1 nativo y aumentan su vida media mediante modificaciones en su molécula, como la adición de un ácido graso (liraglutida y semaglutida), una molécula de albúmina (albiglutida) o la fracción constante de la inmunoglobulina G4 (dulaglutida). En nuestro país están comercializados liraglutida y dulaglutida, ya que albiglutida ha sido retirada del mercado. Se espera la comercialización de semaglutida a lo largo de 2019. Los análogos del GLP-1 se metabolizan en los tejidos diana por la vía común de las grandes proteínas sin que se haya identificado un órgano específico como ruta principal de eliminación. Están protegidos del aclaramiento renal por su gran tamaño molecular o por su unión no covalente a la albúmina. Debido a su similitud estructural con el GLP-1 nativo, su inmunogenicidad es baja.
Clasificación de los arGLP-1
| Por su estructura química |
| Incretinomiméticos (derivados de la exendina-4): exenatida, exenatida LAR, ITCA 650 (bomba exenatida)a, lixisenatida, efpeglenatidaa |
| Análogos de GLP1 humano: liraglutida, albiglutidaa, dulaglutida, semaglutidaa |
| Por la duración de su acción |
| Vida media corta: exenatida, lixisenatida |
| Vida media intermedia: liraglutida |
| Vida media larga: exenatida LAR, albiglutida, dulaglutida, semaglutidaa, efpeglenatidaa, ITCA 650 (bomba exenatida)a |
| Por el tamaño molecular |
| Pequeño tamaño: exenatida, exenatida LAR, ITCA 650 (bomba exenatida)a, lixisenatida, liraglutida, semaglutidaa |
| Gran tamaño: dulaglutida, albiglutidaa, efpeglenatidaa |
Desde un punto de vista práctico resulta útil la clasificación de los arGLP-1 en agonistas de vida media corta y larga11,68. Los arGLP-1 de vida media larga producen una estimulación prolongada del receptor de GLP-1, que condiciona un mejor control de la glucemia basal y de la HbA1c. Los arGLP-1 de vida media corta tienen un efecto menos marcado sobre la glucemia en ayunas y la secreción de insulina basal, pero inducen un descenso más acentuado de la glucemia posprandial en la comida en la que se administran. El efecto sobre la glucemia posprandial de los arGLP1 de vida media corta parece mediado por un retardo en el vaciamiento gástrico, que condiciona una absorción más lenta de glucosa, puesto que los valores de insulina posprandial tras su administración son bajos. Por el contrario, el efecto sobre el vaciamiento gástrico de los arGLP-1 de vida media larga se pierde tras unas semanas de tratamiento por un mecanismo de taquifilaxia. Los arGLP-1 no solo disminuyen la glucemia estimulando la secreción de insulina por las célulasβ, sino que además reducen la secreción de glucagón por las célulasα estimulando la secreción paracrina de somatostatina por las célulasδ. Estos fármacos no inducen hipoglucemias al cesar su efecto en rangos bajos de glucosa plasmática. La activación del receptor del GLP-1 provoca, además, efectos no glucémicos en múltiples tejidos, bien por efecto directo o bien mediante mecanismos indirectos a través de vías neurales y endocrinas, como inhibición de la apoptosis en los islotes de Langerhans, el efecto inotrópico, cronotrópico y protector del miocardio, un efecto antiinflamatorio sistémico, la reducción de la PA, la mejoría del perfil lipídico, la pérdida de peso a expensas de masa grasa o la mejoría de la esteatosis hepática. La pérdida ponderal es secundaria al efecto anorexígeno mediado por receptores localizados en diversas regiones del sistema nervioso central, como el núcleo arcuato del hipotálamo y el circuito de recompensa mesolímbico11,68.
El desarrollo clínico de los arGLP-1 comprende múltiples ensayos clínicos aleatorizados, controlados con placebo o comparador activo. Varios de estos ensayos clínicos han mostrado superioridad de los arGLP-1 frente a sulfonilureas, glitazonas, iDPP-4 o insulina en el descenso de la HbA1c y del peso69. Además, parecen tener una mayor durabilidad de efecto que otros fármacos, como las sulfonilureas. Especialmente relevante es la superioridad o no-inferioridad en el control glucémico de los arGLP-1 cuando se comparan con la insulinoterapia basal, incluso con HbA1c muy elevadas, a pesar de la opinión preconcebida entre muchos médicos de que la insulina es el fármaco antihiperglucemiante más potente11. Se han llevado a cabo varios ensayos clínicos comparativos directos entre arGLP-1. En general los arGLP-1 de vida media larga muestran un mayor descenso de HbA1c que los de vida media corta. Semaglutida ha emergido como el arGLP-1 más eficaz en el descenso de HbA1c, de peso y de la PA en estudios de comparación con otros arGLP-1 de vida media larga como dulaglutida o exenatida LAR70,71.
Protección cardiovascular con arGLP-1A diferencia de lo que ocurre con los iSGLT-2, las curvas de riesgo del MACE3 se separan lentamente con los arGLP-1. Este efecto progresivo es similar al observado con otros fármacos cardioprotectores como las estatinas y parece mediado por un mecanismo antiaterosclerótico72,73. En general se distinguen dos tipos de efectos protectores de los arGLP-1 sobre el corazón y los vasos sanguíneos74,75.
- -
Efectos directos. El receptor de GLP-1 se localiza en el nodo sinusal del corazón humano y ejerce un efecto cronotrópico positivo, lo que en principio no parece beneficioso para un corazón isquémico o en IC. Este hecho podría explicar la falta de efecto protector de los arGLP-1 sobre la hospitalización por IC76, o incluso el incremento de efectos adversos cardiacos con liraglutida en el ensayo clínico LIVE realizado en pacientes con IC y fracción de eyección reducida77. Sin embargo, también encontramos receptores de GLP-1 en las células musculares vasculares lisas de las coronarias, cuya estimulación induce vasodilatación, efectos antiinflamatorios y antioxidantes, aumento de función endotelial, inhibición de la proliferación de músculo liso, estabilización de la placa de ateroma y mayor tolerancia a la isquemia. Además, un metabolito de GLP-1, GLP-19-36, es capaz de ejercer acciones independientes del receptor de GLP-1 en las mitocondrias de las células endoteliales, pudiendo potenciar el efecto vasodilatador de GLP-1.
- -
Efectos indirectos. Los arGLP-1 reducen la glucotoxicidad y la lipotoxicidad y aumentan la utilización de glucosa por el miocardio, sin riesgo de hipoglucemias (tabla 2). Además, la pérdida de peso reduce la grasa corporal y las adipocinas proinflamatorias. Finalmente, los efectos natriurético y vasodilatador reducen la PA.
Los beneficios sobre la progresión de la ERC observados en los estudios con arGLP-1 pueden atribuirse a tres mecanismos principales: sistémicos, hemodinámicos y antiinflamatorios.
- -
Efectos sistémicos. Los arGLP-1 reducen la glucotoxicidad, el peso corporal y la PA sistólica, todos ellos factores de riesgo conocidos de ERC (tabla 2).
- -
Efectos hemodinámicos. Del mismo modo que existe un eje incretínico enteropancreático, también se ha descrito un eje enterorrenal78. Una sobrecarga oral de sodio induce una mayor natriuresis que la misma carga de sodio por vía intravenosa. Se sabe que los arGLP-1 inhiben el intercambiador sodio-hidrógeno NHE-3 del túbulo proximal, induciendo natriuresis. Este efecto es potenciado por la menor expresión de SGLT-2 tubular tras mejorar la hiperglucemia con arGLP-1. La natriuresis tiene un efecto sobre el balance tubuloglomerular similar al descrito con iSGLT-2. Sin embargo, el efecto sobre la arteriola aferente no siempre es vasoconstrictor, ya que los arGLP-1 también estimulan la producción renal de óxido nítrico, que es vasodilatador, aunque el resultado final varía en función de ciertas características fenotípicas de los pacientes, como por ejemplo el tiempo de evolución de la enfermedad. Por el contrario, el efecto vasodilatador sobre la arteriola eferente de los arGLP-1 es más consistente y se debe a la inhibición del eje renina-angiotensina-aldosterona y de la endotelina1. Como resultado de la suma de todos estos factores, el efecto hemodinámico renal de los arGLP-1 es heterogéneo y varía ampliamente en los diferentes estudios, pero en general no se observa una detención de la caída del FG excepto en el subgrupo de pacientes con FG entre 30 y 60ml/min de los estudios LEADER y SUSTAIN639.
- -
Efectos antiinflamatorios. Los arGLP-1 reducen la inflamación, los factores de crecimiento como TGF-β, la infiltración por macrófagos, el estrés oxidativo y el acúmulo de colágeno en el riñón. Todos estos efectos tienen un impacto clínico en la disminución de la proteinuria78.
Los efectos adversos que condujeron a la retirada del fármaco fueron más frecuentes con liraglutida y semaglutida que con placebo, principalmente por causas gastrointestinales; no hubo diferencias entre albiglutida y placebo. Las hipoglucemias graves fueron menos frecuentes con liraglutida y albiglutida que con placebo. Hubo más casos de colecistopatía aguda con liraglutida pero no con semaglutida o albiglutida. Finalmente, en el estudio SUSTAIN6, pero no en otros estudios con arGLP-1, se observó un incremento del 76% (3% vs 1,8%) en el riesgo de complicaciones por retinopatía diabética con semaglutida. Análisis posteriores han permitido determinar que los pacientes que presentaron este efecto adverso tenían, en comparación con la cohorte global, una mayor duración de la DM (17,5años), una HbA1c más elevada (9,4%), estaban en su mayoría tratados con insulina (75,9%) y presentaban retinopatía previa (83,5%). La probabilidad de presentar una complicación por retinopatía se incrementaba si el sujeto tenía un descenso de la HbA1c superior al 1,5% en las 16 primeras semanas, fenómeno ya observado en el DCCT en pacientes con DM1 y en estudios con DM2 en tratamiento con insulina79. Está en marcha un ensayo clínico (FOCUS) cuyo objetivo es valorar el efecto de semaglutida a 5años sobre la incidencia de retinopatía.
¿Hay un efecto de clase en los arGLP-1?Los análogos de GLP-1 humano (liraglutida, semaglutida, albiglutida, previsiblemente dulaglutida) han demostrado reducción de morbimortalidad CV. Por el contrario, los análogos de exendina-4 o incretín-miméticos (exenatida, exenatida LAR, lixisenatida) no han alcanzado la superioridad en estudios de seguridad CV. Una explicación podría ser que el diseño de los estudios, la población estudiada, la potencia, las retiradas o el mero azar son la causa de estas diferencias. Sin embargo, existen diferencias moleculares que pueden haber contribuido al menos parcialmente a estos resultados (fig. 3):
- -
Inmunogenicidad. Los análogos de exendina4 son inmunogénicos y en algunos pacientes el fármaco se inactiva por anticuerpos; esto no sucede con los análogos de GLP-1 humano.
- -
Tolerancia. Los análogos de exendina4 se metabolizan y eliminan por el riñón, por lo que pueden acumularse en pacientes con ERC, precisamente los que tienen mayor riesgo CV, y favorecer su retirada por intolerancia gastrointestinal. Los análogos de GLP-1 humano no se eliminan por el riñón.
- -
Producción del metabolito GLP-19-36. Los análogos de exendina4 son totalmente resistentes a la inactivación por DPP-4. Por el contrario, los análogos de GLP-1 humano pueden ser metabolizados parcialmente a pequeñas cantidades de GLP-19-36, lo que podría tener un efecto cardioprotector adicional80. Por ejemplo, en un estudio experimental la administración de un iDPP-4 atenuó el efecto antiinflamatorio de liraglutida en ratas con hemorragia cerebral al impedir la generación de GLP-19-3681.
Ausencia de efecto de clase en la protección cardiovascular con arGLP-1. Los análogos de GLP-1 han demostrado reducción de morbimortalidad cardiovascular, no así los análogos de exendina-4. Varias hipótesis tratan de explicar el diferente impacto de estas clases terapéuticas en pacientes con alto riesgo cardiovascular11,80,81. * Este aminoácido (alfa-aminoisobutírico) es una modificación presente en la molécula de semaglutida pero no en la de liraglutida.
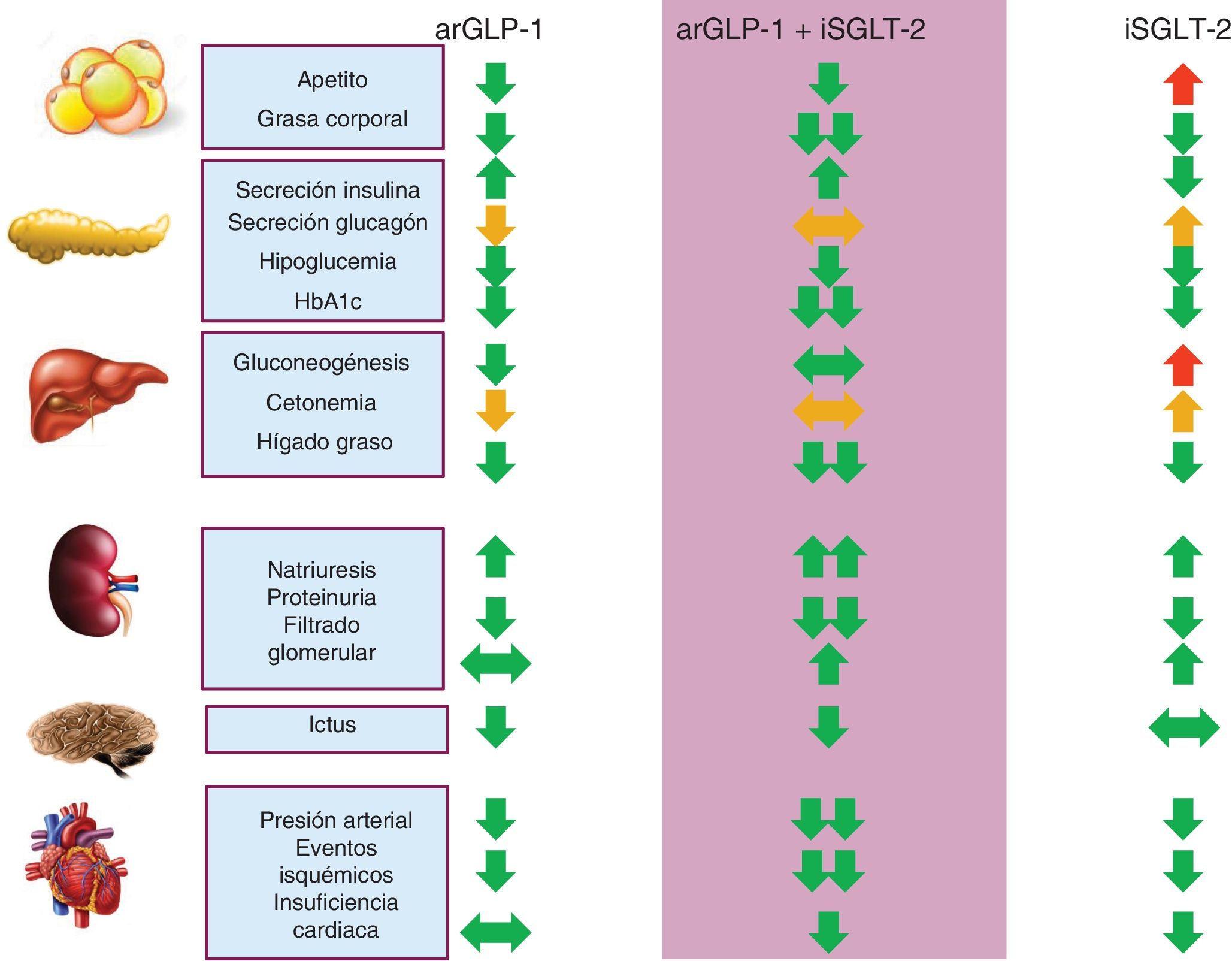
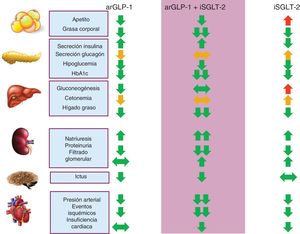
Tras la publicación de los estudios de seguridad CV que han sido revisados en el presente artículo, diversas sociedades científicas recomiendan el uso preferente de arGLP-1 e iSGLT-2 con beneficio CV demostrado en los pacientes con DM2 y ECV o ERC establecida, sustituyendo incluso a otros fármacos que el paciente esté tomando pero sin efecto protector CV o renal82-84. Por primera vez se plantea en algunos documentos la posibilidad de utilizar arGLP-1 o iSGLT-2 antes que la metformina en casos seleccionados de prevención secundaria. Los iSGLT-2 tienen un efecto hemodinámico dominante, y son de elección cuando se pretende una reducción del riesgo de IC o progresión de ERC. Los arGLP-1 muestran un efecto fundamentalmente antiaterogénico junto a una alta eficacia en el control de la HbA1c y el peso, por lo que pueden ser una opción preferente cuando el objetivo es reducir los eventos CV ateroscleróticos o en pacientes con un peor control global de la enfermedad. La combinación arGLP-1/iSGLT-2, hasta el momento probada en ensayos clínicos de eficacia antihiperglucemiante y en algunos estudios observacionales85-87, aporta beneficios metabólicos, CV y renales aditivos o sinérgicos (fig. 4).
Efectos esperables de la combinación de arGLP-1 e iSGLT-2 sobre el control metabólico y el riesgo cardiovascular en pacientes con DM2. La mayoría de efectos son sinérgicos o aditivos, excepto el efecto sobre secreción de insulina y glucagón, la producción hepática de glucosa y la cetogénesis.
Flechas verdes: efecto beneficioso; flechas naranjas: efecto con beneficio no aclarado; flechas rojas: efecto negativo.
Sin embargo, corremos el riesgo de encasillar estos fármacos en el paciente con DM2 y ECV. La triple terapia metformina/arGLP-1/iSGLT-2, paradigma actual del tratamiento farmacológico de la DM2, cubre los 8 defectos fisiopatológicos del octeto ominoso de De Fronzo, y esta asociación es planteada como preferente en la mayoría de escenarios terapéuticos, con la excepción del anciano frágil o en pacientes con contraindicaciones para alguno de estos fármacos82-84. Nuestros pacientes en prevención primaria, con un aumento de grasa visceral inflamada en más de un 80-90% de los casos, se benefician de una estrategia adipocéntrica que consiga simultáneamente una pérdida ponderal suficiente para optimizar el control glucémico sin hipoglucemias, reducir la PA, mejorar otras comorbilidades de la obesidad y, como se observa en algunos ensayos clínicos, una reducción de la morbimortalidad CV. El glucocentrismo finalmente ha sido superado, y actualmente disponemos de dos grupos farmacológicos con un efecto claramente CV que adicionalmente bajan la HbA1c.
Conflicto de interesesJuan José Gorgojo-Martínez ha recibido en los últimos 5años honorarios como asesor de Astra-Zeneca, Janssen Pharmaceuticals, Eli Lilly and Company, Merck Sharp & Dohme, Mundipharma, Novo-Nordisk y Pfizer; honorarios por conferencias de Abbott, AbbVie Inc, Astra-Zeneca, Boehringer Ingelheim Pharmaceuticals Inc, Esteve, Janssen Pharmaceuticals, Eli Lilly and Company, Merck Sharp & Dohme, Novo-Nordisk, Pfizer, Roche Pharma y Sanofi-Aventis; y honorarios por actividades de investigación clínica de Astra-Zeneca, Novo-Nordisk y Sanofi-Aventis.