La recidiva de la hepatitis C tras el trasplante hepático es universal y condiciona un aumento en la morbimortalidad del paciente. El desarrollo de nuevos agentes antivirales directos contra el virus C es un gran avance en el tratamiento de estos pacientes. El tratamiento antes del trasplante permite evitar la infección del injerto y, en algunos casos, obtener una mejoría de la función hepática que permita la retirada del paciente de la lista de espera. En pacientes con cirrosis avanzada, podría ser preferible diferir el tratamiento hasta el periodo postrasplante. Generalmente, el tratamiento antiviral tras el trasplante hepático se realiza en pacientes con evidencia de lesión histológica. En estos pacientes, la eficacia del tratamiento es mayor en estadios iniciales de la enfermedad. La elección del tratamiento antiviral en estos pacientes se basa en el grado de disfunción hepática, la presencia de fallo renal y las potenciales interacciones medicamentosas.
Hepatitis C recurrence after liver transplantation is universal and increases morbidity and mortality in these patients. The development of new direct antiviral agents against the hepatitis C virus is a major treatment advance. Pre-transplant treatment avoids graft infection and sometimes improves liver function, allowing the patient to be withdrawn from the transplant waiting list. Delaying treatment until the postpostransplant period may be advisable in patients with advanced cirrhosis. Generally, antiviral therapy after liver transplantation is provided in patients with histological evidence of the disease. In these patients, treatment is more effective in the initial stages of the disease. The choice of antiviral therapy in these patients is based on the degree of liver function, the presence of renal failure, and potential drug-drug interactions.
La recurrencia de la hepatitis C (VHC) tras el trasplante hepático (TH) es universal y tiene una progresión acelerada en comparación con el paciente inmunocompetente. De hecho, hasta un 20-30% de los pacientes desarrollan cirrosis en los primeros 5 años tras el TH1. El riesgo de descompensación en pacientes con cirrosis es un 40% al año y un 70% a los 3 años del diagnóstico2. La presencia de descompensación hepática en estos pacientes es un indicador de mortalidad precoz, ya que el 60% de estos fallecen en el primer año tras el episodio de descompensación3. Una pequeña proporción de pacientes (5-10%) desarrollan una forma grave de recurrencia del virus C, conocida como hepatitis colestásica fibrosante, que, en ausencia de tratamiento, puede llevar a pérdida del injerto y muerte4.
Durante los últimos años, el uso de agentes antivirales de acción directa (AAD) ha significado un gran avance en el tratamiento de la hepatitis crónica por VHC. La combinación de varios de estos fármacos sin interferón (IFN) ha demostrado altas tasas de respuesta virológica sostenida (RVS) y excelente seguridad y tolerabilidad, aun en pacientes con enfermedad avanzada5,6. Aquí se revisarán los nuevos avances en el tratamiento de la hepatitis C antes y después del TH.
Tratamiento antiviral antes del trasplante hepáticoEl objetivo fundamental del tratamiento antiviral en lista de espera para TH es evitar la infección del injerto. El tratamiento se puede administrar de 2 formas: 1) tratamiento corto (o incompleto) con el objetivo de llegar al TH con un RNA del VHC indetectable, o 2) tratamiento completo con intención de conseguir la RVS antes del TH.
Además de prevenir la infección del injerto, el tratamiento antiviral antes del TH podría conseguir una mejoría de la función hepática que permitiría la retirada de la lista de espera de algunos pacientes. Sin embargo, hasta hoy no existe suficiente evidencia con relación a la frecuencia de esta mejoría, ni a los factores que permitan predecir cuáles son los pacientes que presentarán una mejoría significativa de la función hepática7.
Tratamiento de los pacientes con cirrosis compensadaEl primer estudio realizado en pacientes en lista de espera para TH evaluó la combinación de sofosbuvir (SOF) y ribavirina (RBV) durante 48 semanas en 61 pacientes con cirrosis hepática compensada (Child-Pugh A) y hepatocarcinoma (dentro de los criterios de Milán). De los 43 pacientes que llegaron al momento del TH con un RNA del VHC indetectable, el 70% alcanzó una RVS post-TH. En este estudio, además, se encontró que la probabilidad de alcanzar una RVS tras el TH fue significativamente más elevada en pacientes que presentaban un RNA del VHC indetectable durante más de 30 días antes del TH8. A pesar de la relevancia del estudio, actualmente esta combinación se considera subóptima en pacientes infectados con el genotipo (G) 1, considerando necesaria la combinación de al menos 2 AAD. Dos estudios fase 3 evaluaron la seguridad y eficacia del tratamiento con SOF y ledipasvir (LDV, con o sin RBV) durante 12 o 24 semanas en pacientes cirróticos infectados con el G19,10. El estudio ION-19 incluyó a 865 pacientes naïve, de los cuales 136 (16%) tenían cirrosis. En este subgrupo de pacientes con cirrosis se observó una RVS del 100 y del 97% en pacientes tratados con o sin RBV, respectivamente. El estudio ION-210 evaluó a 440 pacientes previamente tratados (incluyendo pacientes con fallo a triple terapia con un inhibidor de proteasa de primera generación), 88 (20%) de ellos con cirrosis. En este estudio se observó una RVS del 88 y del 100% en pacientes tratados durante 12 o 24 semanas, respectivamente.
Por otra parte, el estudio TURQUOISE-II evaluó la eficacia y seguridad de la combinación de paritaprevir/ritonavir/ombitasvir (PTV/r/OBV) con dasabuvir (DBV) y RBV administrada durante 12 o 24 semanas en 380 pacientes con cirrosis compensada. La tasa de RVS fue del 92 y del 96% en pacientes tratados durante 12 o 24 semanas, respectivamente. La respuesta virológica fue menor en pacientes infectados con el G 1a, en pacientes previamente tratados y en aquellos con signos de hipertensión portal clínicamente significativa11.
En el caso de pacientes infectados con los G2 y 3, los estudios en fase 3 que evaluaron el tratamiento con SOF y RBV durante 12-16 semanas observaron que los pacientes cirróticos presentaron unas tasas de RVS menores que los pacientes no cirróticos (≈80%). A pesar de los avances en el tratamiento antiviral, los pacientes cirróticos infectados con el G3, especialmente aquellos no respondedores a un tratamiento previo, siguen siendo una población difícil de tratar. Las combinaciones de SOF+RBV (24 semanas), o SOF+daclatasvir (DCV, 12 semanas) obtienen resultados subóptimos en esta población de pacientes (61 y 59%, respectivamente)12,13.
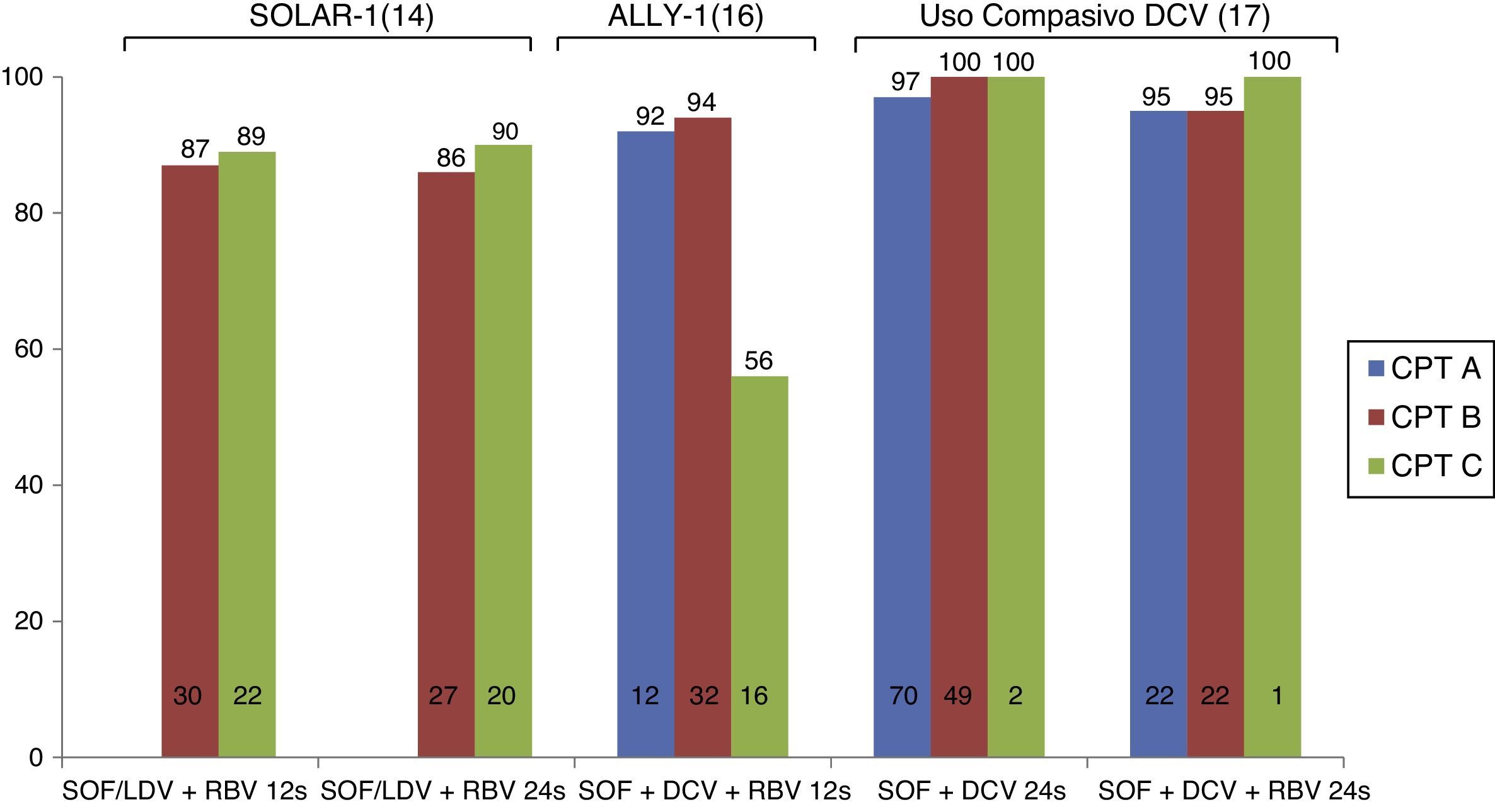
Tratamiento de los pacientes con cirrosis descompensadaEstudios recientes han valorado la eficacia de los nuevos fármacos antivirales en pacientes con cirrosis descompensada (fig. 1). El estudio SOLAR-1 evaluó la eficacia y seguridad del tratamiento con SOF/LDV+RBV durante 12 o 24 semanas en 108 pacientes con cirrosis Child-Pugh B y C infectados con los G1 o 4. Como era de esperar, la mayoría de los pacientes tenían ascitis o encefalopatía hepática y un deterioro relevante de la función hepática. Las tasas de RVS fueron de 87 y de 89% en pacientes tratados durante 12 o 24 semanas, respectivamente, sin diferencias entre los pacientes Child-Pugh B o C. La seguridad del tratamiento fue excelente y solo 3 pacientes interrumpieron el tratamiento por efectos adversos. Entre el 60 y el 80% de los pacientes en este estudio presentaron una mejoría de la función hepática (determinada por el MELD)14. Estos resultados fueron recientemente confirmados con los datos del estudio SOLAR-2 que incluyó a 84 pacientes con cirrosis descompensada15. Es importante resaltar que la práctica totalidad de los pacientes incluidos en estos 2 estudios tenían un MELD entre 10 y 20 y, por lo tanto, no existen datos de eficacia y seguridad de esta combinación (SOF+LDV) en pacientes con un MELD superior a 20.
De forma similar, el estudio ALLY-116 evaluó la combinación de SOF+DCV+RBV durante 12 semanas en pacientes con cirrosis avanzada (MELD ente 8 y 40). Un total de 32 pacientes eran Child-Pugh B (MELD entre 10 y 20) y 20 pacientes eran Child-Pugh C (MELD entre 16 y 25). Las tasas de RVS fueron de 94 y 56% en pacientes Child-Pugh B o C, respectivamente. Asimismo, se observó una menor eficacia del tratamiento en pacientes con ascitis, encefalopatía hepática o albúmina inferior a 28g/l16. En la vida real, el uso compasivo de SOF+DCV a nivel europeo mostró tasas superiores al 90% en pacientes con cirrosis descompensada que recibieron tratamiento durante 24 semanas, sin diferencias entre pacientes que recibieron o no RBV. El número de pacientes con cirrosis Child-Pugh C en este estudio fue muy bajo (n=2), lo que impide sacar conclusiones17.
Recientemente, también se han presentado los datos de la pacientes descompensados (MELD >10) de la cohorte TARGET tratados con SOF y simeprevir (SMV) con o sin RBV. En pacientes no tratados previamente, el 78 y el 69% de los pacientes que recibieron SOF+SMV o SOF+SMV+RBV, respectivamente, alcanzaron una RVS. Resultados similares fueron obtenidos en pacientes pretratados (72 y 69%)18.
Consideraciones sobre el tratamiento en lista de espera para trasplante hepáticoLos pacientes en lista de espera para TH presentan ciertas características que podrían influir en la decisión del tratamiento antiviral:
- a)
El objetivo principal del tratamiento antiviral en estos pacientes es la prevención de la infección del injerto. Dado que la mayor fuente de viriones (hígado) es eliminada con el trasplante, es lógico pensar que un tratamiento antiviral corto con el objetivo de llegar el TH con la carga viral indetectable podría ser suficiente19. Sin embargo, es difícil establecer el momento óptimo de inicio del tratamiento antiviral con tiempo suficiente de negativizar la carga viral. En pacientes con cirrosis compensada parece claro que, para evitar la recidiva postrasplante, el paciente debe permanecer al menos 30 días con el RNA indetectable antes del TH8. Sin embargo, se desconoce si este periodo es suficiente en pacientes con cirrosis descompensada que, al parecer, tienen una cinética viral más lenta comparada con los pacientes con cirrosis compensada20. A pesar de la falta de información, sería recomendable mantener al menos los mismos criterios que en pacientes con cirrosis compensada, es decir, que el paciente llegue al momento del TH con un RNA indetectable durante un minimo de 30 dias.
- b)
La farmacocinética de algunos AAD se ve afectada en el caso de la enfermedad hepática avanzada, principalmente en aquellos pacientes con cirrosis descompensada (tabla 1). Algunos fármacos como el SMV o el PTV/r no deben ser administrados en pacientes con cirrosis Child-Pugh B o C21–23.
Tabla 1.AAD en pacientes con cirrosis avanzada
Fármaco Child-Pugh A Child-Pugh B Child-Pugh C Sofosbuvir Sí Sí Sí Simeprevir Sí Sí No administrar Daclatasvir Sí Sí Sí Ledipasvir Sí Sí Sí Paritaprevir/r Sí No administrar No administrar Ombitasvir Sí Sí Sí Dasabuvir Sí Sí Sí Grazoprevir Sí Requiere reducción de dosis No administrar Elbasvir Sí Sí Sí - c)
Los pacientes con cirrosis avanzada parecen presentar con mayor frecuencia fallos virológicos después de retirar el tratamiento antiviral (recaídas), lo que puede favorecer la aparición de variantes de resistencia. En general, las cepas resistentes suelen ser reemplazadas por virus nativo, ya que están peor preparadas para sobrevivir. La excepción parece ser las cepas seleccionadas por los inhibidores de la NS5A, que persisten en el tiempo24,25. Se desconoce si la aparición de estas variantes de resistencia se asocia con una recidiva del VHC más grave (hepatitis colestásica fibrosante), por lo que la evolución de aquellos pacientes, tratados con los nuevos AAD previamente al trasplante sin conseguir RVS, debería ser monitorizada y estudiada para establecer la importancia de estas cepas resistentes en cuanto a la evolución clínica.
La principal indicación de TH en los países desarrollados es la cirrosis hepática por VHC con o sin hepatocarcinoma. La recurrencia de la infección es constante en este escenario, con una progresión de la enfermedad más rápida si se compara con la que presentan aquellos pacientes inmunocompetentes2,26,27. Aproximadamente un tercio de los pacientes desarrolla cirrosis sobre el injerto en 5 años, por lo que se observa una disminución de la supervivencia global, tanto del injerto como del paciente, cuando se compara con aquellos pacientes trasplantados con una indicación para trasplante distinta al VHC27,28. Existen 2 posibilidades para el tratamiento de la recidiva pos-TH: 1) tratamiento preventivo, antes de que se produzca en daño hepático en el hígado, o 2) tratamiento de la recurrencia cuando la lesión hepática ya está establecida.
Tratamiento preventivoEl tratamiento preventivo consiste en la administración de tratamiento antiviral antes de que se produzca la recurrencia del VHC, evitando el daño histológico en el injerto. La recurrencia en forma de hepatitis aguda habitualmente tiene lugar 1-4 meses tras el trasplante, por lo que este esquema de tratamiento implicaría tratar a los pacientes de manera muy temprana (durante las primeras semana postrasplante)29. Estudios realizados en la era del IFN no evidenciaron ningún beneficio en términos de RVS o prevención del daño hepático, pero sí un elevado número de efectos adversos incluyendo una alta tasa de rechazo del injerto (3,8-23%).
Pese a los recientes avances en el tratamiento antiviral, no existe información sobre la utilización del tratamiento preventivo con los nuevos AAD. Donato et al.30 describieron un caso en el que se inició tratamiento con SOF y RBV una semana antes del trasplante, manteniéndose este durante la cirugía y el postrasplante, sin describirse efectos adversos ni necesidad de suspender el tratamiento a pesar de que el paciente necesitó una reintervención quirúrgica. Recientemente se ha reportado la experiencia de 2 pacientes que iniciaron el tratamiento antiviral libre de IFN durante la hepatectomía (fase anhepática). De momento los pacientes se mantienen con RNA indetectable y la tolerancia al tratamiento fue buena, sin evidencia de toxicidad ni interacciones con los fármacos inmunosupresores31.
Tratamiento de la recurrenciaEn general, el tratamiento antiviral se inicia una vez se observa daño histológico relacionado con la recurrencia del virus. Las indicaciones de tratamiento tradicionalmente eran la presencia de una hepatitis colestásica fibrosante o recurrencia del VHC grave (definida por fibrosis ≥2, hipertensión portal o inflamación grave en el primer año postrasplante). Actualmente, sin embargo, con el uso de fármacos más eficaces y seguros, la indicación de tratamiento se ha extendido a todos los pacientes receptores de TH con evidencia de cualquier grado de recidiva del VHC.
El tratamiento con Peg-IFN y RBV presentaba unas tasas de RVS muy bajas y una elevada tasa de efectos adversos que obligaba a reducir la dosis de uno o ambos fármacos, o a la retirada del tratamiento4. La adición de un inhibidor de la proteasa de primera generación (telaprevir o boceprevir) al tratamiento con IFN y RBV aumentó de manera significativa la posibilidad de alcanzar una RVS32–35, pero también incrementó el riesgo de aparición de efectos adversos graves e interacciones farmacológicas23. Un estudio observacional multicéntrico realizado en EE. UU. describió la experiencia de la triple terapia (90% con teleprevir) en 81 pacientes con G1 tras el TH. Un 53% de la cohorte presentaba fibrosis avanzada (F3-F4) y el 57% eran pacientes no respondedores a Peg-IFN ni a RBV después del trasplante. El 63% presentó RVS a las 12 semanas. Se observó también que la mayor parte de los pacientes presentó anemia: el 81% de ellos necesitaron tratamiento en eritropoyetina y el 57% transfusiones. También se observaron otros efectos adversos graves con necesidad de hospitalización en un 27% de ellos y el 15% de la cohorte también tuvo que suspender el tratamiento de manera prematura.
Recientemente, se han evaluado la eficacia y la seguridad de los nuevos regímenes libres de IFN en el tratamiento de la recurrencia del VHC. Se ha observado que, dependiendo del régimen usado y de la gravedad de la recurrencia, se alcanza RVS entre un 57-97%15,16,36–41 (fig. 2). Por lo tanto, aunque el número de pacientes incluidos en estos estudios es limitado, parece que los nuevos AAD pueden ser una buena opción en el tratamiento de la recurrencia del VHC. Además, los programas de uso compasivo de estos nuevos tratamientos también han mostrado tasas de RVS por encima del 70%, incluso en la recurrencias graves y precoces, como las hepatitis colestásicas37,41.
El primer estudio en evaluar la eficacia del tratamiento libre de IFN en la recidiva del virus C tras el TH analizó la eficacia y seguridad de la combinación de SOF y RBV en 40 pacientes con más de 12 meses tras el TH. A pesar de ser un estudio pequeño con una combinación subóptima, 70% de los pacientes alcanzaron una RVS, demostrando la seguridad y eficacia de las combinaciones orales en esta población de pacientes42. Posteriormente, se han realizado diferentes ensayos clínicos que combinan 2 o 3 AAD con tasas de RVS muy superiores.
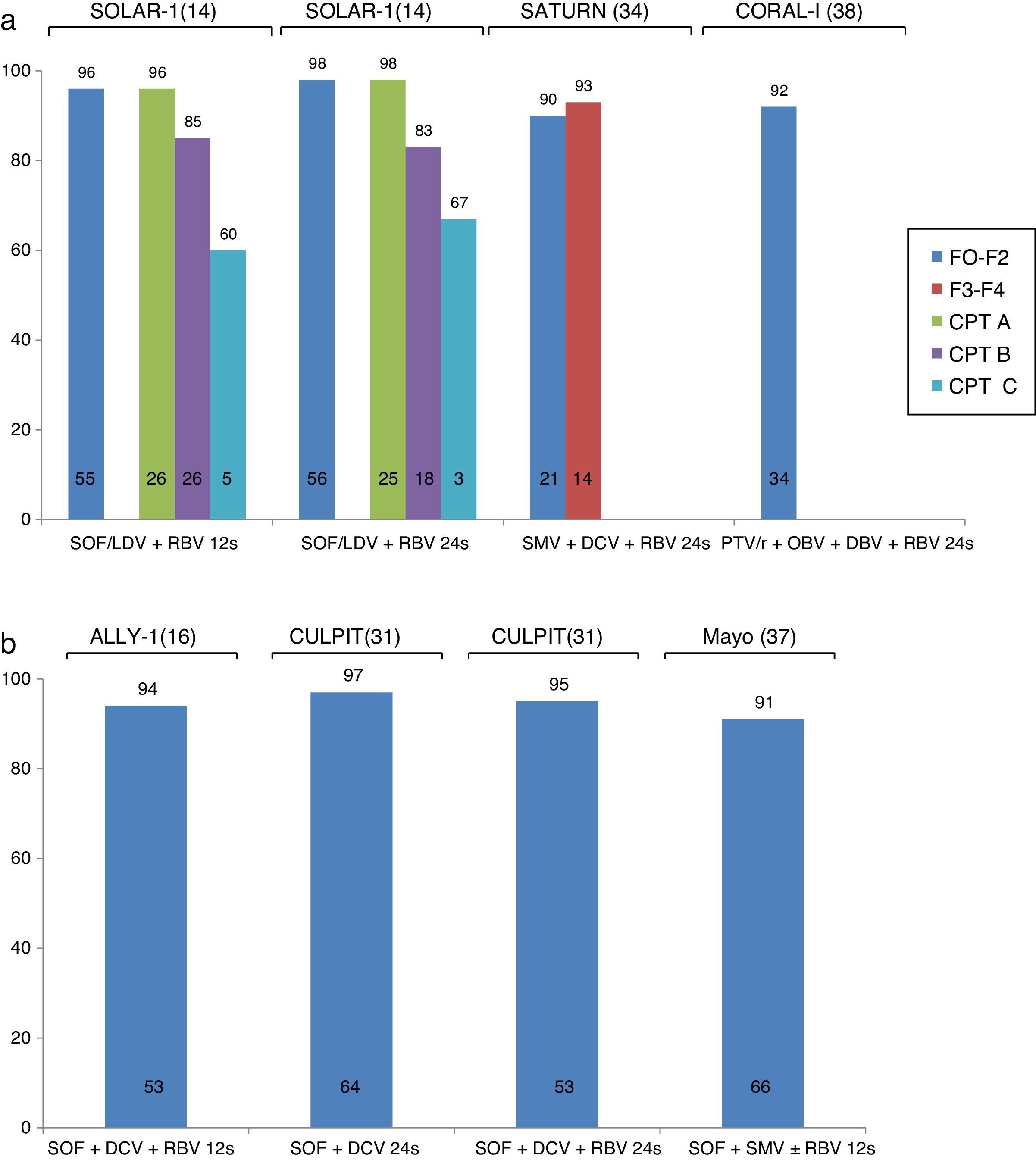
El estudio CORAL-I evaluó la eficacia y seguridad de la combinación de PTV/r/OBV con DBV y RBV en 34 pacientes con recurrencia leve del VHC (F0-F2) tras el TH, infectados con el G1. La tasa de RVS fue del 97% y la tolerancia al tratamiento fue excelente. La principal limitación de esta combinación en el contexto del TH es la presencia de interacciones farmacológicas entre PTV/r y los fármacos inmunosupresores. Así, la dosis de tacrolimus debe ser reducida a 0,5mg/semana y la dosis de ciclosporina a 1/5 parte de la dosis habitual. Ello dificulta el manejo de los pacientes por el potencial riesgo de rechazo o toxicidad por infra- o sobredosificación de los inhibidores de la calcineurina. Los estudios SOLAR-1 y SOLAR-214,15 analizaron la eficacia y seguridad de la combinación de LDV/SOF con RBV en pacientes con recurrencia del virus C en diferentes estadios de la enfermedad: F0-F3, cirrosis compensada (Child-Pugh A) o cirrosis descompensada (Child-Pugh B y C). Los pacientes fueron aleatorizados a recibir esta combinación durante 12 o 24 semanas. El estudio SOLAR-1 evidenció una mayor probabilidad de alcanzar una RVS en pacientes con fibrosis leve o cirrosis compensada (96-98%) comparados con los pacientes con cirrosis descompensada (83-85% en pacientes Child-Pugh B y 60-67% en pacientes Child-Pugh C). El estudio SOLAR-2 mostró datos similares en pacientes de población europea con las mismas características.
Más recientemente se han presentado los resultados del estudio ALLY-1, que evaluó la eficacia del tratamiento con SOF+DCV+RBV en una cohorte de 53 pacientes con recurrencia del VHC tras el TH. La mayoría de los pacientes presentaban una fibrosis avanzada, F3-F4 (55%). El 94% de los pacientes alcanzó un RVS. La tolerancia al tratamiento fue buena y solo un paciente interrumpió el tratamiento por cefalea intensa16. Esta misma combinación ha sido estudiada en diferentes cohortes de práctica clínica real. Entre ellas, la cohorte CULPIT43 recogió los resultados de la combinación de SOF+DCV con o sin RBV durante 12 o 24 semanas (a decisión del médico tratante) en 130 pacientes monoinfectados con el VHC con recurrencia grave de la infección tras el TH. La tasa de RVS fue de 67-100% para pacientes con 12 semanas de tratamiento y de 96-100% para pacientes tratados durante 24 semanas. Es importante destacar que, en el grupo con RVS de 67% (12 semanas con RBV), el número de pacientes era extremadamente bajo (n=3), lo que impide sacar una conclusión definitiva. No se encontraron diferencias significativas en la tasa de RVS según el tipo de respuesta a un tratamiento previo, el genotipo de virus o el estadio de fibrosis. A pesar de la ausencia de interacciones farmacológicas entre los fármacos inmunosupresores y el tratamiento antiviral, hasta un 56% de los pacientes requirieron ajuste de la dosis del inmunosupresor (probablemente por la mejoría de la función hepática) lo que hace necesaria una monitorización estrecha del paciente.
Otra combinación ampliamente estudiada en la práctica clínica es SOF+SMV con o sin RBV. Los resultados de 2 grandes cohortes han sido publicados. La cohorte TARGET incluyó a 227 receptores de TH que recibieron tratamiento antiviral basado en SOF. La mayoría de los pacientes estaban infectados con el G1 y recibieron tratamiento con SOF+SMV con o sin RBV. Globalmente, la tasa de RVS fue del 90%, con tasas ligeramente inferiores en pacientes con cirrosis hepática (86%), especialmente aquellos con MELD >10 (77%) o infección por G1a (83%). También se han publicado los datos de la cohorte de la Clínica Mayo, en la cual se incluyó a 123 receptores de TH (30% con fibrosis F3-F4, 11% con hepatitis colestásica y 82% tratados previamente). Aunque la tasa de RVS fue de un 90%, los pacientes infectados con el G1a y con fibrosis F3-F4 presentaron una menor probabilidad de curación (71 vs. 91% en pacientes con fibrosis F0-F2). La tolerancia al tratamiento fue buena, aunque el 72% de los pacientes que recibieron RBV presentaron anemia.
Finalmente, existen algunos datos que estudian la eficacia de la combinación de SMV y DCV en pacientes con recidiva del VHC e infección por G1b. El estudio SATURN44 incluyó a 35 pacientes con estadio F1-F4 repartidos en 2 cohortes. La primera cohorte incluyó a pacientes con fibrosis leve y tratamiento inmunosupresor con tacrolimus o ciclosporina, y la segunda cohorte incluyó a pacientes con fibrosis avanzada y tratamiento con tacrolimus, dado el riesgo de interacción entre la ciclosporina y el SMV detectado en la primera cohorte. La tasa de RVS a las 4 semanas posfinalización del tratamiento fue de 90-93%, con una buena tolerancia al tratamiento. Todos los fallos virológicos fueron debidos a rebrote virológico intratratamiento (uno de ellos en un paciente con G1a incluido por error en el estudio). Esta combinación también fue evaluada en una cohorte de práctica clínica en la que se recogieron los datos del uso compasivo de SMV a nivel europeo. Veintitrés pacientes con recidiva grave del VHC recibieron esta combinación, con una tasa de RVS de 72%. Cuatro de los 5 fallos virológicos fueron debidos a un rebrote virológico intratratamiento, y uno fue una recaída tras la finalización del tratamiento antiviral. La eficacia de esta combinación parece un poco menor que las mencionadas previamente y podría ser reservada a pacientes con indicación de tratamiento, pero que presenten contraindicaciones para recibir otras combinaciones antivirales.
Los resultados de los estudios mencionados previamente permiten sacar algunas ideas con relación al tratamiento del VHC en el TH: 1) El momento ideal para iniciar el tratamiento antiviral tras el TH no se conoce. Parece claro que la eficacia del tratamiento es mayor en estadios iniciales de la enfermedad (mejor F0-F2 que F3-F4, mejor en cirrosis compensada que en cirrosis descompensada). No existen datos sobre la utilización del tratamiento preventivo (antes del desarrollo de la lesión histológica), pero la administración del tratamiento en el postrasplante inmediato podría verse complicada por la necesidad de reintervención quirúrgica, la aparición de insuficiencia renal, interacciones, etc. Por todo ello, parece claro recomendar el inicio precoz del tratamiento antiviral tras el TH, una vez se evidencie lesión del injerto, pero siempre en estadios muy iniciales del daño hepático. 2) La erradicación del virus tiene un impacto benéfico sobre la función hepática (Child-Pugh y MELD), con lo cual los pacientes con cirrosis descompensada también se benefician de recibir tratamiento antiviral. 3) Las combinaciones sin IFN son seguras tras el TH. 4) La elección del tratamiento debe considerar el grado de disfunción hepática, la función renal del paciente y la posibilidad de interacciones con los inmunosupresores que recibe el paciente.
ConclusionesEl desarrollo de nuevos fármacos con acción antiviral directa ha sido un gran avance en el tratamiento de los pacientes en el contexto del TH. Ello ha permitido tratar a pacientes sin opciones previas de tratamiento, ya sea por la presencia de contraindicación (riesgo de infecciones, muerte o descompensación en pacientes con cirrosis avanzada), ya sea por la necesidad de interrumpir de forma prematura el tratamiento por efectos adversos. Dada la seguridad del tratamiento con fármacos de acción antiviral directa, es ideal intentar la erradicación del virus antes del TH con el objetivo de prevenir la infección del injerto. Algunos pacientes, sin embargo, podrían ver limitada su opción al TH por la mejoría del MELD. Es por ello fundamental seleccionar cuidadosamente los pacientes candidatos a recibir tratamiento. Tras el TH, el impacto benéfico del tratamiento es enorme, al proporcionar una mejoría de la función hepática y, en algunos casos, regresión de la fibrosis hepática. El tratamiento debería iniciarse en fases precoces de la enfermedad (antes del desarrollo de cirrosis o descompensación). La elección del tratamiento deberá basarse en las características del paciente y en la presencia de potenciales interacciones medicamentosas.
Conflicto de interesesMaría-Carlota Londoño: Janssen, MSD, BMS, Abbvie, Gilead. Laura-Patricia Llovet y Sergio Rodríguez-Tajes no tienen conflictos de interés.