INTRODUCCION
Strongyloides stercoralis es un nematodo intestinal de distribución mundial, endémico en zonas rurales de países con clima tropical o subtropical de Asia, África y América, donde las condiciones climáticas de humedad y calor permiten su desarrollo y supervivencia1. La estrongiloidosis es una enfermedad de alta prevalencia mundial (100 millones de casos). En España se han descrito microhábitats en la Comunidad Valenciana, relacionados fundamentalmente con zonas rurales2-4 y casos esporádicos en inmigrantes. La infección se produce a través de la piel con la penetración de las larvas filariformes, desde donde alcanzan el sistema circulatorio y migran al pulmón, atraviesan la barrera alvéolo-capilar para migrar luego a bronquiolos, bronquios, tráquea y laringe, penetrando posteriormente en el tubo digestivo. Resisten el ácido gástrico y llegan al intestino delgado, donde se desarrollan a adultos e inician el ciclo reproductivo por partenogénesis. Ponen huevos en la luz intestinal, que son excretados con las heces. El parásito presenta 3 tipos de ciclos biológicos: directo (volviendo a infectar a otro huésped), indirecto de vida libre y autoinfección (los huevos eclosionan antes de abandonar el colon y las filarias penetran a través del recto pasando al sistema circulatorio)5. La autoinfección endógena se mantiene durante varios años. Puede cursar de manera asintomática durante muchos años, y en los casos en que la infección se manifiesta suelen presentar una clínica muy larvada con síntomas inespecíficos, digestivos, respiratorios y dermatológicos6. Es importante el correcto diagnóstico de estos pacientes, ya que un estado de inmunodepresión adquirido puede provocar una hiperinfección diseminada con sepsis, fallo respiratorio agudo, enfermedad pulmonar restrictiva, hemorragia alveolar o digestiva y en algunos casos la muerte del paciente7,8. En cuanto al diagnóstico, la eliminación de larvas en las heces es variable; puede ser escasa o nula, por lo que el examen de más de una muestra fecal, así como las técnicas de concentración, aumenta la sensibilidad9.
OBSERVACION CLINICA
Mujer de 29 años de edad, de nacionalidad colombiana y 2 años de residencia en España, con antecedentes personales de alergia a metoclopramida, ulcus péptico hace 10 años y cesárea hace 2 años. Refiere conductas de riesgo para enfermedades de transmisión sexual, sin hábitos tóxicos. Está en tratamiento habitual con Pro-ulco® y Trankimazin®. Ingresa en el servicio de aparato digestivo por un cuadro de dolor abdominal en el hemiabdomen derecho más intenso en el epigastrio y tras las comidas, de 2 años de evolución. Se asocia intolerancia alimentaria total en la última semana, pérdida de 10-12 kg de peso en los últimos 2 años, y vómitos biliosos en el último mes. No había presentado sensación febril ni alteración del ritmo intestinal ni síntomas respiratorios. En la ex plo-ración física cabe destacar un moderado estado de desnutrición y deshidratación con una exploración cardiopulmonar dentro de la normalidad.
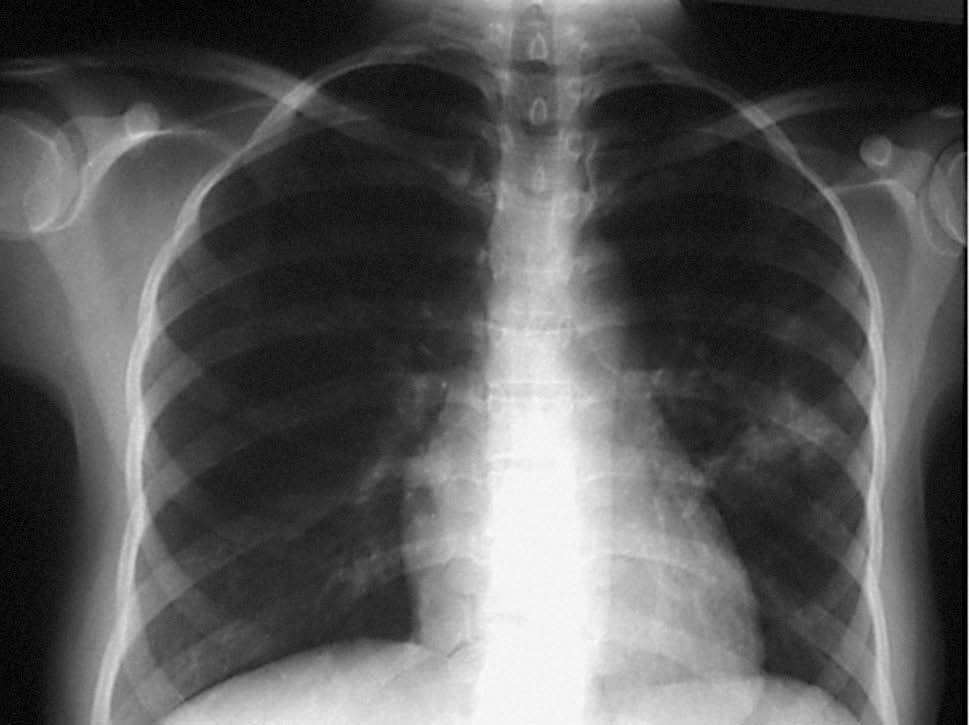
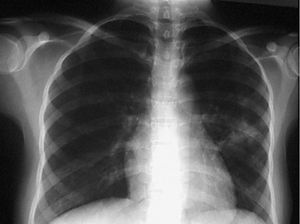
Presentaba un abdomen blando, depresible, doloroso a la palpación en el hemiabdomen derecho, sin masas ni megalias. No se palpan adenopatías a ningún nivel. De las pruebas complementarias cabe destacar una PCR de 4,73 mg/dl, anemia microcítica e hipocrómica (Hb 9,9 g/dl, hematocrito 31%, MCV 79,6 fl, MCH 25,4 pg) y una eosinofilia (leucocitos 7.620/µl, NE 55,2%, EO 9,95%). Hierro de 19,9 µg/dl con un índice de saturación del 7,6%. El resto de parámetros analíticos estaban dentro de la normalidad. En la radiografía de tórax al ingreso presentaba un infiltrado parenquimatoso irregular en el segmento inferior del lóbulo superior izquierdo (fig. 1), sin clínica respiratoria asociada.
Figura 1. Radiografía de tórax en el ingreso. Infiltrado parenquimatoso en el segmento inferior del lóbulo superior izquierdo.
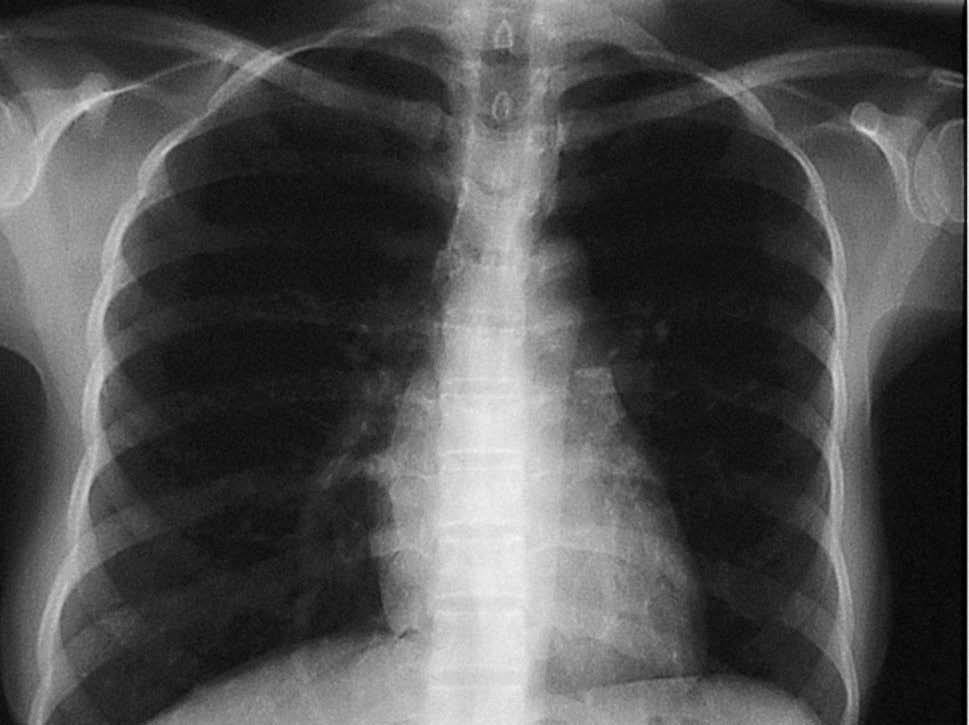
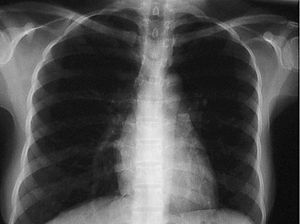
Presentó varios picos febriles, por lo que se realizó una reacción de Mantoux, que resultó positiva, hemocultivos. que fueron negativos. y broncoscopia, ya que la paciente no expectoraba. La broncoscopia mostró la tráquea, la carina y el árbol bronquial sin alteraciones endobronquiales. Se realizó BAS, BAL, citología para células malignas y cultivo del BAS, que resultaron negativos. Se solicitó una radiogra-fía de control posterior, donde el infiltrado había desaparecido (fig. 2). Las serologías para VHC, VHA, VHB, Fasciola y VIH fueron ne gativas.
Figura 2. Radiografía de tórax el noveno día de ingreso.
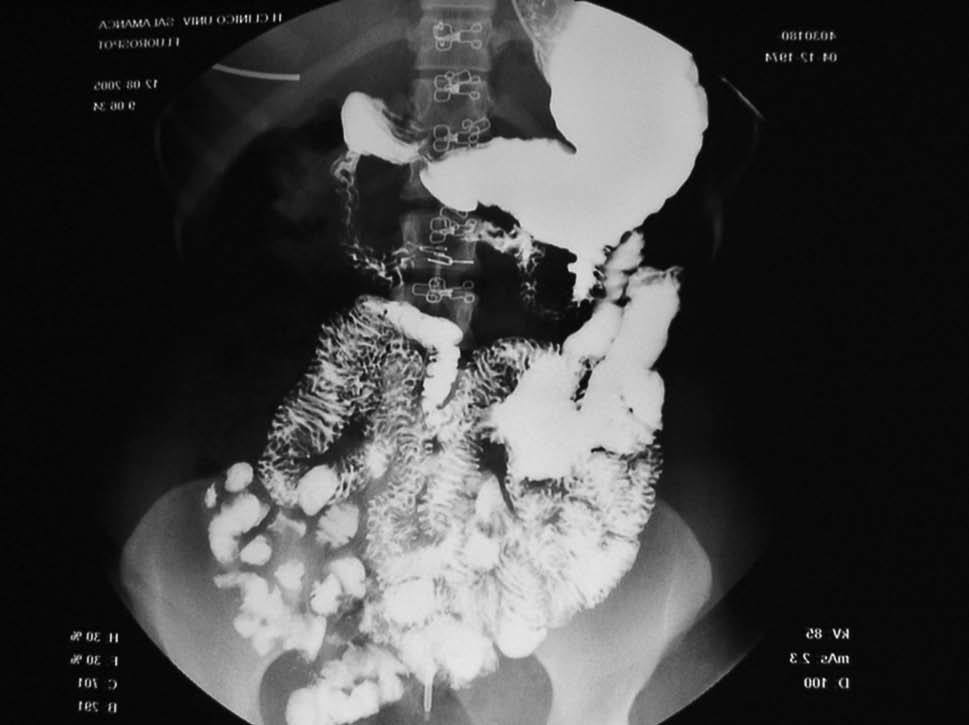
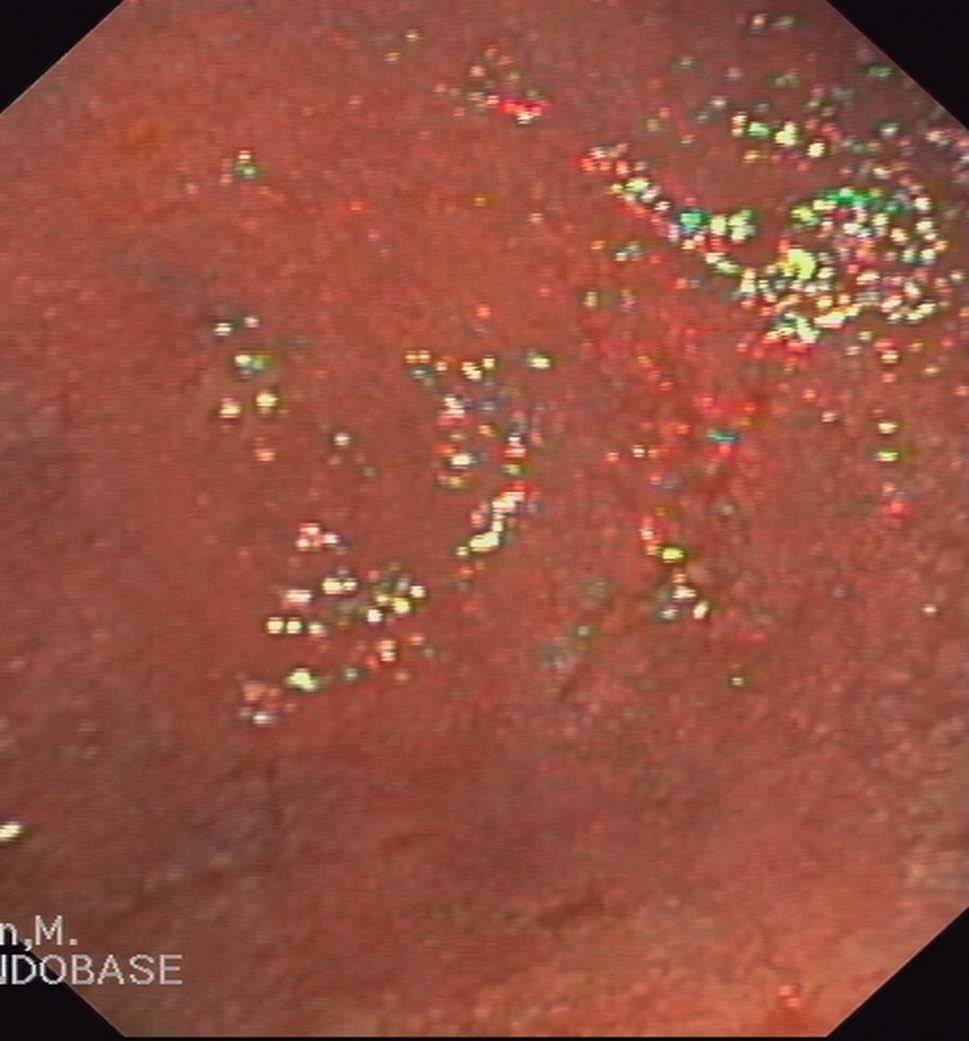
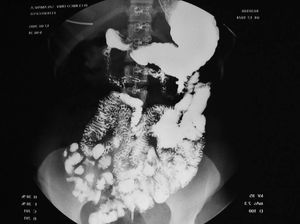
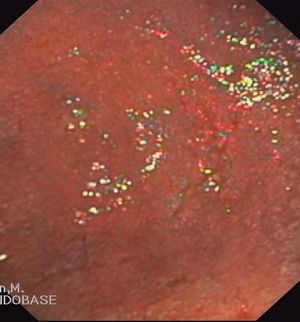
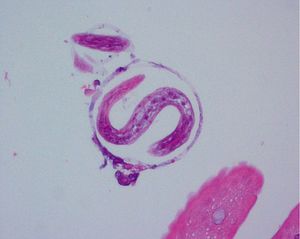
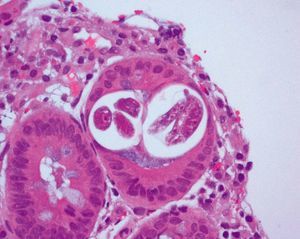
En cuanto a la patología digestiva, se realizó una endoscopia digestiva alta, que fue normal hasta la segunda porción del duodeno, ecografía abdominal sin hallazgos valorables, coprocultivos y búsqueda de parásitos en heces 2 veces, siendo ambas negativas. Anticuerpos de enfermedad celíaca también negativos. Un tránsito intestinal reveló una disminución de pliegues en las asas duodenales, con dilatación de las asas yeyunales y preservación de pliegues (fig. 3). Se decidió entonces realizar una segunda endoscopia digestiva alta con toma de biopsias, que mostró una pérdida de los pliegues intestinales en la tercera porción de duodeno, con una mucosa lisa y discretamente rígida (fig. 4). En las biopsias tomadas a ese nivel se aisló S. stercoralis (figs. 5 y 6). Durante el ingreso, la paciente presentó molestias abdominales que cedían con la analgesia y el reposo digestivo. La anemia ferropénica se trató con hierro oral. Una vez aislado el parásito, se trató con 2 dosis de ivermectina. A los 6 meses no presentó ningún episodio de dolor abdominal, ganó 10 kg de peso y se corrigió la anemia ferropénica.
Figura 3. Tránsito intestinal. Disminución de pliegues de asas duodenales.
Figura 4. Imagen endoscópica de mucosa duodenal. Desaparición de pliegues.
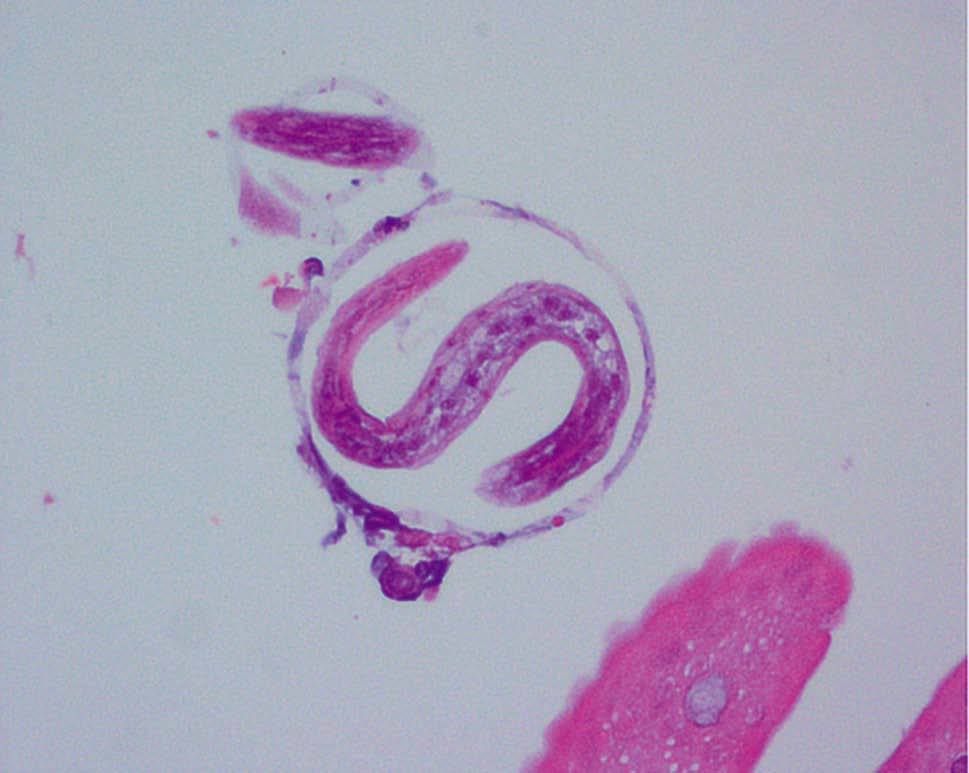
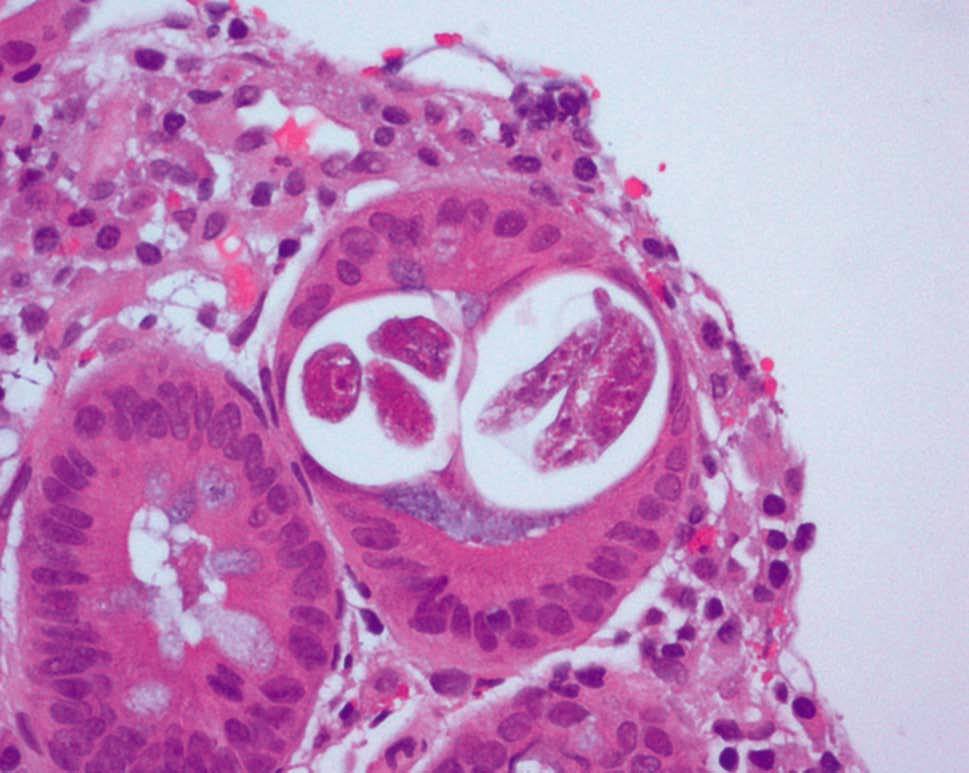
Figura 5. Anatomía patológica de biopsia de mucosa duodenal. Strongyloides stercolaris en el interior de una cripta de Lieberkühn. Tinción de Giemsa con h-e.
Figura 6. Anatomía patológica de biopsia de mucosa duodenal. Tinción de Giemsa con h-e.
DISCUSION
La estrongiloidosis no diseminada debe sospecharse en pacientes procedentes de áreas endémicas (sin importar el tiempo de residencia en nuestro país). La infección cursa con síntomas dermatológicos en el punto de penetración en la piel (prurito, inflamación, edema, petequias, larva currens) más comunes en la infección aguda. Los síntomas gastrointestinales, como diarrea, anorexia, náuseas, vómitos o dolor epigástrico, puede simular una úlcera péptica y, en infecciones crónicas, como en nuestro caso, un síndrome de malabsorción y pérdida de peso10. Las manifestaciones pulmonares se caracterizan por congestión, disnea o hemoptisis. En raras ocasiones se puede observar el paso del parásito a través del parénquima pulmonar (síndrome de Loeffler), produciendo un infiltrado pulmonar en la radiografía de tórax que desaparece a los pocos días sin tratamiento, como ocurre en nuestro caso.
El diagnóstico de estos pacientes es importante, ya que un estado de inmunodepresión adquirida puede provocar un síndrome de hiperinfección7,8.
La eosinofilia es un dato analítico que nos debe hacer sospechar una parasitosis (sensibilidad para estrongiloidosis en algunos estudios del 82%)11. Los valores séricos de IgE a menudo están elevados12. Aproximadamente el 25% de los pacientes infectados presentan exámenes de heces negativos para parásitos13. Los tests específicos, como la técnica de concentración de Baerman, pueden aumentar la sensibilidad del diagnóstico, aunque sin buenos resultados. El estudio del aspirado duodenal o el Enterotest® pueden ser igualmente útiles14. La endoscopia digestiva alta generalmente no establece el diagnóstico. Puede revelar alteraciones inespecíficas, como cambios en la granularidad o la friabilidad de la mucosa intestinal, ulceraciones o áreas de mucosa necrótica. La biopsia de la zona afectada puede ofrecernos el diagnóstico, como ocurre en el presente caso15. El diagnóstico mediante BAL y cultivo de esputo sólo es rentable en infecciones diseminadas. Hay tests serológicos mediante ELISA con alta sensibilidad, pero deben ser solicitados sólo si se sospecha el diagnóstico de estrongiloidosis. El tratamiento con tiabendazol o ivermectina da muy buenos resultados16.
En resumen, la estrongiloidosis, al igual que otras parasitosis, debe ser sospechada en pacientes procedentes de áreas endémicas o que han viajado a ellas, sobre todo los que presentan eosinofilia. El síndrome de Loeffler es una rara manifestación de la estrongiloidosis, que en esta ocasión pudo ser evidenciada.