La incidencia de la enfermedad inflamatoria intestinal (EII) está aumentando en todo el mundo.
ObjetivosEvaluar la incidencia de EII en la comunidad autónoma de Castilla y León y describir las características clínicas de los pacientes al diagnóstico, el tipo de tratamiento recibido y la evolución clínica durante el primer año.
Material y métodosEstudio prospectivo, multicéntrico y poblacional en el que se incluyeron pacientes adultos diagnosticados de EII (enfermedad de Crohn [EC], colitis ulcerosa [CU] o colitis indeterminada [CI]) durante el año 2017 procedentes de 8 centros de Castilla y León. Se incluyeron variables epidemiológicas, clínicas y terapéuticas. Se calculó la incidencia global y por enfermedades.
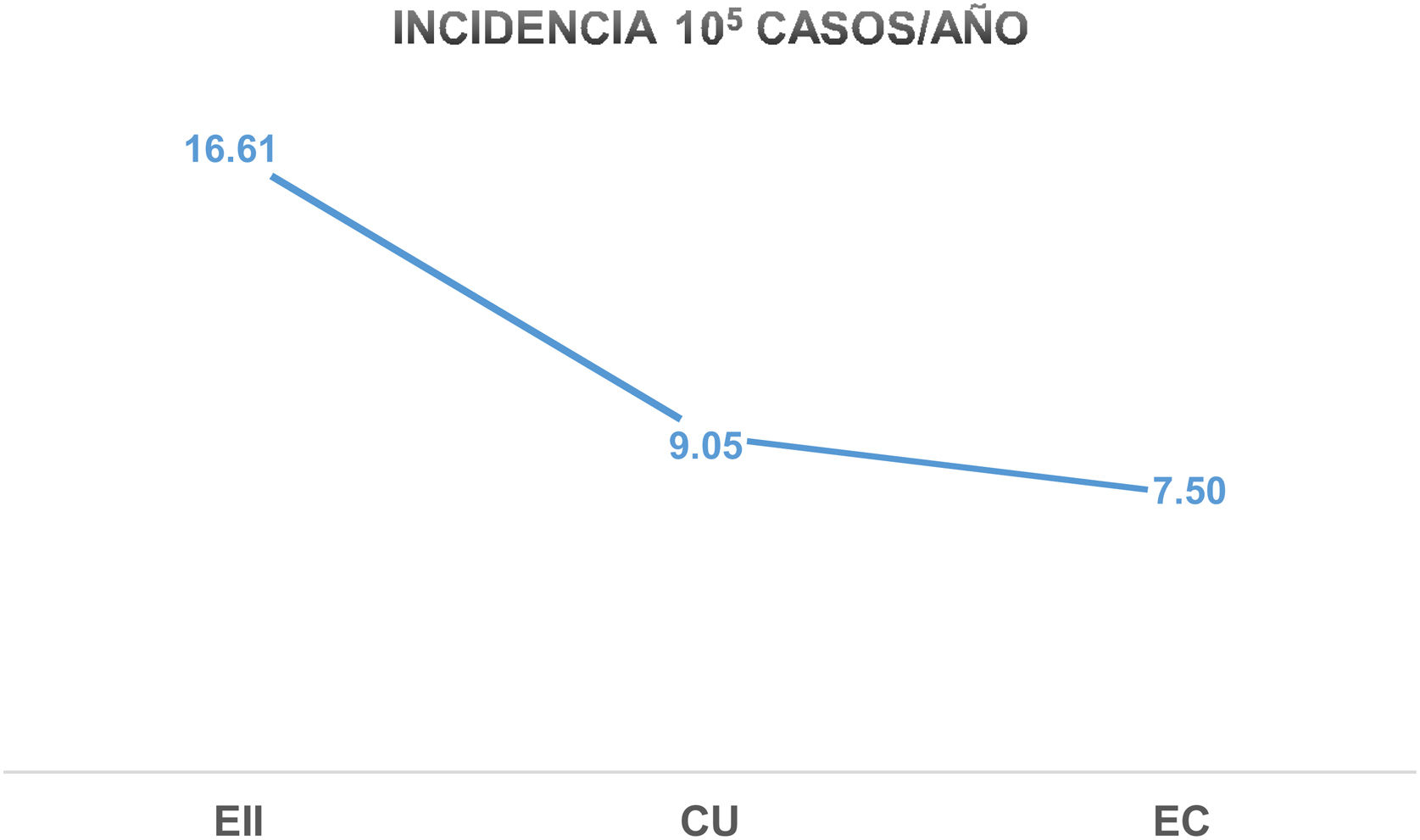
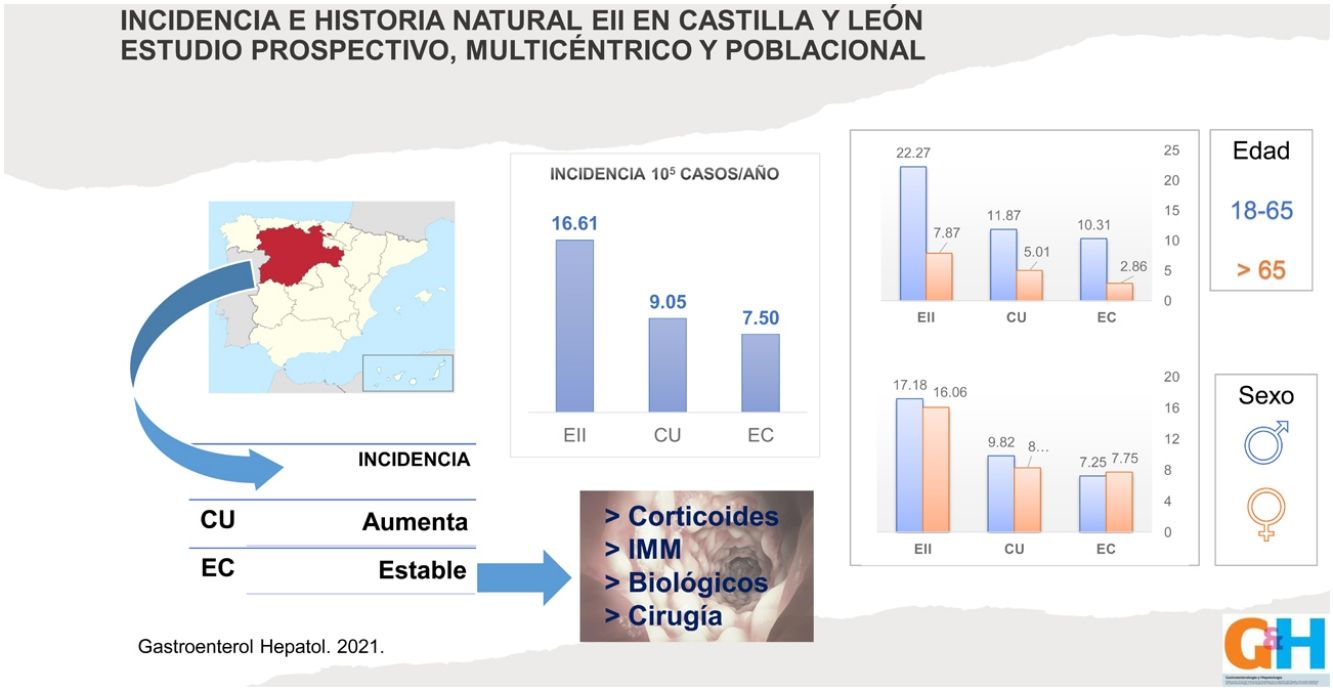
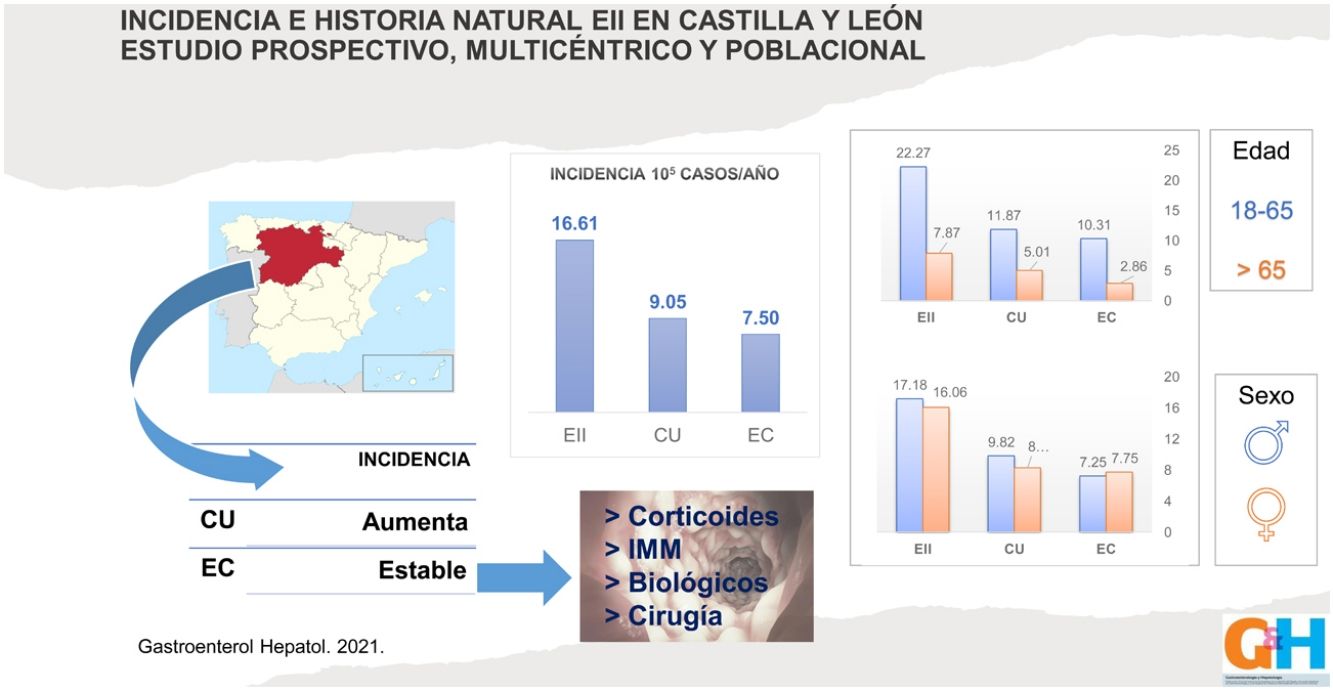
ResultadosDoscientos noventa pacientes fueron diagnosticados de EII (54,5% de CU, 45.2% de EC y 0,3% de CI), con una mediana de seguimiento de 9 meses (rango 8-11). La tasa de incidencia fue de 16,6 casos/100.000 habitantes-año (9/105 casos de CU y 7,5/105 casos de EC), con una proporción CU/EC de 1,2:1. Los pacientes con EC recibieron significativamente más corticoides sistémicos (47% vs. 30%; p=0,002), más tratamiento inmunomodulador (81% vs. 19%; p=0,000), más tratamiento biológico (29% vs. 8%; p=0,000) y mayor necesidad de cirugía (11% vs. 2%; p=0,000).
ConclusionesLa incidencia de pacientes con CU en nuestro medio se incrementa, mientras que la de EC se mantiene estable, con una historia natural de la enfermedad peor (uso de corticoides, inmunosupresores, biológicos y cirugía) para los pacientes con EC comparado con los pacientes con CU en el primer año de seguimiento.
The incidence of inflammatory bowel disease (IBD) is increasing worldwide.
ObjectivesTo evaluate the incidence of IBD in Castilla y León describing clinical characteristics of the patients at diagnosis, the type of treatment received and their clinical course during the first year.
Materials and methodsProspective, multicenter and population-based incidence cohort study. Patients aged >18 years diagnosed during 2017 with IBD (Crohn's disease [CD], ulcerative colitis [UC] and indeterminate colitis [IC]) were included from 8 hospitals in Castilla y León. Epidemiological, clinical, and therapeutic variables were registered. The global incidence and disease incidence were calculated.
Results290 patients were diagnosed with IBD (54.5% UC, 45.2% CD, and 0.3% IC), with a median follow-up of 9 months (range 8−11). The incidence rate of IBD in Castilla y Leon in 2017 was 16.6 cases per 10,000 inhabitants-year (9/105 UC cases and 7.5/105 CD cases), with a UC/CD ratio of 1.2:1. Use of systemic corticosteroids (47% vs 30%; P=.002), immunomodulatory therapy (81% vs 19%; P=.000), biological therapy (29% vs 8%; P=.000), and surgery (11% vs 2%; p=.000) were significatively higher among patients with CD comparing with those with UC.
ConclusionsThe incidence of patients with UC in our population increases while the incidence of patients with CD remains stable. Patients with CD present a worse natural history of the disease (use of corticosteroids, immunomodulatory therapy, biological therapy and surgery) compared to patients with UC in the first year of follow-up.
En el año 1875 se describió por primera vez la colitis ulcerosa (CU)1 y 57 años después la enfermedad de Crohn (EC)2, englobándose junto con la colitis indeterminada (CI) en el grupo de las enfermedades inflamatorias intestinales (EII), y siendo actualmente un problema de salud mundial que afecta aproximadamente a 2,4 millones de personas en Europa y a 1,3 millones en Estados Unidos3.
Estas enfermedades son el resultado de una respuesta inmune alterada en un ambiente de disbiosis intestinal, sobre la que influyen factores ambientales en individuos genéticamente predispuestos4, y su incidencia está aumentando globalmente, con un incremento en la vertiente oeste del mundo (EE. UU., Canadá, Australia, Nueva Zelanda y el oeste de Europa)5, coincidiendo con el crecimiento poblacional y el desarrollo industrial y económico, con cifras de prevalencia de 1 de cada 200-300 habitantes en países desarrollados6,7. Asimismo, están apareciendo nuevos casos de EII en países en vías de desarrollo, donde la presencia de estas enfermedades era inexistente3,6,7.
España es el país que mayor número de estudios prospectivos y poblacionales de incidencia ha publicado, con cifras similares a las referidas en el resto de los países europeos (5-12 casos de CU/100.000 habitantes/año y de 3,5-9,5 casos/100.000 habitantes/año para los pacientes con EC)4.
Nuestro objetivo primario es, en función de los datos recogidos de forma prospectiva a nivel nacional para el registro EPIDEM-IBD que acaba de ser publicado8,9, calcular la incidencia de EII en la comunidad de Castilla y León. Nuestros objetivos secundarios son describir las características clínicas de los pacientes al diagnóstico, evaluar el tipo de tratamiento recibido (fármacos inmunosupresores y/o biológicos y cirugía), así como la evolución clínica durante el primer año de evolución desde su diagnóstico.
Material y métodosEstudio prospectivo, multicéntrico y poblacional en el que se incluyen todos los pacientes mayores de 18 años diagnosticados de EII (EC, CU o CI) desde el 1 de enero de 2017 hasta el 31 de diciembre de 2017 en la comunidad autónoma de Castilla y León, con la participación de 8 centros hospitalarios de 5 provincias de la comunidad (Valladolid: Hospital Universitario Río Hortega, Hospital Clínico Universitario y hospital Medina del Campo; Burgos: Hospital Universitario y Hospital Santos Reyes de Aranda de Duero; Complejo Asistencial Universitario de León, Hospital Universitario de Salamanca y Hospital Virgen de la Concha de Zamora), con una población total de habitantes de 1.745.988 en ese año y un seguimiento medio de 9 meses (rango 8-11)10. En España el sistema de salud es público, teniendo tan solo un 15% de los pacientes seguro privado, y de ellos, tan solo el 15% no utiliza el sistema público, por lo que se decidió a nivel nacional no incluir estos pacientes, dado que no modificarían significativamente los resultados de incidencia11.
Se incluyeron de forma prospectiva los casos incidentes de EII en los diferentes hospitales comprobando las bases de datos de endoscopia y anatomía patológica, así como radiología para evitar la pérdida de casos. Posteriormente se realizó visita en el mes 3 y al año.
Se recogieron las siguientes variables en Research Electrónica Data Capture12, con el permiso de la Asociación Española de Gastroenterología (www.aegastro.es), sociedad sin ánimo de lucro (Red-cap):
- -
Sexo y edad.
- -
Diagnóstico de EII siguiendo las guías de la European Crohn's and Colitis organisation (ECCO) y la European Society of Gastrointestinal and Abdominal Radiology13,14.
- -
Fenotipo y extensión según la clasificación de Montreal15.
- -
Tiempo transcurrido hasta el diagnóstico: tiempo desde la primera consulta sintomática del paciente al médico hasta el establecimiento del diagnóstico.
- -
Hábito tabáquico: definiéndose como fumador aquel paciente que fuma más de 7 cigarrillos a la semana durante al menos 6 meses previos al diagnóstico y ha fumado al menos un cigarrillo los 6 meses previos al diagnóstico; exfumador aquel paciente que ha dejado de fumar desde hace al menos 6 meses previos al diagnóstico y no fumador aquel paciente que no ha fumado nunca o muy esporádicamente.
- -
Antecedente familiar de primer grado de EII.
- -
Apendicectomía previa.
- -
Manifestaciones extraintestinales.
- -
Tratamientos farmacológicos recibidos desde el diagnóstico de la EII:
- ∘
Mesalazina.
- ∘
Corticoides: sistémicos, de acción tópica o rectales.
- ∘
Fármacos inmunosupresores: azatioprina, mercaptopurina y metotrexato.
- ∘
Fármacos biológicos: infliximab, adalimumab, ustekinumab y vedolizumab.
- -
Cirugía al diagnóstico o durante el seguimiento
- -
Hospitalización y sus causas.
Para realizar el análisis estadístico los datos se han procesado mediante el software estadístico IBM SPSS 22. Se realizó un análisis descriptivo de la muestra aportando medianas (rango intercuartílico) y frecuencia (porcentaje) según el tipo de variable. Se realizó un análisis comparativo entre ambas enfermedades (CU vs. EC), valorando datos epidemiológicos, clínicos y tipos de tratamiento. Según el tipo de variables se utilizaron o el test U de Mann-White o el Chi cuadrado (Fisher). Para el cálculo de incidencia por 100.00 habitantes se utilizaron los datos del Sistema Nacional de Estadística para la población de referencia utilizando este dato como denominador. Además, se calculó la tasa estandarizada por edad ajustada a la población europea.
ResultadosDurante el periodo de inclusión (12 meses) un total de 290 pacientes fueron diagnosticados de EII. De ellos, 158 pacientes (54,5%) fueron diagnosticados de CU, 131 (45,2%) de EC y uno (0,3%) de CI, con una mediana de seguimiento de 9 meses (rango 8-11 meses); el 51% eran varones (147), con una edad media de 47 años (33-58). Reflejamos los datos epidemiológicos en la tabla 1.
Variables demográficas descriptivas y comparativa de enfermedad de Crohn y colitis ulcerosa
| EII (n=289) | EC (n=131) | CU (n=158) | p-valor | |
|---|---|---|---|---|
| Edad; años (rango) | 47 (33-58) | 44 (28-55) | 49 (37-60) | 0,233 |
| Sexo masculino, n (%) | 147 (51) | 62 (47) | 84 (53) | 0,323 |
| Tiempo medio de seguimiento, meses | 9 (8-11) | 9 (8-11) | 9 (7,5-13) | 0,768 |
| Tiempo de demora de diagnóstico, meses (RIQ) | 2 (1-6) | 3 (0,7-10,2) | 2 (1-6) | 0,147 |
| Historia familiar EII, n (%) | 40 (14) | 24 (19) | 15 (10) | 0,028 |
| Manif. extraintestinales, n (%) | 30 (10) | 17 (13) | 13 (8) | 0,188 |
| Fumador, n (%) | 72 (25) | 50 (38) | 22 (14) | 0,000 |
| Mesalazina, n (%) | 160 (55) | 19 (15) | 141 (96) | 0,000 |
| Corticoides sistémicos, n (%) | 109 (38) | 62 (47) | 47 (30) | 0,002 |
| Corticoides rectales, n (%) | 13 (0,04) | 2 (2) | 11 (7) | 0,026 |
| Corticoides orales de acción tópica, n (%) | 55 (19) | 39 (30) | 16 (10) | 0,000 |
| Inmunomoduladores, n (%) | 86 (30) | 70 (53) | 16 (10) | 0,000 |
| Biológicos, n (%) | 51 (18) | 38 (29) | 13 (8) | 0,000 |
| Hospitalización por brote, n (%) | 22 (29) | 6 (8) | 16 (21) | 0,001 |
| Cirugía, n (%) | 17 (6) | 14 (11) | 3 (2) | 0,006 |
Los datos se expresan en mediana, rango intercuartílico (RIQ), frecuencia absoluta y relativa. Test U de Mann-White o el Chi Cuadrado (Fisher).
CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal.
En negrita, datos estadísticamente significativos diferentes entre CU y EC p< 0,05.
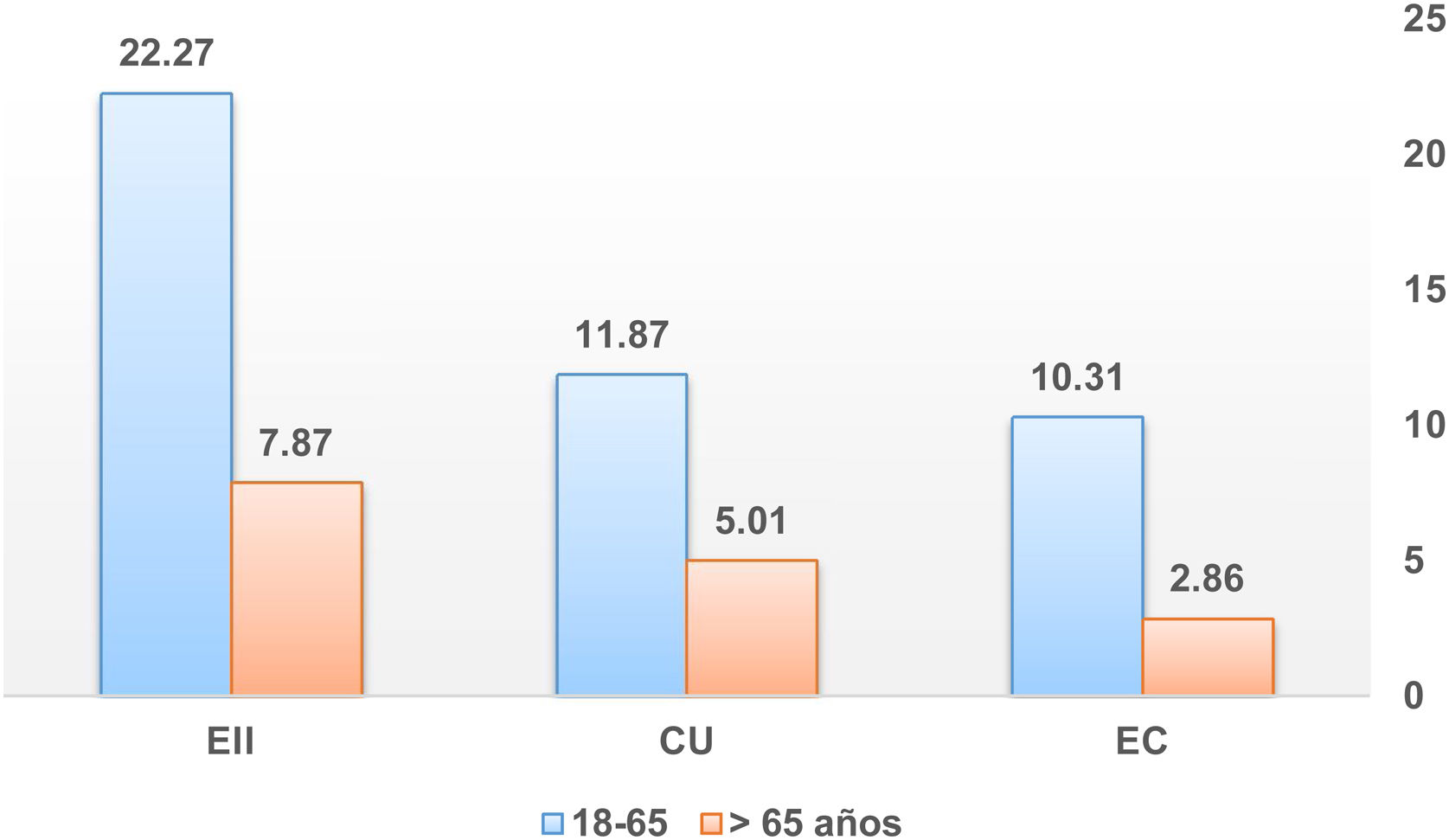
La tasa de incidencia de EII en Castilla y León en el año 2017 fue de 16,6 casos/100.000 habitantes-año (9/105 casos de CU y 7.5/105 casos de EC), con una proporción CU/EC de 1,2:1. La incidencia en pacientes mayores de 65 años fue de 7,9/105 (5/105 casos de CU y 2,9/105 casos de EC). Reflejamos estas tasas de incidencia en las figuras 1-3.
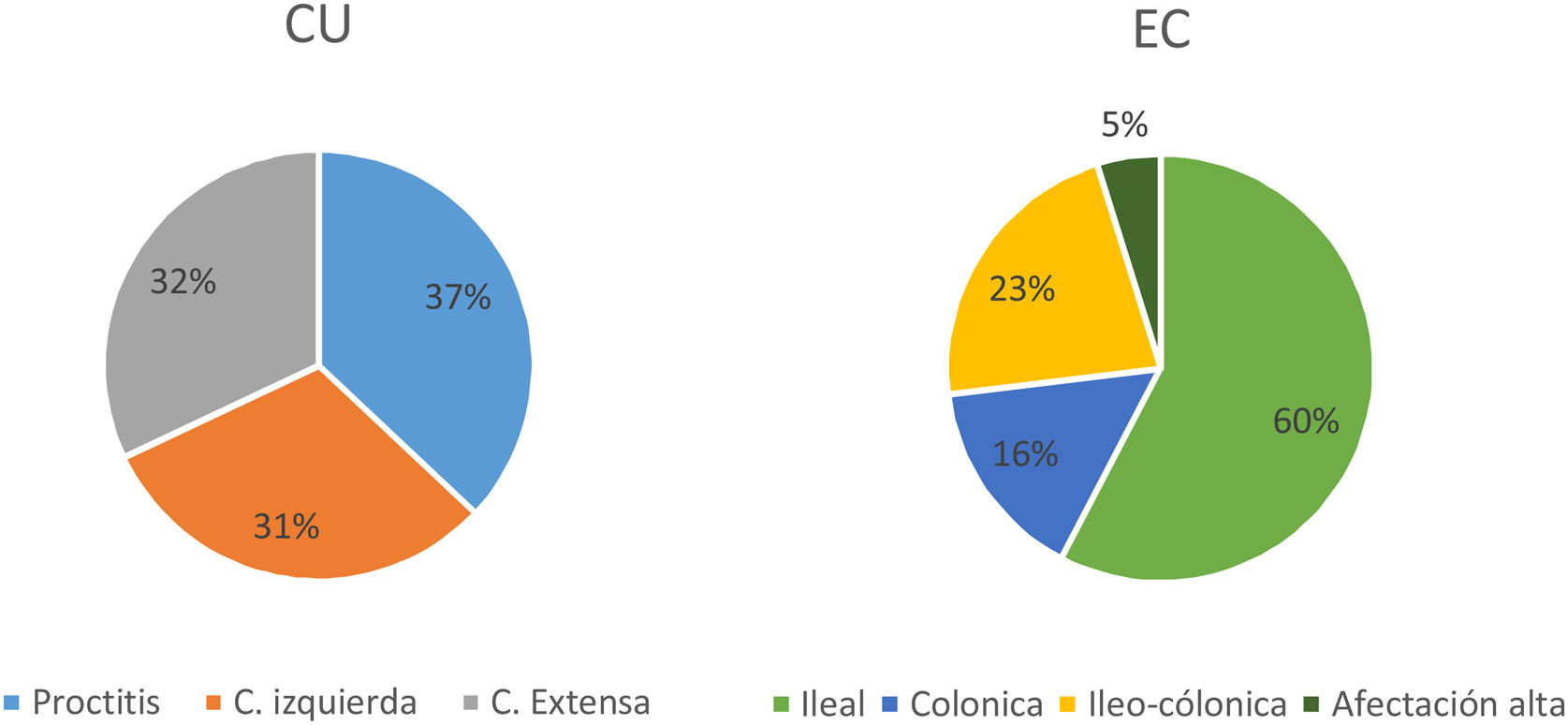
La extensión al diagnóstico (fig. 4) en los pacientes con CU fue de 37% proctitis (E1), 31% colitis izquierda (E2) y 32% colitis extensa (E3). En la EC el 60% presentaba afección en el íleon terminal (L1), el 16% colónica (L2) y el 23% ileocolónica (L3). Siete pacientes (5%) presentaron afectación del tracto digestivo superior (L4) y 12 sujetos (9%) enfermedad perianal concomitante. El fenotipo al diagnóstico de la EC fue mayormente inflamatorio (B1) (84%), en 17 pacientes estenosante (B2) (13%) y en 4 fistulizante (B3) (3%).
La demora media desde la aparición de los síntomas hasta el diagnóstico fue de 2 meses (rango 1-6 meses). La asociación familiar fue del 14%.
Entre los fumadores activos (72 pacientes) más del 69% presentaba EC, mientras que entre los exfumadores (98 pacientes) la mayor parte (77%) estaban diagnosticados de CU, siendo estas diferencias estadísticamente significativas (p=0,000). En el momento del diagnóstico 30 pacientes (10%) tenían manifestaciones extraintestinales, más frecuentes en EC.
Respecto al tratamiento médico instaurado durante el seguimiento desde el momento del diagnóstico (tabla 2):
- -
Ciento setenta y un pacientes (59%) recibieron salicilatos (orales y/o tópicos), casi el total de los pacientes con CU (96%) y el 14% de pacientes con EC.
- -
Un total de 177 pacientes (61%) recibieron corticoterapia en sus distintas formas (sistémica, oral de acción tópica o rectal), 103 pacientes (58%) en el grupo de EC y 74 pacientes (42%) en el grupo de CU. Del total de pacientes tratados con corticoides 109 pacientes (62%) los recibieron de forma sistémica (oral o endovenosa), 55 pacientes (31%) recibieron tratamiento oral con acción tópica y 13 (7%) de acción tópica rectal. Significativamente más pacientes con EC recibieron corticoides sistémicos (47%) comparado con el 30% de los pacientes con CU (p=0,002). Estas diferencias también fueron significativas al comparar el uso de corticoides de acción tópica (30% vs. 10%; p=0,000) entre los pacientes con EC y con CU; sin embargo, la utilización de corticoides rectales fue significativamente más frecuente en los pacientes con CU (7% vs. 2% p=0,0026).
- -
La terapia inmunomoduladora se usó en un total de 86 pacientes (30%), siendo más frecuentemente utilizada en pacientes con EC (81%) que en pacientes con CU (19%); p=0005.
- -
Respecto al tratamiento biológico significativamente más pacientes con EC precisó terapia biológica (29%) frente a los pacientes con CU (8%) (p=0,000), siendo mayoritariamente los fármacos utilizados los anti-TNF (48 pacientes [17%]), 4 pacientes recibieron vedolizumab (1,4%) y un paciente ustekinumab (0,3%).
- -
Diecisiete pacientes (6%) precisaron cirugía al diagnóstico o durante el seguimiento, 9 pacientes (53%) en la región abdominal (resección de intestino delgado y/o colon, protocolectomía total con anastomosis o ileostomía) y 8 pacientes (47%) en la región perianal (drenaje de absceso, setón y tratamiento de fístula). La necesidad de cirugía fue mayor en los pacientes con EC (11%) que en los pacientes con CU (2%); p=0,000.
Tratamiento médico, quirúrgico y hospitalizaciones
| Tratamiento | N (%) |
|---|---|
| Mesalazina | 171 (59) |
| Corticoides | 177 (61) |
| Corticoides sistémicos | 109 (62) |
| Corticoides orales de acción tópica | 55 (31) |
| Corticoides rectales | 13 (7) |
| Inmunomoduladores, n (%) | 86 (30) |
| Biológicos, n (%) | 51 (18) |
| Anti-TNF, n (%) | 48 (94) |
| Vedolizumab, n (%) | 4 (8) |
| Ustekinumab, n (%) | 1 (2) |
| Hospitalización | 76 (26) |
| Al diagnóstico | 49 (64) |
| Brote | 22 (29) |
| Obstrucción intestinal | 4 (5) |
| EPA | 1 (1) |
| Infecciones | 2 (3) |
| Efectos adversos, n (%) | 3 (4) |
| Otros, n (%) | 12 (16) |
| Cirugía, n (%) | 17 (6) |
Los datos se expresan en frecuencia absoluta y relativa.
EPA: enfermedad perianal.
La tasa de hospitalización global fue del 26% (76 pacientes); 44 (58%) de los pacientes con EC y 32 pacientes (20%) con CU. La causa más frecuente fue el ingreso al diagnóstico (64%), seguido del brote (29%), otras causas (16%), obstrucción (5%), efectos adversos farmacológicos (4%), infecciones (3%) y enfermedad perianal (1%). Al analizar la hospitalización por brote clínico de la enfermedad (22 pacientes), los pacientes con CU ingresaron más (72%) que los pacientes con EC (27%); p=0,0001.
Reflejamos en la tabla 1 el estudio comparativo entre las distintas variables de los pacientes con EC y CU.
DiscusiónLas tasas de incidencia de EII están aumentando mundialmente en estas últimas décadas, con un incremento progresivo en paralelo al desarrollo industrial de ciertos países de Asia, África, Sudamérica y este de Europa, aunque los datos prospectivos son escasos y casi en su totalidad provienen de datos retrospectivos6,7. En el registro europeo de Shivananda de incidencia norte-sur de Europa de los años 1990-199316 se reflejaba una diferencia de incidencia a favor de los países del norte de Europa, tanto de CU como de EC, diferencia que actualmente se ha trasladado a la comparación este-oeste, como reflejan los datos de 2010 del registro europeo ECCO-EpiCom5. En comparación con los demás países europeos España se encontraba en tasas similares, con una incidencia de 9,4/105 para la CU y 10,8/105 para la EC)5, si bien hay que precisar que en este estudio europeo tan solo participó un centro español de Galicia. Con el paso del tiempo nuevos estudios publicados en distintos puntos de España (Oviedo, Madrid y Navarra) muestran este incremento de incidencia global de EII en España, acercándose a la incidencia descrita en los países del norte de Europa (5-12/105 casos/CU y 3,5-9,5/105 casos/EC)3,4,7. Este estudio presenta los primeros datos prospectivos de una cohorte incidente de EII en Castilla y León con tasas de incidencia similares a las más altas reportadas de nuestro país para los pacientes con CU (9/105 casos), pero más baja cuando nos referimos a los pacientes con EC (7.5/105 casos). Esta estabilidad en la incidencia de EC coincide con el resto de las regiones españolas que participaron en el EPIDEM-IBD9.
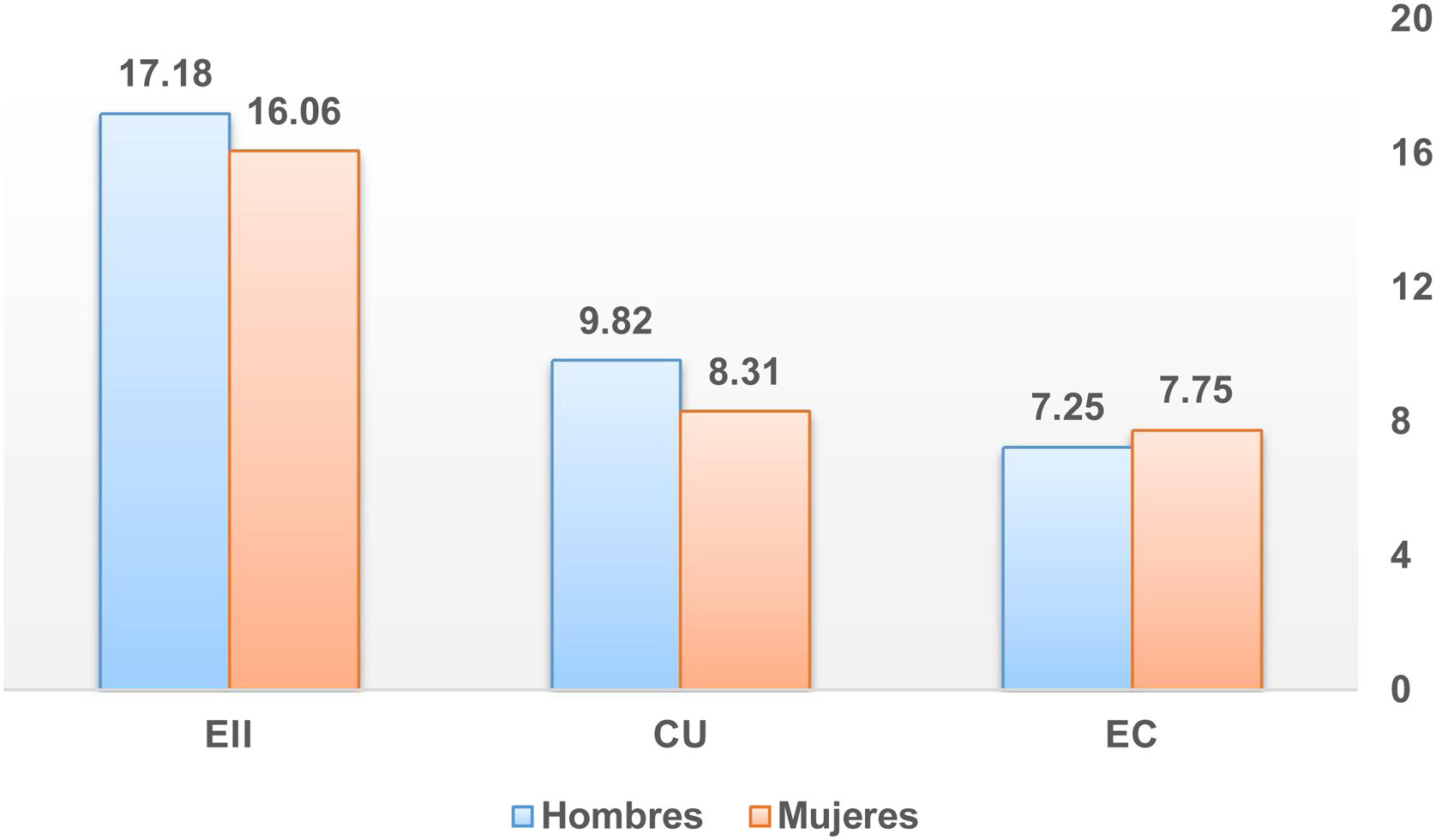
La relación mujer/hombre para nuestros pacientes con EII es de 0,97, con un ligero predominio de varones en la CU, pero sin significación estadística. Los distintos estudios publicados parecen coincidir en que el sexo no influye en la incidencia de EII. Nuestros datos están dentro de lo descrito en la literatura hasta ahora. Sin embargo, un reciente estudio poblacional del área de Asia y el Pacífico expone que existe una predominancia del sexo masculino en ambas EII en todas las edades17.
Los fenotipos clínicos y la evolución de los sujetos en nuestra cohorte son similares a lo descrito en los últimos estudios prospectivos publicados, con un mayor porcentaje de proctitis (37%) comparado con las series europeas (20-21%)18,19, que probablemente refleja una búsqueda exhaustiva de casos por el diseño de nuestro estudio, que muchas veces se pierden en los hospitales terciarios. También observamos un porcentaje menor de afectación alta (L4) en los pacientes con EC (5%) comparado con porcentajes de 10-15%, lo que probablemente se explica por la falta de estudio rutinario precoz del tracto superior en los pacientes recién diagnosticados de EC y el corto intervalo de seguimiento (un año). Aunque en las series clásicas20 el comienzo de los pacientes con EC y patrón inflamatorio es de aproximadamente el 80%, los datos españoles del estudio EpiCom21 presentan un porcentaje menor (66-68%); nuestros datos se acercan más a las series clásicas con un porcentaje al inicio para el patrón inflamatorio del 84%.
En nuestra cohorte incidente el uso de salicilatos es prácticamente la norma en los pacientes con CU, pero debemos señalar que hasta un 15% de pacientes con EC han estado en tratamiento con salicilatos, lo que confirma la resistencia al cambio de una actitud clásica en décadas anteriores, puesto que la evidencia de la eficacia de los salicilatos en los pacientes con EC es muy baja22 y actualmente no se recomienda su utilización en este escenario desde las guías clínicas23.
Respecto a la historia natural, globalmente los pacientes con EC de nuestra cohorte incidente presentan una peor evolución clínica que los pacientes con CU, evaluado por un mayor consumo de corticoides, inmunomoduladores, biológicos y cirugía durante el primer año del diagnóstico, con diferencias estadísticamente significativas, datos que confirman lo publicado en cohortes europeas previas18.
La necesidad de hospitalización en los pacientes con EII es frecuente debido a los brotes de la enfermedad; específicamente en pacientes con CU se ha descrito un porcentaje de hospitalización del 23% en el registro Epi-IBD a 5 años, siendo mayor en los países del oeste que en los del este19. En la revisión sistemática de estudios poblacionales, publicada en 201824, el porcentaje de ingresos en pacientes con CU al año fue del 17-29%. En nuestra cohorte el porcentaje de ingresos para pacientes con CU es del 20%, y aunque el global de ingresos es numéricamente mayor en los pacientes con EC (56%), llama la atención que los ingresos motivados por brote de la enfermedad son estadísticamente más frecuentes en los pacientes con CU (23%) que en los pacientes con EC (8%) (p=0,001).
Se ha descrito que los porcentajes de cirugía en pacientes con CU y EC se han mantenido estables durante las últimas décadas con cifras similares también a las reportadas en nuestra cohorte durante el primer año (2% en CU y 11% en EC).
La mayor fortaleza de nuestro estudio es que se trata de un estudio poblacional y prospectivo, que engloba diferentes hospitales terciarios y comarcales con metodología exhaustiva y que refleja las tasas de incidencia actuales de los pacientes con EII en nuestra comunidad de Castilla y León. Como debilidad, quizá el corto seguimiento (9 meses de media) de los pacientes, aunque los datos del estudio nacional serán publicados con un seguimiento de 5 años, en el que están incluidos los pacientes de nuestra comunidad; no obstante, nuestros resultados son acordes a los publicados en otros países con ese mismo periodo de seguimiento.
ConclusionesLa incidencia de pacientes con CU en nuestro medio se incrementa, mientras que la de EC se mantiene estable, con unos requerimientos mayores en términos de uso de corticoides, inmunosupresores, biológicos y cirugía para los pacientes con EC comparado con los pacientes con CU en el primer año de seguimiento, lo que indirectamente traduce una historia natural peor para estos pacientes.
FinanciaciónApoyo financiero para la logística y coordinación de la investigación del estudio a nivel nacional mediante beca FIS del Instituto Carlos III (PI16/01296 y PFI17/00143), GETECCU y MSD, sin tener ningún papel en el diseño del estudio, análisis e interpretación de los datos, redacción del manuscrito ni en la decisión de su publicación.
Conflicto de interesesDra. R. Sáiz: soporte para actividades formativas de Jannsen, Ferring y Gilead
Dr. J Barrio: ha desempeñado funciones como ponente o consultor y ha recibido financiación para investigación o educación de MSD, Abbvie, Takeda, Janssen y Ferring.
Dr. L. Fernández-Salazar: soporte para investigación y/o actividades formativas de Tillots Pharma, Janssen y Takeda.
Dra. L. Arias: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, FAES Pharma, Kern Pharma, Ferring y MSD.
Dra. M. Sierra Ausín: ha recibido honorarios para actividades formativas, soporte para investigación y advisory para Takeda, Janssen, MSD, Abbvie, Pfizer, Ferring y Falk.
Dra. C. Piñero: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, FAES Pharma, Janssen, Ferring, Pfizer y Takeda
Dra. A. Fuentes Coronel: soporte para investigación y/o actividades formativas de Abbvie, Ferring, MSD, Falk, Tillots Pharma, Janssen, Pfizer y Takeda.
Dra. L. Mata: asesoramiento científico, soporte para investigación y/o actividades formativas de Janssen, Abbvie, Faes y Takeda.
Dra. M. Vásquez: sin conflicto de intereses.
Dra. A. Carbajo: soporte para actividades formativas de Jannsen y Abbvie.
Dra. N. Alcaide: sin conflicto de intereses.
DUE N. Cano: asesoramiento científico, soporte para investigación y/o actividades formativas de Janssen, Sandoz, Takeda, Abbvie y MSD.
Dr. A. Nuñez: soporte para actividades formativas de Jannsen y AbbVie.
Dra. P. Fradejas: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, FAES, Falk, Ferring, Kern Pharma, MSD, Pfizer Pharma y Takeda.
Dr. M. Ibáñez: asesoramiento científico, soporte para investigación y/o actividades formativas de Janssen, Abbvie, Faes y Takeda.
Dr. L. Hernández: sin conflictos de intereses.
Dra. B. Sicilia: asesoramiento científico, soporte para investigación y/o actividades formativas de Tillots Pharma, Kern Pharma, Abbvie, Janssen, Pfizer y Takeda.