Los probióticos pueden actuar como agentes biológicos que modifican la microbiota intestinal y ciertos perfiles de citoquinas, lo que puede conllevar una mejoría en ciertos procesos gastrointestinales.
ObjetivosRealizar una revisión basada en la evidencia del papel de los probióticos en determinadas patologías gastrointestinales del adulto.
Métodos de búsquedaRevisión realizada utilizando los descriptores, filtros y límites adecuados en la base de datos PubMed (MEDLINE).
Criterios de selecciónSe han empleado los términos MeSH Probiotics [en el título] AND Gastrointestinal Diseases, con los siguientes límites o filtros: tipos de estudios: Systematic Reviews, Meta-Analysis, Guideline, Practice Guideline, Consensus Development Conference (y Consensus Development Conference NIH), Randomized Controlled Trial, Controlled Clinical Trial y Clinical Trial; edad: adultos (19 o más años); idioma: en inglés y español; en humanos, y que dispusieran, al menos, de un abstract.
Recogida y análisis de datosSe recuperaron los textos completos de todas las revisiones sistemáticas y metaanálisis directamente relacionados con el objetivo de la revisión, así como los ensayos clínicos aleatorizados de los estudios que se consideraron relevantes y de calidad para realizar esta revisión.
Resultados principalesDeterminados probióticos, diferentes para cada proceso, se han demostrado eficaces y beneficiosos en caso de diarrea aguda infecciosa, diarrea asociada a antibióticos, diarrea asociada a Clostridium difficile, pouchitis y en la erradicación de la infección por Helicobacter pylori.
Conclusiones de los autoresHay ciertas patologías gastrointestinales en las que se puede recomendar el uso de los probióticos, verdaderos agentes biológicos, y otras en las que no se ha demostrado beneficio.
Probiotics may act as biological agents that modify the intestinal microbiota and certain cytokine profiles, which can lead to an improvement in certain gastrointestinal diseases.
ObjectivesTo conduct a review of the evidence of the role of probiotics in certain gastrointestinal diseases in adults.
Search methodsReview conducted using appropriate descriptors, filters and limits in the PubMed database (MEDLINE).
Selection criteriaThe MeSH terms used were Probiotics [in the title] AND Gastrointestinal Diseases, with the following limits or filters: Types of study: Systematic Reviews, Meta-Analysis, Guideline, Practice Guideline, Consensus Development Conference (and Consensus Development Conference NIH), Randomized Controlled Trial, Controlled Clinical Trial and Clinical Trial; age: adults (19 or older); language: English and Spanish; in humans, and with at least one abstract.
Data collection and analysisFull texts of all the Systematic Reviews and meta-analyses directly related to the review's objective were obtained, as well as the Randomised Controlled Trials of the studies that were considered relevant and of sufficient quality for this review.
Main resultsCertain probiotics, different for each process, have proven to be effective and beneficial in cases of acute infectious diarrhoea, antibiotic-associated diarrhoea, Clostridium difficile-associated diarrhoea, pouchitis and Helicobacter pylori infection eradication.
Authors’ conclusionsAlthough some probiotics have not demonstrated any benefit, there are certain gastrointestinal diseases in which the use of probiotics, true biological agents, can be recommended.
El tracto gastrointestinal (TGI) humano alberga un complejo y dinámico ecosistema microbiano, el microbioma gastrointestinal, que se estima en más de 400 especies de bacterias diferentes1, y que es responsable de funciones importantes, entre ellas actividades metabólicas, efectos tróficos sobre el epitelio intestinal e interacciones con el sistema inmune del huésped2.
El término microbioma (anteriormente conocido como «flora intestinal») se refiere a la totalidad de los microbios (bacterias, hongos, virus, etc.), sus elementos genéticos y las interacciones medioambientales en un entorno definido3. El término fue introducido en el MeSH Database en 2014.
La microbiota, la comunidad de microorganismos vivos residentes en un nicho ecológico determinado, como el intestino (colon) humano, actúa como barrera y previene la colonización de microorganismos oportunistas y patógenos2. El microbioma intestinal es indispensable en la interacción entre el epitelio intestinal y el sistema inmune de la mucosa, y afecta al desarrollo y la homeostasis de la inmunidad mucosa normal3.
Los probióticos se definen como «microorganismos vivos (o sus componentes) que, administrados en adecuadas cantidades, confieren un beneficio sobre la salud en el huésped2–10. Esta es la definición propuesta por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la OMS. La Real Academia de la Lengua Española todavía no ha incorporado el vocablo probiótico a su diccionario.
Los probióticos pueden ser ingeridos bajo el estado de cualquier suplemento alimenticio o como fármacos3,5,7. Sin embargo, la mayoría de los productos comerciales derivan de las fuentes de alimentos, especialmente productos lácteos cultivados y fermentados4. Están disponibles en múltiples formulaciones que pueden contener solo uno o una combinación de varios probióticos, y cuya cantidad varía ampliamente entre productos3.
Los microorganismos más usados como probióticos pertenecen al grupo de bacterias de ácido láctico (Lactobacillus) y Bifidobacterium, constituyentes importantes de la microbiota GI humana normal1,7. Otros, menos usados, pero que también están siendo investigados por sus posibles funciones probióticas, son cepas de Streptococcus, Escherichia coli (E.coli) y Bacillus2–4. También se emplean algunas levaduras no patógenas, como Saccharomyces boulardii (S. boulardii) (procedente del Litchi chinensis, una fruta tropical originaria del sur de China) que no se encuentran normalmente en el TGI1,10.
Los probióticos mejoran el equilibrio nutricional y microbiológico del TGI1. Actúan como vectores que entregan sus componentes activos en varios sitios diana del TGI6 y cuyo destino y efectos difieren entre cepas7. La mayoría de los efectos ocurren solo cuando se ingieren microorganismos vivos6, pero, a veces, puede no ser necesario para lograr beneficios4.
Para que un probiótico sea efectivo debe sobrevivir al ambiente ácido del estómago y transitar a través del intestino, lo que, en parte, explica el requerimiento de que deben ser ingeridos en altas concentraciones3. Su supervivencia durante el tránsito GI varía ampliamente3,4,6, ya que depende de los géneros, especies, cepas, dosis ingerida, factores relacionados con el huésped (secreciones ácidas, biliares y pancreáticas) y del vector (alimentos, microencapsulación)6.
Los probióticos difieren en su capacidad de resistir el ácido gástrico y la bilis, de colonizar el TGI y en la influencia que ejercen en las citoquinas secretadas por las células epiteliales intestinales. Como resultado, los beneficios clínicos observados en unos no son necesariamente generalizables a otros4. La capacidad de adhesión a la mucosa intestinal también varía entre las cepas, favoreciendo la exclusión competitiva de patógenos y la inmunomodulación6.
El probiótico apropiado debe ser seleccionado para cada indicación3. Aunque los probióticos son percibidos y provocan respuestas de las células inmunes y/o intestinales, sus mecanismos de acción no están totalmente aclarados4,8.
Los efectos beneficiosos de los probióticos en la función GI se atribuyen a la normalización de la permeabilidad, restauración de la microbiota, mejora de la función inmunológica de la barrera, regulación a la baja de la respuesta inmune proinflamatoria y reequilibrio de citoquinas proinflamatorias y antiinflamatorias3.
El empleo de los probióticos en diferentes patologías se está generalizando cada vez más. Para recoger las principales investigaciones que se están llevando a cabo sobre los mismos, se dispone de una publicación periódica específica llamada Probiotics and Antimicrobial Proteins, que tiene un factor de impacto de 1,283.
Los efectos beneficiosos de los probioticos en las enfermedades gastrointestinales pueden ser considerables (y demostrados), posibles o anecdóticos. Entre los primeros, están la gastroenteritis aguda (viral), la diarrea asociada a antibióticos11, la diarrea del viajero, la reservoritis o pouchitis, y el síndrome del intestino irritable (SII). Entre los segundos, el estreñimiento crónico idiopático (ECI; estreñimiento funcional, en la clasificación Roma IV), la gastritis crónica por Helicobacter pylori (H. pylori) y la colitis ulcerosa (CU). Los beneficios han sido anecdóticos en otros procesos, como en la pancreatitis aguda, la colitis microscópica (colágena), en la enfermedad de Crohn (EC) o en la intolerancia a la lactosa, entre otros3–6.
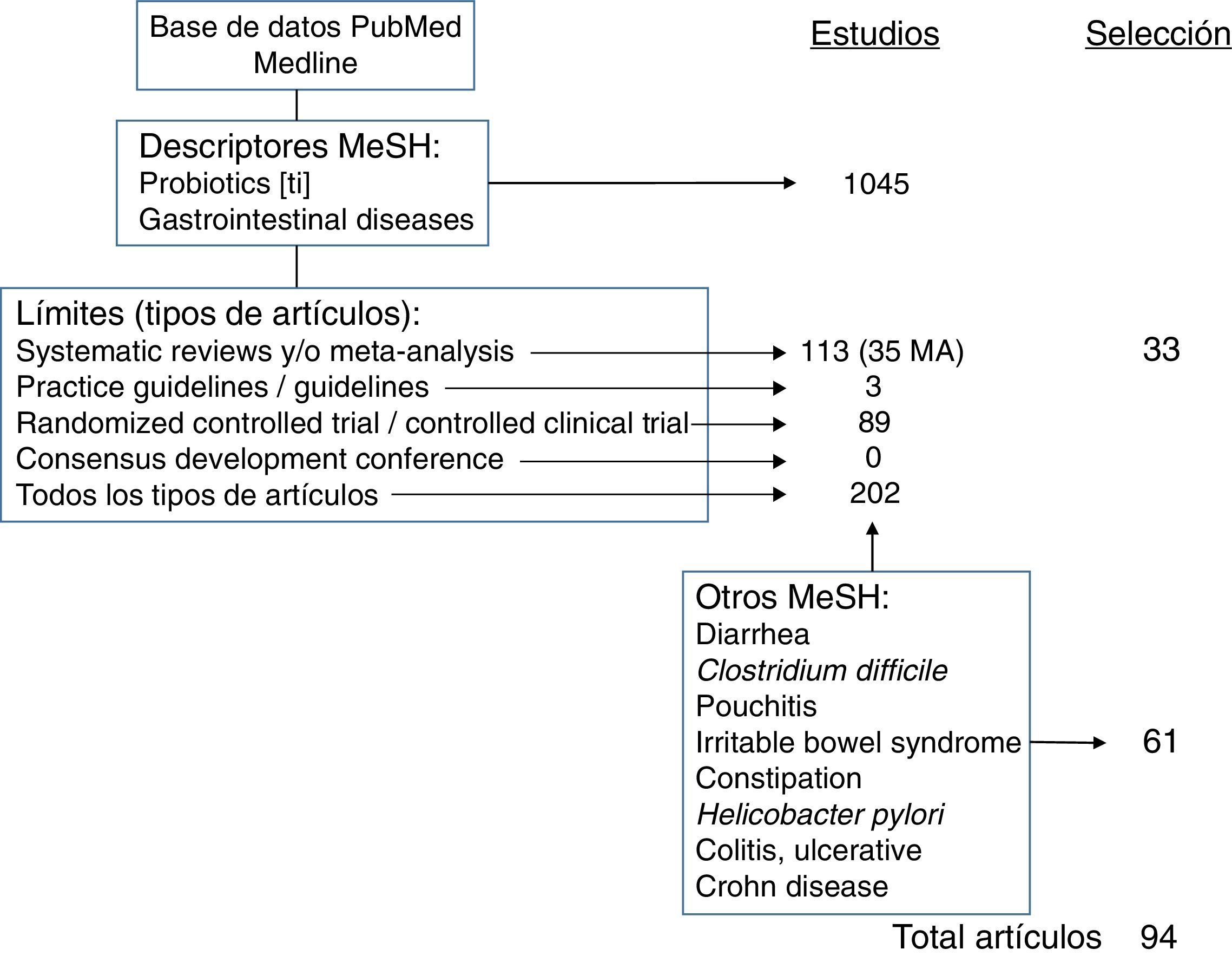
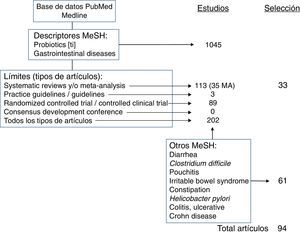
Estrategia de la revisiónLa búsqueda bibliográfica se ha realizado en la base de datos PubMed, de la US National Library of Medicine (pubmed.gov). Para realizar la revisión de las evidencias científicas, se han empleado los términos MeSH (Medical Subjects Headings) Probiotics [en el título] AND Gastrointestinal Diseases, con los siguientes límites o filtros: tipos de estudios: Systematic Reviews, Meta-Analysis, Guideline, Practice Guideline, Consensus Development Conference (y Consensus Development Conference NIH), Randomized Controlled Trial, Controlled Clinical Trial y Clinical Trial; edad: adultos (19 o más años); idioma: en inglés (no hay ningún estudio del papel general de los probióticos en patología GI en español); en humanos, y que dispusieran, al menos, de un abstract.
Todo ello, siguiendo las recomendaciones del trabajo de Shojania12, pero utilizando, además de la herramienta Clinical Queries, la de Systematic Reviews.
Con esta estrategia de búsqueda, se recuperaron 51 estudios, de los que, a su vez, se seleccionaron 28, por su interés y después de descartar procesos infantiles y otros que quedaban fuera de los temas de interés de la revisión (cáncer de colon, VIH, cirugía, uso concomitante con otros fármacos).
El resto de los estudios se seleccionaron tras buscar evidencias con la estrategia Probiotics[ti] AND cada uno de los descriptores MeSH de las entidades concretas revisadas (Diarrhea, Clostridium difficile (C. difficile), Pouchitis, Irritable Bowel Syndrome, Constipation, Helicobacter pylori, Colitis, Ulcerative, Crohn Disease).
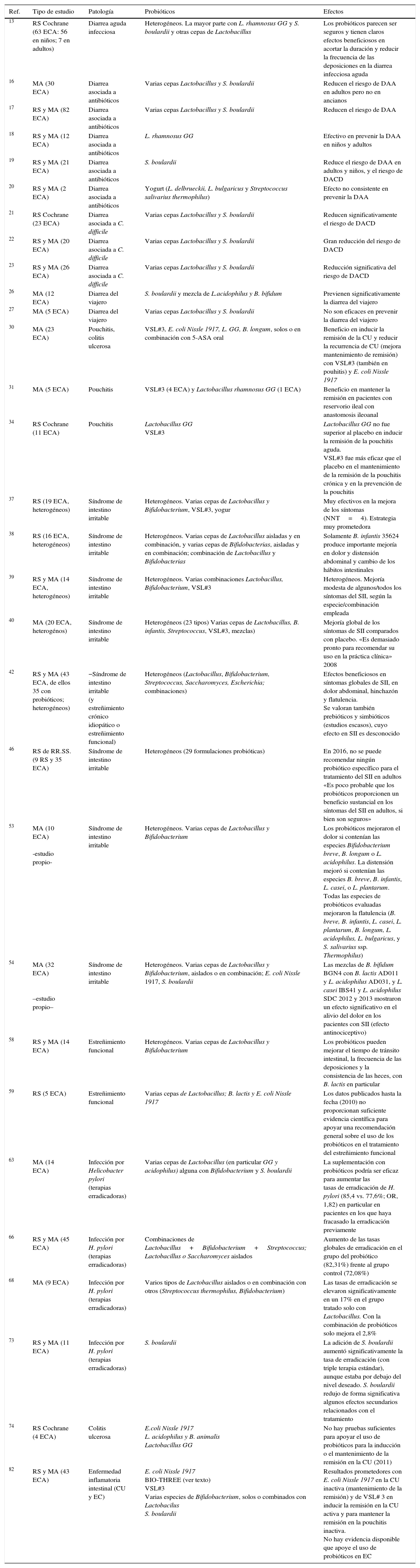
Dado que el mayor nivel de evidencia y grado de recomendación corresponde a las revisiones sistemáticas (RS) y metaanálisis (MA), los datos más destacados y de aplicación en la práctica clínica extraídos de aquellos que han sido utilizados en la elaboración de este manuscrito, un total de 33 estudios, se han recogido en la tabla 1.
RS y MA del uso de los probióticos en diferentes procesos gastrointestinales
| Ref. | Tipo de estudio | Patología | Probióticos | Efectos |
|---|---|---|---|---|
| 13 | RS Cochrane (63 ECA: 56 en niños; 7 en adultos) | Diarrea aguda infecciosa | Heterogéneos. La mayor parte con L. rhamnosus GG y S. boulardii y otras cepas de Lactobacillus | Los probióticos parecen ser seguros y tienen claros efectos beneficiosos en acortar la duración y reducir la frecuencia de las deposiciones en la diarrea infecciosa aguda |
| 16 | MA (30 ECA) | Diarrea asociada a antibióticos | Varias cepas Lactobacillus y S. boulardii | Reducen el riesgo de DAA en adultos pero no en ancianos |
| 17 | RS y MA (82 ECA) | Diarrea asociada a antibióticos | Varias cepas Lactobacillus y S. boulardii | Reducen el riesgo de DAA |
| 18 | RS y MA (12 ECA) | Diarrea asociada a antibióticos | L. rhamnosus GG | Efectivo en prevenir la DAA en niños y adultos |
| 19 | RS y MA (21 ECA) | Diarrea asociada a antibióticos | S. boulardii | Reduce el riesgo de DAA en adultos y niños, y el riesgo de DACD |
| 20 | RS y MA (2 ECA) | Diarrea asociada a antibióticos | Yogurt (L. delbrueckii, L. bulgaricus y Streptococcus salivarius thermophilus) | Efecto no consistente en prevenir la DAA |
| 21 | RS Cochrane (23 ECA) | Diarrea asociada a C. difficile | Varias cepas Lactobacillus y S. boulardii | Reducen significativamente el riesgo de DACD |
| 22 | RS y MA (20 ECA) | Diarrea asociada a C. difficile | Varias cepas Lactobacillus y S. boulardii | Gran reducción del riesgo de DACD |
| 23 | RS y MA (26 ECA) | Diarrea asociada a C. difficile | Varias cepas Lactobacillus y S. boulardii | Reducción significativa del riesgo de DACD |
| 26 | MA (12 ECA) | Diarrea del viajero | S. boulardii y mezcla de L.acidophilus y B. bifidum | Previenen significativamente la diarrea del viajero |
| 27 | MA (5 ECA) | Diarrea del viajero | Varias cepas Lactobacillus y S. boulardii | No son eficaces en prevenir la diarrea del viajero |
| 30 | MA (23 ECA) | Pouchitis, colitis ulcerosa | VSL#3, E. coli Nissle 1917, L. GG, B. longum, solos o en combinación con 5-ASA oral | Beneficio en inducir la remisión de la CU y reducir la recurrencia de CU (mejora mantenimiento de remisión) con VSL#3 (también en pouhitis) y E. coli Nissle 1917 |
| 31 | MA (5 ECA) | Pouchitis | VSL#3 (4 ECA) y Lactobacillus rhamnosus GG (1 ECA) | Beneficio en mantener la remisión en pacientes con reservorio ileal con anastomosis ileoanal |
| 34 | RS Cochrane (11 ECA) | Pouchitis | Lactobacillus GG VSL#3 | Lactobacillus GG no fue superior al placebo en inducir la remisión de la pouchitis aguda. VSL#3 fue más eficaz que el placebo en el mantenimiento de la remisión de la pouchitis crónica y en la prevención de la pouchitis |
| 37 | RS (19 ECA, heterogéneos) | Síndrome de intestino irritable | Heterogéneos. Varias cepas de Lactobacillus y Bifidobacterium, VSL#3, yogur | Muy efectivos en la mejora de los síntomas (NNT=4). Estrategia muy prometedora |
| 38 | RS (16 ECA, heterogéneos) | Síndrome de intestino irritable | Heterogéneos. Varias cepas de Lactobacillus aisladas y en combinación, y varias cepas de Bifidobacterias, aisladas y en combinación; combinación de Lactobacillus y Bifidobacterias | Solamente B. infantis 35624 produce importante mejoría en dolor y distensión abdominal y cambio de los hábitos intestinales |
| 39 | RS y MA (14 ECA, heterogéneos) | Síndrome de intestino irritable | Heterogéneos. Varias combinaciones Lactobacillus, Bifidobacterium, VSL#3 | Heterogéneos. Mejoría modesta de algunos/todos los síntomas del SII, según la especie/combinación empleada |
| 40 | MA (20 ECA, heterogénos) | Síndrome de intestino irritable | Heterogéneos (23 tipos) Varias cepas de Lactobacillus, B. infantis, Streptococcus, VSL#3, mezclas) | Mejoría global de los síntomas de SII comparados con placebo. «Es demasiado pronto para recomendar su uso en la práctica clínica» 2008 |
| 42 | RS y MA (43 ECA, de ellos 35 con probióticos; heterogéneos) | −Síndrome de intestino irritable (y estreñimiento crónico idiopático o estreñimiento funcional) | Heterogéneos (Lactobacillus, Bifidobacterium, Streptococcus, Saccharomyces, Escherichia; combinaciones) | Efectos beneficiosos en síntomas globales de SII, en dolor abdominal, hinchazón y flatulencia. Se valoran también prebióticos y simbióticos (estudios escasos), cuyo efecto en SII es desconocido |
| 46 | RS de RR.SS. (9 RS y 35 ECA) | Síndrome de intestino irritable | Heterogéneos (29 formulaciones probióticas) | En 2016, no se puede recomendar ningún probiótico específico para el tratamiento del SII en adultos «Es poco probable que los probióticos proporcionen un beneficio sustancial en los síntomas del SII en adultos, si bien son seguros» |
| 53 | MA (10 ECA) -estudio propio- | Síndrome de intestino irritable | Heterogéneos. Varias cepas de Lactobacillus y Bifidobacterium | Los probióticos mejoraron el dolor si contenían las especies Bifidobacterium breve, B. longum o L. acidophilus. La distensión mejoró si contenían las especies B. breve, B. infantis, L. casei, o L. plantarum. Todas las especies de probióticos evaluadas mejoraron la flatulencia (B. breve, B. infantis, L. casei, L. plantarum, B. longum, L. acidophilus, L. bulgaricus, y S. salivarius ssp. Thermophilus) |
| 54 | MA (32 ECA) –estudio propio– | Síndrome de intestino irritable | Heterogéneos. Varias cepas de Lactobacillus y Bifidobacterium, aislados o en combinación; E. coli Nissle 1917, S. boulardii | Las mezclas de B. bifidum BGN4 con B. lactis AD011 y L. acidophilus AD031, y L. casei IBS41 y L. acidophilus SDC 2012 y 2013 mostraron un efecto significativo en el alivio del dolor en los pacientes con SII (efecto antinociceptivo) |
| 58 | RS y MA (14 ECA) | Estreñimiento funcional | Heterogéneos. Varias cepas de Lactobacillus y Bifidobacterium | Los probióticos pueden mejorar el tiempo de tránsito intestinal, la frecuencia de las deposiciones y la consistencia de las heces, con B. lactis en particular |
| 59 | RS (5 ECA) | Estreñimiento funcional | Varias cepas de Lactobacillus; B. lactis y E. coli Nissle 1917 | Los datos publicados hasta la fecha (2010) no proporcionan suficiente evidencia científica para apoyar una recomendación general sobre el uso de los probióticos en el tratamiento del estreñimiento funcional |
| 63 | MA (14 ECA) | Infección por Helicobacter pylori (terapias erradicadoras) | Varias cepas de Lactobacillus (en particular GG y acidophilus) alguna con Bifidobacterium y S. boulardii | La suplementación con probióticos podría ser eficaz para aumentar las tasas de erradicación de H. pylori (85,4 vs. 77,6%; OR, 1,82) en particular en pacientes en los que haya fracasado la erradicación previamente |
| 66 | RS y MA (45 ECA) | Infección por H. pylori (terapias erradicadoras) | Combinaciones de Lactobacillus+Bifidobacterium+Streptococcus; Lactobacillus o Saccharomyces aislados | Aumento de las tasas globales de erradicación en el grupo del probiótico (82,31%) frente al grupo control (72,08%) |
| 68 | MA (9 ECA) | Infección por H. pylori (terapias erradicadoras) | Varios tipos de Lactobacillus aislados o en combinación con otros (Streptococcus thermophilus, Bifidobacterium) | Las tasas de erradicación se elevaron significativamente en un 17% en el grupo tratado solo con Lactobacillus. Con la combinación de probióticos solo mejora el 2,8% |
| 73 | RS y MA (11 ECA) | Infección por H. pylori (terapias erradicadoras) | S. boulardii | La adición de S. boulardii aumentó significativamente la tasa de erradicación (con triple terapia estándar), aunque estaba por debajo del nivel deseado. S. boulardii redujo de forma significativa algunos efectos secundarios relacionados con el tratamiento |
| 74 | RS Cochrane (4 ECA) | Colitis ulcerosa | E.coli Nissle 1917 L. acidophilus y B. animalis Lactobacillus GG | No hay pruebas suficientes para apoyar el uso de probióticos para la inducción o el mantenimiento de la remisión en la CU (2011) |
| 82 | RS y MA (43 ECA) | Enfermedad inflamatoria intestinal (CU y EC) | E. coli Nissle 1917 BIO-THREE (ver texto) VSL#3 Varias especies de Bifidobacterium, solos o combinados con Lactobacilus S. boulardii | Resultados prometedores con E. coli Nissle 1917 en la CU inactiva (mantenimiento de la remisión) y de VSL# 3 en inducir la remisión en la CU activa y para mantener la remisión en la pouchitis inactiva. No hay evidencia disponible que apoye el uso de probióticos en EC |
| Ref. | Tipo de estudio | Patología | Probióticos | Efectos |
|---|---|---|---|---|
| 83 | MA (5 ECA) | Colitis ulcerosa (moderadamente activa) | VSL#3 | VSL # asociado al tratamiento convencional (5-ASA y/o inmuno moduladores) es seguro y más efectivo que la terapia convencional sola en obtener respuesta y remisión en la CU activa de intensidad leve a moderada |
| 90 | RS Cochrane (1 ECA) | Enfermedad de Crohn | Lactobacillus GG | No hay pruebas suficientes para establecer conclusiones acerca de la eficacia de los probióticos para inducir la remisión en EC (2008) |
| 91 | RS Cochrane (7 ECA) | Enfermedad de Crohn | Lactobacillus GG VSL#3 S. boulardii E. coli Nissle | No hay evidencia suficiente para sugerir que los probióticos son beneficiosos para mantener la remisión en la EC (2006) |
En la figura 1 se resume la estrategia de búsqueda de aquellas evidencias y cómo se ha llevado a cabo la selección de las utilizadas en la redacción del manuscrito.
A continuación, se revisa el empleo de diferentes probióticos en las enfermedades gastrointestinales de los dos primeros grupos, en los que se recomiendan y se están utilizando actualmente, como se verá, con resultados variables.
Entidades nosológicas en las que los probióticos se están utilizando con considerables efectos beneficiososDiarrea aguda infecciosaLa mayor parte de los estudios son en lactantes y niños. En una RS de la base de datos Cochrane13 en la que se analizaron 63 estudios que incluían un total de 8.014 participantes, solamente 352 (4,4%) eran adultos de 19 o más años. En este MA se encontró que los probióticos reducen el riesgo global de la diarrea que dura cuatro o más días en un 59% y la duración media de la misma en 25 h. Los dos probióticos más comúnmente estudiados fueron Lactobacillus GG y S. boulardii.
Pese a la gran variabilidad en la calidad metodológica de los ensayos, en general, los probióticos, con independencia de la cepa o cepas utilizadas, de las dosis, de las causas (bacteriana o vírica), de la gravedad o del país de estudio, demostraron ser seguros y eficaces en reducir la duración y gravedad de la diarrea, además de prevenir la progresión de la forma aguda (< 14 días) a la forma persistente, en contra del consenso general de que los efectos de los probióticos son específicos de la cepa y que los resultados obtenidos con un probiótico no pueden extrapolarse a otros organismos, incluyendo cepas relacionadas14. Se necesitan estudios bien diseñados de regímenes de probióticos específicos en contextos también específicos, y con la mayor homogeneidad posible, para extraer conclusiones definitivas, si bien los resultados son esperanzadores15.
Diarrea asociada a antibióticosEn una RS de la literatura sobre el uso de los probióticos en el tratamiento de la diarrea asociada a antibióticos (DAA) en adultos (18-64 años) y sujetos de edad avanzada (≥ 65 años de edad), se analizaron 30 ensayos controlados aleatorizados que cumplían con los criterios de inclusión predefinidos. El MA de los mismos sugiere que la administración de probióticos como terapia adyuvante a los antibióticos se asocia con un menor riesgo de DAA en los adultos, pero no en las personas de edad avanzada16. Estos resultados confirman los resultados de MA previos17.
Dentro de los probióticos, han demostrado su eficacia en la prevención de la DAA Lactobacillus rhamnosus (L. rhamnosus) GG18 y S. boulardii19, no así el yogur (Lactobacillus delbrueckii [L. delbrueckii] bulgaricus y Streptococcus salivarius [S. salivarius] ssp. thermophilus), como se comprobó en el estudio PROSPERO20. Sin embargo, se precisan más estudios para conocer con precisión la dosis óptima de la preparación probiótica, el momento de la administración de estos y la duración del tratamiento.
Diarrea asociada a C. difficile (DACD)Los antibióticos son fármacos ampliamente prescritos que pueden causar perturbaciones en la microbiota gastrointestinal, lo que, a su vez, puede reducir la resistencia a algunos agentes patógenos tales como C. difficile. Esto puede dar lugar a una complicación grave, la diarrea asociada a dicho patógeno (DACD). Dado que los probióticos son microorganismos vivos, se cree que pueden equilibrar la microbiota gastrointestinal, evitando este trastorno.
En este sentido, varios estudios han demostrado que algunos probióticos son seguros y efectivos en la prevención de la DACD. Una RS de la Colaboración Cochrane (incluyendo 23 ensayos clínicos, con un total de 4.213 participantes) sugiere que los probióticos reducen significativamente el riesgo de DACD en un 64%. La incidencia de la misma fue de 2,0% en el grupo probiótico, comparado con 5,5% en el grupo control sin tratamiento o con placebo21.
Otra RS y MA, incluyendo 20 ECA y 3.818 pacientes, demostró que los probióticos reducen la incidencia de DACD en un 66%. En una población con una incidencia de DACD asociada a antibióticos del 5%, la profilaxis probiótica impediría 33 episodios por cada 1.000 personas22.
Otro MA, que incluía 26 ECA con 7.957 pacientes, confirmó que el uso de probióticos reduce significativamente el riesgo de desarrollar DACD en un 60,5%. Los probióticos resultaron beneficiosos tanto en adultos como en niños (59,5 y 65,9% de reducción, respectivamente), especialmente entre los pacientes hospitalizados. Lactobacillus, Saccharomyces, y una mezcla de probióticos eran todos beneficiosos en la reducción del riesgo de desarrollar DACD23. También se han mostrado eficaces Lactobacillus acidophilus (L. acidophilus) CL1285 y Lactobacillus casei (L. casei) LBC80R24.
Sin embargo, no todos los estudios han demostrado estos resultados: en un amplio ECA, que incluyó 2.941 adultos con exposición a antibióticos, se comprobó que en los pacientes que recibieron probióticos (una preparación multicepa de L. acidophilus y Bifidobacterium bifidum [B. bifidum]) no se redujo el riesgo de DACD25.
En cuanto al tratamiento, un MA publicado en 2012 evaluó la eficacia de los probióticos en el tratamiento de la DACD, sugiriendo un beneficio de los mismos en el tratamiento de aquella17, aunque muy pocos de los ensayos incluidos habían sido diseñados específicamente para evaluar dicho proceso.
Diarrea del viajeroEn los viajeros es frecuente la diarrea aguda, variando entre el 5 y el 50% dependiendo del destino3,6. La mayor parte de los casos (80%) son debidos a infecciones bacterianas, siendo la más común uno de los siete tipos de E. coli diarreogénica2,3.
Un MA26 mostró que algunos probióticos son seguros y eficaces en la prevención de la diarrea del viajero, estimando que hasta el 85% de estos casos se pueden prevenir con probióticos. Sin embargo, otro metaanálisis posterior27 no confirmó estos resultados.
S. boulardii parece proteger significativamente en estos casos. L. rhamnosus GG y una mezcla de probióticos compuesta por L. acidophilus, Lactobacillus bulgaricus (L. bulgaricus), B. bifidum y Streptococcus thermophilus (S. thermophilus) también produjeron un importante efecto protector frente al placebo2,3,26.
Reservoritis (pouchitis)La proctocolectomía con anastomosis íleo-anal y reservorio ileal es el tratamiento de elección para la reconstrucción de la continuidad intestinal en la colitis ulcerosa (CU) grave refractaria (y poliposis adenomatosa familiar) que requiere cirugía. A su vez, la complicación a largo plazo observada tras dicha intervención con más frecuencia es la inflamación aguda y/o crónica del reservorio ileal, es decir, la pouchitis o reservoritis: hasta el 46% de los pacientes con CU tienen al menos un episodio de pouchitis en los 5 primeros años tras la cirugía28 y entre 10-15% de los pacientes con un reservorio ileoanal desarrollan una reservoritis grave que requiere el uso a largo plazo de antibióticos o la extirpación del mismo29.
Algunas observaciones y el alto índice de respuesta a varios antibióticos hacen pensar en un importante papel de ciertas bacterias intestinales (aumento de las concentraciones de Clostridium perfringens y ausencia de Streptococcus) en la patogenia de la pouchitis y permiten hipotetizar que la administración de algunos probióticos pueden modificar la microbiota y restaurar la barrera mucosa intestinal y, por tanto, reducir el riesgo de inflamación de la mucosa del reservorio4.
En este sentido, se han llevado a cabo diferentes estudios con determinados probióticos que confirman su eficacia y seguridad para mantener en remisión la inflamación del reservorio conseguida tras el tratamiento antibiótico, de forma similar al ácido 5-aminosalicílico30,31, así como en la prevención de la pouchitis aguda32 y de la recurrencia de la pouchitis crónica tras el tratamiento de inducción con antibióticos33.
Las mezclas probióticas utilizadas en los diferentes estudios fueron VSL#3 (L. acidophilus, L. casei, Lactobacillus plantarum [L. plantarum], L. bulgaricus; Bifidobacterium longum [B. longum], Bifidobacterium breve [B. breve], Bifidobacterium infantis [B. infantis]; y S. thermophilus)29,30; Trilac, que contiene L. acidophilus, L. delbrueckii subsp. bulgaricus, y Bifidobacteriumbifidus, durante 9 meses; y Ecologic 825, una mezcla de cepas de B. bifidum, Bifidobacterium lactis (B. lactis), L. acidophilus, L. casei, Lactobacillus paracasei, Lactobacillus plantarum (L. plantarum), Lactobacillus salivarius y Lactococcus lactis32, durante 8 semanas.
En todos los casos, el Pouchitis Disease Activity Index mejoró significativamente y los resultados fueron superiores al placebo.
Finalmente, una RS de la Colaboración Cochrane34 concluyó que VSL#3 era más eficaz que el placebo en el mantenimiento de la remisión de la pouchitis crónica y en la prevención de la aparición de pouchitis.
Síndrome de intestino irritableLa fisiopatología del SII es todavía desconocida. Sin embargo, varias líneas de datos epidemiológicos, fisiológicos y clínicos sugieren un papel de las bacterias intestinales en la patogenia de la enfermedad35,36.
Además, hay estudios fisiológicos que han demostrado que la manipulación de la microbiota intestinal con probióticos puede afectar ciertas funciones intestinales, como la motilidad y la sensibilidad, que parecen relevantes en la patogenia del SII37.
Varias revisiones sistemáticas y metaanálisis37–43, así como algunos ensayos clínicos44,45, aunque otros no46,47, parecen confirmar que determinados probióticos tienen efectos beneficiosos en el SII, de forma global, sobre el dolor y distensión abdominales y la flatulencia, en comparación con el placebo, y pueden mejorar la calidad de vida de estos pacientes.
No obstante, en general, se trata de estudios muy heterogéneos, que analizan y comparan combinaciones y dosis de probióticos muy dispares, y algunos con deficiencias metodológicas importantes, por lo que no pueden establecerse recomendaciones generales.
Ninguna cepa o dosis específica de ningún probiótico analizado parece ser consistentemente eficaz para mejorar los síntomas del SII o la calidad de vida46. Sin embargo, en algún estudio48,49 se comprobó que los síntomas mejoraron de forma significativa en el grupo de pacientes que recibió B. infantis (35.624) con respecto al placebo. Además, se produjo una normalización en la relación IL-10/IL-12 en el suero, lo que sugiere que el probiótico puede ayudar a reducir un estado proinflamatorio asociado con el SII.
L. plantarum es otro probiótico que se ha utilizado con buenos resultados, superiores al placebo, en el control de algunos síntomas en pacientes con SII. En concreto, la cepa DSM 9843 redujo significativamente la flatulencia50 y las cepas LPO 151 y 299V52 redujeron de forma significativa el dolor abdominal.
Nuestro grupo de trabajo realizó dos metaanálisis para valorar el efecto de los probióticos en los síntomas generales del SII53 y, en particular, en el dolor abdominal54 concluyendo que los efectos beneficiosos que tienen los probióticos en cada síntoma del SII son probablemente específicos de la cepa.
Se precisan más datos, procedentes de ECA de alta calidad, en los que se traten perfiles y síntomas específicos para recomendar los probióticos en el manejo del SII.
Entidades nosológicas en las que los probióticos tienen posibles efectos beneficiososEstreñimiento crónico idiopático (estreñimiento funcional)Hay varios mecanismos de acción potenciales por los que los probióticos pueden ser beneficiosos en el estreñimiento funcional. En primer lugar, porque modifican la microbiota gastrointestinal, que está alterada en el estreñimiento55. En segundo lugar, los metabolitos de los probióticos pueden alterar la motilidad intestinal56, y, en tercer lugar, algunos probióticos aumentan la producción de ácido láctico y ácidos grasos de cadena corta, reduciendo el pH luminal, lo que puede mejorar el peristaltismo del colon y acortar el tiempo de tránsito intestinal57.
En base a estas evidencias, se ha hipotetizado sobre el posible efecto beneficioso de ciertos probióticos en el manejo del ECI. Para valorar el mismo, se han llevado a cabo varias revisiones sistemáticas y metaanálisis42,58,59, que concluyen que, aunque los probióticos han demostrado algunos resultados prometedores en este sentido, en concreto un aumento de la media del número de deposiciones por semana, se precisan más ECA de calidad antes de recomendarlos de forma normalizada en el manejo del ECI.
Infección por H. pyloriCuando está recomendada la erradicación de H. pylori60, la tasa de éxito se aproxima al 90% usando un tratamiento de primera línea (en particular con la terapia cuádruple concomitante sin bismuto, que tiene mejores resultados que la terapia triple clásica)61, y de alrededor del 70% con el tratamiento de segunda línea62.
En 2007, Tong et al.63, en un MA, demostraron que la administración de probióticos puede tanto mejorar la tasa de erradicación como reducir la incidencia de eventos adversos.
Posteriormente, diferentes estudios y metaanálisis lo han confirmado64–68, de modo que el uso de probióticos para complementar la terapia erradicadora estándar en pacientes infectados con H. pylori puede llegar a aumentar la tasa de erradicación del microorganismo en alrededor del 13% y disminuir la tasa global de efectos adversos en aproximadamente un 41%, independientemente de la edad del paciente, género o la dosis de probióticos66.
Entre los diferentes tipos de probióticos utilizados para mejorar los resultados de las terapias erradicadoras parece destacar Lactobacillus reuteri (L. reuteri)69, que ha demostrado que puede inhibir la colonización de la mucosa gástrica humana por H. pylori70, además de ser capaz de producir reuterina, un antibiótico de amplio espectro activo frente a H. pylori71. La cepa DSM17648 de L. reuteri parece ser especialmente eficaz para ello72.
La adición de S. boulardii también parece aumentar significativamente la tasa de erradicación, aunque estaba por debajo del nivel deseado de éxito (80%, frente al 71% en el grupo control). Con esta levadura también se redujeron significativamente algunos efectos secundarios relacionados con el tratamiento73.
Se requiere una evaluación económica para establecer el índice coste-eficacia de la adición de probióticos al tratamiento de erradicación de H. pylori, puesto que ello, indudablemente, aumenta los costes del tratamiento.
Colitis ulcerosaPese a que, inicialmente, una RS de la Colaboración Cochrane74, en 2011, había llegado a la conclusión de que no había pruebas suficientes para apoyar el uso de probióticos para la inducción o el mantenimiento de la remisión en la CU, la mayoría de los estudios, aunque pequeños, concluyen que los probióticos eran equivalentes o, cuando menos, no inferiores a la terapia estándar para mantener la remisión de CU75.
En un ensayo76, se informó que la terapia con Lactobacillus GG puede ser más efectiva que la estándar, con mesalazina, para prolongar el tiempo libre de recaída.
La mayoría de los estudios con probióticos en la CU se han realizado con VSL#3 o con E. coli Nissle 191777–79. Los resultados con dichos probióticos tienen una recomendación grado A para el mantenimiento de la remisión de la CU y grado B para la inducción de la remisión de la CU, de acuerdo con el 4.° Taller Trienal de Yale/Harvard sobre las recomendaciones sobre probióticos80.
Así, E. coli Nissle 1917 fue tan eficaz como una dosis baja de 5-ASA en la prevención de la recaída de la CU en adultos81.
Un MA que incluía los ECA en los que se comparaba VSL#3 frente a los controles (placebo o 5-ASA) demostró un beneficio significativo de dicho probiótico frente a los controles para inducir la remisión de la CU82. Otro MA posterior, en el que se comparaba VSL#3 con placebo, demostró unas tasas de remisión del 43,8% en los pacientes tratados con aquel versus del 24,8% en pacientes con placebo83. Previamente, otro ECA84 encontró que los pacientes que recibieron VSL#3 tendían a experimentar una disminución de al menos el 50% en el índice UCDAI después de ocho semanas de tratamiento, en comparación con los pacientes que recibieron placebo (63 frente al 41 por ciento). Las tasas de remisión también fueron superiores en el grupo VSL# 3 (48 frente a 32 por ciento). Sin embargo, los resultados histológicos no mejoraron significativamente con el tratamiento con VS #3.
Para terminar, aunque los beneficios con probióticos han sido, por lo general, anecdóticos, también se han hecho estudios con probióticos en la enfermedad de Crohn.
Enfermedad de CrohnLa gran mayoría de los ECA que han empleado probióticos en EC se han llevado a cabo en sujetos con enfermedad inactiva (en remisión), para evitar la reactivación clínica y/o la recurrencia endoscópica.
Los estudios llevados a cabo con diferentes tipos de Lactobacillus85–87 y con E. coli Nissle 191788,89 no han demostrado que ninguno de ellos sea superior al placebo en términos de evitar la recurrencia de la enfermedad.
Dos RS de la Colaboración Cochrane concluyeron que los datos disponibles no apoyaban la eficacia clínica del tratamiento probiótico en pacientes con EC, ni para la inducción90 ni para el mantenimiento de la remisión91.
Por otro lado, S. boulardii, en un estudio92, demostró que, junto con 2g. diarios de mesalamina, era superior a 3g. diarios de mesalamina solos en reducir las recidivas clínicas en pacientes con EC en remisión. Otro estudio posterior93 no confirmó estos resultados.
En general, con la posible excepción de S. boulardii en ciertas poblaciones (por ejemplo, los no fumadores), el tratamiento a largo plazo con microorganismos probióticos no parece que genere beneficios en el mantenimiento de la remisión en pacientes con EC94.
En cuanto a inducir la remisión clínica, en general, no hay pruebas convincentes de que los probióticos muestren una capacidad significativa para aumentar la eficacia de los tratamientos convencionales en los pacientes con EC94.
En la tabla 1 se presentan los datos más destacados de todas las RS y MA utilizados para la preparación del artículo. De los mismos, pueden extraerse las siguientes conclusiones y recomendaciones:
- 1.
La mayoría de los estudios revisados eran pequeños, y muchos tenían importantes limitaciones metodológicas, por lo que es difícil extraer conclusiones inequívocas respecto a la eficacia de los probióticos empleados. Se necesitan grandes ensayos clínicos controlados multicéntricos bien diseñados para aclarar el papel de probióticos específicos en diferentes poblaciones de pacientes bien definidos.
- 2.
Existen considerables diferencias en la composición, las dosis, y la actividad biológica entre diversas preparaciones comerciales de probióticos, por lo que los resultados con una preparación no se pueden extrapolar a otros o todas las preparaciones probióticas.
- 3.
Ninguna estrategia con un probiótico puede considerarse actualmente como el tratamiento primario estándar en ninguna de las patologías que se han revisado anteriormente.
- 4.
Tras valorar la calidad y consistencia de las evidencias disponibles revisadas, en opinión del autor, determinados probióticos, diferentes para cada proceso, se han demostrado eficaces y beneficiosos en caso de diarrea aguda infecciosa, diarrea asociada a antibióticos, diarrea asociada a C. difficile, pouchitis y en la erradicación de la infección por H. pylori, en las que puede recomendarse su uso:
- -
L. rhamnosus GG y S. boulardii tienen claros efectos beneficiosos en acortar la duración y reducir la frecuencia de las deposiciones en la diarrea infecciosa aguda. De la misma forma, parece que disminuyen significativamente el riesgo de diarrea asociada a antibióticos y de diarrea asociada a C. difficile. La suplementación con estos dos probióticos podría ser eficaz para aumentar las tasas de erradicación de H. pylori.
- -
VSL#3 en la prevención primaria y secundaria de la pouchitis, además de la terapia médica estándar.
- -
E. coli Nissle 1917 parece prometedor en el mantenimiento de la remisión de la CU y podría ser considerado como una alternativa en pacientes intolerantes o resistentes a preparados de 5-ASA.
- -
El autor declara no tener ningún conflicto de intereses.