Los fármacos inhibidores de la mTOR, everolimus (EVL) y sirolimus, son inmunosupresores con muy poco efecto nefrotóxico, limitado al desarrollo de proteinuria en algunos casos. En la prevención del rechazo agudo EVL combinado con tacrolimus a dosis reducidas tiene una eficacia y seguridad comparables a la inmunosupresión estándar con tacrolimus. La aplicación temprana de una inmunosupresión basada en EVL con minimización de la exposición al inmunosupresor calcineurínico en trasplantados hepáticos permite mejorar los resultados de la función renal, con tasas similares de eficacia y seguridad, tanto en el período de novo como de mantenimiento. En pacientes con disfunción renal establecida la introducción de EVL permite minimizar la exposición al inmunosupresor calcineurínico, con la consiguiente mejoría en la función renal. Aunque no hay evidencia suficiente para recomendar su uso para prevenir la recurrencia del hepatocarcinoma y la progresión de tumores de novo, es práctica clínica habitual utilizarlos en este contexto.
Mammalian target of rapamycin (mTOR) inhibitors, everolimus (EVL) and sirolimus are immunosuppressive agents with a minor nephrotoxic effect, limited to the development of proteinuria in some cases. The combination of EVL and low-dose tacrolimus has proven to be as safe and effective as standard therapy with tacrolimus for the prevention of acute cellular rejection. Early initiation of EVL-based immunosuppressive regimens with reduced exposure to calcineurin inhibitors has been shown to significantly improve renal function of LT recipients during induction and maintenance phases, with comparable efficacy and safety profiles. In patients with established kidney failure, initiating EVL may enable clinicians to reduce calcineurin inhibitors exposure, thereby contributing to the improved renal function of these patients. Although there is not sufficient evidence to recommend their use to prevent the recurrence of hepatocellular carcinoma and the progression of de novo tumours, they are used in this context in routine clinical practice.
Con la introducción de los nuevos fármacos inmunosupresores la incidencia de rechazo agudo ha disminuido y la supervivencia postrasplante hepático (TH) ha aumentado, siendo en la actualidad>80% y>70% al 1.er y 5.° año, respectivamente1. Sin embargo, la toxicidad asociada al uso de estos fármacos es importante, por lo que es necesario disponer de regímenes inmunosupresores que puedan cumplir los siguientes objetivos: 1) mantener la eficacia inmunosupresora para evitar el rechazo agudo; 2) disminuir la nefrotoxicidad a corto y largo plazo; 3) disminuir la incidencia de efectos secundarios que conllevan aumento del riesgo cardiovascular (diabetes, hipertensión arterial, dislipidemia, obesidad); 4) reducir la recurrencia del carcinoma hepatocelular (CHC); y 5) reducir la aparición de tumores de novo. Una de las estrategias terapéuticas para conseguir estos objetivos se basa en la retirada o reducción de los inhibidores de la calcineurina (ICN) y su combinación con fármacos inhibidores de la mammalian target of rapamycin —mTOR— (imTOR).
Everolimus (EVL) y sirolimus (SRL) actúan a un nivel distinto que los ICN, concretamente sobre la cascada de activación del linfocito T inhibiendo la mTOR, proteína quinasa involucrada en la señal 3 de activación de los linfocitos2–4.
EVL tiene una vida media más corta que SRL5, lo que le permite alcanzar concentraciones estables en sangre con mayor rapidez6.
Este artículo pretende ser un documento de recomendaciones clínicas de experto basadas en la evidencia y en la experiencia propia.
Everolimus en la prevención de rechazo agudo en el trasplante hepáticoSe han realizado 4 estudios prospectivos con EVL en el TH de novo con distintos objetivos (tabla 1). Levy et al. analizaron la eficacia y seguridad de EVL hasta los 36 meses del TH en un estudio fase ii (estudio RAD B158)7. Todos los pacientes (n=119) fueron tratados con ciclosporina (CsA) más esteroides y se compararon 3 dosis de EVL (1mg, 2mg o 4mg al día) frente a placebo. En los tratados con EVL se observó una tendencia a una menor tasa de rechazo agudo tratado frente al grupo placebo (39,3%, 30%, 29% vs. 40%, respectivamente), que no alcanzó significación estadística. En otro estudio Masetti et al. analizaron el impacto de la retirada precoz de CsA (a los 30 días del TH) seguida de EVL en monoterapia sobre la función renal en 78 receptores de TH8. No hubo diferencias significativas en la eficacia (en términos de rechazo y supervivencia) entre ambos grupos.
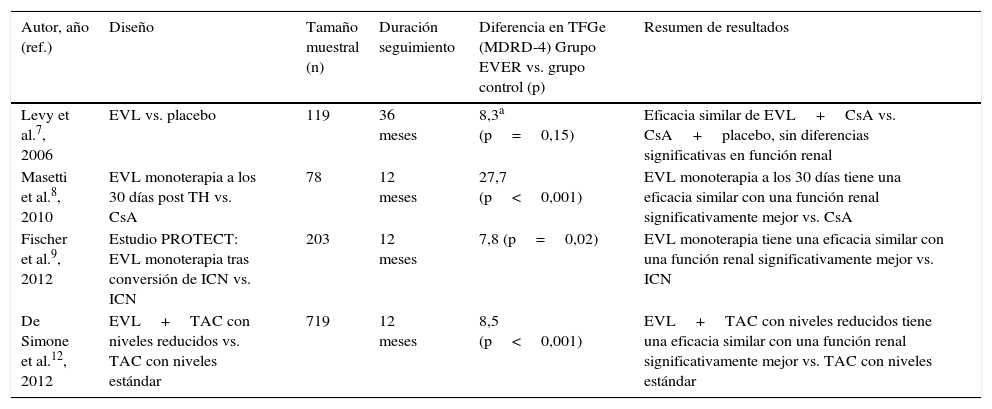
Estudios sobre el uso de everolimus en el trasplante hepático de novo
| Autor, año (ref.) | Diseño | Tamaño muestral (n) | Duración seguimiento | Diferencia en TFGe (MDRD-4) Grupo EVER vs. grupo control (p) | Resumen de resultados |
|---|---|---|---|---|---|
| Levy et al.7, 2006 | EVL vs. placebo | 119 | 36 meses | 8,3a (p=0,15) | Eficacia similar de EVL+CsA vs. CsA+placebo, sin diferencias significativas en función renal |
| Masetti et al.8, 2010 | EVL monoterapia a los 30 días post TH vs. CsA | 78 | 12 meses | 27,7 (p<0,001) | EVL monoterapia a los 30 días tiene una eficacia similar con una función renal significativamente mejor vs. CsA |
| Fischer et al.9, 2012 | Estudio PROTECT: EVL monoterapia tras conversión de ICN vs. ICN | 203 | 12 meses | 7,8 (p=0,02) | EVL monoterapia tiene una eficacia similar con una función renal significativamente mejor vs. ICN |
| De Simone et al.12, 2012 | EVL+TAC con niveles reducidos vs. TAC con niveles estándar | 719 | 12 meses | 8,5 (p<0,001) | EVL+TAC con niveles reducidos tiene una eficacia similar con una función renal significativamente mejor vs. TAC con niveles estándar |
CsA: ciclosporina; EVL: everolimus; ICN: inhibidores de la calcineurina; MDRD: Modification of Diet in Renal Disease; TAC: tacrolimus; TFGe: tasa de filtrado glomerular estimada.
En el estudio PROTECT 203 pacientes recibieron inducción con basiliximab e ICN con o sin esteroides durante 4 semanas9. A partir de la 4.ª semana el grupo control (n=102) continuó con ICN, mientras que en el grupo de estudio (n=101) se redujo las dosis de ICN y se inició EVL con la intención de retirar el ICN a las 8 semanas del TH. No hubo diferencias significativas en la supervivencia ni en la tasa de rechazo agudo confirmado por biopsia al año9, manteniéndose estos resultados a los 3 y 5 años de seguimiento10,11.
El ensayo clínico que dio lugar al registro de EVL en el TH fue el estudio en fase iii H230412. En este estudio prospectivo multicéntrico y abierto, 719 pacientes fueron aleatorizados a los 30+5 días post-TH en 3 brazos: tacrolimus (TAC) eliminación (grupo suspendido prematuramente por una mayor tasa de rechazo agudo), EVL-TAC reducido (TAC-r) (EVL con niveles de 3-8ng/ml y TAC con niveles de 3-5ng/ml) y brazo control, que continuó con TAC (niveles TAC de 8-12ng/ml) hasta el mes 4 y a partir de ese momento con niveles de 6-10ng/ml. En el análisis global a los 12 meses se demostró no inferioridad en la incidencia de la variable principal compuesta (rechazo agudo confirmado por biopsia tratado, pérdida del injerto o muerte) en el brazo de EVL-TAC reducido en comparación con el brazo control de TAC (6,7% vs. 9,7%, p<0,001)12. La eficacia se mantuvo a los 24 y 36 meses en los pacientes que continuaron con EVL13,14. En función de los resultados de este estudio EVL ha recibido la aprobación de la European Medicines Agency y la Food and Drug Administration en la indicación de profilaxis del rechazo agudo, combinado con dosis reducidas de TAC, a partir de la 4.ª semana del TH.
Puntos clave:
- 1.
EVL combinado con TAC a dosis reducidas ha mostrado a los 12, 24 y 36 meses del trasplante hepático una eficacia y seguridad comparables a la inmunosupresión estándar con TAC.
- 2.
No se recomienda el uso de EVL en monoterapia en el postrasplante precoz por riesgo aumentado de rechazo.
Se estima que aproximadamente el 50% de los receptores de un TH presentan disfunción renal en grado variable, y el 8-28% insuficiencia renal grave, cifras que aumentan cuanto mayor es el período de seguimiento post-TH15–17. No obstante, artículos recientes recogen cifras menores de disfunción renal, con una incidencia 18-22% acumulada a los 5 años, con uso de niveles bajos de ICN18. Un descenso>30% en la tasa de filtrado glomerular en el primer año post-TH ha demostrado ser un importante predictor de nefropatía crónica y de muerte después del 1.er año post-TH19,20 y estudios recientes sugieren un aumento importante de la mortalidad cuando la tasade filtrado glomerular es<30ml/min/1,73m2 (medida por aclaramiento de iothalamato)21.
En general, la función renal durante el 1.er año post-TH es el factor predictivo más importante de insuficiencia renal a largo plazo15,17. Aunque los ICN son la piedra angular del tratamiento inmunosupresor en el TH, no obstante su uso se asocia claramente con el desarrollo de nefrotoxicidad, tanto aguda como crónica17,22 y se consideran el mecanismo patogénico principal de la insuficiencia renal crónica (IRC) post-TH.
Basándonos en todo lo anterior, la introducción tardía, la reducción o incluso la retirada de los ICN, tanto en la fase de inducción como en la de mantenimiento a largo plazo post-TH debería conllevar un mayor grado de preservación de la función renal. Para no comprometer la supervivencia del paciente ni la función del injerto hepático estos protocolos «nefroprotectores» deben apoyarse en el uso de inmunosupresores no nefrotóxicos como micofenolato mofetil (MMF) o imTOR, con eventual apoyo de corticoides y anticuerpos monoclonales como basiliximab.
Everolimus en la preservación de la función renal en el período postrasplante inicialEl primer estudio que evaluó la retirada precoz de ICN con conversión precoz a monoterapia con EVL y su efecto sobre la función renal fue realizado por Masetti et al8. (ver el apartado «Everolimus en la prevención de rechazo agudo en el trasplante hepático» y la tabla 1). En este estudio la tasa de filtrado glomerular estimada (TFGe) estimada por la fórmula Modification of Diet in Renal Disease (MDRD-4) fue significativamente mejor (87,6±26,1ml/min/1,73m2) en el grupo con EVL en comparación con el grupo con CsA (58,2±17,9ml/min/1,73 m2; p<0,001).
El estudio PROTECT (ver el apartado «Everolimus en la prevención de rechazo agudo en el trasplante hepático» y la tabla 1) fue publicado inicialmente en 2012 por Fischer et al9., con resultados de seguimiento a los 3 y 5 años10,11. El objetivo fue analizar la función renal tras la conversión a EVL en monoterapia. Al año la función renal valorada por la fórmula MDRD-4 fue significativamente mejor (7,8ml/min/1,73m2; p=0,02) en el grupo de EVL que en el grupo de ICN. A los 3 años la diferencia a favor del régimen libre de ICN aumentó (9,4ml/min/1,73m2) debido a un ligero deterioro progresivo de la TFGe en la cohorte con ICN, a pesar de la disminución en la exposición a los mismos10. Los resultados a los 5 años confirman la tendencia a la mejoría de la función renal a favor del régimen libre de ICN, con un aumento de la TFGe de 11,4ml/min/1,73m211. No se detectó ningún caso de trombosis de la arteria hepática.
El estudio de registro de EVL en TH (ver el apartado «Everolimus en la prevención de rechazo agudo en el trasplante hepático»y la tabla 1) ha permitido comprobar la eficacia de este inmunosupresor no nefrotóxico en la preservación de la función renal tras el TH. Este estudio comparó los resultados de un régimen de EVL+TAC con niveles valle reducidos (3-5ng/ml) vs. TAC con niveles estándar (8-12ng/ml) hasta el mes 4, y a partir de ese momento con niveles de 6-10 ng/ml12-14. La TFGe valorada por la fórmula MDRD-4 fue superior en el grupo everolimus, con diferencias significativas de 8,5ml/min/1,73m2 y de 7,6ml/min/1,73 m2 a los 12 y 24 meses del trasplante, respectivamente, en comparación con el grupo control (p<0,001)12,13. Esta estabilización de la función renal se mantuvo hasta los 36 meses14, no existiendo diferencias respecto a la eficacia entre ambos brazos de tratamiento. Los resultados anteriores confirman que la minimización de TAC con la introducción de EVR el primer mes después del TH es una alternativa segura y eficaz, con mejor función renal en comparación con a la inmunosupresión estándar con TAC. Por otra parte, este estudio de registro mostró que la eliminación precoz de TAC y su sustitución por EVL en monoterapia sí se asocia a una tasa significativamente mayor de rechazo agudo12.
Actualmente está en marcha en España un ensayo prospectivo que compara la terapia con EVL (3-8ng/ml) en combinación con TAC a dosis reducidas (<5ng/ml) (EVL+TAC-r) vs. el tratamiento estándar con TAC (6-10ng/ml) combinado con MMF (NCT02040584). Los resultados de este estudio nos permitirán conocer el impacto en la función renal del régimen basado en everolimus más TAC-r frente a la terapia estándar de inmunosupresión (TAC+MMF).
Everolimus en preservación de la función renal en el período de mantenimientoLa presencia de disfunción renal entre los 3-6 meses tras el TH ha mostrado ser un predictor de insuficiencia renal a largo plazo17,23. Los estudios en el período post-TH precoz y en el trasplante renal sugieren que EVL es un inmunosupresor potente que permite reducir de forma sustancial la dosis de ICN en la fase precoz después del TH, optimizando así la función renal sin comprometer la eficacia antirrechazo10,24,25.
El efecto nefroprotector de EVL en el período de mantenimiento post-TH ha sido analizado en varios estudios. En uno de ellos De Simone et al. no encontraron beneficio sobre la función renal en los pacientes con disfunción renal relacionada con ICN y aleatorizados a introducción tardía de EVL con reducción (20%) o retirada (80%) de los ICN, en comparación con el grupo control26. La alta tasa de reducción de dosis en el grupo control (77%) y el largo tiempo transcurrido desde el TH (>3 años) podría explicar la ausencia de diferencias en la función renal entre los 2 grupos de pacientes. Sin embargo, otros estudios no comparativos han evidenciado una mejoría significativa de la función renal tras la introducción de EVL y la reducción o retirada del ICN, sin aumentar el riesgo de rechazo27,28. Así, en un estudio multicéntrico francés con 240 pacientes se observó un significativo aumento medio de la TFGe>8ml/min/1,73m2 (18,2%) en los pacientes con fallo renal establecido 12 meses después de haber iniciado EVL a una media de 4,9±5,2 años post-TH, y un 60% ya no recibían ICN tras dicho período26. En otro estudio reciente, observacional retrospectivo y multicéntrico realizado en España, se incluyeron 477 pacientes tratados con EVL como terapia de mantenimiento, entre los cuales en el 32,6% de los casos el motivo de la conversión fue la disfunción renal a una media de 23,8 meses post-TH29. Aunque la TFGe, valorada por la fórmula MDRD-4, mejoró en todas las indicaciones de conversión (disfunción renal, profilaxis de CHC y tumores de novo), la mejoría de la función renal fue mayor en el grupo de pacientes en los que se introdujo EVL por disfunción renal, con un aumento significativo de 10,9 y 6,8ml/min/1,73 m2 a los 3 y a los 12 meses de iniciar EVL, respectivamente. Un hallazgo particularmente llamativo de este estudio fue que la mejoría de la TFGe fue mayor en los pacientes en los que la conversión a EVL fue más precoz (inferior a un año post-TH). De hecho, cuando esta conversión se realizó transcurridos 5 años del TH no hubo mejoría de la TFGe, lo que sugiere que el momento de la conversión a EVL post-TH no debe ser pospuesto si no es imprescindible, ya que las estrategias de minimización temprana de ICN son posibles y seguras usando EVL. Las dosis y exposición medias de EVL fueron inferiores a las descritas en el estudio francés28, sin que la seguridad se viese afectada, lo que refleja el aprendizaje derivado del uso cada vez más frecuente de EVL.
Puntos clave:
- 1.
La aplicación temprana e individualizada de un protocolo de inmunosupresión basado en EVL con minimización de la exposición al ICN en receptores de un TH permite obtener mejores resultados de función renal con tasas similares de eficacia y seguridad.
- 2.
Las estrategias basadas en la reducción de ICN combinado con everolimus son eficaces en la prevención de la disfunción renal en el trasplante de novo y también durante el período de mantenimiento.
- 3.
En pacientes con disfunción renal establecida, la introducción de EVL en el régimen inmunosupresor es una buena opción, ya que permite minimizar la exposición al ICN e incluso retirarlo, con la consiguiente mejoría en la función renal.
- 4.
Es esperable que la preservación de la función renal en la fase de inducción y mantenimiento tenga impacto en los resultados finales del TH (morbilidad, supervivencia e incluso costes), sobre todo en enfermos de alto riesgo.
El carcinoma hepatocelular representa la 3.ª causa de mortalidad por cáncer en el mundo30 y el 16-25% de las indicaciones de TH en nuestro medio31,32, con una tasa de recidiva de 16-20% después del TH33. Las recidivas son resecables en<10% de los casos y se asocian con una supervivencia media de un año desde el diagnóstico34,35. En estudios moleculares36 se ha demostrado que el CHC utiliza para su desarrollo la vía mTOR hasta en un 30-40% de los casos37. Este hecho constituye la base para que los inhibidores del mTOR puedan tener un papel en el régimen inmunosupresor de los pacientes trasplantados por CHC38. Este efecto antiproliferativo en líneas celulares de CHC parece mantenerse incluso con la administración concomitante de tacrolimus39. Por otro lado, algunos estudios han establecido una asociación entre el riesgo de recurrencia del CHC y la existencia de niveles altos de ICN, incluso durante el primer mes del trasplante40,41.
La eficacia de los imTOR en la prevención o tratamiento de la recurrencia del CHC post-TH ha sido analizada en 3 metaanálisis42–44. En los 2 primeros42,43 los pacientes trasplantados por CHC tratados con un imTOR como parte de su pauta inmunosupresora tenían una mayor supervivencia que los no tratados con imTOR. Sin embargo, estos resultados se basaban solo en 5 estudios retrospectivos, con escaso número de pacientes y que usaron criterios no uniformes al definir las características del tumor. Un metaanálisis más reciente44 evidenció la misma tendencia en el análisis global, pero cuando los resultados eran ajustados por el tipo de estudio y el por tipo de tumor, solo se observaba cierto beneficio en aquellos casos que estaban dentro de los criterios de Milán.
Recientemente, se han publicado los resultados del estudio SILVER45, el único estudio prospectivo, aleatorizado y con seguimiento prolongado que ha evaluado el uso de imTOR (SRL) en los pacientes trasplantados por CHC. Globalmente, el estudio muestra un beneficio en la supervivencia libre de recurrencia durante los primeros 3-4 años del seguimiento que no se mantiene a partir del 5.° año. Los beneficios son también mayores en el subgrupo de pacientes<60 años y con tumores dentro de los criterios de Milán (y no en pacientes de alto riesgo según el explante), pero sobre todo los beneficios más importantes a corto y largo plazo son los presentados por pacientes en monoterapia con SRL, aunque estos pacientes representan solo el 19% del grupo que recibió SRL. Otro de los puntos débiles del estudio es que no analiza otros factores reconocidos de mal pronóstico para clasificar como de «alto riesgo de recidiva» a los pacientes (una pobre diferenciación del tumor, la presencia de invasión microvascular y los niveles altos de alfafetoproteína).
Yanik et al46. han analizado en un estudio reciente el efecto de una inmunosupresión de mantenimiento con SRL en 3.936 trasplantados por CHC entre 2002-2012 en Estados Unidos, de los que 234 (6%) recibieron SRL en los 3 primeros meses post-TH, sin encontrar diferencias entre los pacientes que recibieron o no SRL en la mortalidad por cáncer o en la tasa de recurrencia de CHC46. No obstante, se trata de un estudio subóptimo por el pequeño tamaño del grupo de SRL que, por tanto, carece del poder estadístico necesario para identificar diferencias significativas. Además, en el 26% de los pacientes de dicho grupo no existe seguimiento pasados 3 meses post-TH y no se dispone de datos de los explantes, por lo que no se analizan el grado diferenciación histológica del tumor, ni tampoco la existencia de invasión microvascular.
Por otro lado, se ha valorado también el papel de EVL asociado a sorafenib en el tratamiento de la recidiva del CHC post-TH con resultados contradictorios, tanto de eficacia como de efectos adversos47–49.
En la actualidad está en marcha un ensayo clínico (NCT01888432) que evalúa el uso de EVL con dosis reducidas de TAC en receptores de donante vivo. Como objetivo secundario se analizará si el beneficio de esta pauta inmunosupresora en la recurrencia de CHC se mantiene en tumores extra-Milán (que no suponen un motivo de no inclusión de pacientes) y también evaluará el papel que además analizará la alfafetoproteína, la invasión microvascular y el grado de diferenciación tumoral.
Es necesario, por tanto, la realización de nuevos estudios que evalúen prospectivamente las ventajas del uso de EVL en los pacientes trasplantados por CHC, que en la práctica clínica diaria suponen el 30% de las indicaciones de uso de este fármaco29, y que se identifique el subgrupo de pacientes con alto riesgo de recidiva que podrían beneficiarse del uso de imTOR.
Everolimus en los tumores de novoLa incidencia de tumores de novo tras el TH oscila entre el 5% y el 16%, 2-3 veces mayor que en la población general no trasplantada50. Los tumores de novo son una de las causas principales de mortalidad a largo plazo51. Los principales factores de riesgo son la inmunosupresión, la edad y el consumo de tabaco y alcohol, estos 2 últimos especialmente en los tumores de novo pulmonares y del área orofaríngea52,53.
Numerosos estudios pre-clínicos, tanto en cultivos celulares in vitro como en modelos animales, han demostrado que una importante variedad de tumores sólidos, así como la enfermedad linfoproliferativa, son dependientes de la vía de la mTOR54. La evidencia clínica del papel de los imTOR como tratamiento de los tumores de novo post-TH es todavía escasa y está basada en publicaciones de casos aislados o de series cortas retrospectivas55–59. Sin embargo, a pesar del bajo grado de evidencia, la práctica clínica habitual en España muestra que la tercera parte de las indicaciones de EVL en el post-TH ha sido en el contexto de la aparición de un tumor de novo29, ya que en muchos centros de trasplante se procede a introducir EVL (niveles 3-8ng/ml) y a reducir al máximo o retirar el ICN en este escenario.
A pesar de que no hay evidencia suficiente como para hacer una recomendación al respecto, las pautas inmunosupresoras con imTOR dirigidas a la prevención o al tratamiento de la recurrencia post-TH del CHC, o tras aparición de tumor de novo, son una práctica clínica habitual en las unidades de trasplante hepático.
Puntos clave:
- 1.
Los imTOR inhiben la angiogénesis y la apoptosis necesarias para la transformación y propagación de las células neoplásicas.
- 2.
Los estudios retrospectivos, así como el único estudio prospectivo, realizados en pacientes trasplantados por CHC han mostrado menor recurrencia y mayor supervivencia en determinados subgrupos de pacientes que reciben imTOR. Sin embargo, a falta de confirmación de estos datos en nuevos estudios prospectivos, no puede recomendarse el uso generalizado de imTOR en todos los pacientes trasplantados por CHC, y parece razonable por el momento utilizarlos en casos con mayor riesgo de recidiva.
- 3.
La evidencia de la eficacia de pautas inmunosupresoras con imTOR dirigidas a la prevención o al tratamiento de la recurrencia post-TH del CHC o tras aparición de tumor de novo, debe confirmarse con futuros estudios prospectivos y aleatorizados.
Además de las indicaciones comentadas anteriormente, los imTOR pueden ser usados en otros escenarios como en el tratamiento coadyuvante en casos de rechazo grave o en el caso de neurotoxicidad por ICN incluso en el postrasplante precoz. Así, en el estudio EVEROLIVER29 entre las indicaciones de conversión a EVL en el 11,6% casos (56/481) fue por neurotoxicidad de ICN y en el 5,2% (6/481) por rechazo confirmado por biopsia. No obstante, no hay evidencia suficiente como para hacer una recomendación sobre dichas indicaciones.
Consideraciones prácticas: metabolismo e interaccionesEVL es un fármaco de estrecho margen terapéutico y administración por vía oral, en 2 dosis/día, que se puede tomar con o sin alimentos y junto al ICN. Se metaboliza principalmente en el hígado, por lo que se requiere ajuste de dosis en caso de función hepática alterada (reducir la dosis inicial en un 30%, 50% y 60% en pacientes con cirrosis grado Child-Pugh A, B y C, respectivamente)60. EVL se metaboliza por el CYP3A4, por lo que no se recomienda la administración conjunta con inhibidores (por ejemplo ketoconazol, itraconazol, voriconazol, claritromicina y ritonavir) o inductores (por ejemplo rifampicina y rifabutina) potentes del CYP3A4 a menos que el beneficio supere el riesgo.
A diferencia del trasplante renal, donde el desarrollo de EVL se realizó combinando este con CsA, en el trasplante hepático se hizo con dosis reducidas de TAC12. En el trasplante renal se evidenció que la CsA tiene un efecto sinérgico con EVL cuando ambos fármacos se administran conjuntamente (se precisa menor dosis de EVL cuando se coadministra con CsA, y cuando se disminuye la dosis de CsA pueden disminuir los niveles de EVL6,61,62, especialmente si los niveles valle de CsA son<50 ng/ml). Este efecto no se observó con TAC en el TH, por lo que de ambas experiencias parece prudente administrar dosis de EVL de inicio inferiores con CsA que con TAC en el TH.
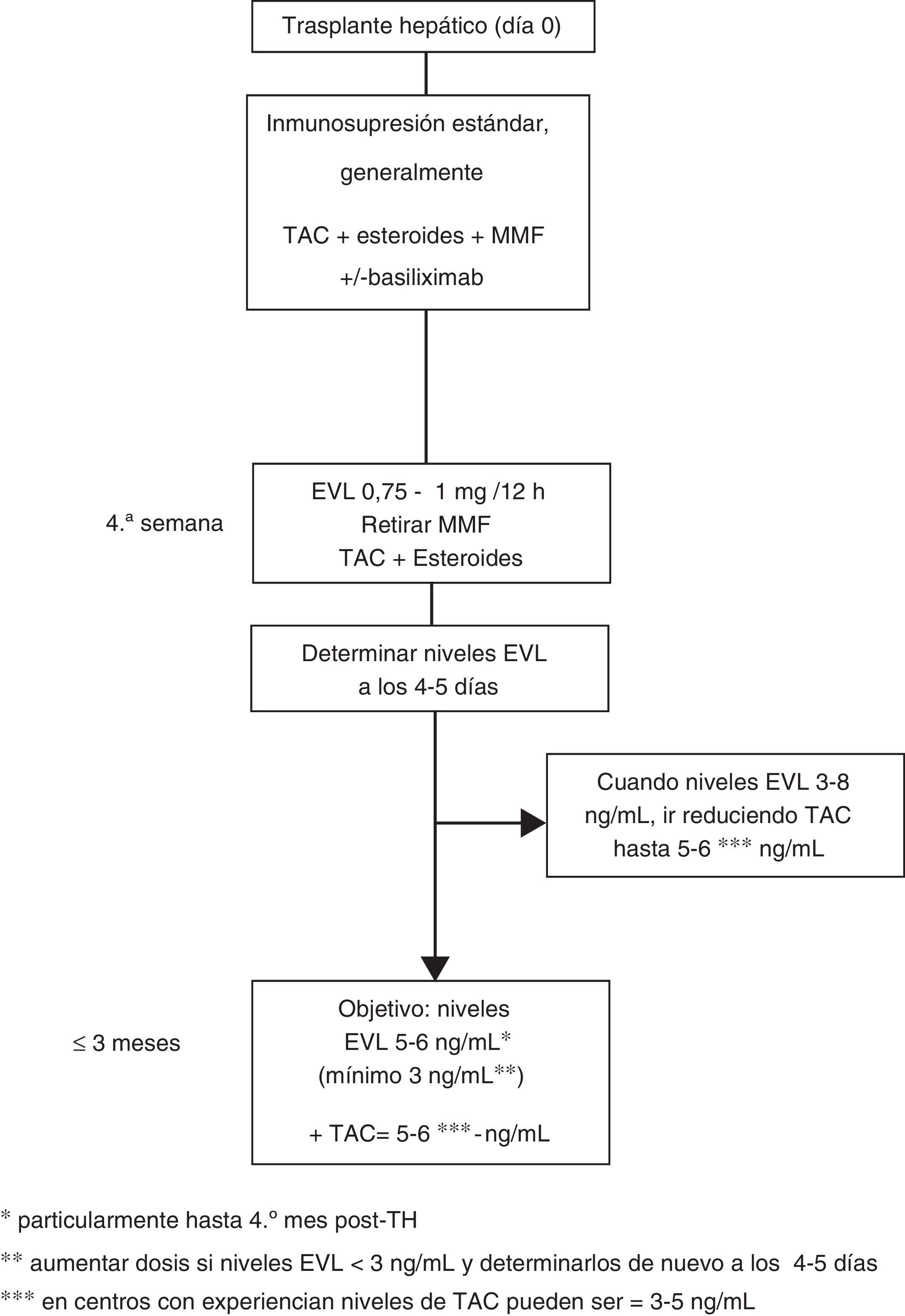
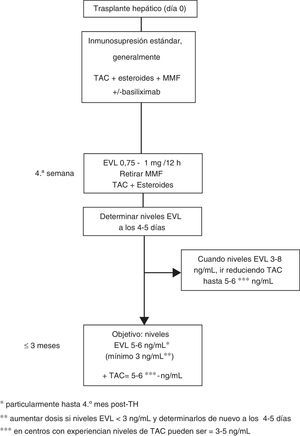
Dosificación de everolimus63En el uso precoz la dosis inicial de EVL es 1mg cada 12h, administrado al mismo tiempo que TAC (0,75mg/12h si es con CsA). Los ajustes de dosificación (incrementos o descensos de EVL de 0,25mg/12h) se realizan según los niveles valle (C0) obtenidos al menos 5 días desde el cambio de dosis previa, hasta alcanzar un nivel C0 de 3-8ng/ml. Se deben realizar controles hasta que 2 niveles C0 consecutivos muestren concentraciones estables de EVL. Una vez conseguidos estos niveles se ha de reducir progresivamente la dosis de TAC. Aunque la concentración reducida de TAC en el TH de novo en combinación con EVL no ha sido bien establecida, una cifra razonable podría ser 5-6ng/ml, que fue el nivel medio alcanzado en el estudio de registro12. No obstante, el diseño de varios ensayos clínicos actualmente en marcha, así como el uso de EVL en centros con experiencia en trasplante, permiten deducir que los niveles de TAC reducidos pueden ser aún más bajos, de 3-5 ng/ml (fig. 1).
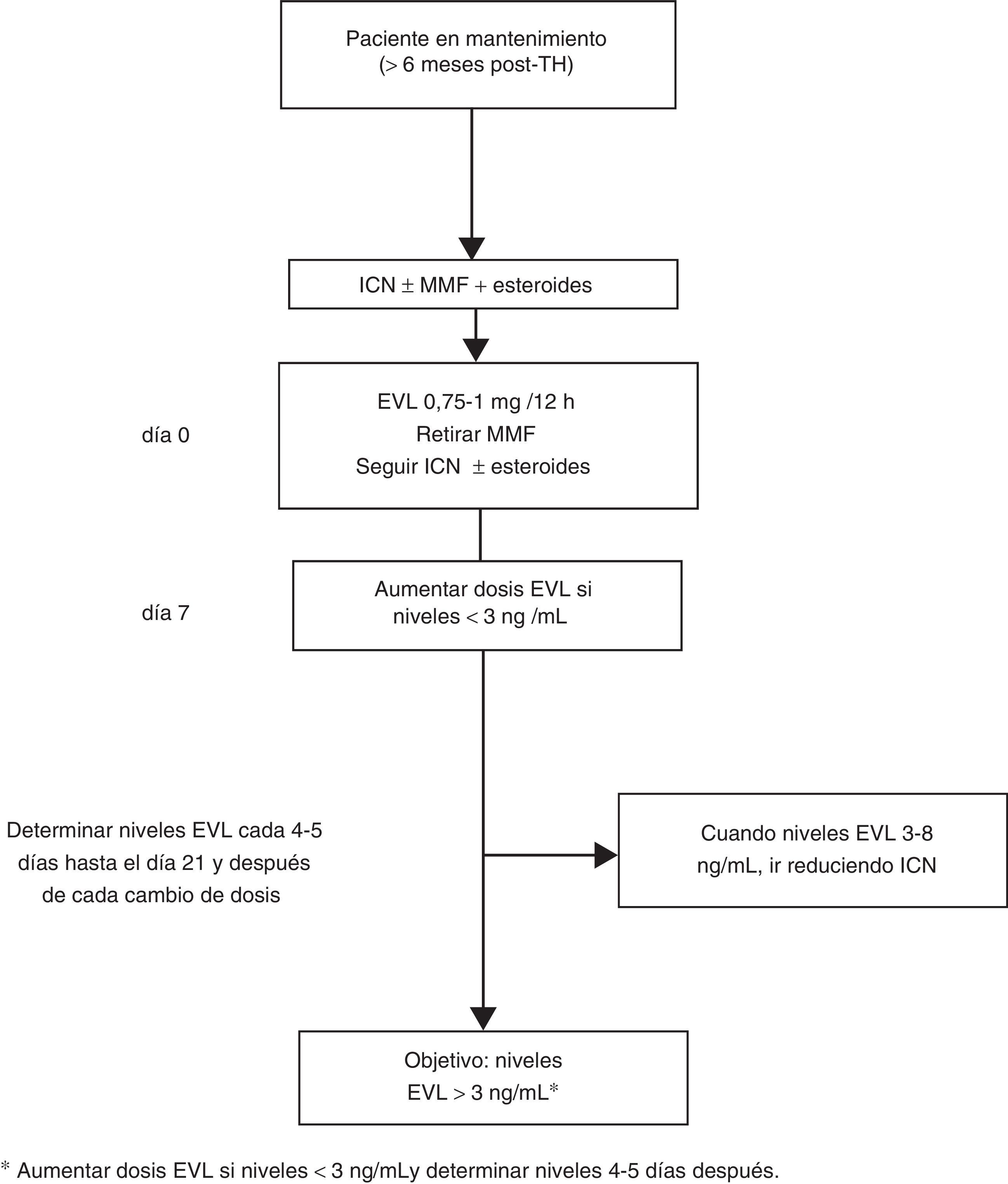
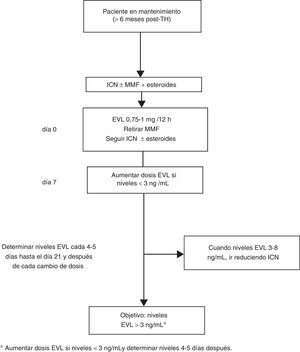
En los casos de inicio tardío de EVL la introducción de EVL (0,75-1mg/12h) puede hacerse simultáneamente al descenso del 25-30% de la dosis del ICN, procediendo posteriormente a ajustes según niveles y tolerancia54 (fig. 2). Si el paciente está recibiendo tratamiento con CsA, el cambio es similar, si bien por su especial interacción con EVL los niveles de EVL pueden disminuir si la exposición a la CsA se reduce notablemente (concentración valle<50 ng/ml).
Monitorización de nivelesLos datos de exposición-eficacia y exposición-seguridad han establecido que los niveles C0 de EVL≥3,0 ng/ml se asocian con una incidencia menor de rechazo agudo confirmado mediante biopsia que los niveles<3,0 ng/ml. El límite superior recomendado es 8ng/ml64–68 y los niveles>8ng/ml se asocian con mayores efectos secundarios. Por tanto, los niveles recomendados son de 3-8ng/ml. No se requiere ajuste de dosis en pacientes de edad avanzada (>65 años) ni en caso de insuficiencia renal.
Hay que monitorizar estrechamente los niveles de EVL en las siguientes circunstancias:
- 1.
Insuficiencia hepática.
- 2.
Administración de fármacos que induzcan o activen la isoenzima CYP3A4 del sistema citocromo P450.
- 3.
Cuando se minimiza el tratamiento basado en ciclosporina.
- 4.
Ante la aparición de efectos adversos, en cuyo caso se reduce la dosis de EVL al menos en 0,25mg cada 12h, manteniendo niveles C0 de EVL>3 ng/ml.
Los efectos secundarios asociados al uso de imTOR son bien conocidos y suelen poder controlarse con tratamiento médico y reducción de dosis69. En todos los ensayos clínicos (EC) controlados, las reacciones adversas asociadas a EVL más frecuentes son: anemia, edema periférico, elevaciones de creatinina cuando se utilizan junto con dosis plenas del ICN, hiperlipidemia, alteración de la cicatrización y aftas orales12,13,26,70.
En el estudio de registro de EVL12 la tasa de efectos adversos que condujeron a la discontinuación del tratamiento fue del 25,5% en el grupo de EVL-TAC reducido vs. 14,1% grupo TAC estándar. La proteinuria (2,9%), la hepatitis C recurrente (2%) y la pancitopenia (3%) fueron los eventos que con mayor frecuencia provocaron la interrupción del tratamiento con EVL.
Se describen a continuación algunos de los efectos adversos más frecuentes con recomendaciones sobre su manejo (tabla 2).
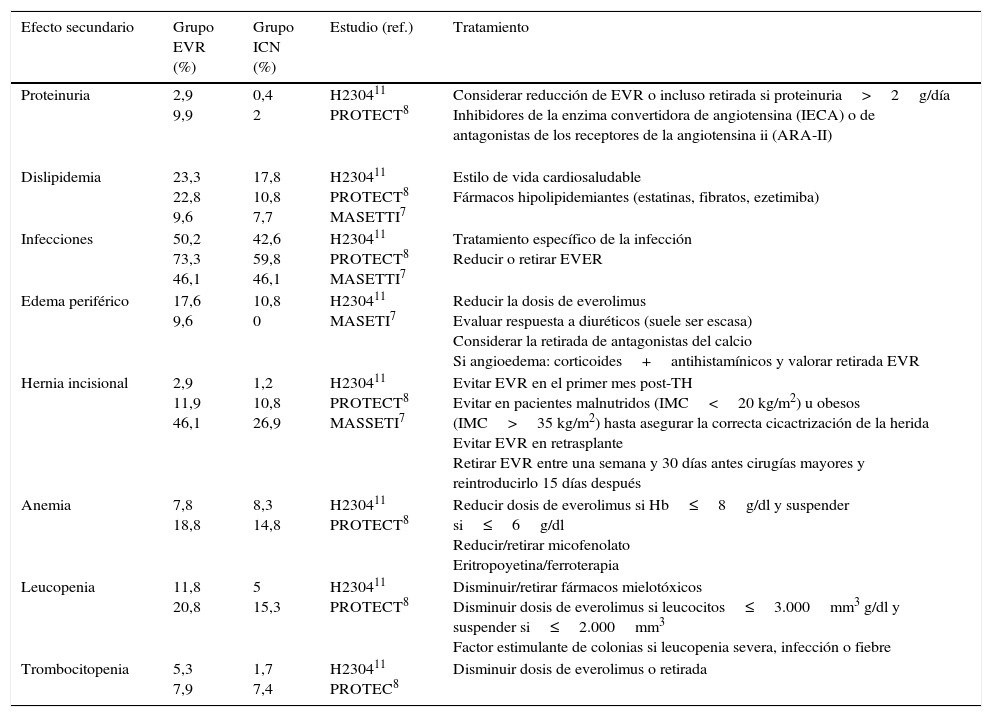
Principales efectos adversos de everolimus a los 12 meses en estudios prospectivos
| Efecto secundario | Grupo EVR (%) | Grupo ICN (%) | Estudio (ref.) | Tratamiento |
|---|---|---|---|---|
| Proteinuria | 2,9 9,9 | 0,4 2 | H230411 PROTECT8 | Considerar reducción de EVR o incluso retirada si proteinuria>2g/día Inhibidores de la enzima convertidora de angiotensina (IECA) o de antagonistas de los receptores de la angiotensina ii (ARA-II) |
| Dislipidemia | 23,3 22,8 9,6 | 17,8 10,8 7,7 | H230411 PROTECT8 MASETTI7 | Estilo de vida cardiosaludable Fármacos hipolipidemiantes (estatinas, fibratos, ezetimiba) |
| Infecciones | 50,2 73,3 46,1 | 42,6 59,8 46,1 | H230411 PROTECT8 MASETTI7 | Tratamiento específico de la infección Reducir o retirar EVER |
| Edema periférico | 17,6 9,6 | 10,8 0 | H230411 MASETI7 | Reducir la dosis de everolimus Evaluar respuesta a diuréticos (suele ser escasa) Considerar la retirada de antagonistas del calcio Si angioedema: corticoides+antihistamínicos y valorar retirada EVR |
| Hernia incisional | 2,9 11,9 46,1 | 1,2 10,8 26,9 | H230411 PROTECT8 MASSETI7 | Evitar EVR en el primer mes post-TH Evitar en pacientes malnutridos (IMC<20 kg/m2) u obesos (IMC>35 kg/m2) hasta asegurar la correcta cicactrización de la herida Evitar EVR en retrasplante Retirar EVR entre una semana y 30 días antes cirugías mayores y reintroducirlo 15 días después |
| Anemia | 7,8 18,8 | 8,3 14,8 | H230411 PROTECT8 | Reducir dosis de everolimus si Hb≤8g/dl y suspender si≤6g/dl Reducir/retirar micofenolato Eritropoyetina/ferroterapia |
| Leucopenia | 11,8 20,8 | 5 15,3 | H230411 PROTECT8 | Disminuir/retirar fármacos mielotóxicos Disminuir dosis de everolimus si leucocitos≤3.000mm3 g/dl y suspender si≤2.000mm3 Factor estimulante de colonias si leucopenia severa, infección o fiebre |
| Trombocitopenia | 5,3 7,9 | 1,7 7,4 | H230411 PROTEC8 | Disminuir dosis de everolimus o retirada |
El edema periférico es frecuente, con poca o nula respuesta a diuréticos y, a veces, incapacitante.
Proteinuria e insuficiencia renalLa proteinuria tiene una incidencia variable (3,7-9,9%) en los EC con EVL de novo post-TH8,9,13 y en la mayoría de los casos es leve. El mecanismo por el cual los imTOR inducen proteinuria no está bien establecido, habiéndose relacionado con una disminución en la reabsorción tubular de proteínas. Se ha descrito deterioro de la función renal tras la administración de imTOR, sobre todo en pacientes con proteinuria significativa previa. Por este motivo, antes de iniciar imTOR debe realizarse una proteinuria basal, y si es>800mg/día se desaconseja su uso71,72, así como en pacientes con TFGe (MDRD4)<40ml/min/1,73 m2. Se recomienda la monitorización periódica (cada 3-6 meses) de la función renal y de la proteinuria en pacientes en tratamiento con EVL.
Hernia incisional y problemas de la herida quirúrgicaEl uso de imTOR tras el trasplante de órganos sólidos se ha asociado con mala cicatrización de las heridas quirúrgicas y con el desarrollo de linfoceles. En el estudio de Masetti et al. existió una mayor incidencia de hernia incisional en el grupo EVL (46,1% vs 26,9%, p=0,16), si bien la administración de este tras el TH era muy precoz, en el día 10.° post-TH8. Sin embargo, en el estudio de registro, en el que EVL se iniciaba al mes del TH, la incidencia de complicaciones de la herida quirúrgica y de hernias incisionales fue comparable entre los grupos con y sin EVL (11% vs. 8,3%, p=0,36 y 9,8% vs. 7,9%, p=0,52, respectivamente)12.
DislipidemiaSe asocia al tratamiento con EVL tanto en los regímenes de novo (26,9% grupo EVL vs. 11,6% grupo control, p=0,001)13 como en los de conversión tardía (9,7% grupo EVL vs. 2,7% grupo control p=0,017)24. La prevalencia de dislipidemia oscila entre el 7% y el 43%73. En general, se controla con fármacos hipolipidemiantes.
InfeccionesLa incidencia de infecciones relacionadas con el uso de EVL varía en los diferentes estudios publicados. No fue más alta en los estudios de incorporación de novo8,13, pero sí en las terapias de introducción tardía de EVL9,24. Dado que los imTOR inhiben la proliferación inducida por la interleuquina-2 de los linfocitos T activados y de interferón gamma, ambas necesarias para la inmunidad frente a bacterias intracelulares, pueden predisponer a la infección por dichos microorganismos.
En uno de los estudios de registro13 el 56% de pacientes (138/245) del grupo de EVL+TAC-reducido presentó infecciones vs. el 51,7% (125/242) del grupo de TAC convencional, sin diferencias significativas entre ambos grupos tanto en el global como en el tipo de infección (bacteriana: 19,6% vs. 13-2%, viral: 18,4% vs. 18,2% y fúngica 3,3% vs. 6,2%).
Depresión de médula óseaEVL se asocia con depresión de la médula ósea, manifestada como anemia (7,8-18,8%), leucopenia (11,8-20,8%) o trombocitopenia (5,3-7,9%). Deben descartarse otras causas que puedan contribuir a la aparición de estas manifestaciones hematológicas como infecciones víricas, estados carenciales y fármacos mielotóxicos (MMF, ganciclovir, valganciclovir…). Suele corregirse con reducción de la dosis de EVL aunque puede llegar a requerir en ocasiones la retirada del fármaco.
Estomatitis y aftosisLas lesiones aftosas son relativamente frecuentes en los pacientes tratados con EVL. Su incidencia fue del 10,6% en el estudio de registro13 y del 26,4% en los estudios de conversión tardía26. Ante este tipo de lesiones se deben descartar infecciones concomitantes. El tratamiento incluye reducción de la dosis del imTOR y tratamiento tópico con anestésicos. En ocasiones son recidivantes y obligan a la retirada de EVL.
Lesiones cutáneasGeneralmente mejoran espontáneamente en semanas, aunque pueden requerir tratamiento tópico dermatológico y reducción de dosis de EVL. Debe descartarse origen infeccioso.
NeumonitisSu incidencia fue del 2-5% en los estudios H230412–14 y PROTECT9–11. La clínica es variable, desde alteraciones radiográficas asintomáticas hasta alteración respiratoria grave, potencialmente fatal. Su incidencia es mayor cuando los niveles de imTOR están por encima del margen terapéutico.
Puntos clave:
- 1.
La función renal debe estimarse mediante las fórmulas MDRD y/o Chronic Kidney Disease Epidemiology Collaboration, periódicamente en pacientes en tratamiento con EVL.
- 2.
Debe realizarse un estudio de proteinuria de 24horas antes de introducir EVL y determinaciones periódicas (cada 3-6 meses) una vez iniciado el tratamiento. En caso de proteinuria>2g/día debe considerarse reducción/retirada de EVL.
- 3.
Dosis y administración:
- •
Inicio: a partir del día 30 post-TH, a dosis de 1mg/12h por vía oral, administrado al mismo tiempo que TAC (0,75mg/12h si es con CsA), con o sin comida, pero siempre de la misma manera, y a la vez que el ICN.
- •
Mantenimiento y ajuste: ajustar la dosis semanalmente hasta lograr niveles valle (C0) de 3-8 ng/ml.
- 4.
Poblaciones especiales:
- •
No se requiere ajuste de dosis en caso de insuficiencia renal ni en pacientes ancianos.
- •
Insuficiencia hepática: leve (disminuir la dosis inicial en un 30%), moderada (disminuir la dosis inicial en un 50%), grave (disminuir la dosis inicial en un 60%).
- 5.
Precauciones:
- •
Se deben monitorizar niveles valle (C0) de everolimus tras cada ajuste de dosis, y tras la administración de fármacos que interaccionan con su metabolismo.
- •
Se requiere monitorizar periódicamente (cada 3-6 meses) la función renal (fórmulas MDRD y/o Chronic Kidney Disease Epidemiology Collaboration), proteinuria, hemograma y lípidos.
- •
Trabajo financiado por Novartis®.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo realizado de forma independiente por expertos de la Sociedad Española de Trasplante Hepático (SETH) y avalado por la SETH. Financiado por Novartis.