INTRODUCCIÓN
Las pruebas del aliento que detectan la presencia de carbono o hidrógeno marcados con 13C tras la administración de diversas sustancias, sustratos de diferentes rutas enzimáticas, ha permitido una aproximación a los mecanismos fisiopatológicos de diversas enfermedades digestivas de una forma indirecta1. A lo largo del presente artículo, se revisará la utilidad de las diferentes pruebas del aliento en la valoración de la capacidad funcional hepática, la reserva pancreática exocrina, el sobrecrecimiento bacteriano, la motilidad gastrointestinal, la malabsorción de hidratos de carbono y, fundamentalmente, la infección por Helicobacter pylori.
PRUEBA DEL ALIENTO PARA EL DIAGNÓSTICO DE LA INFECCIÓN POR H. PYLORI
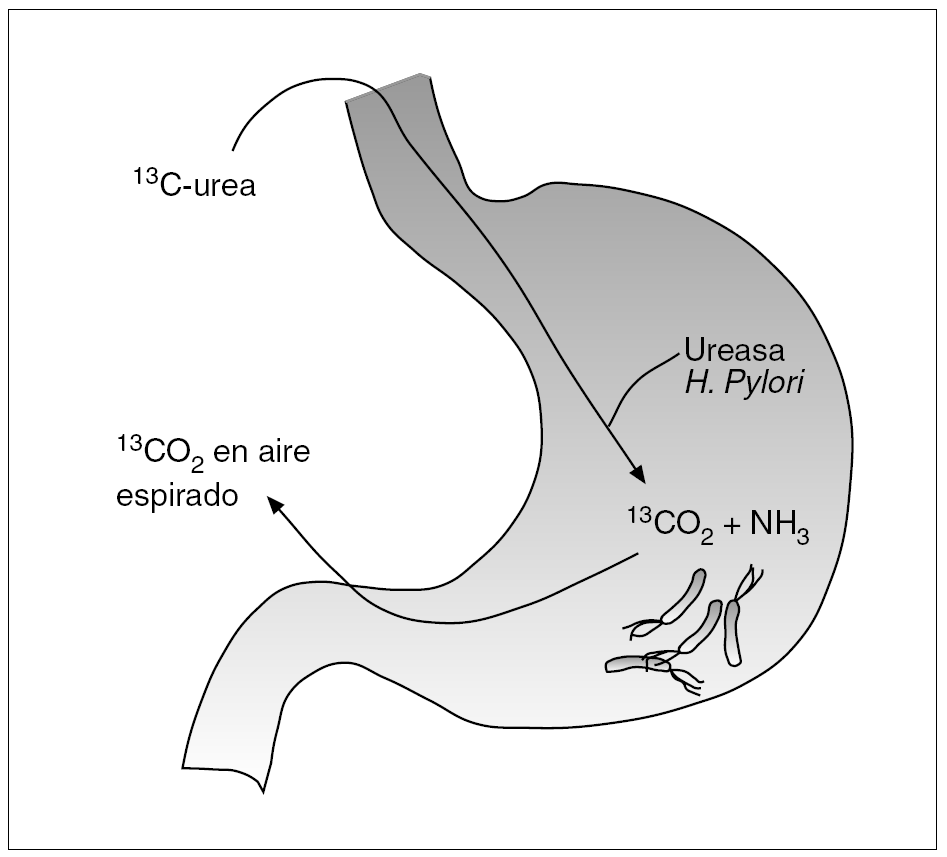
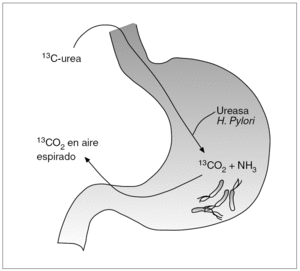
La infección por H. pylori desempeña un papel fundamental en el desarrollo de diversas lesiones gastroduodenales, por lo que su identificación representa un tema clínicamente relevante. Los métodos diagnósticos de la infección por H. pylori se han dividido tradicionalmente en directos e indirectos2. Los primeros se basan en la demostración directa del microorganismo mediante el estudio de muestras obtenidas por biopsia gástrica. Son, por tanto, técnicas que precisan una endoscopia y, por ello, resultan agresivas o molestas para el enfermo. Los métodos indirectos se basan en el estudio y la detección de ciertas características de la bacteria (p. ej., la capacidad de hidrolizar la urea) o de la respuesta del sistema inmunitario del huésped frente a la infección (cuantificación de anticuerpos específicos mediante las diversas pruebas serológicas). Este tipo de técnicas no precisan endoscopia y, por tanto, pueden considerarse poco agresivas o molestas para el enfermo. La prueba del aliento con urea (PAU) se basa en la capacidad de la ureasa producida por H. pylori para hidrolizar una solución de urea previamente marcada con el isótopo 13C o 14C. Como se representa gráficamente en la figura 1, el CO2 marcado se absorbe, se difunde a la sangre, es transportado a los pulmones y de allí es excretado a través del aire espirado.
Fig. 1. Fundamento de la prueba del aliento con urea marcada con 13C.
La utilización de 13C comporta indudables ventajas (en comparación con el 14C), ya que se trata de un isótopo natural estable y no radiactivo, que puede utilizarse tantas veces como sea necesario3. Por el contrario, la PAU que utiliza 14C, técnica que no está autorizada por las autoridades sanitarias españolas para el diagnóstico de H. pylori, se asocia a una dosis de radiación que, aunque considerablemente baja, hace necesario disponer de licencia para su manejo, precisa un almacenamiento adecuado y no permite su empleo en mujeres embarazadas o en niños. En esta última población, la PAU con 13C se configura como una prueba ideal para la determinación de la infección por H. pylori, y recientemente se ha demostrado que este test posee el mismo excelente rendimiento diagnóstico en niños que en adultos3. En el otro extremo de la vida, algunos autores han comprobado cómo la PAU es también notablemente precisa para diagnosticar la infección por H. pylori en los pacientes ancianos4.
Para confirmar la erradicación de H. pylori tras el tratamiento la prueba que se debe emplear dependerá de la enfermedad de base. Así, en la úlcera duodenal o en la dispepsia en caso de que se decida administrar tratamiento en ella la PAU es el método diagnóstico de elección5,6. En estas situaciones la PAU confirma precozmente la desaparición de H. pylori tras el tratamiento, a diferencia de las técnicas serológicas, que precisan un período prolongado para objetivar el efecto de la erradicación7. De ahí que en el momento actual la PAU deba considerarse la técnica de elección para confirmar la erradicación de H. pylori (cuando no es precisa la gastroscopia), lo que deberá comprobarse al menos 4 semanas después de haber finalizado el tratamiento2.
La exactitud diagnóstica de la PAU ha sido muy elevada en la mayoría de los estudios publicados entre el 90 y el 100%, e incluso con cifras superiores al 95% cuando únicamente se consideran aquellos protocolos metodológicamente más correctos7-19. La elevada sensibilidad obtenida en la mayoría de los estudios podría ser debida a que la PAU valora la totalidad de la mucosa gástrica, a diferencia de los métodos diagnósticos basados en el análisis de la muestra obtenida por biopsia, que están sujetos por tanto a la distribución heterogénea de H. pylori en la cavidad gástrica. No obstante, el empleo de antibióticos o inhibidores de la bomba de protones en los días previos a la realización de la prueba es una causa demostrada de resultados falsos negativos3. Por ello, se recomienda que transcurra al menos un mes desde la finalización del tratamiento antibiótico hasta la realización de la prueba y al menos 14 días desde la retirada de los inhibidores de la bomba de protones5. La especificidad de la PAU es también excelente3; aunque se ha descrito que, al menos en teoría, pueden obtenerse resultados falsos positivos como consecuencia de la existencia en el estómago de otras bacterias productoras de ureasa, la relevancia clínica de este hecho parece ser muy limitada2.
Se han propuesto numerosas modificaciones de la técnica de la PAU y se han publicado multitud de trabajos en relación a su metodología, a pesar de lo que, en la actualidad, no existe todavía una estandarización definitiva de la prueba. A continuación, se revisan los aspectos más relevantes del protocolo de esta prueba diagnóstica.
¿Qué equipamiento puede emplearse para detectar el 13C?
Para la realización de la PAU se ha empleado tradicionalmente la tecnología de espectrometría de masas de relaciones isotópicas. Sin embargo, esta técnica se asocia con una serie de inconvenientes, como su elevado coste, su relativa complejidad de uso y mantenimiento, su considerable tamaño y una cierta demora en la obtención de los resultados. Por ello, en una época más reciente se han desarrollado otras técnicas para detectar 13C en el aire espirado, entre las que destaca la que utiliza la tecnología láser o la espectrofotometría de infrarrojos3. Este último método tiene una serie de ventajas, entre las que destaca, en primer lugar, su menor coste. Otra ventaja es que tiene un mantenimiento más sencillo, entre otros motivos porque no necesita helio para su funcionamiento. El pequeño tamaño del espectrofotómetro de infrarrojos, en comparación con el espectrómetro de masas, supone otra ventaja adicional, haciendo del primer método una atractiva opción para los laboratorios que procesan un reducido número de muestras o para el uso en la propia consulta del médico. Esta última alternativa se ve favorecida por la rapidez con la que se obtienen los resultados, pues éstos están disponibles en tan sólo unos pocos minutos3,19,20.
No obstante, el espectrómetro de masas posee también algunas ventajas con respecto a la tecnología de infrarrojos3,19. En primer lugar, su precisión es muy elevada, lo que exige la recogida de tan sólo una pequeña cantidad de aire espirado en tubos de reducido tamaño (10 ml); en contraste, el espectrofotómetro de infrarrojos precisa la obtención de un volumen de aire considerablemente mayor, por lo que se necesita utilizar bolsas en lugar de tubos. En segundo lugar, permite el procesamiento automatizado de un elevado número de muestras (más de 200, esto es, más de 100 pacientes al día), lo que lo hace ideal para grandes centros sanitarios, típicamente de referencia, donde se realicen numerosas pruebas del aliento; sin embargo, el espectrofotómetro de infrarrojos sólo permite el procesamiento de un número muy limitado de muestras. Por último, el pequeño tamaño de los tubos del espectrómetro de masas en los que se recoge el aire espirado facilita el almacenamiento de las muestras y su envío a otros centros, lo que permite que el equipo esté disponible únicamente en algunos centros de referencia, abaratándose con ello los costes considerablemente3.
¿Es preciso el ayuno previo a la PAU?
La mayoría de los protocolos recomiendan realizar la PAU tras un período de ayuno de, al menos, 4 h. Esta recomendación se basa en la suposición de que la «comida de prueba» que generalmente se utiliza para retrasar el vaciamiento gástrico será menos efectiva si no se ha mantenido un período de ayunas previo. Además, se ha sugerido que la presencia de comida en el estómago puede contribuir a que la variabilidad de la excreción de 13CO2 sea mayor.
Algunos autores sugieren que la ausencia del ayuno se asocia con falsos negativos de la PAU en los pacientes infectados y, al mismo tiempo, con falsos positivos en aquellos que no sufren la infección21,22. En este sentido, Mana et al23 realizaron dos pruebas sucesivas, con y sin ayuno, a un grupo de voluntarios sanos; la concordancia entre los dos protocolos fue perfecta respecto a los casos H. pylori-positivos, pero un 33% de los pacientes H. pylori-negativos en condiciones de ayuno fueron considerados erróneamente infectados, al realizar el test tras la ingesta alimentaria.
No obstante, la diferencia entre los valores * (con los que se cuantifica el resultado de la prueba) en condiciones de ayuno o sin restricciones de dieta ha sido muy reducida en algunos estudios23,24 o incluso inexistente en otros25. Así, algunos autores han demostrado que la eliminación del requisito del ayuno no reduce la exactitud diagnóstica de la PAU, haciendo la prueba más fácil y cómoda para el paciente24-30. Incluso, alguno de estos autores ha demostrado la equivalencia de ambos protocolos, con y sin ayuno, en el mismo grupo de pacientes24,27,28.
En resumen, la necesidad del ayuno previo a la PAU continúa representando un capítulo debatido. Por tanto, aunque es probable que este aspecto metodológico no sea esencial para efectuar la prueba, parece prudente la realización de la PAU en ayunas (lo que en la práctica no supone un gran trastorno para el paciente) hasta que nuevos datos clarifiquen definitivamente la cuestión.
¿Es necesaria una «comida de prueba»29,30? ¿Cuál es la mejor?
Se han empleado distintas «comidas de prueba» con la intención de mejorar los resultados de la PAU, pues se ha sugerido que la administración de urea sin dicho preparado previo daría lugar al vaciamiento del sustrato antes de que pudiera producirse la suficiente interacción con H. pylori, con el consiguiente riesgo de resultados falsos negativos3. La solución de ácido cítrico es, en la actualidad, una de las más utilizadas, y se ha descrito que gracias a su empleo se obtienen unas concentraciones máximas de 13CO2 en aliento más elevadas y precoces31-37. En consecuencia, se ha sugerido que la administración de ácido cítrico incrementaría el poder de discriminación entre los valores positivos y negativos de la PAU.
El grupo alemán de Malfertheiner et al fue el primero en describir y optimizar el protocolo de la PAU en el que se administraba la urea 10 min después de la ingestión de una solución de ácido cítrico38. Posteriormente, este mismo grupo demostró que este protocolo podía simplificarse, sin perder exactitud diagnóstica, al administrar la urea disuelta en la propia solución de ácido cítrico38,39. Esta modificación hace posible preparar el volumen total de la solución (urea disuelta en ácido cítrico) que se requiere para todos los pacientes en los que se llevará a cabo la PAU durante un día o incluso varias semanas38.
Además del ácido cítrico, el zumo de naranja también se ha evaluado como «comida de prueba»34,40-43, aunque las comparaciones directas entre ambas alternativas son excepcionales34,41. En uno de estos estudios comparativos se demostró que ambas «comidas de prueba» eran igualmente efectivas41. Sin embargo, en un reciente estudio se concluye que el ácido cítrico se asocia con mejores resultados que el zumo de naranja en el diagnóstico de la infección por H. pylori34. Así, cuando se empleó ácido cítrico se alcanzó una sensibilidad del 100%, mientras que ésta fue del 88% cuando se administró zumo de naranja. Estas diferencias son atribuidas a una menor recuperación de 13CO2 cuando se emplea zumo de naranja en lugar de ácido cítrico34. Por último, el zumo de piña parece asociarse con resultados insatisfactorios, con una exactitud diagnóstica menor del 90%44.
No obstante, es preciso señalar que algunos autores han obtenido también resultados esperanzadores sin emplear ácido cítrico (u otra «comida de prueba»)25,28,37,45-51, aunque alguno de estos estudios únicamente ha incluido pacientes que no habían recibido tratamiento erradicador37 o un número muy reducido de éstos postratamiento49,50. En este sentido, la exactitud diagnóstica de la PAU debe evaluarse y confirmarse no sólo antes de recibir tratamiento sino también tras la administración de antibióticos para H. pylori, situación en la que, a pesar de la persistencia de la infección, la densidad de microorganismos en la mucosa gástrica es menor. De este modo, Menegatti et al52 han demostrado que la sensibilidad de la PAU con ácido cítrico para el diagnóstico de la infección por H. pylori tras el tratamiento erradicador es del 100%, mientras que esta cifra desciende hasta el 80% cuando se prescinde del ácido cítrico.
En resumen, a la espera de más estudios que clarifiquen definitivamente el tema, probablemente deba seguir empleándose una «comida de prueba» (especialmente una solución de ácido cítrico) en el protocolo de la PAU. Aunque es posible que el beneficio de administrar esta «comida de prueba» se restrinja a unos pocos casos concretos, la simplicidad, la buena tolerancia y el reducido coste del ácido cítrico probablemente hagan recomendable su empleo sistemático en la práctica clínica.
¿Qué dosis de urea debe administrarse?
La dosis precisa de urea no está claramente establecida, y ésta ha disminuido progresivamente con el paso del tiempo. Mientras las primeras pruebas se realizaron con 350 mg de urea53, posteriormente se han empleado con éxito 125 o 100 mg. Más recientemente se ha sugerido que 75 mg serían suficientes para obtener unos buenos resultados, ésta es la dosis de urea más utilizada en la actualidad3. Por último, diversos estudios han confirmado que incluso 50 mg de urea podrían permitir obtener una excelente exactitud diangóstica41,50,54-57.
La flora orofaríngea productora de ureasa puede, en teoría, causar falsos positivos de la PAU. Para obviar este problema, algunos investigadores han encapsulado la urea o han administrado el sustrato en forma de tabletas35,41,56,58. Con esta forma de administración se han descrito excelentes resultados al emplear únicamente 50 mg de urea41,50,56,57 o incluso 38 mg de este sustrato58. Puesto que la excreción endógena de CO2 es menor en niños que en adultos, probablemente se requiere una dosis menor de urea en los primeros. Así, se ha demostrado que 50 mg de urea son más que suficientes para obtener excelentes resultados en la edad pediátrica59-63.
¿Cuándo tiempo después de ingerir la urea deben obtenerse las muestras de aliento?
Las muestras de aliento recogidas demasiado tarde pueden ser responsables de resultados falsos negativos, debido al vaciamiento de la urea del estómago3. Contrariamente, se ha constatado que los protocolos que recogen las muestras de aire espirado demasiado pronto (a los 5 o 10 min) pueden tener una menor especificidad (esto es, más falsos positivos), debido a la interferencia de los organismos productores de ureasa localizados en la cavidad oral12,62. Por ello, clásicamente ha existido acuerdo en la recogida de 2 muestras del aliento, una basal y la otra entre 20 y 30 min después de la ingestión de urea. No obstante, el problema de la interferencia de la flora orofaríngea podría obviarse con el empleo de la urea en forma de cápsulas o tabletas en lugar de su formulación líquida habitual, con lo que la PAU podría realizarse tan sólo 10 min después de haber ingerido la urea35,41,56.
La elección del momento ideal para la recogida de las muestras de aliento depende del tiempo necesario para que se produzca la hidrólisis de la 13C-urea tras el contacto con la ureasa de H. pylori. Como se ha mencionado previamente, la solución de ácido cítrico induce un incremento más rápido del CO2 marcado en el aliento31-36, lo que sugiere que una toma de aliento a los 10-15 min podría ser apropiada32. Además, el ácido cítrico ha demostrado ser capaz de disminuir la interacción de la ureasa oral a través de la inducción de la producción de saliva33.
En resumen, cuando la PAU se lleva a cabo siguiendo el protocolo más ampliamente utilizado (esto es, con ácido cítrico y 75 mg de urea), la exactitud diagnóstica es excelente cuando las muestras de aliento se recogen tan pronto como a los 10-15 min tras haber ingerido la urea, lo que indica que probablemente es innecesario esperar hasta los tradicionales 30 min.
¿Cuál es el punto de corte más adecuado para discriminar entre pacientes H. pylori positivos y negativos?
La elección precisa del punto de corte para definir si la PAU es positiva o negativa representa un aspecto crítico y notablemente controvertido. El punto de corte se ha localizado clásicamente en 5 unidades *64. Más recientemente, diversos autores han evidenciado que dicha cifra puede reducirse hasta 3,0 o 3,5 sin comprometer la sensibilidad y la especificidad de la PAU, e incluso mejorando su eficacia diagóstica3. Por último, algunos investigadores han sugerido, incluso, la utilización de puntos de corte inferiores a los señalados, en torno a 2,5 unidades *, aunque en general han empleado dosis inferiores de urea (la dosis de urea probablemente determina, a su vez, el punto de corte más adecuado)3.
Algunos autores han recomendado establecer una zona «gris» en la que los resultados serían considerados como no concluyentes3. La amplitud de esta zona indeterminada varía según los estudios, pero generalmente incluye valores entre 2,0 y 5,0, o incluso entre 2,5 y 3,5. Afortunadamente, sólo una mínima proporción de los pacientes (aproximadamente el 1-2%) se encuentran en esta zona «gris»3, lo que indica que cuando la PAU es positiva los valores * habitualmente se encuentran muy por encima del punto de corte; en el sentido contrario, los valores * de los pacientes no infectados se sitúan generalmente en cifras cercanas a cero y, por tanto, alejadas también del punto de corte. Estos hallazgos sugieren que los valores del test cercanos al punto de corte deberían interpretarse con cautela y confirmarse con una nueva PAU o con otros métodos diagnósticos.
El punto de corte seleccionado puede depender de la dosis de urea utilizada, de modo que el empleo de dosis menores de substrato se debe acompañar de una disminución del punto de corte44,65. Así, la mayoría de los protocolos que han administrado 75 mg de urea han empleado un punto de corte inferior al clásico 5,0 (generalmente, entre el 3,5 y el 5,0) y esta cifra se ha situado entre el 2,5 y el 3,5 en casi todos los protocolos que han administrado 50 mg de urea3. Además, la presentación de la urea, y no sólo su dosis, puede influir sobre el protocolo que se va a elegir, puesto que se ha sugerido que el punto de corte debería reducirse cuando se emplea el substrato en forma de tabletas35,66.
Finalmente, el punto de corte ideal puede también depender de que la PAU se realice antes o después de haber administrado tratamiento erradicador para H. pylori67. De este modo, la densidad gástrica de microorganismos parece ser menor (en comparación con la situación pretratamiento) en los pacientes en los que a pesar de haber recibido tratamiento erradicador continúan estando infectados. Así, la mayoría de los estudios pretratamiento han situado el punto de corte en el 4, aproximadamente, mientras que esta cifra se encuentra más cerca del 3 en aquellos estudios llevados a cabo en pacientes en los que se pretende confirmar la erradicación de H. pylori tras el tratamiento3.
En resumen, la selección de un punto de corte único e invariable para todos los casos no parece realista, pues hemos revisado cómo el valor más adecuado puede depender de múltiples factores, como la comida de prueba empleada, la dosis y la formulación de la urea, o el escenario clínico (pre o postratamiento) en el que se emplee la PAU. Afortunadamente, debido a que los resultados positivos y negativos de la PAU tienden a situarse fuera del rango comprendido entre el 2 y el 5, es esperable que los cambios del punto de corte dentro de este rango tengan un efecto muy limitado en la exactitud diagnóstica del test68.
PRUEBA DEL ALIENTO PARA LA VALORACIÓN DE LA FUNCIÓN HEPÁTICA
En general, las hepatopatías crónicas son característicamente progresivas, por lo que históricamente ha sido importante el desarrollo de un test dinámico que permita al clínico estimar la reserva funcional hepática y definir tanto un pronóstico funcional o vital como el momento más adecuado para iniciar una determinada acción terapéutica. En este sentido, se han diseñado numerosos métodos que tratan de valorar la función hepática mediante su correlación con diversas rutas metabólicas de predominio hepático; sin embargo, pese a su satisfactoria correlación en algunos casos y la sencillez e inocuidad del procedimiento, no han podido sustituir a la ya clásica estadificación clinicobiológica de Child-Pugh. No obstante, aún queda algún papel para este tipo de exploraciones, ya que además de confirmar los datos clinicobiológicos, gracias a la exploración íntima de la función hepática, son capaces de evaluar la actividad de unas rutas enzimáticas concretas y de determinar el impacto de diversas sustancias, farmacológias o tóxicas, sobre una ruta metabólica específica.
Prueba el aliento en la valoración de la actividad del citocromo P-450
Uno de los primeros tests diseñados para valorar la función hepática fue el de la aminopirina marcada con 13C, cuya demetilación a cargo del citocromo P-450 es fácilmente determinable, ya que, como el diazepam, la eritromicina o la cafeína, su metabolismo sólo depende de la actividad de este citocromo. Sin embargo, no se ha conseguido demostrar una adecuada correlación entre los hallazgos de este test y la función hepática determinada por el estadio de Child-Pugh69, además de que se han podido comprobar interacciones con diversos fármacos como el albendazol70, los anticonceptivos71 o incluso los inhibidores de la bomba de protones72.
Por el contrario, la cafeína marcada con 13C ha sido recientemente validada como indicador de la función hepática con una buena correlación con la escala de Child-Pugh, en un grupo de 65 individuos que incluyó controles sanos, pacientes con hepatitis crónica en estadio no cirrótico y pacientes cirróticos, aunque también se comprobó un incremento significativo de los valores plasmáticos en los pacientes fumadores, lo que podría falsear los resultados73.
Por otro lado, este tipo de test del aliento se ha empleado para determinar el fenotipo en el marco de estudios orientados a detectar posibles interacciones farmacológicas relacionadas con el citocromo P-450.
Prueba del aliento en la valoración de la actividad de enzimas citosólicas
Existen varias moléculas, cuyo metabolismo tiene lugar principalmente a escala citosólica hepática, que son susceptibles de ser administradas de forma oral o intravenosa para evaluar la función metabolizadora del hígado, que estará presumiblemente disminuida en la hepatopatía crónica.
Algunos aminoácidos esenciales se encuentran en este grupo; en concreto, la tirosina y la fenilalanina marcadas se han empleado en este sentido74,75, y recientemente se ha comprobado en un grupo de 47 pacientes, 37 de ellos con hepatopatía crónica por el virus de la hepatitis C, una estrecha correlación entre la excreción acumulada de
13C-fenilalanina a los 45 min y el grado histológico de fibrosis según el sistema METAVIR76.
Clásicamente se ha empleado la capacidad de eliminación de galactosa para medir la reserva funcional hepática, pero era necesaria la administración intravenosa del sustrato y repetidas extracciones de sangre. La prueba del aliento basada en el metabolismo de la galactosa marcada parece haber evitado estos inconvenientes, y podría tener un valor pronóstico y en la monitorización de la lesión hepática77, aunque haya que mantener ciertas reservas dada la importante variabilidad interindividual y la posible interacción con la hiperglucemia propia de los pacientes diabéticos mal controlados e incluso con algunos fármacos.
Prueba del aliento en la valoración de la actividad de las enzimas mitocondriales
Existen varias enfermedades hepáticas cuyo origen se encuentra en un defecto metabólico de las vías enzimáticas mitocondriales del hígado y cuyo sustrato histológico es la esteatosis microvesicular. Ello puede suceder en el contexto de la gestación, el síndrome de Reye o la toxicidad mediada por el ácido valproico o las tetraciclinas. Incluso el enolismo induce una disfunción mitocondrial que es la base de la esteatosis que se observa en este tipo de pacientes.
Se han desarrollado diferentes pruebas del aliento que evalúan la actividad de diversas rutas enzimáticas mitocondriales78. Así, el ácido cetoisocaproico marcado con 13C ha servido para monitorizar esta función enzimática en alcohólicos, e incluso para distinguir los pacientes con esteatosis hepática de origen alcohólico de los de origen no alcohólico79. Por su parte, la 13C-metionina se ha utilizado con éxito para monitorizar la función hepática mitocondrial tanto en pacientes alcohólicos como en hepatópatas de otro origen80, o para monitorizar la función hepática en un caso de intoxicación aguda por ácido valproico81.
PRUEBA DEL ALIENTO PARA LA VALORACIÓN DE LA FUNCIÓN PANCREÁTICA
La función exocrina pancreática, pilar fundamental de la digestión de los nutrientes, se ha evaluado de forma clásica mediante diversas pruebas funcionales. De entre ellas, la prueba de la secretina o la ceruleína, junto con el test de Van de Kamer, siguen siendo el patrón oro, aunque su sensibilidad sea escasa o se trate de exploraciones metodológicamente complicadas de llevar a cabo. Así, se han desarrollado varios test del aliento basados en la administración de diferentes sustratos de enzimas pancreáticas que valoran la función de distintas fases de este proceso de digestión y absorción, fundamentalmente lipídica, y que han cobrado especial importancia clínica a la hora de valorar pacientes con fibrosis quística o pancreatitis crónica que precisan suplementos orales de enzimas pancreáticas, así como en neonatos en los que la función lipolítica puede ser aún inmadura.
En este sentido, estudios recientes han comprobado la utilidad de la prueba del aliento tanto con trioleína marcada con 13C en pacientes adultos con fibrosis quística, con el objeto de monitorizar la malabsorción y ajustar las dosis de suplementos enzimáticos82, como la de la hioleína marcada, para evaluar la sensibilidad y la reproducibilidad en voluntarios sanos comparados con pacientes con pancreatitis crónica con y sin esteatorrea83. Por otro lado, una mezcla de triglicéridos marcados también se ha empleado clásicamente en la evaluación de la malabsorción tanto en casos de pancreatitis crónica84 como fibrosis quística85; sin embargo, este procedimiento presenta problemas metodológicos y de interpretación clínica que aún no se han solventado del todo, ofreciendo una sensibilidad y reproducibilidad más baja de lo que cabría esperar, pudiendo verse afectada por la edad, el ejercicio o la dieta86.
Otras aproximaciones a la función exocrina pancreática han sido menos prometedoras, ya que el resto de las enzimas, como la amilasa, se afecta de una manera menos llamativa en la insuficiencia pancreática. Así, la utilidad de otros test del aliento basados en las rutas enzimáticas de otros sustratos nutricionales como los carbohidratos no ha podido ser comprobada.
PRUEBA DEL ALIENTO Y SOBRECRECIMIENTO BACTERIANO
Un aumento en la cantidad o una variación en la calidad de la flora entérica de suficiente magnitud como para acompañarse de significación clínica (incomodidad abdominal, diarrea, malabsorción o déficit nutricionales) suele tener lugar en el seno de alguna enfermedad orgánica que favorezca el sobrecrecimiento bacteriano. Este tipo de circunstancia frecuentemente implica estasis, tanto como consecuencia de alteraciones anatómicas como de defectos motores en relación con neuro o miopatías congénitas, esclerodermia, diabetes, etc., sin olvidar que otras causas como la aclorhidria propia de la gastritis atrófica o del tratamiento con inhibidores de la bomba de protones facilitan el desarrollo de sobrecrecimiento bacteriano; la carencia de secreción biliar (hepatopatía crónica) o pancreática (pancreatitis crónica) podrían favorecer también este trastorno. Sin embargo, la demostración de la existencia de un sobrecrecimiento bacteriano en pacientes susceptibles de padecerlo ha sido tradicionalmente complicada desde el punto de vista técnico, ya que habitualmente requería la intubación intestinal, aspiración de contenido intestinal y su cultivo en diferentes medios. Además, los resultados son de difícil interpretación clínica, ya que el punto de corte en cuanto al número de colonias necesarias para el diagnóstico de sobrecrecimiento bacteriano ha estado debatido.
Hasta la fecha, se han ensayado diferentes pruebas del aliento para evitar estos procedimientos, encontrando en todos ellos problemas de sensibilidad y especificidad. Así, el test de la coliglicina marcada puede dar falsos positivos si los microorganismos no hidrolizan la amida unida a la molécula; tanto este test como el de la 13C-xilosa pueden falsearse por un tránsito rápido, y la prueba del aliento que detecta hidrógeno tras la administración de lactulosa es sensible sólo a microorganismos anaerobios, por lo que en algunos estudios se ha revelado como menos sensible que los anteriores87.
La inocuidad y la sencillez de la prueba del aliento la han hecho atractiva para el estudio del impacto que podría tener el sobrecrecimiento bacteriano en diversos escenarios clínicos. Así, ha servido para justificar los síntomas de dismotilidad que se dan en los pacientes intervenidos de obesidad mórbida mediante un bypass yeyunoileal88 o la malnutrición de los pacientes gastrectomizados en relación con las diferentes reconstrucciones quirúrgicas89. Además, recientemente se ha intentado atribuir al sobrecrecimiento bacteriano un papel en la génesis de los síntomas que se engloban en el cuadro que conocemos como síndrome del intestino irritable; este sobrecrecimiento se ha detectado mediante diferentes tests el aliento, habitualmente el de la lactulosa, en un alto porcentaje de los pacientes con este síndrome, y comprobado posteriormente cómo mejoran los síntomas al erradicar este sobrecrecimiento con antibioterapia90.
PRUEBA DEL ALIENTO Y MOTILIDAD GASTROINTESTINAL
La motilidad gastrointestinal se ha estudiado con propósitos fisiopatológicos, farmacológicos o incluso clínicos, y el tiempo de vaciamiento gástrico y el tiempo completo de tránsito orocecal han sido los aspectos que más atención han suscitado.
Dado que en principio no hay mecanismos enzimáticos en el intestino que permitan la digestión de un azúcar como la lactulosa, el sorbitol o la propia glucosa, éstos llegan intactos hasta el colon, donde son digeridos por la flora produciendo hidrógeno y metano, dos gases que convenientemente marcados pueden permitir estimar el tiempo de tránsito digestivo; en este sentido, un estudio reciente llevado a cabo en 551 pacientes con enfermedad inflamatoria intestinal sugiere que diferentes patrones en la proporción de hidrógeno y metano se correlacionarían con diferentes presentaciones clínicas, y que un predominio de la producción de metano estaría relacionado con la existencia de estreñimiento como síntoma predominante91. Sin embargo, estos procedimientos pueden presentar inconvenientes técnicos, ya que por sus propiedades osmóticas pueden acelerar precisamente el tránsito gastrointestinal; por este motivo es necesario emplear la menor dosis posible que permita mantener una correlación adecuada con el patrón oro, que hasta hoy son los métodos escintigráficos, o bien utilizar una prueba del aliento alternativa. Recientemente se ha propuesto una prueba del aliento basada en la inulina con hidrógeno marcado, que no presenta los inconvenientes del test de la lactulosa y sí tiene aparentemente una buena correlación con los métodos más clásicos92. Otro trabajo reciente propone que la combinación de un test del aliento con hidrógeno marcado, como el de la lactulosa, con otro basado en el 13C-acetato podría aumentar la eficacia de estos procedimientos para la detección de alteraciones motoras digestivas93.
Hoy sabemos que existen muy diversas circunstancias que modifican el tiempo de tránsito orocecal, como algunas bebidas alcohólicas o la pimienta, además de numerosas enfermedades en las que puede verse afectado, como la disfunción tiroidea, el embarazo, la hepatopatía crónica, el esprúe celíaco, la enfermedad de Crohn, la diabetes mellitus o la anorexia nerviosa. En estos casos un método sencillo y no invasivo, como el test del aliento, puede cobrar importancia clínica. Así, se ha empleado para detectar retardos en el tiempo de tránsito orocecal secundarios a estenosis en el seno de la enfermedad de Crohn; más aún, se ha podido relacionar este tiempo de tránsito orocecal con las diversas localizaciones de la enfermedad, estando más alargado en los casos de afectación ileal o ileocolónica, lo que podría ser útil a la hora de diseñar una estrategia terapéutica basada en tratamientos de liberación retardada94.
Finalmente, el tiempo de vaciamiento gástrico representa también un importante capítulo en el estudio de la motilidad gastrointestinal, con implicaciones fisiopatológicas y clínicas. Una vez más, los métodos escintigráficos que se utilizan para su evaluación son complicados e incómodos, por lo que se han desarrollado varias pruebas del aliento que alcanzan una buena correlación con los métodos clásicos de forma más cómoda y sencilla. Así, el empleo de ácido octanoico marcado con 13C ha sido validado adecuadamente, incluso comparativamente con la ultrasonografía abdominal en tiempo real95, por lo que resulta un método más reproducible y menos «operador dependiente»; de hecho, se ha empleado recientemente con éxito en estudios con interés fisiopatológico, como los que han tratado de determinar la influencia de la cantidad o el comienzo de la ingesta en el vaciamiento gástrico, pero también en otros con interés clínico en diferentes circunstancias, como en los pacientes nefrópatas habitualmente en programa de diálisis, diabéticos o, fundamentalmente, pacientes con síntomas englobables dentro del cuadro de síndrome del intestino irritable o dispepsia. En estos últimos se ha centrado buena parte de la atención de los estudios más recientes, y se ha demostrado retrasos en el vaciamiento gástrico de algunos pacientes dispépticos. En este sentido, un reciente estudio llevado a cabo en un total de 722 de estos pacientes encontró que un 23% de los casos tendrían alargado el tiempo de vaciamiento gástrico para sólidos y un 35% lo tendrían para líquidos, lo que podría estar además en relación con las diferentes manifestaciones clínicas del cuadro96. Por último, esta prueba del aliento también ha permitido demostrar que en niños con esprúe celíaco se encuentra alterado el tiempo de vaciamiento gástrico y que éste se normaliza tras realizar una dieta sin gluten97.
Más recientemente se ha propuesto otra prueba del aliento para valorar el tiempo de vaciamiento gástrico basada en el acetato marcado con 13C, cuya fiabilidad y metodología han sido validadas98.
PRUEBA DEL ALIENTO EN LA VALORACIÓN DE LA MALABSORCIÓN DE HIDRATOS DE CARBONO
Diversas pruebas del aliento se han empleado para la valoración de la digestión y el metabolismo de diferentes carbohidratos; en la literatura médica se puede encontrar estudios que emplean como sustrato la glucosa, galactosa, fructosa o lactosa. De todos ellos, por su prevalencia y su posible papel en la génesis de algunas afecciones, el estudio más importante es el que valora la malabsorción de la lactosa o, lo que es lo mismo, la actividad de la lactasa, enzima propia de las vellosidades intestinales cuya actividad se pierde a lo largo de la vida en un importante porcentaje de individuos europeos; en ellos, la actividad reducida de esta enzima puede dar lugar a diversos síntomas tras la ingesta de leche, lo que constituye el cuadro denominado intolerancia a la lactosa. Por otra parte, la actividad de esta enzima puede emplearse como marcador de la integridad de la mucosa del intestino delgado, que puede afectarse en diferentes situaciones, como la enfermedad celíaca.
Una vez más, a pesar de que el patrón oro es la cuantificación de la actividad enzimática en biopsias de intestino delgado, el coste y la incomodidad de este procedimiento han dado paso al desarrollo de pruebas del aliento específicas. Aunque se ha empleado una prueba del aliento basada en la lactosa, tanto con hidrógeno como con carbono marcado para estimar la actividad de la lactasa intestinal, existen varios problemas técnicos que limitan la sensibilidad y la especificidad de cualquier test del aliento basado en la lactosa: el ejercicio puede aumentar la oxidación de la glucosa y la dosis a emplear está en debate, ya que dosis altas podrían sobreestimar la prevalencia de malabsorción. De hecho, un reciente estudio español en 67 pacientes ha propuesto la homogeneización del test del aliento con hidrógeno a 3 h con altas dosis de lactosa, alcanzando buenos resultados99. Así, se ha propuesto un método combinado consistente en la detección de hidrógeno además de la de 13C durante el mismo test del aliento con la intención de aumentar su sensibilidad y especificidad100.