INTRODUCCIÓN
El diagnóstico y el tratamiento del cáncer de recto es uno de los paradigmas de colaboración multidisciplinaria en el que participan digestólogos, oncólogos, radioterapeutas, patólogos y cirujanos. El objetivo final de esta participación integrada es conseguir erradicar la enfermedad con el mejor resultado clínico posible. Durante las últimas 2 décadas los cirujanos han tratado de predecir y evaluar los resultados de la cirugía, así como establecer unos niveles mínimos de calidad exigibles. No hay, sin embargo, una medida absoluta de la calidad asistencial en la práctica quirúrgica1. Donabedian propuso la ya clásica tríada para medir o evaluar la calidad en la actividad asistencial: estructura, proceso y resultados2. La estructura se refiere a los medios materiales y humanos así como a la propia infraestructura organizativa de la institución sanitaria. El proceso surge de la interacción entre los médicos y el paciente e incluye toda la secuencia de hechos que conducen a la decisión terapéutica final y a su realización. En este proceso, hemos de considerar 3 fases distintas: preoperatoria, intraoperatoria y postoperatoria. Determinadas intervenciones sobre cada una de estas fases, como por ejemplo una evaluación preoperatoria adecuada de la función cardiopulmonar de los pacientes o un diagnóstico temprano de las complicaciones postoperatorias, pueden tener un impacto positivo sobre los resultados finales. Estos resultados reflejan el estado de salud final del paciente consecuencia de la estructura y el proceso utilizados para aplicar una determinada opción terapéutica.
Los resultados en cirugía del cáncer de recto, al igual que en muchas otras áreas quirúrgicas, han sido clásicamente medidos mediante indicadores como la morbilidad, la mortalidad y la estancia hospitalaria. Sin embargo, estos indicadores no permiten una adecuada evaluación de la calidad asistencial puesto que no tienen en cuenta el estado de salud final del paciente o su capacidad funcional. En los últimos años el interés de los cirujanos ha ampliado los parámetros que valoran la calidad asistencial y se han incluido otros como la incidencia de recidivas tumorales, los resultados funcionales de la técnica quirúrgica, la calidad de vida y el coste del proceso asistencial.
En este artículo revisaremos el planteamiento diagnóstico y terapéutico integrado del cáncer de recto y los parámetros que en la actualidad son utilizados para predecir y evaluar los resultados de la cirugía así como los niveles de calidad exigibles.
ESTUDIO DE EXTENSIÓN DEL CÁNCER DE RECTO
Un diagnóstico de extensión preciso es fundamental para poder indicar el tratamiento neoadyuvante y planear la cirugía en pacientes con cáncer de recto3. La ecografía endorrectal es la técnica de elección para valorar la profundidad de la infiltración de la neoplasia y la presencia de adenopatías afectadas con una precisión superior al 90% para el estadio T y superior al 80% para el estadio N, mejorando la precisión diagnóstica de la tomografía computarizada (TC)4. La ecografía endorrectal con dispositivos rígidos permite el examen de los 12 cm distales del recto con una clara definición de las diferentes capas de la pared rectal. En un metaanálisis de Solomon y McLeod5 en el que se analizaron 11 estudios las sensibilidades fueron del 84, el 76, el 96 y el 76% en pacientes con estadios T1 a T4, respectivamente. Las neoplasias T2 son las que con una mayor frecuencia son diagnosticadas en un estadio superior al anatomopatológico, probablemente debido a cambios inflamatorios alrededor del tumor que resultan indistinguibles de infiltración tumoral. Por otra parte, la infraestadificación se debe a una baja resolución, lo que limita la detección de infiltración microscópica. La precisión del estudio de extensión local depende, asimismo, del nivel en el que se encuentre el tumor; los errores más frecuentes se producen en el recto inferior (16,7%) en comparación con el recto medio y superior (6,3%)6,7.
La principal limitación de la ecografía endorrectal está en la estadificación de los tumores que infiltran extensamente la grasa perirrectal e incluso órganos adyacentes. En estos casos, la TC y, especialmente, la resonancia magnética (RM) son una buena alternativa capaz de valorar con precisión la afección extrarrectal. La precisión total de la RN en la estadificación del cáncer de recto utilizando dispositivos metálicos endoanales asciende a un 95% y en el diagnóstico de enfermedad ganglionar desde un 40 a un 95%8. El dispositivo metálico endoanal aumenta la resolución en la pared rectal y, como ocurre con la endosonografía, puede definir la profundidad de la invasión tumoral, lo que contribuye a incrementar la precisión de la estadificación tumoral que puede ascender hasta el 90%9,10. Aunque la RM es menos precisa que la ecografía endorrectal en la estadificación tumoral y ganglionar, es la mejor prueba diagnóstica para detectar infiltración tumoral profunda y afección de la fascia mesorrectal11.
TRATAMIENTO MULTIMODAL DEL CÁNCER DE RECTO
Hasta hace unos años, el planteamiento terapéutico en los pacientes con cáncer de recto parecía claro y definitivo. El tratamiento aceptado era la resección convencional del recto seguida de radioterapia y quimioterapia adyuvante en caso de que el estudio histopatológico confirmase la presencia de invasión transmural o ganglios linfáticos positivos12. Sin embargo, durante la última década, el tratamiento de estos pacientes se ha hecho más complejo como consecuencia de la multiplicación de opciones terapéuticas así como de la elección de las mismas en función no sólo de las características sino también de las preferencias de cada paciente. Así, el papel de la resección local, la necesidad de radioterapia en los casos en los que es posible realizar una cirugía óptima, la dosis ideal de radioterapia y el momento en que ésta es administrada son algunos de los aspectos todavía debatidos. La tendencia actual es hacia el perfeccionamiento de cada una de las formas de tratamiento, es decir, perfeccionamiento de la técnica quirúrgica y optimización del tratamiento con radioterapia y quimioterapia13.
Indicaciones de la quimiorradioterapia
El objetivo principal de la radioterapia asociada a la cirugía es prevenir las recidivas locales y, en segundo lugar, aumentar la supervivencia. En la conferencia de consenso de los National Institutes of Health de 1990 se recomendó el tratamiento postoperatorio combinado de quimioterapia y radioterapia en pacientes con cáncer de recto en estadios II y III12. Estas recomendaciones estaban basadas en varios estudios en los que el tratamiento adyuvante combinado mejoraba de forma significativa el control local y la supervivencia14,15. En ocasiones, las indicaciones del tratamiento adyuvante pueden estar condicionadas por la calidad de la cirugía como, por ejemplo, en pacientes con afección microscópica del margen de resección o en aquellos en los que se ha producido la perforación del tumor durante la intervención quirúrgica16.
En los últimos años, varios estudios han demostrado que el tratamiento neoadyuvante con radioterapia, combinado o no con quimioterapia, no sólo disminuye el porcentaje de recidivas locales y mejora la supervivencia17,18, sino que también disminuye el tamaño tumoral facilitando la resección de neoplasias T4 en las que inicialmente no es posible practicar una cirugía radical19. Otras ventajas teóricas de la quimiorradioterapia preoperatoria sobre el tratamiento postoperatorio son la posibilidad de preservar el esfínter en tumores del recto inferior, la disminución del riesgo de diseminación de células tumorales por la manipulación quirúrgica y una menor toxicidad20. Los resultados definitivos del único estudio aleatorizado en el que se compara el tratamiento neoadyuvante con el tratamiento adyuvante han demostrado que la quimiorradioterapia preoperatoria mejora el control local con una menor toxicidad aunque no se observaron diferencias en la supervivencia21. Actualmente, la práctica habitual en la mayoría de los centros es administrar quimiorradioterapia preoperatoria en pacientes con cáncer de recto en los que el estudio de extensión demuestra una infiltración del mesorrecto y/o ganglios aumentados de tamaño en su espesor sospechosos de estar afectados.
Principios básicos en la cirugía del cáncer de recto: exéresis total del mesorrecto
El mesorrecto está constituido por tejido graso que contiene estructuras linfáticas, vasculares y nerviosas, y que rodea al recto de forma circunferencial, empezando a nivel del promontorio sacro. La importancia del mesorrecto en pacientes con cáncer de recto se debe a que puede estar afectado por la neoplasia, ya sea mediante extensión directa, infiltración de los ganglios linfáticos o en forma de depósitos aislados alejados del tumor primario22,23. El objetivo principal del tratamiento quirúrgico es la escisión radical con intención curativa minimizando el riesgo de diseminación ya sea por perforación inadvertida del recto, ya sea por transección del tumor durante la cirugía. La resección amplia a través de los planos anatómicos es la técnica de elección que incluye la disección del espacio presacro mediante visualización directa, preservación de la integridad de la fascia mesorrectal y la exéresis total del mesorrecto (ETM), especialmente en los tumores del tercio medio e inferior16. Asimismo, la disección cuidadosa por planos permite preservar los nervios autónomos de la pelvis y las funciones genitourinarias24.
El margen proximal debería estar al menos a 5 cm mientras que el margen distal ideal debe ser de unos 2 cm como mínimo desde el borde del tumor. Sin embargo, en tumores del recto inferior, un margen distal de 1 cm es aceptable16. Esta recomendación está basada en varios estudios en los que se ha observado que la extensión distal intramural se extiende más allá de 1 cm en menos de un 10% de los cánceres de recto y que, en estos casos, el pronóstico es muy pobre independientemente de la longitud del margen distal25,26. La importancia de obtener un margen circunferencial libre de tumor se apoya en el hecho de que la afectación de este margen se correlaciona con un mayor riesgo de recurrencia27 y por la evidencia de que la mayoría de las recidivas locales son extrarrectales y no anastomóticas.
La perforación inadvertida del recto durante la cirugía ocurre entre un 8 y un 26% de los casos y se asocia a un aumento de la recidiva local y una disminución de la supervivencia a los 5 años28. En caso de existir perforación debe ser registrado en la hoja operatoria y en el informe anatomopatológico así como tenido en cuenta en la selección de los pacientes para radioterapia adyuvante.
Aproximadamente un 15% de las neoplasias de recto primarias están adheridas a órganos adyacentes, y en un 50% de éstas se demuestra infiltración tumoral en el estudio histopatológico. El tratamiento quirúrgico ideal de estos tumores es la resección en bloque. La sección del tumor por la zona de la adherencia no debe considerarse una resección completa, aumenta el porcentaje de recurrencia local y disminuye la supervivencia16.
En relación con la ligadura proximal del pedículo linfovascular, ésta debería ser inmediatamente distal al origen de la arteria cólica izquierda. No hay evidencia de que la ligadura de la arteria mesentérica inferior en su origen tenga un beneficio oncológico. De la misma manera, tampoco hay evidencias que apoyen la realización de una linfadenectomía extensa en pacientes sin ganglios linfáticos sospechosos de estar afectados16.
El valor de la ETM no ha sido demostrado de forma rigurosa y, probablemente, nunca llegue a realizarse un estudio prospectivo y aleatorizado. Sin embargo, algunos estudios de cohortes y de casos y controles han demostrado que es una técnica que puede implementarse en pocos años, y que permite reducir la recidiva local por debajo del 10%29-31. Recientemente, algunos centros han publicado las primeras series de pacientes a los que se les ha practicado una ETM mediante cirugía mínimamente invasiva32,33. Estos trabajos han demostrado que es posible realizar la ETM por laparoscopia siguiendo principios de cirugía oncológica, aunque será necesario esperar a la realización de estudios controlados con seguimiento a largo plazo antes de poder recomendar su utilización.
FACTORES PRONÓSTICOS Y RESULTADOS EXIGIBLES EN LA CIRUGÍA DEL CÁNCER DE RECTO
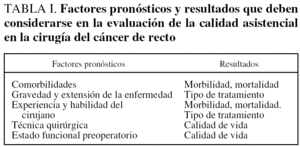
Durante muchos años se ha considerado que las comorbilidades del paciente y las variables relacionadas con la gravedad de la enfermedad eran los factores capaces de predecir el resultado de la cirugía del cáncer de recto34. Estos resultados han sido clásicamente medidos mediante la mortalidad, la morbilidad y la curación o el control de la enfermedad. Según los parámetros tradicionales la salud del paciente predecía el riesgo de complicaciones y de muerte, y la gravedad y la extensión de la enfermedad predecían la necesidad de la cirugía y la probabilidad de un resultado satisfactorio. Sin embargo, durante las últimas 2 décadas, se han incorporado nuevas variables tanto como factores pronósticos como en la evaluación de los resultados de la cirugía. Entre los nuevos factores pronósticos hay que incluir la experiencia del cirujano y el estado funcional preoperatorio del paciente. Por otra parte, la evaluación de los resultados de la cirugía debe incluir, además de los parámetros tradicionales, la supervivencia a largo plazo, el resultado funcional postoperatorio y la calidad de vida (tabla I)34. Aunque estos cambios en la evaluación de la calidad asistencial afectan a todas las áreas quirúrgicas son especialmente manifiestos en la cirugía del cáncer de recto.
El cirujano como factor pronóstico
Así como la afección del mesorrecto es un importante indicador de la gravedad de la enfermedad, la ETM es una importante variable técnica16. La influencia que la variabilidad en la técnica quirúrgica tiene sobre el resultado de la cirugía del cáncer de recto ha sido bien demostrada, especialmente en lo que se refiere a porcentajes de recurrencia local35. La técnica realizada por el cirujano adquiere, de esta forma, un importante valor pronóstico. La rotura de la fascia que envuelve el mesorrecto durante la intervención quirúrgica y su exéresis incompleta favorecen la diseminación local de células neoplásicas y la persistencia de enfermedad en la pelvis, especialmente en pacientes con tumores que infiltran extensamente la grasa perirrectal.
En esos casos, el riesgo de recidiva local aumenta de forma significativa al mismo tiempo que disminuye el tiempo libre de enfermedad. Por esa razón, dado que la ETM presenta una mayor dificultad técnica, especialmente en pacientes varones con una pelvis estrecha, algunos países europeos, como Alemania, Países Bajos, Suecia y Noruega, han introducido programas destinados a formar a grupos específicos de cirujanos en la técnica de la ETM. Estudios recientes han demostrado que la especialización de los cirujanos no sólo ha permitido reducir los porcentajes de recurrencia local del 40 al 10% sino también mejorar la supervivencia31,36,37. Estos resultados clínicos se relacionan directamente con el número de procedimientos que se realizan en una determinada institución sanitaria38. Sin embargo, el número de intervenciones realizadas y la competencia del cirujano no son suficientes para obtener los resultados deseados39. No debe ser infravalorado el hecho de que la calidad en cirugía depende de un proceso asistencial bien coordinado. Si la infraestructura organizativa es mediocre, el cirujano más competente obtendrá unos pobres resultados40.
Control de calidad de la técnica quirúrgica
La evaluación que el patólogo realiza de la pieza de resección, complemento de la valoración realizada por el cirujano durante la operación, proporciona una información muy útil sobre la calidad de la ETM y, por tanto, sobre la probabilidad de recurrencia local41. Esta valoración debe ser cuidadosa y estandarizada por lo que también es necesario el entrenamiento de patólogos especialmente dedicados al cáncer de recto42. La tinción con tinta china de los márgenes de resección, especialmente el margen radial o circunferencial, y la documentación fotográfica facilitan esta valoración. En un estudio sobre 478 pacientes intervenidos por cáncer de recto, 2 tercios de todas las recurrencias locales fueron anticipadas por la evidencia, quirúrgica o patológica, de una resección incompleta43.
La mayoría de las recidivas locales son extrarrectales (más que anastomóticas) y la ETM con márgenes radiales libres se asocia con porcentajes menores de recurrencia local44,45 lo que apoya la importancia de conseguir una resección completa del mesorrecto. La mayoría de los estudios consideran que el margen circunferencial está afectado cuando la distancia entre éste y el tumor es igual o inferior a 1 mm23. Sin embargo, algunos autores han propuesto recientemente que el límite debería establecerse en 2 mm. Así, en un estudio sobre 656 pacientes un margen igual o inferior a 2 mm se asoció con un riesgo de recurrencia local del 16% comparado con un 5,8% en pacientes con más de 2 mm de tejido mesorrectal alrededor del tumor46. Cuando se realiza la valoración de la técnica quirúrgica, es necesario tener en cuenta que la afectación del margen circunferencial tras realizar una resección completa del mesorrecto con intención curativa indica enfermedad avanzada, no cirugía inadecuada; en estos casos la muerte por enfermedad a distancia suele producirse antes que la recurrencia local16,47.
Por otra parte, estudios histopatológicos en los que se ha investigado con especial interés los depósitos tumorales en el mesorrecto indican que un margen mesorrectal distal al tumor de unos 4 cm es suficiente48. Por esta razón, se recomienda realizar una ETM en pacientes con tumores localizados en el tercio medio o inferior, mientras que en el caso de los tumores localizados en el tercio superior del recto una resección anterior con sección del recto 4-5 cm por debajo del tumor es suficiente.
De la amputación abdominoperineal a la cirugía con preservación de esfínteres
Al igual que en otras áreas de la cirugía, el énfasis en la cirugía del cáncer de recto se ha puesto durante los últimos años en la calidad de vida, especialmente en la preservación de la continuidad intestinal y en el estado funcional postoperatorio. En este sentido es posible ofrecer a la mayoría de los pacientes varias opciones en las que se preservan los esfínteres como la resección local y, especialmente, la resección anterior baja con anastomosis colorrectal o coloanal.
La resección local tiene un papel limitado en el tratamiento del cáncer de recto. Aunque afecta mínimamente a la función de reservorio del recto y evita la necesidad de un estoma, se asocia con porcentajes muy elevados de recidiva local ya que no se practica la exéresis del mesorrecto que puede tener ganglios linfáticos afectados por el tumor. Aproximadamente, un 5% de los pacientes con cáncer de recto limitado a la submucosa (T1) y un 20% de los pacientes con un cáncer de recto limitado a la capa muscular (T2) tienen ganglios positivos49,50, lo que explica que en estos tumores la recurrencia local después de una resección endoanal alcance hasta el 28% en algunas series51. En la actualidad la resección local se recomienda en lesiones en las que la ecografía determina un nivel de invasión uT1, completamente resecadas, bien diferenciadas y sin infiltración vascular ni linfática. La resección local también puede ser considerada en lesiones en estadios más avanzados en pacientes de edad avanzada y con comorbilidades que limiten sus expectativas de vida combinada con radioterapia postoperatoria52.
La introducción de nuevas técnicas para realizar anastomosis coloanales y la aceptación general de los dispositivos para suturas mecánicas, incrementaron los procedimientos con preservación de esfínteres en pacientes con cáncer de recto medio y bajo hace ya veinte años. Esta tendencia ha continuado durante la última decada y actualmente la amputación abdominoperineal se realiza en un número limitado de casos53. En un reciente estudio sobre 7.257 pacientes con cáncer de recto en estadio I-III operados en California entre los años 1994 y 1997, se realizó una colostomía definitiva en el 33%38. La probabilidad de que al paciente se le practicase una colostomía definitiva aumentó de forma estadísticamente significativa a medida que el número de intervenciones practicadas en los hospitales disminuía: en los centros con un menor volumen los pacientes con cáncer de recto tenían un incremento del 7% del riesgo absoluto de que se les practicara una colostomía definitiva. En conjunto, podemos establecer como estándar de calidad un porcentaje entre el 30 y 35% de amputaciones abdominoperineales en pacientes con cáncer de recto31,37,54.
Varias razones podrían explicar el incremento en la cirugía con preservación de esfínteres: en primer lugar, actualmente está aceptado que, en tumores del recto distal (a menos de 5 cm del margen anal), una distancia de resección de 1 cm del tumor es oncológicamente segura16; en segundo lugar, el tratamiento neoadyuvante facilita la resección de tumores extensos y las subsecuentes anastomosis55, y en tercer lugar, la resección anterior de recto no sólo trata con tanta efectividad el cáncer de recto distal como la amputación abdominoperineal sino que incluso evita la necesidad de realizar un estoma permanente.
Morbilidad y mortalidad
La dehiscencia anastomótica después de una resección anterior de recto es la complicación más grave y se asocia a una morbilidad y mortalidad elevadas. La presentación clínica puede variar desde un absceso pélvico localizado hasta una peritonitis difusa grave. Esta complicación ocurre entre un 3 y un 20% de los casos, y el factor de riesgo más importante es la altura de la anastomosis56,57. La anastomosis colorrectal baja y la anastomosis coloanal después de una ETM se asocian con un mayor riesgo de dehiscencia anastomótica en comparación con las anastomosis altas. El sexo masculino y la ausencia de un estoma de protección son otros posibles factores de riesgo de la dehiscencia de sutura. En conjunto, la tasa global de dehiscencias debe ser inferior al 15%, considerando las series de los grupos con una mayor experiencia36,45,58-60.
Por otra parte, los estomas derivativos o de protección también pueden presentar complicaciones como la retracción, el prolapso, el débito elevado y la dermatitis, que contribuyen a aumentar la morbilidad después de una resección anterior baja. Por esta razón, es conveniente establecer su indicación de forma selectiva en pacientes con factores de riesgo como las anastomosis a < 6 cm, ser varón y siempre que ocurra algún problema técnico durante la intervención como la hemorragia importante, disecciones dificultosas, test de fuga con aire positivo o anillos de resección incompletos57,61. El tipo de estoma derivativo que debe ser utilizado es todavía objeto de controversia62. En 3 de 4 estudios controlados aleatorizados se ha recomendado el uso de una ileostomía en asa en comparación con la colostomía transversa en asa63-66. Sin embargo, todos esos estudios han sido realizados con un tamaño de muestra insuficiente. Aunque nosostros utilizamos la ileostomía derivativa en asa casi exclusivamente, el cirujano debe seleccionar aquel procedimiento con el que esté más familiarizado.
La tasa de mortalidad operatoria (30 días de postoperatorio) descrita en diversas series y que puede ser aceptada como estándar de calidad oscila entre el 2 y el 3%. Aunque algunos autores han observado que la dehiscencia anastomótica tiene un impacto directo sobre la mortalidad67, otros no han hallado esta relación37. Este hecho podría explicarse por la realización de estomas de protección de forma sistemática que disminuyen la gravedad de la dehiscencia anastomótica en caso de que ocurra esta complicación.
Aunque la morbilidad y la mortalidad son medidas objetivas de los resultados del tratamiento quirúrgico utilizadas para evaluar la calidad asistencial dentro de un mismo centro o entre instituciones distintas, para que sea auténticamente objetiva debe ser ajustada según los factores de riesgo de los pacientes. Las características de los pacientes asistidos pueden ser tan distintas entre centros que los resultados de los distintos indicadores de calidad no sean comparables si no se realizan estos ajustes. Recientemente, se han desarrollado varios sistemas de puntuación, entre los que destacan el CR-POSSUM y el de la Asociación de Coloproctología de Gran Bretaña e Irlanda (ACPGBI score) basados en una serie de variables como la edad, el sexo, el estado preoperatorio del paciente o las características de la intervención (electiva o urgente) que permiten predecir la morbilidad y mortalidad postoperatoria ajustada a las características de los pacientes68-70. Aunque con algunas limitaciones, estos sistemas de puntuación permiten monitorizar y comparar los resultados de la cirugía y la calidad asistencial entre distintos hospitales, por lo que su utilización es muy recomendable.
Resultados funcionales
Los factores pronósticos del resultado funcional incluyen el estado preoperatorio del paciente, específicamente el grado de continencia y la frecuencia de las deposiciones, así como el tratamiento con radioterapia. Entre los factores técnicos hay que incluir el tamaño del recto residual, en el caso de la resección anterior baja con anastomosis colorrectal, y la configuración de un reservorio colónico en «J», en el caso de las anastomosis coloanales.
Hasta en un 50% de los pacientes se produce un deterioro funcional tras la resección anterior baja71,72. El denominado síndrome de la resección anterior baja se caracteriza por un aumento del número de las deposiciones con fragmentación, urgencia de defecación y varios grados de incontinencia. La causa más importante es la reducción en la capacidad del reservorio rectal junto con una alteración en la función de los esfínteres57. El deterioro es mayor en pacientes con complicaciones postoperatorias en la anastomosis73,74, y en aquellos que han recibido radiación pélvica adyuvante75. El peor resultado funcional ha sido mostrado asimismo en un selecto grupo de pacientes con cáncer de recto extendido tanto primario como recurrente, sometidos a un tratamiento multimodal incluyendo resecciones pélvicas extensas y radioterapia intraoperatoria76.
Aunque estos síntomas normalmente mejoran varios meses tras la cirugía, la mitad de los pacientes sigue teniendo problemas un año después del procedimiento quirúrgico77, y al menos el 10% de los pacientes persiste con una función intestinal deteriorada por más tiempo que en algunos casos obliga a realizar una colostomía permanente75,78.
Con la intención de mejorar los resultados funcionales de la resección anterior baja, se describió por primera vez a finales de la década de los ochenta la realización de un reservorio colónico en «J» como sustituto del recto tras la resección rectal. Varios estudios aleatorizados han confirmado los buenos resultados iniciales con esta técnica en comparación con la anastomosis colorrectal baja o coloanal directa79-81. En conjunto, el reservorio colónico tiene una mayor capacidad de distensión y un mayor volumen que el colon en la anastomosis directa, disminuyendo la frecuencia de las deposiciones y, en muchos casos, mejorando la continencia. Estas ventajas son aparentes poco después de la cirugía y se mantienen durante más de un año, período después del que mejora el resultado funcional de la resección con anastomosis directa y se hace comparable al del reservorio. Dado que esta técnica quirúrgica no se asocia a una mayor morbilidad, es el procedimiento de elección para reconstruir el tránsito intestinal tras una resección anterior baja siempre que la anastomosis se realice con el ano o con un muñón rectal inferior a 4 cm57.
Al analizar los resultados funcionales, se debe considerar también las funciones sexual y urinaria. Si bien la exéresis del tumor es el principal objetivo en la cirugía del cáncer de recto, la preservación de los nervios autónomos de la pelvis es esencial para minimizar la afección de estas funciones y obtener unos buenos resultados. La introducción de la ETM con identificación y preservación de los nervios autónomos de la pelvis se asocia a una disminución por debajo del 10% de las alteraciones de la función urinaria secundarias a una vejiga neurógena82. La edad del paciente es el principal factor predictivo de disfunción sexual después de la cirugía; esta complicación es más frecuente en individuos mayores de 60 años. Aunque la incidencia de impotencia es elevada después de una amputación abdominoperineal (> 40%), el riesgo se reduce a la mitad después de una resección anterior con identificación de los nervios hipogástricos y plexos pelvianos83. Es necesario tener en cuenta que las funciones sexual y urinaria son complejas, y la situación basal de los pacientes puede ser muy diferente, lo que hace difícil su evaluación. La hipertrofia benigna de próstata o la incontinencia urinaria no son infrecuentes en la población. Por otra parte, la quimiorradioterapia preoperatoria puede asociarse por sí misma a alteraciones urinarias o a impotencia por diferentes mecanismos24.
Resultados oncológicos
Varios estudios han evaluado los resultados oncológicos de la resección anterior de recto y la anastomosis coloanal con o sin reservorio. La recurrencia local en estas series asciende del 4 al 18%, y la supervivencia a 5 años, desde el 70 al 80%. Estudios retrospectivos no controlados han demostrado que la amputación abdominoperineal no ofrece ninguna ventaja en términos de supervivencia o prevención de la recidiva local cuando se compara con la cirugía con preservación de esfínteres71,84-86.
La tasa de recidiva local varía según los estudios, la experiencia de los cirujanos y la utilización o no de tratamiento neoadyuvante. La introducción de la ETM realizada por cirujanos con experiencia ha permitido reducir el porcentaje de recidiva local por debajo del 10%, y éste debe ser el estándar de calidad exigible. Algunos consideran que la ETM puede reducir los porcentajes de recurrencia local de forma suficiente y que no sea necesaria la radioterapia preoperatoria en un gran número de pacientes. Esta hipótesis ha sido estudiada en un reciente ensayo
clínico holandés en el que pacientes con cáncer de recto resecable, no adherido a estructuras adyacentes, fueron aleatorizados en 2 grupos: exéresis completa del mesorrecto frente a exéresis completa del mesorrecto más radioterapia externa preoperatoria (25 Gy)87. Los resultados preliminares de este estudio, tras un seguimiento de
2 años, demuestran que la radioterapia todavía proporciona un beneficio adicional: la radioterapia preoperatoria disminuye el porcentaje de recurrencia local incluso cuando se administra a aquellos pacientes a los que posteriormente se les practica una ETM. Los resultados de este estudio sugieren que no todas las recurrencias locales son atribuibles a una técnica quirúrgica subóptima sino que en algunos casos pueden explicarse mejor por la extensión local del tumor o por sus características biológicas en el momento de la cirugía.
La relación entre un mayor volumen de intervenciones y una mayor supervivencia, aunque controvertida, se ha demostrado en varios estudios38,88,89. En el estudio de Hodgson et al38 sobre más de 7.000 pacientes operados de cáncer de recto durante un período de 3 años se observaron que en los hospitales con un menor volumen de intervenciones al año no sólo aumentaba el porcentaje de colostomías definitivas y la morbilidad postoperatoria sino que también disminuía de forma significativa la supervivencia a los 2 años. Se ha sugerido recientemente que la dehiscencia anastomótica se asocia a un mayor porcentaje de recurrencia local lo que demuestra, una vez más, el importante valor pronóstico del cirujano y su técnica90,91.
Calidad de vida
La calidad de vida de los pacientes después de la cirugía del cáncer de recto ha sido el objeto de algunos trabajos realizados en los últimos años. En la mayoría de estos estudios se ha comparado la calidad de vida entre los pacientes a los que se les había practicado una amputación abdominoperineal con el consiguiente estoma definitivo y aquellos a los que se les había realizado una resección anterior de recto con preservación de esfínteres pero con deterioro funcional en algunos casos. Los cuestionarios de calidad de vida utilizados con más frecuencia fueron el SF-36 Health Status, el EORTC QLQ-C30 con su correspondiente módulo colorrectal (QLQ-CR38) y el Fecal Incontinence Quality of Life Score. Aunque los resultados de estos estudios observacionales no son concluyentes92, en la mayoría de ellos, los pacientes a los que se les había practicado una amputación tenían una peor calidad de vida que aquellos a los que se les había realizado una resección anterior93. En otros, no se han observado diferencias significativas entre los 2 tipos de intervención. La preservación de los esfínteres no debe realizarse a cualquier precio, puesto que algunos pacientes pueden presentar un deterioro significativo de la calidad de vida después de una anastomosis colorrectal ultrabaja o coloanal. Es necesario tener en cuenta factores como el estado funcional preoperatorio, el riesgo de complicaciones o la necesidad de tratamiento adyuvante en la toma de decisiones94. En general, la calidad de vida a largo plazo entre los pacientes intervenidos de un cáncer de recto es alta, tengan o no un estoma definitivo. La utilización de cuestionarios de calidad de vida es recomendable puesto que constituyen una herramienta muy útil para monitorizar los resultados del tratamiento95.