Hay un amplio consenso internacional sobre la necesidad del cribado del cáncer colorrectal (CCR) en varones y mujeres con edad igual o superior a 50 años, sin antecedentes personales ni familiares de adenomas ni CCR. El principal problema es el desacuerdo entre las distintas guías de cribado sobre cuál es el mejor método. En el 2003, la Unión Europea extendió la recomendación de implantar el cribado del CCR mediante la prueba de detección de sangre oculta en heces (PDSOH) a la población entre los 50 y los 74 años. El 70% de los estados miembros están implantando un programa, pero hay una gran heterogeneidad. En España se recomienda la PDSOH con periodicidad bienal a una población diana entre 50 y 69 años. Actualmente, 3 comunidades autónomas desarrollan programas piloto y están en la fase de extensión del programa a toda la población. Otras muchas comunidades han anunciado el inicio de programas en el corto plazo.
There is broad international consensus on the need for colorectal cancer screening in men and women aged 50 years old or older with no personal or familial history of adenoma or colorectal cancer. The main problem is the disagreement among the various screening guidelines on the best screening method. The European Union (2003) extended the recommendation of implanting colorectal cancer screening using the fecal occult blood test (FOBT) in the population aged between 50 and 74 years. Seventy percent of the member states are introducing a program but there is wide heterogeneity. In Spain, 2-yearly FOBT is recommended in the target population aged 50 to 69 years. Currently, three autonomous communities have developed pilot programs and are extending the program to the entire population. Many other communities have announced they will commence programs shortly.
El objetivo principal de los programas de cribado es la reducción de la incidencia y la mortalidad mediante el diagnóstico de la enfermedad en las fases más precoces. Con el conocimiento actual, el cáncer colorrectal (CCR) cumple las condiciones necesarias para ser susceptible de cribado. En consecuencia, hay un amplio consenso internacional sobre la necesidad del cribado del CCR en la población de riesgo medio.
El principal problema para su implantación definitiva es el desacuerdo entre las distintas guías de cribado sobre cuál es el mejor método1–3. Los ensayos clínicos aleatorizados (ECA) publicados y los programas piloto desarrollados denotan distintos grados de eficacia (impacto potencial), efectividad (impacto real en la población) y aceptación por parte de la población.
Para cualquier programa de cribado de base poblacional es necesario conocer la población diana que potencialmente puede beneficiarse de la intervención. Para el CCR se han definido grupos de riesgo sobre la base de la edad y de los antecedentes personales y familiares de CCR1–3. Se establece que la población de riesgo medio es la tributaria a participar en este tipo de programas. Se está hablando de personas con edad igual o superior a 50 años, sin antecedentes personales ni familiares de adenomas ni de CCR.
Las condiciones de Frame y Carlson de 19754 definen los requisitos básicos que debe tener una enfermedad para que se pueda aplicar un cribado poblacional. Éstas son el conocimiento de la historia natural de la enfermedad, que la detección precoz junto con el tratamiento disminuyan la morbimortalidad, que la enfermedad sea un problema de salud pública relevante, que se disponga de una prueba de cribado aceptable, válida y razonablemente segura y, finalmente, que se haya demostrado mediante ECA una buena relación coste-efectividad.
Historia natural de la enfermedadActualmente los conocimientos sobre la historia natural de la enfermedad permiten proponer una secuencia de adenoma y carcinoma con un período inicial asintomático de formación del adenoma y su progresión neoplásica en varios años. En general, el crecimiento de los adenomas es lento y se estima entre 5 y 10 años el tiempo necesario para que un pólipo inferior o igual a 10mm se transforme en cáncer invasivo5.
Los estudios de seguimiento han mostrado que algunos adenomas aumentan de tamaño, otros se mantienen estables e incluso algunos pueden llegar a desaparecer6. A su vez, se acepta que son muy pocos los tumores que aparecen sin haber estado precedidos de un pólipo adenomatoso7.
La prevalencia de pólipos aumenta con la edad, a los 50 años es del 20 al 25% y a los 75 a 80 años es del 50%. La posibilidad de degeneración maligna del pólipo se asocia a la edad del paciente, al tamaño y a las características histológicas de éste8,9. Por tanto, el riesgo acumulado de transformación neoplásica de un adenoma superior o igual a 10mm de diámetro es del 2,5, el 8 y el 24% después de 5, 10 y 20 años de seguimiento, respectivamente.
La detección precoz disminuye la morbimortalidadEl pronóstico del cáncer tiene una estrecha relación con el estadio del tumor en el momento del diagnóstico y el tratamiento es notablemente distinto. El 70 al 75% de los casos de CCR son esporádicos y se dan en personas sin ningún factor de riesgo conocido10.
Las mejores pruebas de que los adenomas son una lesión premaligna proviene del hecho de que la polipectomía endoscópica disminuye la incidencia del CCR11,12. Las estrategias de prevención del CCR deben ir dirigidas fundamentalmente a detectar de manera precoz los adenomas avanzados (lesiones superiores o iguales a 10mm con componente velloso o con displasia de alto grado), dado que son los que tienen una mayor probabilidad de progresar a cáncer.
Problema de salud pública relevanteEl CCR representa un importante problema de salud. Mundialmente se estimaron 1.024.000 casos nuevos y 520.000 muertes en el año 2002, lo que representa la tercera causa de cáncer en el mundo, después del cáncer de pulmón y el de mama13,.
En Europa en el año 2004 se estimó una incidencia de 377.000 nuevos casos, fue el segundo cáncer en frecuencia si se tienen en cuenta ambos sexos y la segunda causa de muerte por cáncer después del cáncer de pulmón14. La incidencia por sexos se estimó en 197.200 nuevos casos en varones y 179.200 en mujeres, con unas tasas de mortalidad del 50,7 y del 49,3%, respectivamente. El CCR representa el 13% de todos los nuevos casos de cáncer y el 11,9% de muertes por cáncer en Europa15. Las tasas de incidencia y mortalidad más altas se encuentran en Hungría (106 y 54,4 respectivamente) y las más bajas en Grecia (31 y 15,5 respectivamente).
En España en el año 2002 se estimó una incidencia de 22.000 casos nuevos15,16. Si se considera conjuntamente ambos sexos, se estima que, actualmente, es el cáncer con más incidencia. El CCR es más frecuente en la población de edad avanzada, éste se incrementa de forma notoria a partir de los 50 años. Presenta una mayor incidencia en los varones (razón varón/mujer de 1,3)15,17. Hay tasas más elevadas en Mallorca, Navarra, Asturias y Tarragona y tasas más bajas en Albacete y Granada. La mortalidad en el año 2002 fue de 10.800 muertes (49%). En los últimos años la mortalidad por el CCR muestra una tendencia a la disminución en ambos sexos.
Al contrario que en EE. UU., la mayoría de los países europeos, incluida España, presentan una tendencia al alza tanto en incidencia como en mortalidad18,19.
Prueba de cribado aceptable, válida y razonablemente seguraHay diversas pruebas para realizar el cribado. Actualmente hay un gran debate entre diversas sociedades científicas de prestigio y guías de práctica clínica sobre cuál es la mejor prueba y con qué periodicidad se debe aplicar. Las más utilizadas y estudiadas para la población de riesgo medio son la prueba de detección de sangre oculta en heces con reactivo guayaco (PDSOHg), la prueba de detección inmunológica de sangre oculta en heces (PDSOHi) anual o bienal, la sigmoidoscopia cada 5 años, la colonoscopia cada 10 años, la combinación de la PDSOH anual con la sigmoidoscopia cada 5 años o el enema baritado con doble contraste20. Actualmente se están realizando ECA en los que se emplean nuevas pruebas de cribado como el ácido desoxirribonucleico (ADN) fecal y la colonoscopia virtual también llamada colonografía por tomografía computarizada.
Se distinguen 3 tipos de pruebas de cribado fecales: la PDSOHg, la PDSOHi y la prueba de detección de ADN fecal, de reciente aparición. La PDSOHg es la estrategia diagnóstica más reconocida y validada con un mayor número de ECA y controlados. El descenso en la mortalidad en los grupos a los que se les realizó un cribado mediante la PDSOHg se estima entre un 15 y un 25%21,22. La periodicidad anual es más eficaz que la bienal21. En el contexto de un cribado poblacional se tienen pruebas indirectas que muestran que la PDSOHi tiene una sensibilidad mayor que la PDSOHg, pero una especificidad menor. Si se habla de la aceptación de la prueba entre la población, la PDSOHi tiene una mejor aceptación en comparación con la PDSOHg23. Actualmente se está trabajando con las PDSOHi cuantitativas y con la lectura automatizada que permite seleccionar un punto de corte asociado al óptimo equilibrio entre sensibilidad y especifidad24. Respecto al análisis de ADN fecal, no se disponen de ECA que evalúen su eficacia en el cribado y presenta una peor relación coste-efectividad que limita su aplicabilidad25,26.
La sigmoidoscopia se está evaluando mediante ECA (2 europeos y uno americano). Estos estudios no disponen todavía de resultados sobre la reducción de la mortalidad, pero sí han descrito que, en el contexto de un cribado poblacional, la sigmoidoscopia detecta más cánceres y adenomas distales que la PDSOHg27. La sensibilidad a la sigmoidoscopia se estima del 58 al 75% para las lesiones pequeñas y del 72 al 82% para las neoplasias avanzadas26. El riesgo de neoplasia proximal es más elevado cuando en la sigmoidoscopia se detecta un adenoma distal superior o igual a 10mm28–30. La sigmoidoscopia confiere un efecto protector durante un período de 9 a 10 años, por lo que se establece conservadoramente un intervalo de 5 años entre sigmoidoscopias de cribado31,32.
La combinación de la PDSOHg con la sigmoidoscopia en cribado poblacional no ha demostrado ser más eficaz que la PDSOHg ni tampoco ha demostrado superar las limitaciones de cada una de las 2 pruebas por separado27,33,34. Para el enema de bario con doble contraste tampoco hay pruebas de que sea eficaz para el cribado poblacional35–37.
No se disponen de ECA que evalúen la eficacia de la colonoscopia en el cribado del CCR en términos de reducción de la mortalidad. No obstante, diversos estudios apoyan la eficacia de forma indirecta y han demostrado que esta prueba no sólo favorece la detección del CCR en fases iniciales sino que también permite reducir la incidencia a partir de la identificación y resección de los pólipos10,11. Se estima que una colonoscopia negativa se asocia a una incidencia ajustada del CCR que decrece en el tiempo29,38, por lo que la mayoría de las guías de práctica clínica recomiendan, de manera conservadora, un intervalo de 10 años entre colonoscopias negativas.
Para la colonoscopia virtual o colonografía por tomografía computarizada tampoco se disponen de ECA que demuestren su eficacia como prueba de cribado poblacional, pero publicaciones recientes indican una tasa de detección del CCR y de adenomas superior o igual a 10mm, similar a la de la colonoscopia óptica39.
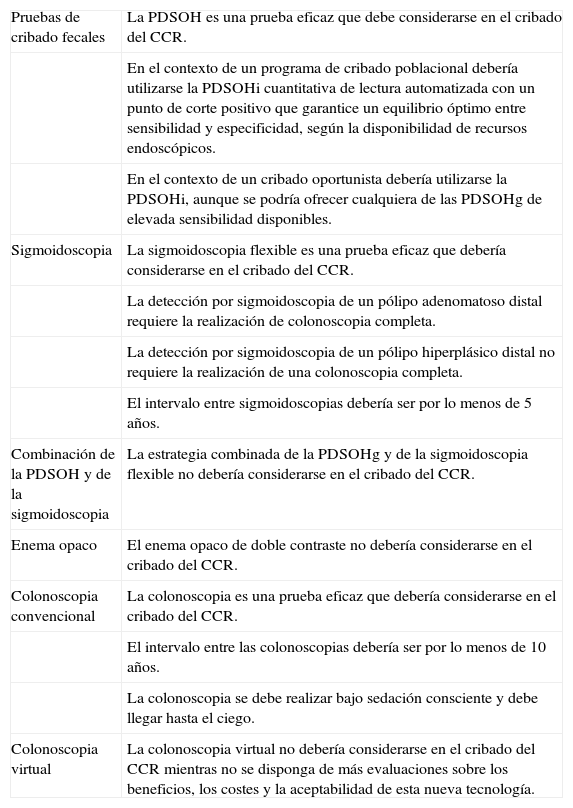
De las pruebas que están aportando los ECA, las sociedades científicas elaboran sus recomendaciones. En la tabla 1 se resumen las principales recomendaciones de la Sociedad Española de Gastroenterología, la Sociedad Española de Medicina Familiar y Comunitaria y el Centro Cochrane Iberoamericano.
Recomendaciones del grupo de trabajo de la guía de práctica clínica de prevención del cáncer colorrectal (2009)1
| Pruebas de cribado fecales | La PDSOH es una prueba eficaz que debe considerarse en el cribado del CCR. |
| En el contexto de un programa de cribado poblacional debería utilizarse la PDSOHi cuantitativa de lectura automatizada con un punto de corte positivo que garantice un equilibrio óptimo entre sensibilidad y especificidad, según la disponibilidad de recursos endoscópicos. | |
| En el contexto de un cribado oportunista debería utilizarse la PDSOHi, aunque se podría ofrecer cualquiera de las PDSOHg de elevada sensibilidad disponibles. | |
| Sigmoidoscopia | La sigmoidoscopia flexible es una prueba eficaz que debería considerarse en el cribado del CCR. |
| La detección por sigmoidoscopia de un pólipo adenomatoso distal requiere la realización de colonoscopia completa. | |
| La detección por sigmoidoscopia de un pólipo hiperplásico distal no requiere la realización de una colonoscopia completa. | |
| El intervalo entre sigmoidoscopias debería ser por lo menos de 5 años. | |
| Combinación de la PDSOH y de la sigmoidoscopia | La estrategia combinada de la PDSOHg y de la sigmoidoscopia flexible no debería considerarse en el cribado del CCR. |
| Enema opaco | El enema opaco de doble contraste no debería considerarse en el cribado del CCR. |
| Colonoscopia convencional | La colonoscopia es una prueba eficaz que debería considerarse en el cribado del CCR. |
| El intervalo entre las colonoscopias debería ser por lo menos de 10 años. | |
| La colonoscopia se debe realizar bajo sedación consciente y debe llegar hasta el ciego. | |
| Colonoscopia virtual | La colonoscopia virtual no debería considerarse en el cribado del CCR mientras no se disponga de más evaluaciones sobre los beneficios, los costes y la aceptabilidad de esta nueva tecnología. |
CCR: cáncer colorrectal; PDSOHg: prueba de detección de sangre oculta en heces con reactivo guayaco; PDSOHi: prueba de detección inmunológica de sangre oculta en heces.
La implantación de todo programa de salud debe analizarse desde la perspectiva sanitaria (evolución natural en ausencia de intervención) y económica. El cribado del CCR es coste-efectivo respecto a la no realización del cribado y con independencia de la prueba empleada. No obstante, la limitada información disponible sobre los costes hace difícil definir la estrategia más coste-efectiva y el intervalo óptimo de la edad para cribar27,40. En los modelos de simulación se atribuyen ganancias similares en años de vida a la PDSOHg o a la PDSOHi anuales, a la sigmoidoscopia cada 5 años asociada a la PDSOHg y a la colonoscopia cada 10 años41.
Además, los estudios de coste-efectividad deben valorarse en su contexto. En España la estrategia de cribado más coste-efectiva es la PDSOHi con periodicidad anual frente a la no realización del cribado, con un coste incremental de 2.154 euros por año de vida ajustado por calidad (AVAC) ganado. Le siguen la PDSOHg anual (2.211 euros), la PDSOHi bienal (2.233 euros), la sigmoidoscopia flexible cada 5 años (2.305 euros), la PDSOHg bienal (2.322 euros) y la colonoscopia cada 10 años (2.369 euros) por AVAC ganado42.
Prevención secundaria en la población de riesgo medio en EuropaLa Unión Europea (UE) en el año 2003, sobre la base de la importancia epidemiológica del cáncer y de las pruebas científicas existentes, extendió la recomendación a los estados miembros de implantar el cribado del CCR mediante una PDSOH a varones y a mujeres con edades comprendidas entre los 50 y los 74 años43,44.
Durante el año 2008 la UE ha publicado un primer informe sobre el seguimiento de las recomendaciones, en el que consta que 19 de los 27 estados miembros han aceptado incorporar un programa de salud pública de cribado del CCR. La UE considera cubierto el 78% de los aproximadamente 136 millones de varones y mujeres que forman la población diana (de 50 a 74 años) de toda la UE. Pese a estas cifras, la UE considera que hay una menor implantación y una menor proporción de población diana cubierta que en los programas de cribado de cáncer de mama o cáncer de cérvix45,46.
Uno de los aspectos más relevantes es la gran heterogeneidad entre los distintos programas estatales. Hay variaciones importantes en cuanto al tipo de programa (poblacional o no poblacional), la fase de desarrollo (implantado, en desarrollo, en proyecto o en planificación) y las características propias del programa como pueden ser los criterios de selección de candidatos (edad de la población diana) y la estrategia a emplear (tipo de prueba utilizada y periodicidad de ésta).
De los 19 estados miembros que se encuentran en la fase de implantación de un programa de cribado del CCR, 12 (Bulgaria, República Checa, Finlandia, Francia, Hungría, Letonia, Portugal, Rumania, Eslovenia, España, Suecia y Reino Unido) han escogido la prueba recomendada por la UE (PDSOH), 6 (Austria, Chipre, Alemania, Grecia, Italia y República Eslovaca) utilizan tanto la PDSOH como las pruebas endoscópicas; mientras que Polonia es el único estado miembro que tiene implantado un programa de cribado nacional que utiliza la colonoscopia. Actualmente 5 estados manifiestan tener en funcionamiento un programa nacional: Francia, Finlandia, Reino Unido (PDSOH), Italia (PDSOH y sigmoidoscopia) y Polonia (colonoscopia)46,47.
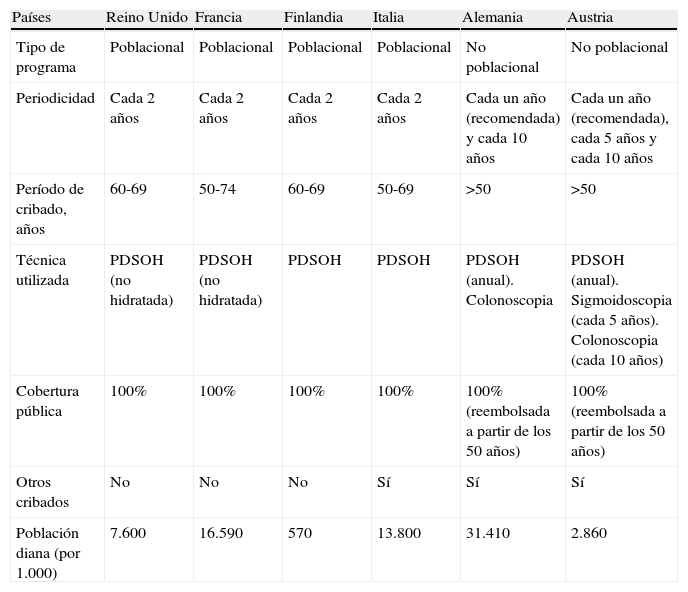
Respecto a la periodicidad empleada en los programas con la PDSOH, 11 estados han adoptado el intervalo de 2 años, 2 estados (Austria y Alemania) han adoptado el intervalo de uno o 2 años, según la población de riesgo, 2 estados (Bulgaria y Letonia) un año y, finalmente, Grecia utiliza un intervalo de 5 años. Nueve estados miembros (Austria, Bulgaria, República Checa, Francia, Alemania, Grecia, Letonia, Rumania y República Eslovaca) cubren el rango de edad recomendado de 50 a 74 años, mientras que otros 9 estados utilizan un rango de edad menor (Chipre, Finlandia, Hungría, Italia, Portugal, Eslovenia, España, Suecia y Reino Unido). La invitación más temprana para la PDSOH la realiza Bulgaria con 31 años, mientras que el resto empieza las invitaciones a los 50 años. En la tabla 2 se analizan las principales diferencias entre los programas nacionales con la PDSOH ya implantados.
Comparativa de los programas estatales implantados en la Unión Europea46,47
| Países | Reino Unido | Francia | Finlandia | Italia | Alemania | Austria |
| Tipo de programa | Poblacional | Poblacional | Poblacional | Poblacional | No poblacional | No poblacional |
| Periodicidad | Cada 2 años | Cada 2 años | Cada 2 años | Cada 2 años | Cada un año (recomendada) y cada 10 años | Cada un año (recomendada), cada 5 años y cada 10 años |
| Período de cribado, años | 60-69 | 50-74 | 60-69 | 50-69 | >50 | >50 |
| Técnica utilizada | PDSOH (no hidratada) | PDSOH (no hidratada) | PDSOH | PDSOH | PDSOH (anual). Colonoscopia | PDSOH (anual). Sigmoidoscopia (cada 5 años). Colonoscopia (cada 10 años) |
| Cobertura pública | 100% | 100% | 100% | 100% | 100% (reembolsada a partir de los 50 años) | 100% (reembolsada a partir de los 50 años) |
| Otros cribados | No | No | No | Sí | Sí | Sí |
| Población diana (por 1.000) | 7.600 | 16.590 | 570 | 13.800 | 31.410 | 2.860 |
PDSOH: prueba de detección de sangre oculta en heces.
Muchos países, a su vez, están realizando diversos programas que incluyen cribados regionales y experiencias locales con la finalidad de determinar las estrategias y las pruebas más útiles y eficientes para administrarse. Italia (Italian Store Trial) y Reino Unido (UK Flexible Sigmoidoscop Screening Trial) están realizando ECA dirigidos a evaluar la eficacia de la sigmoidoscopia única en personas de 55 a 64 años. Noruega también está realizando un estudio similar, pero con un rango de edad superior (50 a 74 años). Dinamarca y Noruega están realizando ECA para evaluar la combinación de la PDSOHg y una sola sigmoidoscopia para varones y para mujeres de 50 a 64 años. En Holanda están realizando 2 ensayos clínicos que comparan, por una parte, 2 técnicas diagnósticas (PDSOH y sigmoidoscopia) y, por la otra, la aplicación de la PDSOH (inmunológico) frente al no cribado47.
Prevención secundaria de la población de riesgo medio en EspañaEn España las últimas reuniones de expertos realizadas (Murcia y Madrid, 2007) recomiendan una estrategia poblacional con la PDSOH con periodicidad bienal a una población diana de 50 a 69 años. Se propone, además, analizar la posibilidad de utilizar la PDSOHi y ampliar la población diana al grupo de 70 a 74 años. Estas recomendaciones están también avaladas por varias sociedades científicas entre las que se encuentra la Asociación Española de Gastroenterología1.
El Ministerio de Sanidad y Consumo en el año 2006 en la «Propuesta de Estrategia del Cáncer del Sistema Nacional de Salud» para el CCR establece entre sus objetivos la realización de estudios piloto de cribado poblacional, con la utilización de la PDSOH, que permita concluir, en el plazo más breve posible, cuál es la mejor estrategia de implantación de un programa de carácter poblacional48.
Los planes oncológicos publicados en los últimos años por algunas comunidades autónomas (CC. AA.) incluyen también en sus objetivos la realización de estudios piloto del CCR49,50. Tres comunidades (Cataluña49, Comunidad Valenciana50 y Murcia) han desarrollado programas piloto de cribado poblacional, mientras que otras muchas comunidades ya han anunciado la previsión de iniciar programas a corto plazo (Andalucía, Asturias, Baleares, Canarias, Castilla y León, Galicia, Extremadura, Madrid y País Vasco)51.
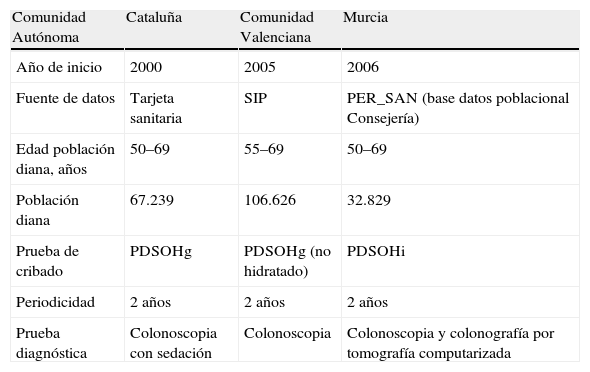
Todos los programas piloto de base poblacional iniciados en España se realizan mediante la PDSOH. Mantienen, no obstante, pequeñas diferencias respecto al tipo de PDSOH y su periodicidad, la edad de la población diana y las fuentes de obtención de los datos de la población (tabla 3). Los principales objetivos de estos programas piloto son conocer la aceptabilidad en la población diana, evaluar alternativas organizativas, analizar la calidad técnica (resultados de las pruebas, valor predictivo, etc.) y determinar las necesidades de recursos humanos y técnicos para su futura extensión. Los 3 programas se encuentran implantados (Cataluña en tercera ronda, y Comunidad Valenciana y Murcia en segunda ronda) y en distintas fases de evaluación. En noviembre se realizó en el Institut Català d’Oncologia un taller de trabajo en el que se presentaron resultados preliminares. En resumen, las tasas de detección y los valores predictivos positivos han sido los esperables de acuerdo con las tasas de incidencia en España y los resultados de los ensayos clínicos. La participación obtenida se valora como baja comparada con las tasas de los programas de cribado de cáncer de mama. Es mayor en los programas de Valencia y de Murcia respecto al programa de Cataluña. La tasa de pruebas positivas es mayor en el programa de Murcia que utiliza la PDSOHi.
Programas piloto de cribado poblacional de cáncer de colon y recto
| Comunidad Autónoma | Cataluña | Comunidad Valenciana | Murcia |
| Año de inicio | 2000 | 2005 | 2006 |
| Fuente de datos | Tarjeta sanitaria | SIP | PER_SAN (base datos poblacional Consejería) |
| Edad población diana, años | 50–69 | 55–69 | 50–69 |
| Población diana | 67.239 | 106.626 | 32.829 |
| Prueba de cribado | PDSOHg | PDSOHg (no hidratado) | PDSOHi |
| Periodicidad | 2 años | 2 años | 2 años |
| Prueba diagnóstica | Colonoscopia con sedación | Colonoscopia | Colonoscopia y colonografía por tomografía computarizada |
SIP: Sistema de Información Poblacional; PDSOHg: prueba de detección de sangre oculta en heces con reactivo guayaco; PDSOHi: prueba de detección inmunológica de sangre oculta en heces.
Como rasgos diferenciales entre los programas, cabe destacar que en Cataluña la participación se ha incrementado notablemente en la segunda y en la tercera ronda, se observa una amplia variación de participación por áreas básicas de salud. En la Comunidad Valenciana se han creado 2 grupos de población diana: de 50 a 69 años y de 70 a 74 años. Utilizan como fuente de datos el Sistema de Información Poblacional, que incluye a toda la población empadronada en la Comunidad, independientemente del sistema de aseguramiento. En la comunidad murciana utilizan como prueba de cribado la PDSOHi con 2 determinaciones en 2 días sucesivos. Como prueba de confirmación diagnóstica utilizan la colonoscopia óptica cuando es posible y la colonografía por tomografía computarizada en los casos en que esté contraindicada la anterior o no se consiga visualizar todo el colon.
Actualmente, estas 3 CC. AA. están en fase de extensión del programa de cribado a toda la población.
ConclusionesLa incidencia del CCR presenta una clara tendencia ascendente en los últimos años. El progresivo envejecimiento de la población influye en esta tendencia. Por tanto, es necesario implantar estrategias que permitan diagnósticos en estadios más precoces, que mejoren la supervivencia y, a su vez, que produzcan un efecto estabilizador en la incidencia.
En el CCR hay pruebas de la eficacia (en términos de disminución de incidencia y de mortalidad) en las estrategias de detección precoz, aunque actualmente hay una gran heterogeneidad respecto a cuál debería ser la prueba de cribado y los rangos de edad en que debe aplicarse. Por esta razón, es esencial continuar realizando ECA que permitan identificar cuál es la mejor prueba y la mejor estrategia de aplicación. Por ejemplo, recientemente, la Asociación Española de Gastroenterología ha iniciado un ECA multicéntrico en la población de riesgo medio en 8 CC. AA. (Aragón, Canarias, Cataluña, País Vasco, Galicia, Madrid, Murcia y Valencia) para evaluar la eficacia de la colonoscopia en comparación con la PDSOHi.
El segundo elemento clave para la efectividad de un programa de cribado es el disponer de una buena organización que permita una óptima implantación y la más alta aceptabilidad por parte de la población diana. Es necesario disponer de una buena base de datos que incluya toda la población diana. Un plan funcional que facilite la realización y recogida de la prueba. Un plan de comunicación exhaustivo y ambicioso. La coordinación entre atención primaria, atención especializada y Salud Pública ha de permitir llegar con mensajes claros y congruentes a la población. Es imprescindible garantizar la continuidad asistencial con el tratamiento de las lesiones detectadas y un seguimiento adecuado de los pacientes en función del potencial riesgo de transformación maligna de los adenomas. Es necesario establecer, desde el inicio, un plan de calidad para todo el proceso de cribado, con una definición clara y concisa de los objetivos, con protocolos consensuados y disponer de indicadores definidos que permitan evaluar la actividad e identificar tendencias. Finalmente, es esencial dotar de continuidad a los programas mediante la aportación económica suficiente que permita una dotación de recursos materiales y humanos óptima.
Un tercer elemento clave es la necesidad de sensibilizar y concienciar a la población, a los profesionales de la salud y a las autoridades sanitarias de la importancia de los programas de prevención en el CCR. Es necesario organizar campañas publicitarias en medios de comunicación y organizar reuniones científicas o divulgativas. Con este objetivo durante el mes de marzo de 2009 se celebrará el mes europeo del cáncer de colon. En España, 5 asociaciones científicas —Asociación Española de Gastroenterología, Sociedad Española de Medicina Familiar y Comunitaria, Sociedad Española de Oncología Médica, Sociedad Española de Oncología Radioterápica y Sociedad Española de Epidemiología— y 2 organizaciones no gubernamentales —Asociación Española contra el Cáncer y una asociación de pacientes denominada Europacolon España— están organizando toda una serie de actividades de difusión en prevención del CCR en el marco de la «Alianza para la prevención del cáncer de colon».