Los datos de cinética viral en las semanas 4 y 12 orientan la duración del tratamiento que obtiene la mejor riesgo-beneficio en la hepatitis crónica por virus C. La respuesta virológica rápida (RVR) y la respuesta virológica precoz (RVP) ofrecen un alto valor predictivo positivo y negativo, respectivamente. Los pacientes con genotipo-1, RVR, sin fibrosis significativa y carga viral basal baja (<600.000U/ml) pueden recibir tratamiento durante 24 semanas sin pérdida de eficacia, mientras que la ausencia de RVP en estos pacientes es criterio de interrupción del tratamiento. Existen datos contradictorios para recomendar la prolongación del tratamiento a 72 semanas a pacientes con genotipo 1 y descenso de >2 log de la viremia sin negativización de ésta en la semana 12. En el caso de los genotipos 2 y 3, el tratamiento de 24 semanas es superior al de 16 semanas, si bien se puede valorar el tratamiento de 16 semanas en pacientes con genotipo 3 y RVR. En el caso de pacientes infectados con genotipo 2 y RVR, las tasas de respuesta virológica sostenida son similares en el tratamiento de 14 semanas que en el de 24, mientras que los que no presentan RVR deben continuar 24 semanas. Factores como dosis de ribavirina ajustada por peso y el cumplimiento terapéutico son factores clave en la optimización del tratamiento.
The treatment duration that obtains the optimal risk-benefit ratio in chronic hepatitis C infection is guided by viral kinetic data in weeks 4 and 12. Rapid virological response (RVR) and early virological response (EVR) have high positive and negative predictive value, respectively. Patients with genotype-1, RVR, without significant fibrosis and low baseline viral load (<600,000UI/ml) can receive treatment for 24 weeks without loss of efficacy, while the absence of EVR in these patients is a criterion for treatment interruption. Data on prolonging treatment to 72 weeks in patients with genotype 1 and a decrease of >2log in viremia without negativization of viremia in week 12 are contractictory. In patients with genotypes 2 and 3, 24-week treatment is superior to 16-week treatment, although 16-week treatment can be evaluated in patients with genotype 3 and RVR. In patients with genotype 2 and RVR, rates of RVR in 14-week treatment are similar to those in 24-week treatment, while in patients without RVR, treatment should be continued to 24 weeks. Key factors in treatment optimization are the weight-adjusted dose of ribavirin and therapeutic adherence.
El tratamiento actual de la hepatitis crónica por virus C consigue la erradicación de la infección en la mayoría de los pacientes tratados1–5. Sin embargo, el aclaramiento del virus no es universal, los efectos adversos del tratamiento son frecuentes y el coste es elevado. Se espera que los nuevos fármacos, actualmente en desarrollo, incrementen la tasa de respuesta virológica sostenida (RVS) con menor duración. Mientras tanto, se han identificado diferentes factores predictivos de respuesta pretratamiento e intratratamiento, que orientan la modificación terapéutica para mejorar la RVS y disminuir la exposición innecesaria a los fármacos sin disminuir su eficacia1,6,7–10. El propósito de esta revisión es presentar la evidencia disponible sobre factores antes del tratamiento y durante el tratamiento (cinética viral) que predicen respuesta, para guiar la duración terapéutica, describir el papel de la ribavirina (RBV) en el genotipo 1 y las estrategias para mejorar la adhesión.
Factores predictivos pretratamiento de respuesta virológica sostenidaLa presencia de genotipos del virus de la hepatitis C (VHC) diferentes del 2 y 3, la carga viral basal >800.000U/ml, el estadio de fibrosis F2-F4 en la biopsia hepática, el sexo varón la edad >40 años son factores reconocidos de peor respuesta porque aumentan significativamente el riesgo de recidiva1,3,6–11. Hasta la fecha, la utilización de dosis de 270μg/semana de peginterferón alfa 2a o de peginterferón alfa 2b y dosis de RVB hasta 1.600mg/día, con o sin factores de crecimiento, no ha mostrado utilidad o solo una utilidad marginal en los pacientes con este perfil de respuesta desfavorable12.
Individualización del tratamiento según los factores de respuesta pretratamientoRecientemente, D’Arondel et al13 analizaron las tasas de RVS en 98 pacientes que iniciaron tratamiento en un estudio prospectivo y fueron tratados con peginterferón alfa 2b con 1,5μg/kg y RBV 11mg/kg. La duración del tratamiento se individualizó según los pacientes presentaran un ARN-VHC negativo en la semana 24 (<50U/ml) y 2 o más factores de riesgo de recidiva (genotipos diferentes de 2 y 3, carga viral basal >800.000U/ml, fibrosis F2-F4 en la biopsia o en el fibrotest, sexo varón o edad >40 años). Los pacientes con ARN-VHC negativo en la semana 24 y dos o más factores de riesgo de recidiva continuaron tratamiento durante otras 24 semanas. El tratamiento se interrumpió en los casos de ARN-VHC positivo o ARN-VHC negativo con uno o ningún factor de riesgo de recidiva. El tratamiento se continuó 24 semanas adicionales también en los pacientes con ARN-VHC negativo en la semana 24 y dos o más factores de riesgo de recidiva. Las tasas de RVS fueron del 73%, y del 85% en los genotipos 2 y 3 y del 63% en el resto.
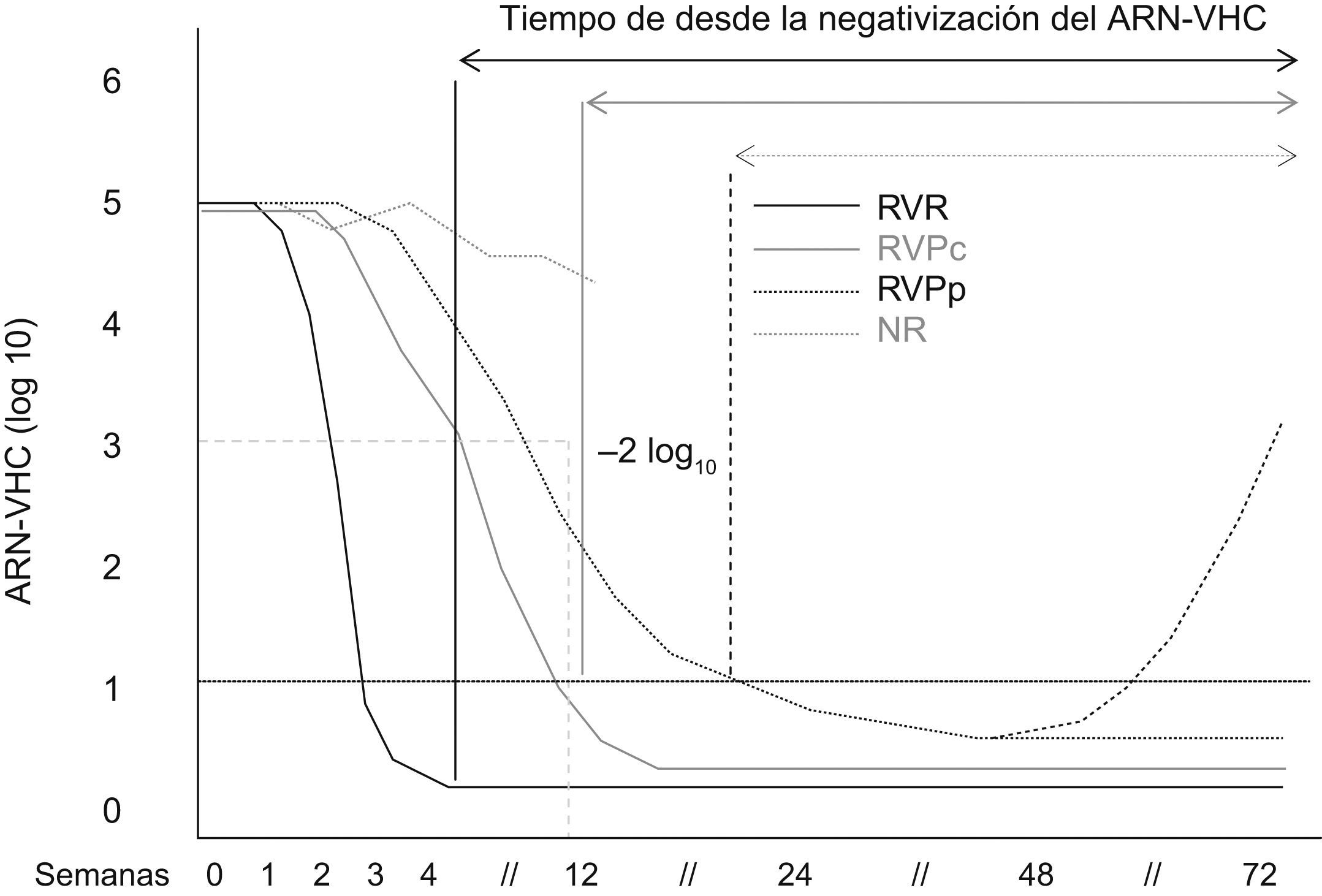
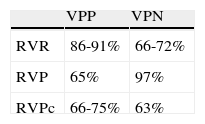
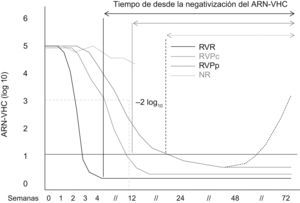
Respuesta durante el tratamiento. Definición de tipos de respuesta virológicaLos diferentes tipos de respuesta virológica durante tratamiento se presentan en la figura 1. El primer factor predictivo de respuesta se describió en 2002 a raíz del estudio de registro de Fried et al1. Se denominó respuesta virológica precoz (RVP) y se define como un descenso de la carga viral basal de al menos 2 logaritmos decimales en la semana 12 de tratamiento. En este estudio, el 86% de los pacientes presentaron RVP; de ellos, el 65% alcanzó la RVS. Por el contrario, solo un 3% de los pacientes que no presentaron RVP alcanzó RVS. Por tanto, el valor predictivo negativo (VPN) de la RVP es del 97% (tabla 1). La RVP se ha venido utilizando en los últimos años para decidir la interrupción del tratamiento en la semana 12, en los pacientes que no presentan RVP, lo que se denomina regla de interrupción del tratamiento. Esta interrupción evita efectos adversos innecesarios y disminuye costes de tratamiento.
Diferentes tipos de respuesta virológica según la cinética viral de las semanas 4 y 12. Respuesta virológica rápida (RVR) (línea negra); respuesta virológica precoz completa (RVPc) (línea gris); respuesta virológica precoz parcial (RVPp) (línea puntos negros), y respuesta nula (RN) o sin respuesta (línea puntos gris). Los pacientes con RVPp presentan un mayor riesgo de recidiva (línea discontinua). Si la viremia es negativa en la semana 24, estos pacientes se denominan respondedores lentos. VHC: virus de la hepatitits C.
Posteriormente, se observó que los pacientes que negativizaban el ARN-VHC en las primeras 4 semanas de tratamiento tenían una probabilidad muy elevada de alcanzar RVS7. La determinación debe realizarse mediante reacción en cadena de la polimerasa (PCR), de manera que el umbral de detección de la viremia sea, aproximadamente, de 50U/ml. Este tipo de respuesta se denomina respuesta virológica rápida (RVR).
La RVP se ha subdividido, a su vez, en respuesta RVP completa (RVPc), cuando los pacientes presentan negativización del ARN-VHC en la semana 12, y RVP parcial (RVPp), cuando a pesar de existir un descenso de la carga viral de al menos 2 log10, permanece detectable en la semana 126.
Factores predictivos durante el tratamiento de respuesta en el genotipo 1En los últimos años, se han definido diferentes tipos de respuesta virológica en función de los resultados de cinética viral en las semanas 4 y 12 de tratamiento6,7,9. Según este tipo de respuesta virológica, se ha propuesto una duración diferente del tratamiento para disminuir los efectos adversos y los costes, y mejorar la eficacia de la respuesta virológica sostenida. Las tablas 1 y 2 sintetizan los resultados del valor predictivo positivo (VPP) y el VPN, y de cinética viral según los diferentes tipos de respuesta intratratamiento. Como se observa, cuanto antes se negativiza el ARN-VHC durante el tratamiento, mayor es la probabilidad de alcanzar una RVS.
| RVS | 91% | 72-83% | 60-78% | 48-59% | 33-43% | 2-4% |
| Semana 4 | Negativo | >2log | <2log | >2log | <2log | Cualquiera |
| Semana 12 | Negativo | Negativo | Negativo | >2log | >2log | Cualquiera |
| Semana 24 | Negativo | Negativo | Negativo | Negativo | Negativo | Positivo |
RVS: respuesta virológica sostenida.
Tomado de Ferenci et al7.
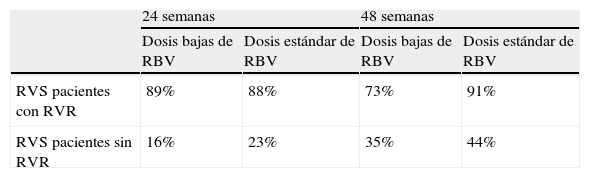
En 2004, Drusano y Preston14 formularon la hipótesis de que cuanto más tiempo permanecía indetectable el ARN-VHC en los pacientes tratados, mayor es la probabilidad de alcanzar la RVS. Existen varios estudios que parten de este concepto para conocer si el acortamiento del tratamiento a 24 semanas es tan eficaz como la duración de 48 semanas en pacientes con genotipo 1 y RVR. Ferenci et al7 realizaron un análisis retrospectivo de varios estudios, que incluían a 1.121 pacientes. Los resultados mostraban que cuanto mas precoz era la negativización de la viremia, mayor era la probabilidad de alcanzar una RVS (tabla 2). En 2006, Zeuzem et al9 observaron un 89% de RVS en pacientes con genotipo 1, viremia basal<600.000U/ml y RVR con una duración de 24 semanas de tratamiento con peginterferón alfa 2b y RBV. Por el contrario, en pacientes sin RVR, este tratamiento reducido supuso una tasa de recidivas muy elevada. Como se observa en la tabla 1, el VPP de la RVR oscila entre el 86 y el 91%. Jensen et al8 analizaron el efecto de la RVR en la tasa de RVS en pacientes con genotipo 1 procedentes de varios ensayos clínicos; la tasa de RVS fue elevada en los respondedores rápidos, independientemente de recibir tratamiento con dosis bajas de RBV frente a dosis estándar, o tratados durante 24 o 48 semanas. Sin embargo, los pacientes que no presentaban RVR se beneficiaron de dosis estándar de RBV y de tratamiento de 48 semanas (tabla 3). En este estudio, el factor más importante asociado a RVR fue la carga viral<400.000U/ml.
| 24 semanas | 48 semanas | |||
| Dosis bajas de RBV | Dosis estándar de RBV | Dosis bajas de RBV | Dosis estándar de RBV | |
| RVS pacientes con RVR | 89% | 88% | 73% | 91% |
| RVS pacientes sin RVR | 16% | 23% | 35% | 44% |
RBV: ribavirina; RVR: respuesta virológica rápida; RVS: respuesta virológica sostenida.
Tomado de Jensen et al8.
Recientemente, Ferenci et al15 han observado una tasa de RVS en pacientes con genotipo 1 y una RVR del 79% en pacientes con RVR y genotipo 4 del 87%, si bien este es un genotipo infrecuente en Europa y, por tanto, la cifra de pacientes es pequeña, por lo que no se deben extrapolar estos resultados.
En otro estudio reciente de 669 pacientes infectados con genotipo 1, 459 fueron asignados de forma aleatoria a recibir un tratamiento «flexible», según el momento de negativización de la viremia, y 210 recibieron tratamiento con duración estándar10. Los pacientes del grupo variable recibieron tratamiento durante 24 semanas si eran respondedores rápidos (26,7%), durante 48 semanas si el ARN-VHC era indetectable en la semana 8 (27,8%) y durante 72 semanas si la viremia era indetectable en la semana 12 (11,3%). Las tasas de RVS fueron del 48,8% en el grupo flexible y del 45,1% en el grupo estándar; sin embargo, hubo un 63,5% de pacientes con viremia negativa en la semana 12 que alcanzaron RVS en el grupo variable frente al 38,1% en el grupo estándar. En el análisis multivariante la carga viral basal<400.000U/ml y la ausencia de fibrosis significativa se asociaron independientemente a la RVR.
En cuanto a los pacientes que presentan RVPc, la tasa de RVS oscila entre el 60 y el 83%, dependiendo de que el descenso de la carga viral haya sido superior o inferior a 2log en la semana 4 (tabla 2).
Los respondedores lentos se definen como los que presentan ARN-VHC positivo en las semanas 4 y 12, pero negativo en la semana 2413,15,16. En estos pacientes, las tasas de RVS oscilan entre el 33 y el 43% (tabla 2).
Prolongación del tratamiento en respondedores lentos con genotipo 1Existen cuatro ensayos clínicos16–19, uno de ellos publicado en forma de abstract18, que, partiendo de esta hipótesis, han estudiado el efecto de prolongar el tratamiento a 72 semanas en pacientes con respuesta lenta y genotipo 1. En el estudio TERAVIC16, los pacientes que no presentaron RVR recibieron tratamiento durante 72 semanas; la dosis de RBV fue de 800mg/día, las tasas de RVS se incrementaron del 28% en la semana 48 al 44% en la semana 72. Sin embargo, no se dispone de datos de un posible beneficio con la terapia prolongada de pacientes que negativizaran el ARN-VHC entre las semanas 4 y 12. En el estudio de Berg17, se prolongó el tratamiento a los pacientes con RVPp hasta 72 semanas y la dosis de RBV también fue de 800mg/día. Las tasas de RVS aumentaron de un 33% a un 46% con la extensión del tratamiento.
Ferenci at al18 prolongaron el tratamiento a 19 pacientes con respuesta lenta; la dosis de RBV fue de 1.200mg/día. Había también un 10% de pacientes con genotipo 4; las tasas de RVS aumentaron del 37 al 77%, si bien el número de pacientes es muy pequeño y, por tanto, estos resultados se deben interpretar con precaución.
Recientemente, se ha analizado la utilidad de prolongar el tratamiento de los respondedores lentos con genotipo 1 de 48 a 72 semanas. Se identificaron 159 (11%) respondedores lentos, que fueron aleatorizados a continuar 48 o 72 semanas. Los resultados mostraron que los pacientes con tratamiento prolongado alcanzaban unas tasas de RVS del 48% frente a 43%, lo que no fue significativo19.
Dosis altas de ribavirina (RBV) en genotipo 1En el estudio de registro de Manns2, se observó, mediante un análisis retrospectivo de los datos, una relación lineal entre la dosis de RBV y una reducción en la tasa de recidivas en pacientes con genotipo 1. En el estudio Win-R, se observó que la dosis de RBV ajustada por peso (13,3mg/kg) fue superior a la dosis fija (800mg) en el genotipo 1 (RVS el 34 frente al 29%; p=0,004)20,21. En este mismo estudio, la dosis de hasta 1.400mg en pacientes con más de 105kg de peso se toleró bien, aunque la reducción de dosis de RBV por anemia fue más frecuente en el grupo de RBV ajustada por peso y la tasa de interrupción fue similar en ambos grupos. Recientemente, se ha estudiado el papel de la dosis alta de RBV en el genotipo 1, en un estudio unicéntrico. Se asignaron aleatoriamente a 150 pacientes a 3 grupos; todos ellos recibieron peginterferón alfa 2b 1,5μmg/kg/semana; el primer grupo recibió además RBV 13,3mg/kg/día (800 a 1.400mg/día); el segundo, el mismo tratamiento más 40.000U de EPO a la semana, y el tercero una dosis más alta de RBV (15,2mg/kg/día; 1.000 a 1.600mg/día)+EPO. La EPO se administró desde el inicio para mantener la hemoglobina (Hb) entre 12 y 15g/dl21. Los pacientes del segundo grupo tuvieron un menor descenso de la Hb por debajo de 10g/dl (el 9 frente al 34%; p<0,05) y necesitaron menos reducción de RBV (el 10 frente al 40% del grupo 1; p<0,05). Aunque la tasa de RVS fue similar en ambos grupos (el 19 y el 29%), fue significativamente mayor en el grupo 3 (49%; p<0,05) a expensas de una menor tasa de recidiva (el 8 frente al 38% en los grupos 1 y 2). Sin embargo, pese al soporte de la EPO, el 27% de los pacientes precisaron una reducción de la dosis de RBV.
Papel de la ribavirina en la triple terapia con STAT-CLa RBV seguirá siendo necesaria en la triple terapia con fármacos específicamente dirigidos a dianas del VHC (STAT-C)22,23, como se demuestra en los brazos sin RBV, donde se observaron más recidivas22,23. En el estudio SPRINT-1, la reducción de la RBV a 400–800mg/día disminuye la probabilidad de RVS23. Por tanto, la RBV a dosis plenas en combinación con tratamientos basados en el interferón y agentes STAT-C seguirá siendo imprescindible en los próximos años.
Adhesión al tratamiento y respuesta virológica sostenidaEn un análisis retrospectivo de pacientes infectados con genotipo 1, los pacientes que recibieron el 80% de la dosis de peginterferón y RVB durante al menos el 80% de la duración tenían más probabilidades de alcanzar respuesta virológica sostenida que los que no alcanzaron este grado de cumplimiento24. Aunque es un punto aún no esclarecido de forma suficiente, parece que la reducción de la dosis de tratamiento durante las primeras 12 semanas a menos del 80% de la dosis planeada disminuye las probabilidades de respuesta25,26. Por tanto, la adhesión en este período, puede optimizar la respuesta al tratamiento.
Individualización del tratamiento en pacientes con genotipos 2 y 3 (fig. 2b)El estudio ACCELERATE es el más grande realizado hasta la fecha con genotipos 2 y 3 e incluyó a 1.469 pacientes de 132 hospitales de todo el mundo27. Los pacientes fueron asignados de forma aleatoria en la semana 16 a continuar tratamiento hasta la semana 24 o a seguimiento. Las tasas de RVS fueron del 76% en los pacientes tratados 24 semanas frente al 65% en los tratados 24 semanas. Sin embargo, el 67% de los pacientes presentó RVR. Cuando se analizaron los resultados según los pacientes habían alcanzado o no RVR, se observó que el 82% de los pacientes con RVR y tratados 16 semanas presentaba RVS frente al 90% de los tratados 24 semanas. Por tanto, aunque la tasa de RVS era algo inferior en los pacientes del tratamiento corto, las tasas de RVS en los que habían tenido RVR eran muy elevadas. En el caso de los pacientes sin RVR, las tasas de RVS eran muy bajas, independientemente de la duración del tratamiento: el 27% los del tratamiento corto frente al 49% los del tratamiento estándar.
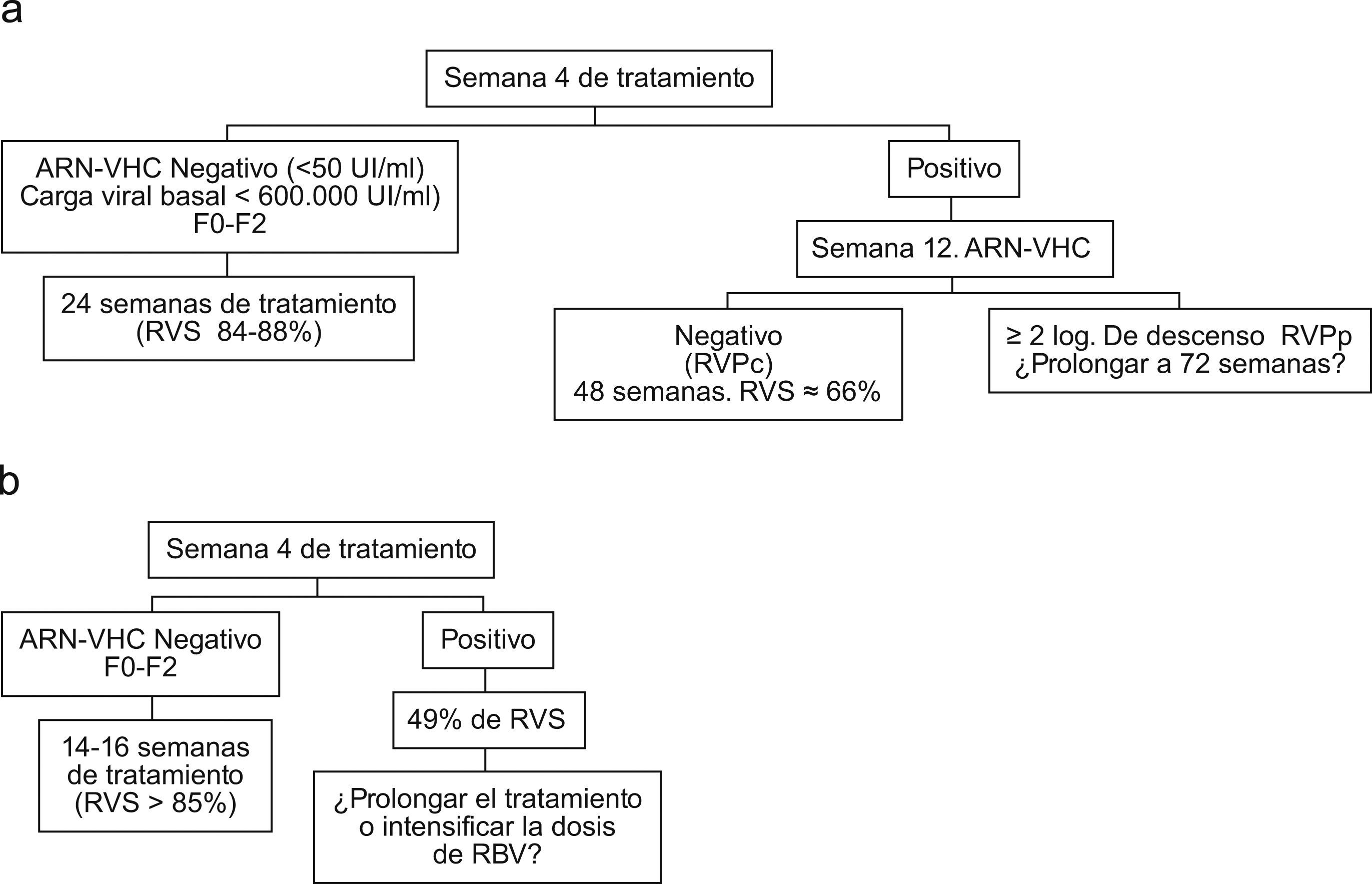
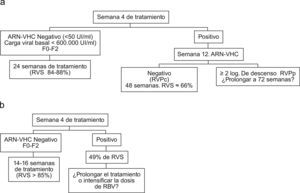
a) Propuesta de algoritmo en el tratamiento de los pacientes con genotipo 1. b) Propuesta de algoritmo en el tratamiento de los pacientes con genotipos 2 y 3. RVPc: respuesta virológica completa; RVPp: respuesta virológica precoz parcial; RVS: respuesta virológica sostenida; VHC: virus de la hepatitis C.
Existen pocos estudios que analicen la duración óptima del tratamiento en pacientes con genotipo 2. Yu et al28 estudiaron a 150 pacientes consecutivos con genotipo 2; los pacientes fueron aleatorizados en una proporción 1 a 2 para recibir tratamiento durante 14 o 24 semanas, respectivamente. Las tasas de RVS fueron del 94% en el grupo de 14 semanas de tratamiento y del 95% en el grupo de 24 semanas; las tasas de RVS en los pacientes con RVR fueron del 100% en el tratamiento abreviado y del 98% en el tratamiento estándar. Sin embargo, las tasas de RVS en los pacientes sin RVR fueron del 57 y el 77%, respectivamente.
Recientemente, Andriulli et al29 realizaron un metaanálisis de ensayos clínicos con genotipos 2 y 3 procedentes de 8 estudios. El genotipo 2 mostró mejor respuesta que el genotipo 3, en tratamientos de 24 semanas (el 74 frente al 68%). Sin embargo, esta diferencia fue más evidente cuando la viremia basal era alta (>600.000U/ml) (el 75 frente al 58%) o en ausencia de RVR (el 62 frente al 46%). Mientras que no hubo diferencias entre tratamientos cortos (12–16 semanas) y tratamiento de 24 semanas si los pacientes alcanzaban RVR, genotipo 2, el 83 y el 84%, respectivamente, y genotipo 3, el 84 y el 86%, respectivamente.
Propuesta de optimización del tratamiento de la hepatitis crónica por VHCLos pacientes con genotipo 1, fibrosis F0-F2, carga viral basal<600.000U/ml y RVR pueden tratarse 24 semanas con resultados similares a la duración de 48 semanas. No existe evidencia clara de que el tratamiento de 72 semanas en el subgrupo de pacientes con genotipo 1, que continúan con viremia detectable en la semana 12 pero negativizan el ARN-VHC en la semana 24, aporte beneficio clínico.
Los pacientes con genotipo 2 que alcanzan RVR pueden tratarse durante 14 semanas. Los que no alcanzan RVR deben tratarse al menos durante 24 semanas. En los pacientes con genotipo 3 y RVR, el tratamiento acortado consigue tasas de RVS elevadas, aunque ligeramente inferiores a los pacientes con RVR tratados durante 24 semanas. Los pacientes con genotipo 3 que no alcanzan RVR, no deben continuar incluyéndose entre la población denominada «fácil de tratar», y se desconoce si una intensificación del tratamiento (mayor duración o dosis mayores de RBV) aumentaría sus tasas de RVS.