Las enfermedades crónicas inmunomediadas, entre las cuales se encuentra la enfermedad inflamatoria intestinal (EII), presentan un riesgo mayor de desarrollar aterosclerosis precoz y eventos cardiovasculares (ECV) a edades tempranas.
ObjetivoDescribir el perfil cardiovascular basal y al año de tratamiento de los pacientes con EII según el tratamiento biológico recibido, teniendo en cuenta la actividad inflamatoria.
Pacientes y métodosEstudio retrospectivo y observacional que incluyó a 374 pacientes. Se recogieron los factores de riesgo cardiovascular (FRCV) y los ECV en la visita basal y al año de seguimiento para describir el RCV según el tratamiento biológico recibido, valorando también la remisión clínica y biológica.
ResultadosSe incluyó a un total de 374 pacientes 146 (38,73%) fueron tratados con infliximab, 128 (33,95%) con adalimumab, 61(16,18%) con ustekinumab y 42 (11,14%) con vedolizumab.
Los cambios en el valor de glucemia son 86,31mg/dl (84,57-88,06) vs. 89,25mg/dl (87,54-90,96), p=0,001, en el caso de los tratados con antifactor de necrosis (TNF)-α y de 86,52mg/dl (83,48-89,55) vs. 89,44mg/dl (85,77-93,11), p=0.11, en el otro grupo.
En el grupo tratado con anti-TNF-α los valores de colesterol total en la visita basal son 169,40mg/dl (164,97-173,83) vs. 177,40mg/dl (172,75-182,05) al año de tratamiento, p=<0,001, los de HDL 50,22mg/dl (48,39-52,04) vs. 54,26mg/dl (52,46-56,07), p=<0.001, y los de triglicéridos 114,77mg/dl (106,36-123,18) vs. 121,83mg/dl (112,11-131,54), p=0,054.
En cuanto al peso, se observó un aumento, tanto en aquellos pacientes tratados con anti-TNF-α (71,39kg [69,53-73,25] vs. 72,87kg [71,05-74,70], p <0,001), como en el grupo tratado con ustekinumab y vedolizumab (67,59kg [64,10-71,08] vs. 69,43kg [65,65-73,04], p=0,003].
En cuanto a los ECV, no se observaron diferencias clínica ni estadísticamente significativas ni en función del fármaco utilizado (p=0,36), ni atendiendo a los antecedentes personales de ECV (p=0,23) ni según la actividad inflamatoria (p=0,46).
ConclusionesNuestros resultados sobre una cohorte real de pacientes con EII en tratamiento con fármacos biológicos objetivan un mejor control de ciertos parámetros cardiovasculares tales como la proteína C reactiva o el HDL, pero con empeoramiento de otros, como el colesterol total o los triglicéridos, independientemente del fármaco utilizado. Por lo tanto, es posiblemente el control de la enfermedad y no la diana terapéutica empleada lo que influya sobre el RCV de estos pacientes.
Chronic immune-mediated diseases, including inflammatory bowel disease (IBD), present an increased risk of developing early atherosclerosis and cardiovascular events (CVE) at early age.
ObjectiveTo describe the baseline and 1-year cardiovascular profile of patients with IBD according to the biologic treatment received, taking into account the inflammatory activity.
Patients and methodsIt is a retrospective, observational study that included 374 patients. Cardiovascular risk factors (CVRF) and CVE were collected at the baseline visit and at one-year follow-up to describe the cardiovascular risk according to the biological treatment received, also assessing clinical and biological remission.
ResultsA total of 374 patients were included: 146 (38.73%) were treated with Infliximab, 128 (33.95%) with adalimumab, 61 (16.18%) with ustekinumab and 42 (11.14%) with vedolizumab.
The changes in blood glucose levels are [86.31mg/dL (84.57–88.06) vs. 89.25mg/dL (87.54–90.96), P=.001] for those treated with antiTNFα and [86.52mg/dL (83.48–89.55) vs. 89.44mg/dL (85.77–93.11), P=.11] in the other group.
In the group treated with antiTNFα total cholesterol values at baseline visit are [169.40mg/dL (164.97–173.83) vs. 177.40mg/dL (172.75–182.05) at one year of treatment, P=<.001], those of HDL [50.22mg/dL (48.39–52.04) vs. 54.26mg/dL (52.46–56.07), P=<.001] and those of triglycerides [114.77mg/dL (106.36–123.18) vs. 121.83mg/dL (112.11–131.54), P=.054].
Regarding weight, an increase was observed, both in those patients treated with antiTNFα [71.39kg (69.53–73.25) vs. 72.87kg (71.05–74.70), P<.001], and in the group treated with ustekinumab and vedolizumab [67.59kg (64.10–71.08) vs. 69.43kg (65.65–73.04), P=.003].
Concerning CVE, no significant differences were observed neither according to the drug used (p=0.36), nor according to personal history of CVE (P=.23) nor according to inflammatory activity (P=.46).
ConclusionsOur results on a real cohort of patients with IBD treated with biologic drugs show a better control of certain cardiovascular parameters such as CRP or HDL, but a worsening of others such as total cholesterol or triglycerides, regardless of the treatment. Therefore, it is possibly the disease control and not the therapeutic target used, the one that affect the cardiovascular risk of these patients.
La enfermedad inflamatoria intestinal (EII) agrupa una serie de trastornos crónicos, en los que se rompe la situación fisiológica de tolerancia inmunológica entre los antígenos luminales y el huésped, desarrollándose una respuesta inmunitaria desmesurada que produce lesiones de profundidad y extensión variable en el intestino. Sus principales manifestaciones clínicas son la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la colitis pendiente de clasificar o indeterminada (CI)1,2.
La EII forma parte de las llamadas enfermedades crónicas inmunomediadas (ECI), entre las cuales también se encuentran la artritis reumatoide, el lupus eritematoso sistémico o la esclerosis sistémica. Diversos estudios3-5 han demostrado la asociación existente entre este grupo de enfermedades y la enfermedad cardiovascular. Las ECI presentan un mayor riesgo de desarrollar aterosclerosis precoz y disfunción microvascular coronaria y, por tanto, un mayor riesgo de padecer eventos cardiovasculares (ECV) a edades tempranas. Se establecería entonces una relación directa entre el grado de inflamación presente en los individuos afectos y el riesgo de desarrollar ECV6,7.
Los antifactor de necrosis tumoral (TNF)-α han demostrado ser eficaces en disminuir el riesgo cardiovascular (RCV) en estas ECI8-10. Sin embargo, debido a su mecanismo de acción, no podemos determinar si dicha eficacia se debe al adecuado control de la inflamación o al propio bloqueo de la citocina que interviene tanto en el proceso aterogénico como en el proinflamatorio11.
Teniendo en cuenta lo anteriormente expuesto, en nuestro trabajo planteamos describir las modificaciones en los factores de RCV (FRCV) en pacientes con EII al inicio y al año de tratamiento, según si recibieron anti-TNF-α u otras moléculas con dianas terapéuticas (ustekinumab/vedolizumab). Como objetivo secundario, valoraremos la presencia de ECV teniendo en cuenta el tratamiento y la actividad inflamatoria de la enfermedad.
Pacientes y métodosSe trata de un estudio retrospectivo y observacional. Se incluyó a los pacientes diagnosticados de EC, CU y colitis indeterminada (CI) según los criterios de las guías europeas1,2, entre enero del 2006 y enero del 2020. Se incluyó únicamente a aquellos en los que la indicación de inicio de tratamiento fue la actividad luminal intestinal y que continuaban seguimiento estable en nuestro centro desde el inicio del tratamiento biológico hasta la actualidad.
Se recogieron los FRCV, incluyendo el índice de masa corporal (IMC), la hipertensión arterial (HTA), la glucemia, el colesterol total, el colesterol HDL, los triglicéridos y la prealbúmina en la visita basal previa al inicio del tratamiento biológico y al año de inicio de tratamiento.
También se recogieron los ECV mayores (ictus, infarto de miocardio) desde el inicio del tratamiento biológico hasta el final del seguimiento.
Asimismo, se obtuvieron las variables relativas a su EII, tales como tipo, afectación perianal, presencia de manifestaciones extraintestinales, antecedentes familiares, hábito tabáquico y la indicación del inicio del tratamiento. Por otro lado, mediante revisión de la historia clínica, se recogieron variables relativas al estado inflamatorio de su enfermedad en la visita basal y al año de tratamiento. La presencia de remisión clínica fue definida por los índices Mayo parcial ≤ 1 para CU y Harvey-Bradshaw ≤ 4 para EC. Para establecer la remisión bioquímica se fijaron valores de proteína C reactiva (PCR) <5mg/dl.
Se realizó un análisis descriptivo de las características basales y las relacionadas con su EII. Para las variables continuas, se calcularon la media y la desviación estándar; para las categóricas, se calcularon los porcentajes y los intervalos de confianza del 95%. Siempre que las variables tuviesen una distribución normal (comprobado mediante el test de Shapiro-Wilk), las variables categóricas fueron comparadas mediante el test de la χ2 y las variables cuantitativas mediante el de la t de Student para muestras relacionadas. En caso contrario, se aplicó el test no paramétrico de Wilcoxon. Un valor de p <0,05 fue considerado estadísticamente significativo. Para el análisis de los datos se empleó el programa Stata versión 15 (StataCorp, 2017. Stata Statistical Software: Release 15. College Station, TX: StataCorp LLC).
ResultadosSe incluyó a un total de 374 pacientes. La tabla 1 recoge las características basales de los pacientes incluidos. De nuestros pacientes, 291 (77,81%) presentaban EC, 79 (21,12%), CU, y 4 (1,07%), CI. De estos, 146 (38,73%) fueron tratados con infliximab, 128 (33,95%) con adalimumab, 61 (16,18%) con ustekinumab y 42 (11,14%) con vedolizumab.
Características basales de los pacientes incluidos
| Tipo de EII | Anti-TNF | Vedolizumab/ustekinumab | Total | Valor p |
|---|---|---|---|---|
| EC | 211 (72,5%) | 80 (27,5%) | 291 (77,81%) | |
| CU | 57 (72,15%) | 22 (27,85%) | 79 (21,12%) | 0,99 |
| CI | 3 (75%) | 1 (25%) | 4 (1,07%) | |
| Enfermedad perianal | ||||
| Sí | 83 (73,45%) | 30 (26,55%) | 133 (31,74%) | 0,60 |
| No | 172 (70,78%) | 71 (29,22%) | 113 (31,74%) | |
| Manifestaciones extraintestinales | ||||
| Sí | 114 (73,54%) | 41 (26,46%) | 155 (43,91%) | 0,48 |
| No | 139 (70,2%) | 59 (29,8%) | 198 (56, 09%) | |
| Antecedentes familiares | ||||
| Sí | 45 (36,6%) | 78 (63,4%) | 63 (18,21%) | 0,87 |
| No | 205 (91,9%) | 18 (8,1%) | 283 (81,79%) | |
| Fumador | ||||
| Activo | 62 (63,9%) | 35 (36,1%) | 97 (29,22%) | |
| Exfumador | 78 (83,88%) | 15 (16,12%) | 93 (28,01%) | |
| No | 97 (68,3%) | 45 (31,7%) | 142 (42,77%) | 0,006 |
| Indicación inicio tratamiento | ||||
| Fístula perianal | 24 (88,89%) | 3 (11,11%) | 27 (7,16%) | 0,061 |
| Inducción remisión | 187 (69%) | 84 (31%) | 271 (71,88%) | |
| Manifestaciones extraintestinales | 13 (86,67%) | 2 (13,33%) | 15 (3,98%) | |
| Mantenimiento remisión | ||||
| Otras fístulas | 22 (81,48%) | 5 (18,52%) | 27 (7,16%) | |
| Profilaxis recurrencia | 7 (100%) | 0 (0%) | 7 (1,86%) | |
| Otro | 14 (77,78%) | 4 (22,22%) | 18 (4,77%) | |
| 7 (58,33%) | 5 (41,67%) | 12 (3,18%) | ||
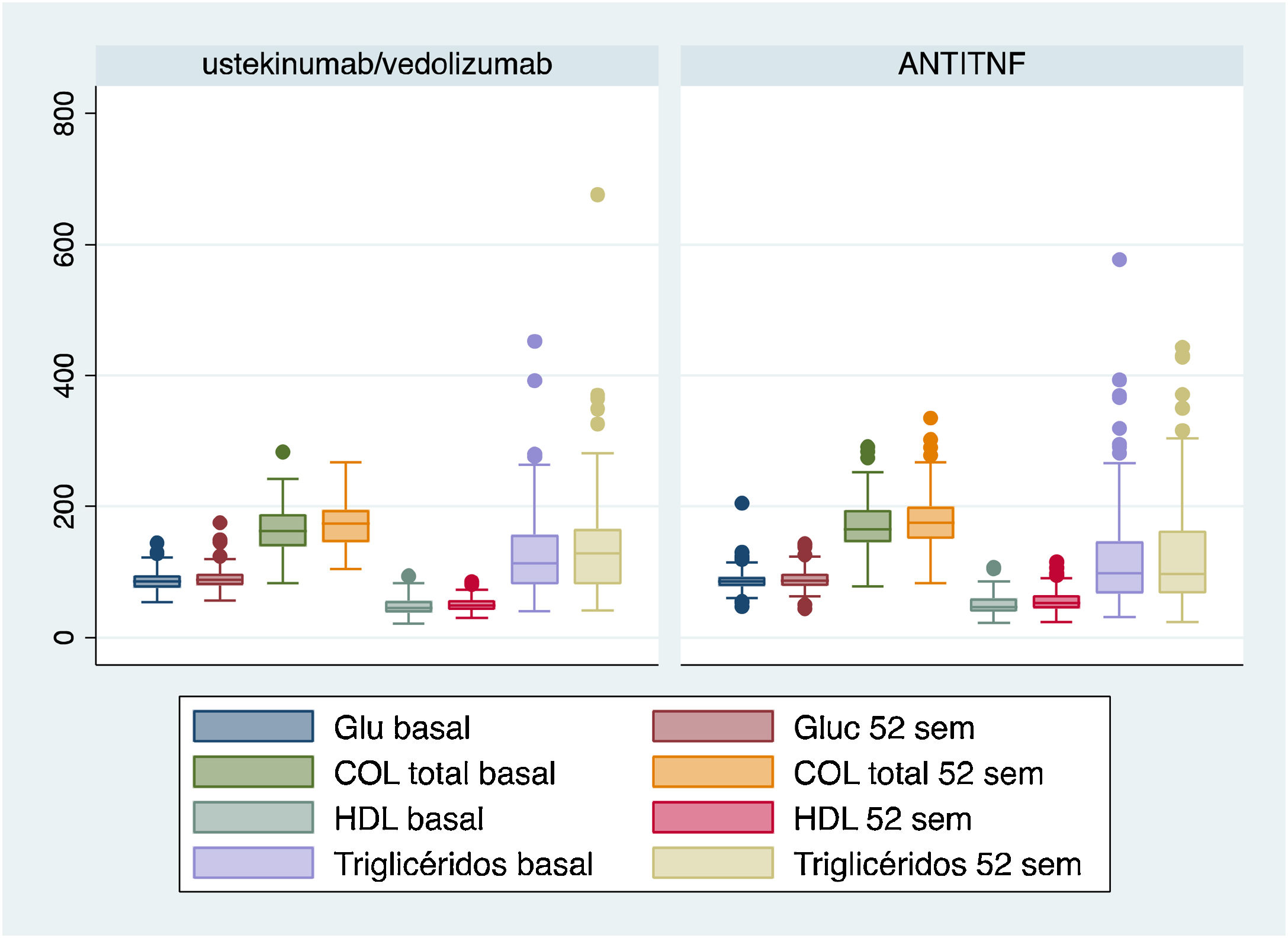
La figura 1 recoge los valores analíticos de los diferentes FRCV en ambos grupos de tratamiento (anti-TNF-α vs. vedolizumab y ustekinumab) comparando la visita inicial y el seguimiento al año.
Los cambios en el valor de glucemia son 86,31mg/dl (84,57-88,06) vs. 89,25mg/dl (87,54-90,96), p=0,001, en el caso de los tratados con anti-TNF-α y de 86,52mg/dl (83,48-89,55) vs. 89,44mg/dl (85,77-93,11), p=0.11, en el otro grupo.
En el grupo tratado con anti-TNF-α los valores de colesterol total en la visita basal son 169,40mg/dl (164,97-173,83) vs. 177,40mg/dl (172,75-182,05) al año de tratamiento, p=<0,001, los de HDL 50,22mg/dl (48,39-52,04) vs. 54,26mg/dl (52,46-56,07), p=<0,001, y los de triglicéridos 114,77mg/dl (106,36-123,18) vs. 121,83mg/dl (112,11-131,54), p=0,054.
En aquellos tratados con vedolizumab y ustekinumab, los valores de colesterol total son 159,77mg/dl (152,27-167,26) vs. 172,33mg/dl (165,27-179,39), p=<0,001, los de HDL 47,38mg/dl (44,15-50,60) vs. 50,44mg/dl (47,56-53,31), p=0,018, y los de triglicéridos 128,83mg/dl (113,23-144,43) vs. 142,08mg/dl (122,03-162,13), p=0,042.
En cuanto a los valores de la PCR, encontramos una disminución de estos al año de tratamiento. Los valores en el grupo de anti-TNF-α son 10-45mg/l (7,75-13,14) vs. 3,55mg/l (2,36-4,73), p<0,001, y 17,76mg/l (11,45-24,07) vs. 4,41mg/l (3,37-5,45), p=<0,001, en los tratados con vedolizumab y ustekinumab.
Respecto a los valores de prealbúmina en los tratados con anti-TNF-α, sus valores son 27,16mg/dl (19,87-34,45) vs. 30,37mg/dl (24,84-35,90), p=0,14. En el grupo tratado con vedolizumab y ustekinumab son 23,21mg/dl (12,92-33,50) vs. 27,31mg/dl (18,84-35,78), p=0,55.
En cuanto al peso, se observó un aumento, tanto en aquellos pacientes tratados con anti-TNF-α (71,39kg [69,53-73,25] vs. 72.87kg [71,05-74,70], p<0.001), como en el grupo tratado con ustekinumab y vedolizumab (67,59kg [64,10-71,08] vs. 69,43kg [65,65-73,04], p=0,003).
Dentro de nuestra muestra, de los 101 pacientes que no presentaban diabetes al inicio, 2 (1,98%) desarrollaron la enfermedad tras tratarse (p=<0,001). En el caso de la HTA, 3 pacientes (1,11%) de los 271 sanos al inicio la desarrollaron (p=<0,001).
En cuanto a los ECV, no se observaron diferencias clínica ni estadísticamente significativas ni en función del fármaco utilizado (p=0,36), ni atendiendo a los antecedentes personales de ECV (p=0,23) ni según la actividad inflamatoria (p=0,46). Nueve pacientes (2,39%) presentaron un nuevo ECV, de los cuales 4 (1,06%) fueron tratados con infliximab, 2 (0,53%) con adalimumab, 3 (0,79%) con ustekinumab y ninguno con vedolizumab.
DiscusiónEn la EII existen estudios que muestran unos valores de colesterol total y LDL al diagnóstico menores que en la población sana12, sin que esto suponga un factor protector de cara al desarrollo de ECV, ya que estos valores más bajos se explican en el contexto de consumo por la inflamación crónica.
Como observamos en nuestra muestra, un adecuado tratamiento de la enfermedad conlleva un aumento de los valores de colesterol equiparándolos a los de la población general. Por lo tanto, podría ser necesario el control de niveles de lípidos postratamiento para determinar si el aumento tras el control de la enfermedad se asocia a ECV.
Respecto al peso, aunque clásicamente los pacientes con EII presentan IMC más bajos, en la actualidad la obesidad supone una amenaza emergente13,14. Los pacientes incluidos en nuestro estudio son un claro ejemplo de este cambio, ya que la media de los valores de IMC, tanto en la visita basal (IMC 24,49, DE 4,58) como al año de tratamiento (IMC 24,93, DE 4,74), se encuentran en el rango de sobrepeso.
Existen estudios retrospectivos que muestran como un aumento en el IMC de pacientes tratados con infliximab se traduciría en una mayor probabilidad de presentar un brote de la enfermedad a pesar del buen cumplimiento terapéutico15. De acuerdo con esto, los datos de un aumento de peso obtenidos al año de tratamiento deben ser tratados con cautela, ya que no podemos discernir entre la ganancia debida a un mejor control de la enfermedad de base y la secundaria a malos hábitos higiénico-dietéticos.
En nuestra muestra observamos también un aumento en los niveles de glucemia en ambos grupos. Al centrarnos en la significación clínica de los mismos, reflejada en el desarrollo de diabetes mellitus, un 1,98% desarrolló la enfermedad tras tratarse, demostrándose una asociación estadísticamente significativa (p=<0,001), a pesar del pequeño tamaño muestral.
Aunque hasta la fecha la posible relación entre la EII y la diabetes no está claramente establecida, varios estudios sugieren un aumento de riesgo de presentar diabetes en pacientes con un estado de inflamación crónica16. En este sentido, un estudio realizado sobre la cohorte nacional de Corea del Sur muestra una mayor incidencia de diabetes en los pacientes con EII, tras ajustar por edad, sexo, IMC, hábito tabáquico y ejercicio físico. En especial en aquellos con EC y menores de 40 años17.
La tasa de desarrollo de HTA en nuestro estudio al año de tratamiento es del 1,11% y muestra un aumento estadísticamente significativo (p=<0.001). Estos datos irían en contra de lo recogido en estudios previos, donde se observó una menor tasa de HTA en pacientes con EII18. Esta tendencia que observamos precisaría de un estudio más exhaustivo, de cara a discernir la causa de dicho aumento en nuestros pacientes.
En cuanto a los marcadores séricos, los valores de PCR de nuestros pacientes muestran una reducción claramente significativa al año del inicio de tratamiento, lo cual se correspondería con un mejor control de la inflamación y una disminución del RCV.
En cuanto a los fármacos biológicos, estudios más recientes de la EII demuestran una reducción del riesgo de ECV en aquellos pacientes tratados con anti-TNF-α, en especial en hombres con EC19.
En nuestro estudio, si bien el número de ECV es muy limitado, encontramos datos concordantes con lo comentado previamente, ya que no se observó un mayor número de eventos independientemente del fármaco utilizado.
Más recientemente, contamos con un estudio realizado en pacientes con EII tratados con ustekinumab con resultados que contradicen la evidencia previa. Este estudio publicado en 2020 en una cohorte francesa, muestra un mayor riego de presentar ECV en los 6 primeros meses tras el inicio del tratamiento entre aquellos pacientes de alto RCV (OR 4,17; IC del 95%, 1,19-14,59)20. Estos datos se apoyarían en la hipótesis del cambio inmunológico agudo inducido tras el inicio de un tratamiento biológico, que actuaría sobre la placa de ateroma desestabilizándola.
En nuestra muestra el número de ECV en los pacientes tratados con los distintos tipos de biológicos es bajo (2,39%). No observamos influencia del tipo de biológico ni del control de la actividad inflamatoria, por lo que nuestros resultados apoyarían los hallazgos previos21,22, que indican que no existen diferencias sustanciales en el riesgo cardiovascular asociado al uso de los diferentes fármacos biológicos, si bien nuestros resultados pueden no ser concluyentes debido a que el bajo número de ECV registrados es insuficiente para detectar diferencias significativas si las hubiera.
Por otro lado, en nuestra muestra los pacientes con FRCV y antecedentes de ECV mostraron un riesgo similar de ECV al año de tratamiento, independientemente del fármaco empleado y no diferente respecto a población general23, entendida como aquellos pacientes sin antecedentes de interés. Este hecho podría tener utilidad en la práctica clínica a la hora de elegir qué tratamiento iniciar en un paciente con antecedentes personales, ya que estos no supondrían una limitación en la elección según nuestros datos, si bien para confirmar nuestros resultados serían necesarios estudios prospectivos donde el número de ECV en la muestra tuvieran la suficiente potencia estadística.
ConclusionesDescribimos la evolución del perfil cardiovascular de una cohorte real de pacientes con EII en tratamiento con fármacos biológicos. Objetivamos un mejor control de ciertos parámetros cardiovasculares, tales como la PCR o el HDL, pero con empeoramiento de otros como el colesterol total, los triglicéridos o la glucemia, independientemente del fármaco utilizado. Por lo tanto, es posiblemente el control de la enfermedad y no la diana terapéutica empleada lo que influya sobre el riesgo cardiovascular.
Además, los resultados sugieren que dichos tratamientos no suponen un aumento del RCV para los pacientes, si bien, dado el escaso número de ECV de nuestra muestra, son necesarios estudios prospectivos, de base poblacional para llegar a dichas conclusiones.
Consideraciones éticasEn cumplimiento de la Ley de Portabilidad y Responsabilidad del Seguro Médico (HIPAA), los datos de los pacientes incluidos en el análisis fueron anonimizados. Dado que este estudio fue un análisis retrospectivo de datos no identificados, no se requirió ni se solicitó la revisión del comité de Ética.
FinanciaciónNo se ha recibido financiación de ningún tipo para la realización de este estudio.
Conflicto de interesesCristina Suárez Ferrer ha recibido financiación para formación o ha colaborado con Abbvie, Takeda, Jannsen, MSD, Thillotts Pharma, Pfizer. María Dolores Martín Arranz ha recibido honorarios como ponente, consultora y miembro asesor de o ha recibido financiación para investigación de MSD, AbbVie, Hospira, Pfizer, Takeda, Janssen, Shire Pharmaceuticals, Tillotts Pharma, Faes Pharma. Estas empresas fabrican tratamientos médicos para la EII. Eduardo Martín Arranz ha recibido apoyo financiero para viajes y actividades educativas o ha recibido honorarios como ponente o consultor de Janssen Ferring, MSD, AbbVie y Takeda. Joaquín Poza Cordón ha recibido financiación para formación o ha colaborado con Janssen, AbbVie, Merck Sharp & Dohme, Ferring Pharmaceuticals, Shire Pharmaceuticals. María Sánchez Azofra ha recibido apoyo financiero para viajes y actividades educativas, o ha recibido honorarios como ponente de Janssen, Takeda, Pfizer, Tillotts Pharma, Ferring Pharmaceuticals. Jose Luis Rueda García ha recibido apoyo financiero para viajes y actividades educativas, o ha recibido honorarios como ponente de Janssen, Pfizer, Takeda, Ferring, Tillotts Pharma, Faes Farma, Norgine y Casen Recordati.