La enfermedad inflamatoria intestinal (EII), comprende tanto a la colitis ulcerosa como a la enfermedad de Crohn, entidades consideradas enfermedades inmunomediadas, sistémicas y de curso crónico que conllevan a menudo el desarrollo de manifestaciones extraintestinales. A pesar de que el estudio de las comorbilidades haya sido desarrollado tradicionalmente en contexto de otras enfermedades inflamatorias sistémicas, este concepto está emergiendo también en la EII. Multitud de patologías han sido vinculadas a la EII, entre las que destaca la enfermedad cardiovascular, la primera causa de muerte en los países desarrollados. Los pacientes con EII están expuestos a un mayor riesgo de entidades tales como arterosclerosis precoz e infarto de miocardio, o trombosis venosas y tromboembolismo pulmonar. El objetivo de esta revisión es hacer una aproximación a la fisiopatología de las diferentes manifestaciones de la enfermedad cardiovascular en los pacientes con EII y de cómo prevenirlas.
Inflammatory bowel disease (IBD) includes both ulcerative colitis and Crohn's disease, which are well recognised as chronic systemic and immune-mediated conditions that frequently involve extraintestinal manifestations. Although comorbidities have long been the subject of research in other chronic inflammatory diseases, this concept is also emerging in IBD. Many pathologies have been linked to IBD, including cardiovascular disease, which is the main cause of death in developed countries. IBD patients are at increased risk of conditions such as early atherosclerosis and myocardial infarction or venous thrombosis and pulmonary thromboembolism. The aim of this review is to make an approximation of the physiopathology of the different manifestations of cardiovascular disease in patients with IBD and how to prevent them.
La enfermedad de Crohn (EC) y la colitis ulcerosa (CU) son enfermedades inflamatorias crónicas inmunomediadas que afectan principalmente al tracto gastrointestinal1. Sin embargo, hasta un quinto de los pacientes pueden presentar compromiso de otros órganos o sistemas2,3, por lo que parece razonable considerarlas como enfermedades sistémicas4,5.
A pesar de que los estudios sobre comorbilidad en enfermedad inflamatoria intestinal (EII) son menos comunes en comparación con artritis reumatoide y psoriasis, ya en 1996 Hudson et al., sugirieron que la EII podría suponer un factor de riesgo independiente para el incremento de riesgo cardiovascular (CV)6. La inflamación crónica sistémica se asocia a arteriosclerosis precoz7,8, aunque otros factores como obesidad o el síndrome metabólico contribuyen también de forma significativa a este riesgo en los pacientes con EII9,10.
Los objetivos de esta revisión narrativa de la literatura son evaluar los factores y mecanismos probables que subyacen al mayor riego de enfermedad CV en pacientes con EII. Para ello se ha realizado una búsqueda sistematizada, en metabuscadores Pubmed, Cochrane Database y Embase, sin restricción de lenguaje de los últimos 10 años.
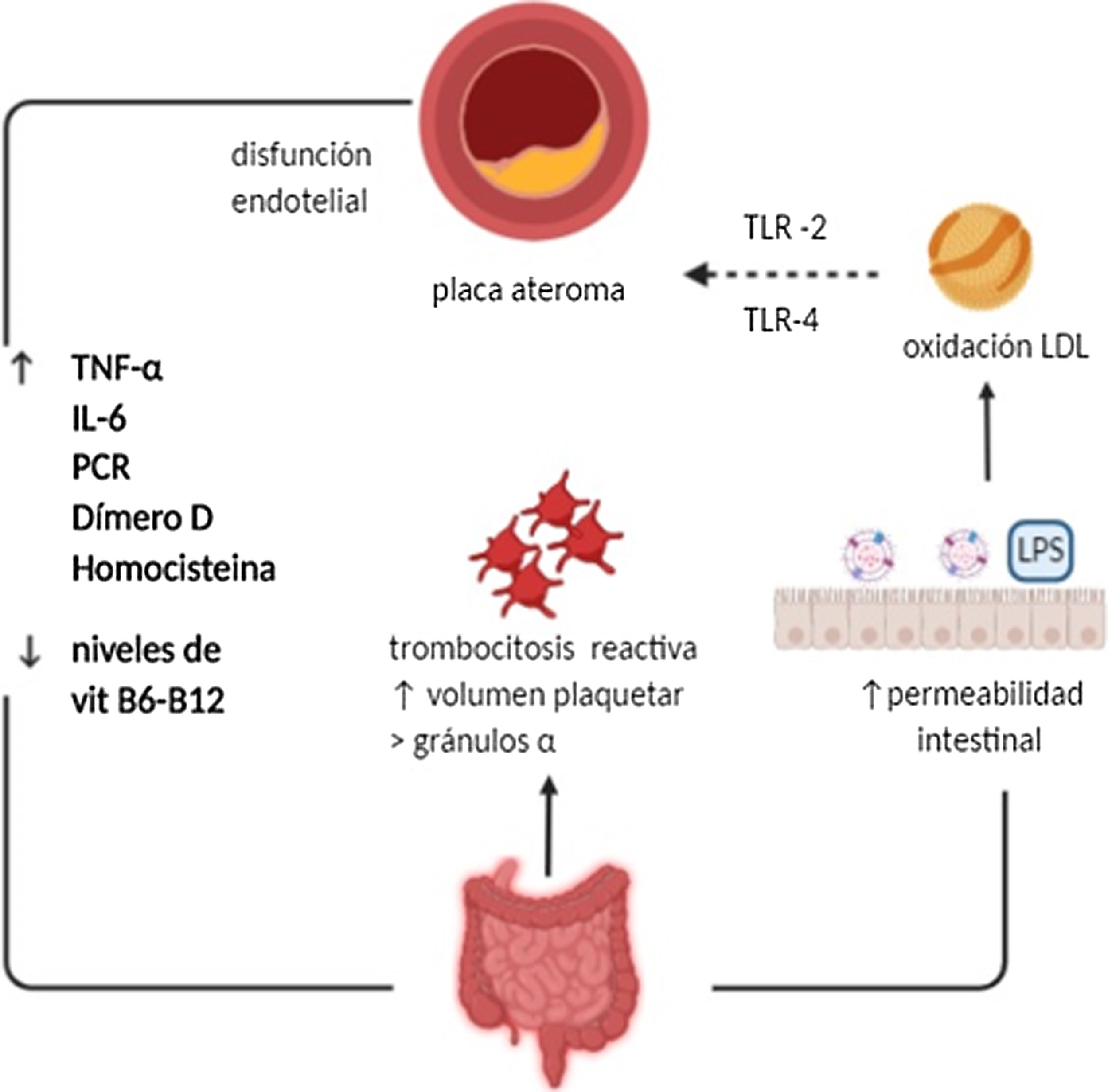
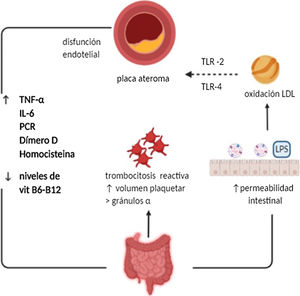
Fisiopatología de la enfermedad cardiovascular en pacientes con EIIArteriosclerosis en pacientes con EIILa arteriosclerosis es una enfermedad crónica de curso progresivo, caracterizada por la pérdida de elasticidad de los vasos arteriales. Sus lesiones precursoras consisten en depósitos subendoteliales de macrófagos cargados de moléculas de colesterol. Posteriormente, las formaciones de lípidos y células inmunes (macrófagos, mastocitos y células T) activadas previamente por microorganismos, autoantígenos y moléculas inflamatorias, constituyen verdaderas placas de ateroma que se localizan en la capa íntima de las grandes y medianas arterias8. Las placas que se generan pueden ser extremadamente complejas, con calcificaciones y ulceraciones en su superficie. Además, cuando se produce la activación de las células inmunes se genera la liberación de citoquinas inflamatorias que provocan inestabilidad en la placa al propiciar la formación de agentes protrombóticos y procoagulantes. De esta forma, pueden generar una oclusión total de su luz debido a la génesis de un trombo en su superficie, o bien porque este ha migrado y se comporta como un émbolo que ocluye sus porciones distales11.
En los pacientes con EII es también frecuente observar desórdenes plaquetarios que pueden contribuir en el fenómeno de la aterotrombosis. La primera vez que se describieron fue a fines de la década de los 60, cuando se correlacionó el incremento en el número de plaquetas con la intensidad de la actividad inflamatoria clínica12. Además, estas se caracterizan por un mayor tamaño y densidad, lo que se correlaciona también con la intensidad de la actividad inflamatoria. Las plaquetas de mayor tamaño son metabólica y enzimáticamente más activas que las de menor tamaño, lo que se traduce en un mayor potencial trombótico debido al aumento del tromboxano A2 y B2 y a la expresión del receptor de la glicoproteína IIb-IIIa. Además, pueden liberar de sus gránulos-α sustancias tales como: factor plaquetario, selectina-P, y factor derivado del crecimiento plaquetario que contribuye a la proliferación vascular neo-intimal13,14.
Múltiples marcadores de aterosclerosis han sido estudiados en pacientes con EII, incluyendo reactantes de fase aguda como dímero D y factor von Willenbrand15,16. Otra molécula implicada en su fisiopatología es la proteína C reactiva (PCR), que se encuentra elevada especialmente durante los brotes de la enfermedad17. El factor de necrosis tumoral alfa (TNF-α), citoquina proinflamatoria y proaterogénica, también se encuentra elevada en la EII18. Del mismo modo, niveles elevados de homocisteína han demostrado ser parte del proceso fisiopatológico de la arterosclerosis a través del incremento del estrés oxidativo y descenso de los niveles de óxido nítrico. En pacientes con EII, la hiperhomocisteinemia es 4,6 veces más frecuente que en sujetos sanos, especialmente en los momentos de enfermedad clínicamente activa19. Niveles disminuidos de vitamina B6 y B12 se han visto relacionados también con este incremento de riesgo en pacientes con EII20,21. Por último, el parámetro bioquímico más específico asociado a actividad inflamatoria en los pacientes con EII es la calprotectina, que además ha demostrado ser un factor de riesgo independiente de padecer enfermedad CV recurrente de forma precoz22.
Un mecanismo adicional en pacientes con EII que puede incrementar el riesgo tromboembólico, es el aumento de la permeabilidad de la pared intestinal que, si bien es la causa principal de la inflamación sistémica, permite además el paso directo de péptidos bacterianos o microorganismos al torrente sanguíneo generando una endotoxemia metabólica, sustrato directo para la formación de microcoágulos de fibrina23,24. A su vez, niveles elevados de lipopolisacáridos bacterianos, pueden inducir citoquinas proinflamatorias que contribuyan al daño endotelial y formación de células espumosas (macrófagos) estimulando la oxidación de las LDL, siendo estas últimas tóxicas para el endotelio25,26. El efecto microbiano sobre la aterogénesis podría estar mediado por los receptores toll-like receptors 2 (TLR2) y 4 (TLR4), que se encuentran elevados en las placas ateroscleróticas27 (fig. 1).
Factores asociados con el riesgo cardiovascular en pacientes con enfermedad inflamatoria intestinal8-17.
La prevalencia de sobrepeso y obesidad en pacientes con EII es similar o superior a la de la población general como se ha observado en algunos estudios28,29. Esto puede generar un efecto deletéreo en el curso de la enfermedad puesto que el tejido adiposo constituye un órgano hormonalmente activo y es capaz de producir citoquinas proinflamatorias30. Otros factores de riesgo para la enfermedad CV como la diabetes mellitus, pueden presentarse también con más frecuencia en los enfermos con EII31.
La dislipemia, constituye uno de los principales factores de riesgo CV32 y la inflamación crónica puede generar importantes cambios en el perfil lipídico33. La detección de niveles alterados de lípidos en los pacientes con EII puede ser debida también al posible estado de malnutrición, malabsorción o al antecedente de resección intestinal34. Algunos estudios afirman que los pacientes con EII presentan con mayor frecuencia niveles disminuidos de colesterol HDL, y elevados de LDL35. Sin embargo, se ha descrito también el incremento del riesgo CV a pesar de niveles disminuidos36. Parece, por tanto, que son necesarios más estudios acerca del papel que juegan las lipoproteínas en el riesgo CV de estos pacientes.
También se ha descrito la coexistencia entre la enfermedad hepática grasa no alcohólica y la EII con una prevalencia superior a la de la población general37, de tal forma que algunos autores recomiendan su cribado38.
Eventos cardiovascularesTrombosis arteriales: infarto agudo de miocardio (IAM)/accidentes cerebrovasculares (ACV)Bernstein et al., reportaron un mayor riesgo de fenómenos tromboembólicos arteriales en la población con EII al compararla con sujetos sanos, destacando los cerebrales como más frecuentes en la EC [incidence rate ratio (IRR) 1,26; IC 95% (1,05-1,66)], fenómeno que se ha atribuido, entre otros, a su mayor riesgo de déficit de vitamina B6 y niveles aumentados de homocisteina39. El grupo de Anderson detectó este incremento de riesgo en los pacientes menores de 50 años40, y en un estudio francés, la actividad inflamatoria actuó como factor independiente41, lo que concuerda con los datos de otro estudio en que el número de IAM y de ACV fue significativamente superior en pacientes con enfermedad activa [IRR 1,76 (1,14-2,74) y IRR1,88 (1,26-2,81 respectivamente]42.
En cuanto al sexo, en una cohorte retrospectiva de 17.487 pacientes EII vs 69.948 controles, se observó que las mujeres mayores de 40 años con EII tienen un mayor riesgo de IAM (HR = 1,6, p = 0,003), mientras que las menores de 40 exhiben un riesgo dos veces mayor de ACV (HR = 2,1, p = 0,04) lo que no se apreció en la población masculina43. En una revisión sistemática se determinó también un mayor riesgo para eventos cardiovasculares y cerebrovasculares en las mujeres [OR 1,26 (1,18-1,35)] pero no en los hombres [OR 1,05 (0,92-1,21)]44. A pesar de que el sexo femenino tiene menor riesgo de enfermedad coronaria que el masculino en la población general, parece que las mujeres con EII presentan una mayor activación de la cascada inflamatoria, desempeñando este hecho un papel clave45. Los eventos CV son más frecuentes durante el primer año posdiagnóstico, momento en el que el control de la actividad inflamatoria puede llegar a suponer en algunos casos un verdadero reto clínico46.
Trombosis venosasLos eventos trombóticos venosos suponen una importante causa de morbimortalidad en los enfermos con EII, con un incremento de riesgo de 1,5-4 con respecto a la población general, especialmente en los períodos de actividad de la enfermedad47, o el embarazo y el posparto48,49. Los lugares donde habitualmente se manifiestan son el sistema venoso de las extremidades inferiores y el pulmonar, seguido del portal y mesentérico. Otras localizaciones más infrecuentes son la cerebrovascular y retiniana.
Para prevenir estos eventos es importante un correcto asesoramiento de los pacientes dirigido a la importancia de evitar la vida sedentaria, el tabaco, el tratamiento anticonceptivo oral, así como mantener una correcta hidratación. La corrección de los déficits vitamínicos es importante, especialmente de vitaminas B6, B12 y ácido fólico, puesto que pueden ayudar a reducir los niveles de homocisteína50. Durante los brotes de la enfermedad, el tratamiento profiláctico con heparina debe ser considerado en todos los casos según las guías de práctica clínica51. Sin embargo, su duración es objeto de debate en la actualidad, y no hay estudios aleatorizados y controlados que permitan establecer recomendaciones firmes al respecto.
Pericarditis-miocarditisSe ha observado la presencia de pericarditis con mayor frecuencia que en la población general, tanto en EC (prevalencia de 0,19%) como en CU (0,23%); con mayor probabilidad en hombres48,52. En un estudio de seguimiento danés en 15.572 pacientes, se observó un riesgo global de 4,6 casos/100.000 pacientes/año, con un IRR de 8,3 en EC y 2,6 en CU49. No obstante, aunque pueda deberse a mecanismos inmunomediados, hay que excluir siempre su relación con el tratamiento con mesalazina o infliximab. El diagnóstico diferencial es complejo, y puede exigir biopsia endomiocárdica53,54.
Trastornos del ritmo: fibrilación auricular y otrosLa inflamación crónica y las alteraciones hidroelectrolíticas son factores que pueden influir en el aumento del intervalo QT y por tanto la aparición de arritmias ventriculares55. Por otra parte, un estudio nacional danés de 24.499 de pacientes EII, observó una mayor incidencia de FA durante los brotes [IRR 2,63 (2,26-3,06)] y en presencia de actividad inflamatoria persistente [IRR 2,06 (1,67-2,55)], no así en los períodos de remisión clínica [IRR 0,97 (0,88-1,08)]56.
Es conocido el aumento de la prevalencia de FA con la edad, sin embargo, en pacientes con EII, se ha observado prospectivamente una mayor incidencia edades tempranas y significativamente mayor en pacientes sin factores de riesgo CV asociados como diabetes mellitus, hipertensión o dislipemia y en aquellos que se encontraban en tratamiento con inmunomoduladores, corticoides o terapia biológica (HR 1,46; 1,37 y 2,38, respetivamente)57.
Es por ello, que parece recomendable realizar un electrocardiograma a todo paciente con EII que presente taquicardia, sobre todo en pacientes hospitalizados o que se encuentren en período de brote de la enfermedad, por la importancia de instaurar de forma precoz el tratamiento antiarrítmico y anticoagulante oportuno58.
Tratamiento para la EII y riesgo CV- -
Corticosteroides: Se ha asociado a un incremento del riesgo CV en los pacientes tratados con corticosteroides46. Este efecto, podría explicarse por su influencia en la aparición de factores de riesgo CV tradicionales que condicionan mayor riesgo CV también en la población general.
- -
5-aminosalicilatos (5-ASA): El estudio liderado por Rungoe46, observó que el tratamiento con fármacos 5-ASA está vinculado a una reducción dosis dependiente del riesgo CV en pacientes con EII.
- -
Fármacos anti-TNF(infliximab, adalimumab, certolizumab y golimumab): Parece no haber diferencias en cuanto al riesgo CV en pacientes sometidos a tratamiento anti-TNF al compararlos con los que no (IRR 0,6; 95% CI 1,16-1,32)46. Sin embargo, es importante considerar que los fármacos anti-TNF están contraindicados en pacientes con insuficiencia cardíaca moderada-grave59.
- -
Inhibidores de la α4β7 integrina: Vedolizumab, parece ser un fármaco seguro desde el punto de vista CV, como notificaron recientemente Cross et al. tras evaluar los efectos adversos notificados a la FDA durante un año en pacientes en tratamiento con anti-TNF y vedolizumab60.
- -
Inhibidores de la JAK kinasa: Se ha relacionado con una mayor tendencia a presentar alteraciones del perfil lipídico61 y desarrollar eventos trombóticos venosos en pacientes con artritis reumatoide, mayores de 65 años y con dosis elevadas (10 mg dos veces al día)62,63.
Durante los últimos años se ha observado que los pacientes con EII están expuestos a un mayor riesgo CV. La fisiopatología que condiciona este aumento de riesgo no se conoce con certeza, sin embargo, los datos disponibles sugieren que las consecuencias de la inflamación sistémica pueden contribuir de forma notable.
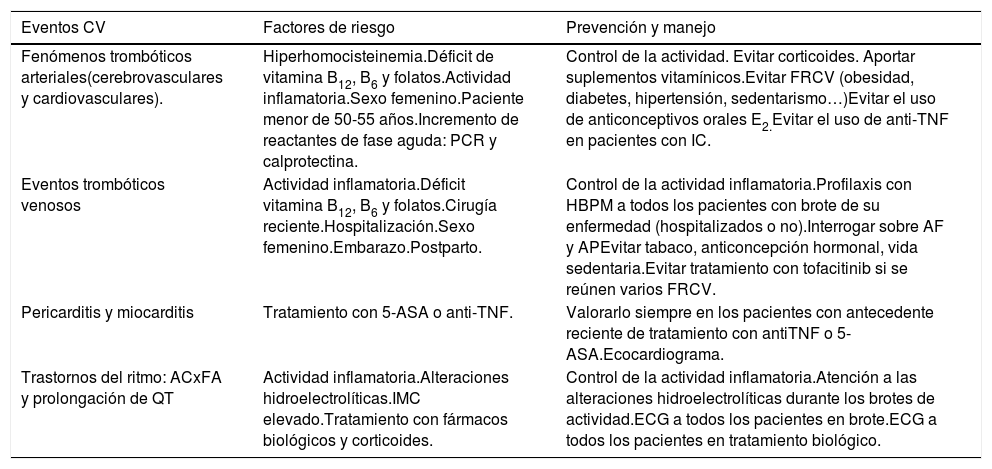
De este modo, se ha determinado un incremento tanto de eventos trombóticos venosos como arteriales, siendo estos últimos menos frecuentes. Los principales eventos arteriales son los cerebrovasculares, que ocurren con mayor frecuencia en pacientes jóvenes, mujeres y durante períodos de actividad de la enfermedad. Es en este último escenario donde también se pueden presentar cuadros de pericarditis y arritmias. Por todo ello, es de vital importancia el control de la actividad inflamatoria, lo que podría disminuir la probabilidad de desarrollar estas complicaciones. En la tabla 1, se describen los principales eventos CV descritos en los pacientes con EII, sus factores de riesgo y herramientas de prevención.
Eventos cardiovasculares asociados con enfermedad inflamatoria intestinal
| Eventos CV | Factores de riesgo | Prevención y manejo |
|---|---|---|
| Fenómenos trombóticos arteriales(cerebrovasculares y cardiovasculares). | Hiperhomocisteinemia.Déficit de vitamina B12, B6 y folatos.Actividad inflamatoria.Sexo femenino.Paciente menor de 50-55 años.Incremento de reactantes de fase aguda: PCR y calprotectina. | Control de la actividad. Evitar corticoides. Aportar suplementos vitamínicos.Evitar FRCV (obesidad, diabetes, hipertensión, sedentarismo…)Evitar el uso de anticonceptivos orales E2.Evitar el uso de anti-TNF en pacientes con IC. |
| Eventos trombóticos venosos | Actividad inflamatoria.Déficit vitamina B12, B6 y folatos.Cirugía reciente.Hospitalización.Sexo femenino.Embarazo.Postparto. | Control de la actividad inflamatoria.Profilaxis con HBPM a todos los pacientes con brote de su enfermedad (hospitalizados o no).Interrogar sobre AF y APEvitar tabaco, anticoncepción hormonal, vida sedentaria.Evitar tratamiento con tofacitinib si se reúnen varios FRCV. |
| Pericarditis y miocarditis | Tratamiento con 5-ASA o anti-TNF. | Valorarlo siempre en los pacientes con antecedente reciente de tratamiento con antiTNF o 5-ASA.Ecocardiograma. |
| Trastornos del ritmo: ACxFA y prolongación de QT | Actividad inflamatoria.Alteraciones hidroelectrolíticas.IMC elevado.Tratamiento con fármacos biológicos y corticoides. | Control de la actividad inflamatoria.Atención a las alteraciones hidroelectrolíticas durante los brotes de actividad.ECG a todos los pacientes en brote.ECG a todos los pacientes en tratamiento biológico. |
ACxFA: arritmia completa por fibrilación auricular; AF: antecedentes familiares; AP: antecedentes personales; CV: cardiovascular; E2: estrogénicos; ECG: electrocardiograma; FRCV: factores de riesgo cardiovascular. IC: insuficiencia cardíaca; IMC: índice de masa corporal; PCR: proteína C reactiva.
Por último, es necesario considerar las terapias utilizadas a corto y largo plazo dado que pueden contribuir al aumento del riesgo CV en estos pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.