El registro y la medición de los indicadores de calidad suponen una oportunidad de mejora. Sin embargo, no existen experiencias previas en nuestro medio sobre su cumplimiento en la esofagogastroduodenoscopia (EGD).
ObjetivoAnalizar el cumplimiento de los criterios de calidad de las EGD y evaluar la mejora tras la realización de un programa de formación.
Pacientes y métodos Estudio comparativo de 2 cohortes: una, retrospectiva (grupo control) y otra, prospectiva (grupo intervención), antes y después de un programa de formación que consistió en una sesión informativa y la mejora del programa de elaboración de informes. Se utilizaron los indicadores de calidad propuestos por la American Society for Gastrointestinal Endoscopy y el American College of Gastroenterology.
ResultadosSe incluyeron un total de 1.200 EGD de forma secuencial (600 en cada grupo). Tras el programa de formación se observó una mejoría significativa en los siguientes indicadores: indicación documentada (93 vs. 99,8%; p<0,01), exploraciones completas documentadas (94,7 vs. 97,3%; p<0,01), actuación correcta (63,7 vs. 87,9%; p<0,01), toma adecuada de biopsias según protocolos (57,9 vs. 83,8%; p<0,01), fotodocumentación de lesiones descritas (84,1 vs. 94,9%; p<0,01], fotodocumentación por segmentos (52,9 vs. 70,5%; p<0,01) y valoración global correcta (56,9 vs. 90,5%; p<0,01). La toma de biopsias para celiaquía, la indicación documentada, la exploración completa y la actuación correcta, si procedía, consiguieron superar el estándar recomendado.
ConclusiónUn programa de formación muy sencillo mejora los indicadores de calidad de la EGD, alcanzando la mayoría los estándares recomendados por la American Society for Gastrointestinal Endoscopy y el American College of Gastroenterology.
There is an opportunity for improvement in the recording and measuring of quality indicators. However, no previous experiences exist in our field in terms of their compliance in esophagogastroduodenoscopy (EGD).
ObjectiveTo analyse compliance with EGD quality criteria and evaluate improvement after conducting a training programme.
Patients and methodsComparative study of 2 cohorts: one retrospective (control group) and one prospective (intervention group), before and after a training programme consisting of an information session and the report writing improvement programme. The quality indicators proposed by the American Society for Gastrointestinal Endoscopy and the American College of Gastroenterology were used.
ResultsA total of 1,200 EGDs were included in a sequential manner (600 in each group). Following the training programme, a significant improvement was observed in the following indicators: documented indication (93 vs. 99.8%; P<0.01), documented full examinations (94.7 vs. 97.3%; P<0.01), correct performance (63.7 vs. 87.9%; P<0.01), appropriate biopsies according to protocols (57.9 vs. 83.8%; P<0.01), photo-documentation of described lesions (84.1 vs. 94.9%; P<0.01), photo-documentation per segment (52.9 vs. 70.5%; P<0.01) and correct overall assessment (56,9 vs. 90.5%; P<0.01). Biopsies for coeliac disease, documented indication, full examination and correct performance, if it went ahead, exceeded the recommended standard.
ConclusionA very simple training programme improves EGD quality indicators, with the majority reaching the standards recommended by the American Society for Gastrointestinal Endoscopy and the American College of Gastroenterology.
La esofagogastroduodenoscopia (EGD) se utiliza ampliamente en el diagnóstico y tratamiento de lesiones esofágicas, gástricas y del duodeno y es considerada un procedimiento seguro y bien tolerado. Entre las múltiples indicaciones aceptadas se incluyen: disfagia, hemorragia gastrointestinal, úlcera péptica, enfermedad por reflujo refractaria al tratamiento, estudio de anemia y enfermedad celiaca. Durante la exploración pueden realizarse biopsias diagnósticas, así como tratamientos para extirpar lesiones, obtener la hemostasia y la dilatación, o la colocación de prótesis en estenosis1.
La calidad de la atención de la salud puede medirse comparando el trabajo de un individuo o de un grupo con un patrón de referencia. El parámetro que se utiliza para la comparación se denomina indicador de calidad. Los indicadores de calidad se pueden registrar como la relación entre la incidencia de funcionamiento correcto y la oportunidad para el mismo o como la proporción de las intervenciones que logren un objetivo predefinido. Los indicadores de calidad se pueden dividir en 3 categorías: 1) estructurales, que evalúan las características de toda la atención de la salud (por ejemplo, la participación de un médico u otro tipo de personal clínico en un registro de datos clínicos que incluye un consenso aprobado de medidas de calidad de la colonoscopia de cribado del cáncer colorrectal); 2) del proceso, que evalúan el rendimiento durante la intervención o exploración (por ejemplo, la frecuencia con la que los antibióticos profilácticos se prescriben antes de la colocación de una gastrostomía de alimentación), y 3) valoración del resultado o atención proporcionada (por ejemplo, la tasa de eventos adversos de la EGD)1,2.
Los indicadores de calidad deben ser objetivos, factibles, fáciles de ser medidos e implicar una mejora en el manejo del paciente. El propósito de la medición y el registro de los indicadores de calidad es identificar aquellos aspectos en los que existe una falta de cumplimiento, lo que permitirá centrar los esfuerzos en mejorarlos y conducir a una atención de la más alta calidad que beneficie a nuestros pacientes3.
La evaluación de la calidad en endoscopia es actualmente una prioridad y en la última década se ha realizado un gran esfuerzo para identificar indicadores de calidad de la colonoscopia (tiempo de inspección, tasa de detección de adenomas, cáncer de intervalo, etc.). Sin embargo, la selección de indicadores de calidad para la EGD es todo un reto y no está bien establecida.
En 2006, la American Society for Gastrointestinal Endoscopy (ASGE) y el American College of Gastroenterology (ACG) publicaron la primera versión de indicadores de calidad en la gastroscopia, que ha sido actualizada recientemente en 2015, integrando nuevos indicadores de calidad de proceso, divididos en 3 periodos: previo al procedimiento, intraprocedimiento y después del procedimiento1,2. Sin embargo, no existen estudios que hayan utilizado estos indicadores y no tenemos ningún dato de la calidad de las EGD en nuestro medio.
El objetivo de nuestro estudio fue valorar la calidad de las EGD realizadas en nuestro centro y evaluar la mejora tras la realización de un programa de formación.
Pacientes y métodosDiseñoEstudio comparativo de 2 cohortes: una, recogida de forma retrospectiva (grupo control) y otra, prospectiva (grupo intervención), antes y después de un programa de formación. El protocolo fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínic y para el estudio prospectivo los pacientes firmaron el consentimiento informado.
Sujetos a estudioTodas las EGD realizadas en el Hospital Clínic de Barcelona durante el periodo de evaluación.
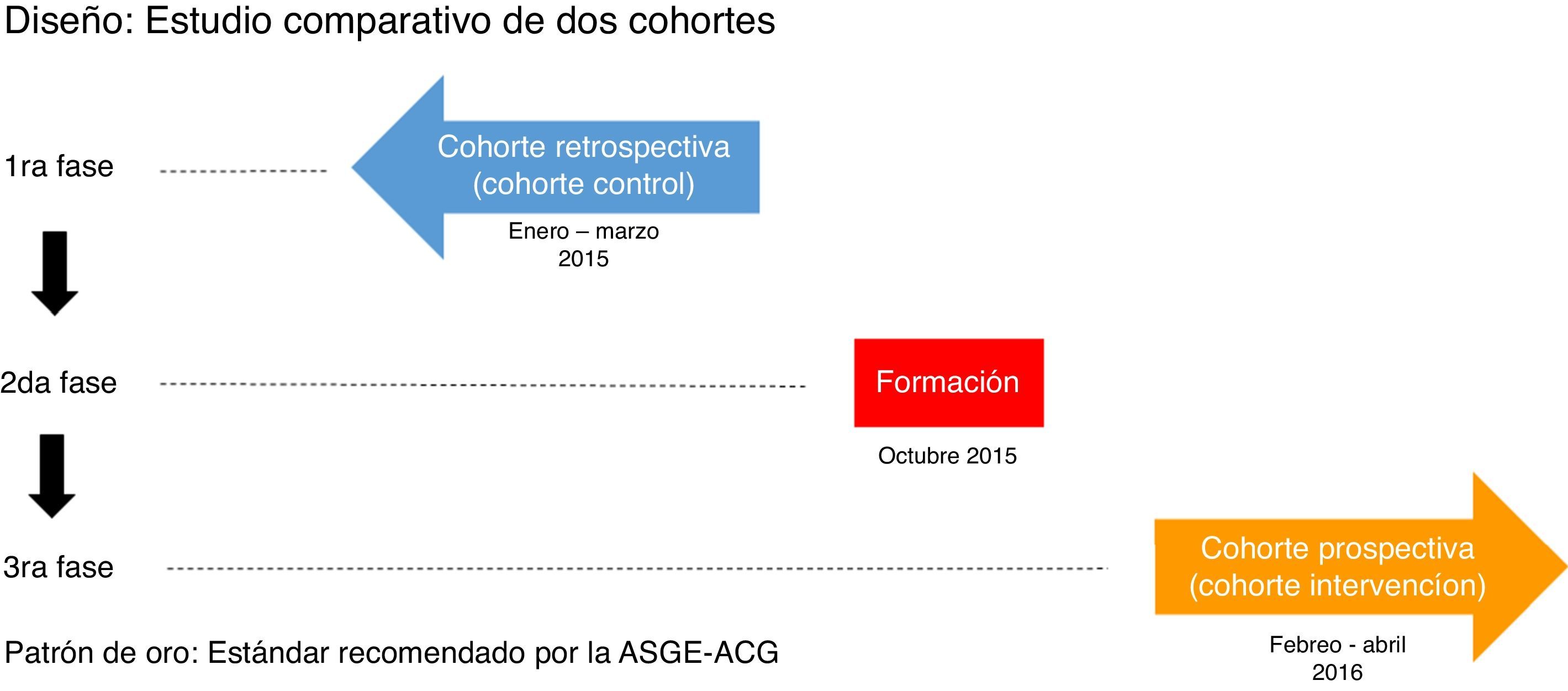
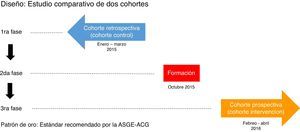
MétodoConsta de 3 fases (fig. 1):
- -
Primera fase: revisión de 600 EGD consecutivas desde el 1 de enero al 31 de marzo de 2015 (grupo control) a través del programa Endobase® para elaboración de informes de endoscopia y de la historia clínica electrónica, recogiéndose los datos referidos en la hoja de recogida de datos.
- -
Segunda fase: programa de formación en indicadores de calidad en la EGD a los gastroenterólogos que realizan endoscopia en el hospital, mediante una sesión informativa en la que se discutieron las indicaciones aceptadas en la actualidad, las clasificaciones utilizadas en las distintas enfermedades, los protocolos actualizados de obtención de biopsias para cada indicación, y se revisaron todos los puntos recogidos en el documento de indicadores de calidad de la ASGE-ACG. Además, se actualizaron estos protocolos en el programa Endobase®.
- -
Tercera fase: revisión de 600 EGD realizadas consecutivamente tras el programa de formación desde el 1 de febrero al 30 de abril de 2016 (grupo intervención) a través del programa Endobase® y la historia clínica electrónica.
Se definió como endoscopista experto todos los médicos del staff de la Unidad de Endoscopia del Hospital Clínic con una dedicación exclusiva a la endoscopia, y como endoscopista no experto a los gastroenterólogos con una dedicación parcial a la endoscopia digestiva. Las EGD realizadas por los residentes no se han incluido en este estudio.
La medición de los indicadores de calidad se realizó calculando la proporción de las intervenciones que lograron un objetivo predefinido antes y durante la EGD.
Se consideró una actuación correcta en la realización de algún procedimiento (tanto la toma de biopsias como alguna terapéutica) cuando estaba indicado y como la no obtención de biopsias ni la realización de ningún procedimiento cuando no era necesario.
El procedimiento fue valorado como globalmente correcto si cumplía criterios de exploración completa, actuación correcta y existía fotodocumentación de la lesión (cuando procedía).
Análisis estadísticoLas variables cualitativas se expresan en valores absolutos y sus porcentajes, mientras que las variables continuas se expresan como media±desviación estándar. La comparación de las proporciones antes y después del programa de formación se realizó con la prueba de Chi-cuadrado, mientras que la comparación de las variables cuantitativas se realizó con la t-Student. El análisis de los datos se realizó con el paquete estadístico SPSS® versión 22.
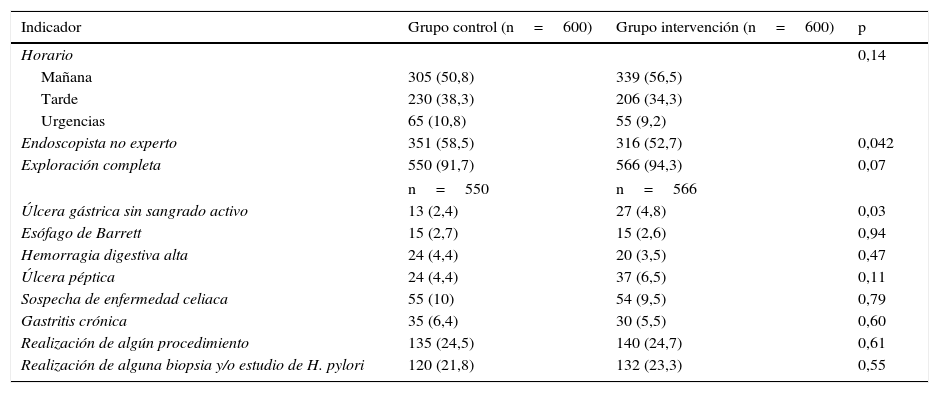
ResultadosSe incluyeron un total de 1.200 EGD (600 en cada grupo). La mayoría de las EGD se realizaron en el turno de mañana y más del 50% por endoscopistas no expertos (control 351 [58,5%] vs. intervención 316 [52,7%]; p=0,04). No se observaron diferencias en las indicaciones ni en el número de exploraciones completas entre los 2 grupos, siendo las causas de exploración incompleta las siguientes: presencia de alimentos, coágulos, intolerancia a la prueba y realización de ecoendoscopia simultáneamente. En cuanto a los hallazgos patológicos, se encontraron más úlceras gástricas sin estigmas de sangrado en el grupo intervención que en el control (27 [4,8%] vs. 13 [2,4%]; p=0,03). No hubo diferencias en cuanto al diagnóstico de otras enfermedades, la realización de algún procedimiento terapéutico ni la obtención de biopsias entre los 2 grupos (tabla 1).
Características de los 2 grupos
| Indicador | Grupo control (n=600) | Grupo intervención (n=600) | p |
|---|---|---|---|
| Horario | 0,14 | ||
| Mañana | 305 (50,8) | 339 (56,5) | |
| Tarde | 230 (38,3) | 206 (34,3) | |
| Urgencias | 65 (10,8) | 55 (9,2) | |
| Endoscopista no experto | 351 (58,5) | 316 (52,7) | 0,042 |
| Exploración completa | 550 (91,7) | 566 (94,3) | 0,07 |
| n=550 | n=566 | ||
| Úlcera gástrica sin sangrado activo | 13 (2,4) | 27 (4,8) | 0,03 |
| Esófago de Barrett | 15 (2,7) | 15 (2,6) | 0,94 |
| Hemorragia digestiva alta | 24 (4,4) | 20 (3,5) | 0,47 |
| Úlcera péptica | 24 (4,4) | 37 (6,5) | 0,11 |
| Sospecha de enfermedad celiaca | 55 (10) | 54 (9,5) | 0,79 |
| Gastritis crónica | 35 (6,4) | 30 (5,5) | 0,60 |
| Realización de algún procedimiento | 135 (24,5) | 140 (24,7) | 0,61 |
| Realización de alguna biopsia y/o estudio de H. pylori | 120 (21,8) | 132 (23,3) | 0,55 |
Datos expresados como n (%).
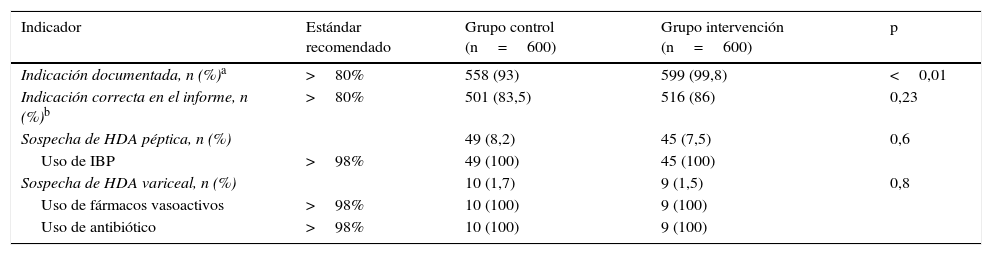
Todos los indicadores preprocedimiento fueron superiores a los valores recomendados, observándose además una mejoría significativa tras el programa de formación en la indicación documentada (558 [93%] vs. 599 [99,8%]; p<0,01) (tabla 2).
Indicadores de calidad preprocedimiento
| Indicador | Estándar recomendado | Grupo control (n=600) | Grupo intervención (n=600) | p |
|---|---|---|---|---|
| Indicación documentada, n (%)a | >80% | 558 (93) | 599 (99,8) | <0,01 |
| Indicación correcta en el informe, n (%)b | >80% | 501 (83,5) | 516 (86) | 0,23 |
| Sospecha de HDA péptica, n (%) | 49 (8,2) | 45 (7,5) | 0,6 | |
| Uso de IBP | >98% | 49 (100) | 45 (100) | |
| Sospecha de HDA variceal, n (%) | 10 (1,7) | 9 (1,5) | 0,8 | |
| Uso de fármacos vasoactivos | >98% | 10 (100) | 9 (100) | |
| Uso de antibiótico | >98% | 10 (100) | 9 (100) |
HDA: hemorragia digestiva alta; IBP: inhibidores de la bomba de protones.
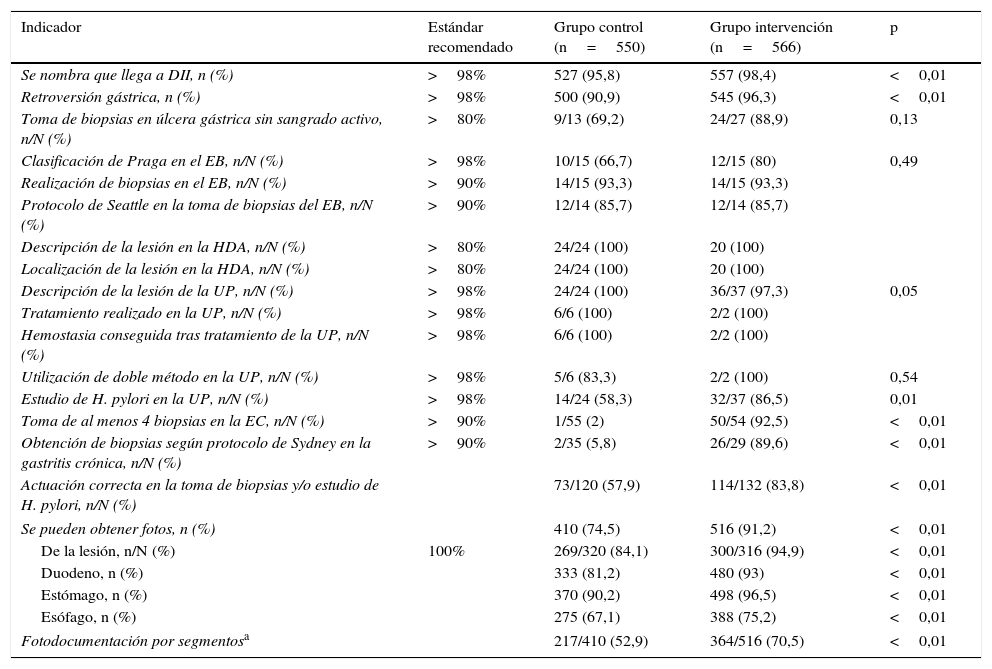
Los resultados de los indicadores intraprocedimiento se muestran en la tabla 3. Tras el programa de formación se observó un aumento de la mención de la llegada a la segunda porción duodenal (527 [95,8%] vs. 557 [98,4%]; p<0,01) y la realización de retroversión gástrica (500 [90,9%] vs. 545 [96,3%]; p<0,01), aunque solo el primero consiguió situarse por encima del valor recomendado. Otros indicadores en los que se observó una mejoría significativa fueron la obtención de biopsias según los protocolos para el estudio de la enfermedad celiaca (1/55 [2%] vs. 50/54 [92,5%]; p<0;01), gastritis crónica (2/35 [5,8%] vs. 26/29 [89,6%]; p<0,01) y estudio del H. pylori en la enfermedad ulcerosa péptica gastroduodenal (73/120 [57,9%] vs. 114/132 [83,8%]; p<0,01), aunque solo en la enfermedad celiaca se consiguió superar el valor recomendado. En muchos casos en los que no se objetivó mejoría tras el programa de formación, los valores iniciales ya superaban el estándar recomendado. Para los indicadores en que no se consiguió superar el estándar recomendado, tampoco se logró cuando se tuvo en cuenta el grado de experiencia, el tipo de endoscopia urgente o programada y el turno de mañana o tarde, excepto para la toma de biopsias en la úlcera gástrica sin sangrado activo. Para este indicador, los endoscopistas no expertos pasaron del 50 al 100% (p=0,007).
Indicadores de calidad intraprocedimiento
| Indicador | Estándar recomendado | Grupo control (n=550) | Grupo intervención (n=566) | p |
|---|---|---|---|---|
| Se nombra que llega a DII, n (%) | >98% | 527 (95,8) | 557 (98,4) | <0,01 |
| Retroversión gástrica, n (%) | >98% | 500 (90,9) | 545 (96,3) | <0,01 |
| Toma de biopsias en úlcera gástrica sin sangrado activo, n/N (%) | >80% | 9/13 (69,2) | 24/27 (88,9) | 0,13 |
| Clasificación de Praga en el EB, n/N (%) | >98% | 10/15 (66,7) | 12/15 (80) | 0,49 |
| Realización de biopsias en el EB, n/N (%) | >90% | 14/15 (93,3) | 14/15 (93,3) | |
| Protocolo de Seattle en la toma de biopsias del EB, n/N (%) | >90% | 12/14 (85,7) | 12/14 (85,7) | |
| Descripción de la lesión en la HDA, n/N (%) | >80% | 24/24 (100) | 20 (100) | |
| Localización de la lesión en la HDA, n/N (%) | >80% | 24/24 (100) | 20 (100) | |
| Descripción de la lesión de la UP, n/N (%) | >98% | 24/24 (100) | 36/37 (97,3) | 0,05 |
| Tratamiento realizado en la UP, n/N (%) | >98% | 6/6 (100) | 2/2 (100) | |
| Hemostasia conseguida tras tratamiento de la UP, n/N (%) | >98% | 6/6 (100) | 2/2 (100) | |
| Utilización de doble método en la UP, n/N (%) | >98% | 5/6 (83,3) | 2/2 (100) | 0,54 |
| Estudio de H. pylori en la UP, n/N (%) | >98% | 14/24 (58,3) | 32/37 (86,5) | 0,01 |
| Toma de al menos 4 biopsias en la EC, n/N (%) | >90% | 1/55 (2) | 50/54 (92,5) | <0,01 |
| Obtención de biopsias según protocolo de Sydney en la gastritis crónica, n/N (%) | >90% | 2/35 (5,8) | 26/29 (89,6) | <0,01 |
| Actuación correcta en la toma de biopsias y/o estudio de H. pylori, n/N (%) | 73/120 (57,9) | 114/132 (83,8) | <0,01 | |
| Se pueden obtener fotos, n (%) | 410 (74,5) | 516 (91,2) | <0,01 | |
| De la lesión, n/N (%) | 100% | 269/320 (84,1) | 300/316 (94,9) | <0,01 |
| Duodeno, n (%) | 333 (81,2) | 480 (93) | <0,01 | |
| Estómago, n (%) | 370 (90,2) | 498 (96,5) | <0,01 | |
| Esófago, n (%) | 275 (67,1) | 388 (75,2) | <0,01 | |
| Fotodocumentación por segmentosa | 217/410 (52,9) | 364/516 (70,5) | <0,01 | |
DII: segunda porción duodenal; EB: esófago de Barrett; EC: enfermedad celiaca; HDA: hemorragia digestiva alta; UP: úlcera péptica.
En cuanto a la fotodocumentación, se observó una mayor obtención de fotos en el grupo intervención (410 [74,5%] vs. 516 [91,2%]; p<0,01), tanto de las lesiones (269/320 [84,1%] vs. 300/316 [94,9%]; p<0,01) como de los diferentes segmentos explorados (217/410 [52,9%] vs. 364/516 [70,5%]; p<0,01), aunque en ningún caso se alcanzó el estándar de calidad (tabla 3).
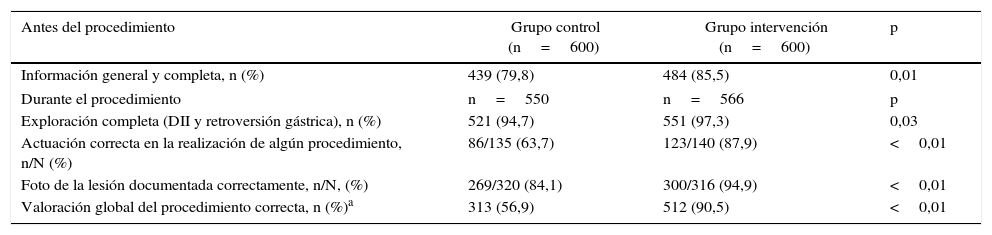
Como valoración general del programa de mejora, se registró un progreso significativo en el número de exploraciones completas, actuaciones correctas y obtención de fotos, que se tradujo en un aumento del número de pruebas con valoración global correcta (316 [56,9%] vs. 512 [90,5%]; p<0,01) (tabla 4).
Valoración general tras el programa de mejora
| Antes del procedimiento | Grupo control (n=600) | Grupo intervención (n=600) | p |
|---|---|---|---|
| Información general y completa, n (%) | 439 (79,8) | 484 (85,5) | 0,01 |
| Durante el procedimiento | n=550 | n=566 | p |
| Exploración completa (DII y retroversión gástrica), n (%) | 521 (94,7) | 551 (97,3) | 0,03 |
| Actuación correcta en la realización de algún procedimiento, n/N (%) | 86/135 (63,7) | 123/140 (87,9) | <0,01 |
| Foto de la lesión documentada correctamente, n/N, (%) | 269/320 (84,1) | 300/316 (94,9) | <0,01 |
| Valoración global del procedimiento correcta, n (%)a | 313 (56,9) | 512 (90,5) | <0,01 |
DII: segunda porción duodenal.
Este estudio describe por primera vez la calidad de las EGD realizadas en un hospital de tercer nivel de nuestro medio y cómo se consigue una sustancial mejoría después de la realización de una sencilla intervención de forma que se cumplen los estándares recomendados por la ASGE-ACG en la mayoría de los indicadores.
El registro y la medición de los indicadores de calidad suponen una oportunidad de mejora del endoscopista y de las unidades de endoscopia4–6. Los programas de formación y entrenamiento han demostrado una clara mejoría en los indicadores de calidad en las colonoscopias de cribado poblacional de cáncer colorrectal7,8 y en la detección del cáncer gástrico precoz9. Sin embargo, existen pocos estudios que evalúen la calidad de las EGD10 y ninguno que evalúe la repercusión de un programa de formación.
La calidad de la endoscopia se encuentra íntimamente relacionada con la calidad del informe endoscópico y la utilización de terminología estandarizada que permita una mejor comunicación entre profesionales y un reconocimiento inequívoco de los hallazgos patológicos descritos5,11. Para describir diferentes hallazgos endoscópicos disponemos de diversas nomenclaturas, como la clasificación de Los Ángeles para la esofagitis o la clasificación de París para las lesiones visibles12,13. En los últimos años se ha hecho un esfuerzo por estandarizar la descripción del esófago de Barrett y se ha generalizado el uso de la clasificación de Praga14. A pesar de que en nuestro medio se produjo un aumento de su uso, no llegó a presentar diferencias significativas y no alcanzó los estándares recomendados. En cualquier caso, pensamos que una intervención tan sencilla como la inclusión de estas clasificaciones en las pestañas obligatorias de los programas de elaboración de informes como el Endobase® puede ser de gran ayuda para mejorar el cumplimiento de este indicador.
La obtención de biopsias y el cumplimiento de los protocolos de biopsias bien establecidos para determinadas enfermedades15,16 es otro de los aspectos cruciales en la evaluación de la calidad de las endoscopias, ya que guarda una estrecha relación con la detección precoz de cáncer. Por el contrario, la obtención de biopsias no ajustadas a protocolos puede limitar la calidad de la endoscopia17–19. La secuencia metaplasia intestinal-displasia se ha propuesto como parte de la historia natural del adenocarcinoma esofágico y gástrico20. La identificación de lesiones precursoras de cáncer es de vital importancia, ya que se ha descrito que hasta un 10-19% de los pacientes con cáncer gástrico invasivo tenían una EGD negativa realizada en los 3 años previos al diagnóstico21,22. En nuestro estudio se consiguió mejorar significativamente el uso del protocolo de Sydney en los casos con sospecha inicial o seguimiento de gastritis crónica atrófica con metaplasia intestinal y casi se alcanzó el estándar recomendado. A pesar de que los endoscopistas no usaban correctamente la clasificación de Praga, sí que conocían el protocolo de biopsias y se consiguió superar el estándar recomendado antes incluso de seguir el programa de formación. En el caso de las úlceras gástricas, en nuestro estudio se consiguió el cumplimiento del estándar recomendado tras el programa de formación, aunque no alcanzó la significación estadística debido probablemente al pequeño número de casos. Un programa de entrenamiento más intensivo y específico, como el realizado por Zhang et al.9, que incluya una mayor sensibilización de los endoscopistas hacia la detección del cáncer gástrico precoz y la asistencia a conferencias por expertos japoneses podría contribuir a una mejora significativa en este indicador.
La existencia de guías clínicas sobre la hemorragia digestiva alta no varicosa ha supuesto un notable beneficio en el manejo de esta afección en los últimos años23. Como consecuencia de la generalización del uso de estas guías en nuestro estudio se comprobó un adecuado cumplimiento de los estándares recomendados por la ASGE-ACG, incluso antes de la intervención, en todos los diferentes aspectos: descripción y localización de la lesión causante de una hemorragia digestiva alta, descripción de los estigmas de sangrado de la úlcera péptica, tratamiento endoscópico indicado de una úlcera péptica, uso de un doble método y la obtención de hemostasia.
Sorprende el mal cumplimiento del estudio del H. pylori en la úlcera péptica gastroduodenal, que está recomendado en más del 98% de los casos y que no consiguió alcanzar a pesar de una mejora significativa tras el programa formativo. Una posible explicación podría ser el hecho de que en nuestras guías locales no se recomienda el estudio del H. pylori en la úlcera duodenal, sino que se recomienda directamente su tratamiento sin previo estudio24.
No existen datos sobre la necesidad de hacer fotografías de los puntos de referencia anatómicos normales ni si hacer estas fotografías puede mejorar el rendimiento diagnóstico de la endoscopia. La ASGE-ACG sí que recomienda la fotodocumentación de todos los hallazgos patológicos y alteraciones descritas. Sin embargo, no se hace ninguna recomendación con respecto al número de fotos ni qué segmentos se deben fotografiar. La importancia de una adecuada fotodocumentación es que podría mejorar el diagnóstico de ciertas enfermedades, principalmente el cáncer gástrico precoz. Las recomendaciones de la fotodocumentación pueden variar según diferentes sociedades; así, la Sociedad Europea de Endoscopia Gastrointestinal recomienda 8 fotos, mientras que autores japoneses recomiendan entre 20-40 fotografías (como en el caso del systematic screening protocol for the stomach)25–28.
Las recomendaciones de la ASGE-ACG no incluyen otros posibles indicadores de calidad, como el tiempo de exploración o la utilización de colorantes en los pacientes con riesgo de tener un cáncer de esófago o estómago. Estos indicadores sí que han sido propuestos como medidas menores de rendimiento de la EGD en el recientemente publicado documento para mejorar la calidad29. El tiempo de exploración ha demostrado aumentar la rentabilidad diagnóstica de forma que cuando se dedican 7min o más se detecta el doble de lesiones gástricas premalignas y malignas30 y, en el caso del esófago de Barrett, se detecta más displasia con un tiempo de inspección de un minuto por centímetro31. Tampoco existe actualmente un indicador sobre el uso del protocolo de Sydney en la sospecha inicial ni en el seguimiento de las gastritis crónicas con metaplasia intestinal; sin embargo, parece razonable su inclusión en el futuro dado que la localización, la extensión y la severidad de la metaplasia intestinal y la atrofia gástricas son factores de riesgo asociados al desarrollo del cáncer gástrico18,20.
La principal limitación de nuestro estudio es el carácter retrospectivo de una de las cohortes, que impidió la valoración de indicadores de resultados (efectos adversos inmediatos y tardíos) e indicadores después de la exploración (como, por ejemplo, la satisfacción del paciente). La falta de mejoría en algunos indicadores de calidad se podría explicar por el bajo número de casos y/o el tiempo transcurrido (4 meses) desde que se realizó la sesión formativa hasta el inicio de la recogida de los datos. Finalmente, el diseño del estudio no permite deducir si las mejoras observadas se deben realmente a un aprendizaje de los endoscopistas o a la ayuda del programa informático. Como los cambios introducidos en el programa de elaboración de informes fueron mínimos y se utilizaron después de acabar la endoscopia, pensamos que la mejoría refleja un mejor conocimiento de los protocolos de actuación por parte de los endoscopistas.
En conclusión, un programa de formación muy sencillo, dirigido a los endoscopistas, mejora los indicadores de calidad de la EGD, que alcanzan los estándares recomendados por la ASGE-ACG en la mayoría de los casos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.