INTRODUCCIÓN
El hígado es el principal órgano implicado en la biotransformación de cualquier sustancia ajena al organismo, incluidos los agentes químicos, los nutrientes, los fármacos y otros xenobióticos. Este hecho lo hace especialmente vulnerable a los fenómenos de toxicidad química. Hasta la fecha, más de 1.100 medicamentos, excluidos drogas de abuso y productos de herboristería, se han implicado en reacciones de hepatotoxicidad (HTX)1. En general, se acepta que el riesgo de HTX idiosincrásica para la mayoría de los fármacos varía entre 1 por 10.000 a 1 por 100.000 pacientes expuestos2. Aunque no existen figuras consistentes de incidencia y prevalencia de los efectos adversos hepáticos de los fármacos, se estima que éstos suponen de 1/600 a 1/3.500 de todos los ingresos hospitalarios, entre el 3 y el 5% de los ingresos por ictericia y un 10% de las hepatitis agudas ictéricas (hasta un 20% en pacientes geriátricos). Además, un estudio reciente realizado en Estados Unidos demuestra que más del 50% de los casos de insuficiencia hepática aguda grave son secundarios a medicamentos (incluido el paracetamol)3. Por todo ello, las reacciones adversas hepáticas (RAH) a fármacos, aunque menos frecuentes que otros efectos adversos ligados al uso de medicamentos, son de especial trascendencia por su potencial gravedad y constituyen la causa más frecuente de retirada de medicamentos del mercado farmacéutico4.
Una minoría de fármacos causa lesión hepática de forma intrínseca (dependiente de la dosis), predecible y reproducible. Algunas de estas hepatotoxinas actúan directamente sobre el hepatocito, y otras a través de un compuesto tóxico generado durante su metabolismo (p. ej., paracetamol). Con una amplia mayoría de agentes, no obstante, la toxicidad hepática ocurre de modo impredecible y no relacionado con la dosis: HTX idiosincrásica. Esta última aparece en 1 de cada 10.000-100.000 pacientes que ingieren el fármaco a dosis terapéutica, está determinada por la susceptibilidad individual, puede aparecer tras un período de tolerancia y producir manifestaciones clinicopatológicas desiguales y es la que plantea mayores problemas desde el punto de vista del diagnóstico del proceso5. Se cree que el mecanismo básico subyacente a esta forma de HTX es una variabilidad genética de las isoenzimas del CYP, que determinaría la ausencia de metabolismo de un precursor determinado, o generación en exceso de metabolitos tóxicos (idiosincrasia metabólica). El compuesto tóxico generado (radicales libres que agotan el glutatión de la célula o compuestos electrofílicos) puede unirse irreversiblemente (por un enlace covalente) a macromoléculas, principalmente proteínas y lípidos. En ocasiones el metabolito reactivo altera el funcionalismo mitocondrial, o se comporta como especie oxidativa al inducir un estrés oxidativo celular, que es un importante mecanismo de activación de la muerte celular programada (apoptosis). De forma simultánea y no excluyente con el anterior puede predominar un mecanismo inmunoalérgico (hipersensibilidad), probablemente derivado de la formación de aductos fármaco-proteínas que actúan como neoantígenos y son expuestos en la superficie del hepatocito con el concurso de las moléculas del sistema mayor de histocompatibilidad HLA, y despiertan una respuesta inmunitaria humoral o celular. La respuesta inmunitaria es otro importante mecanismo de inducción de la muerte celular programada. Un mismo fármaco puede provocar lesión hepática por diferentes mecanismos, aunque el mecanismo patogénico más comúnmente implicado en los efectos adversos hepáticos es la idiosincrasia metabólica6.
Existe en el hepatocito un delicado balance, tanto entre vías proapoptóticas y protectoras como entre los estímulos que regulan las citocinas tóxicas y las protectoras, y el resultado final depende de la predominancia de unas u otras. Evidencias recientes sugieren que individuos que tienen polimorfismos o defectos genéticos infrecuentes en citocinas protectoras como la interleucina (IL) 10 pueden estar predispuestos a reacciones hepatotóxicas idiosincrásicas a ciertos fármacos7. Por otra parte, si las vías supresoras son eficientes, la HTX puede resolverse a pesar de la continuación del tratamiento como ocurre con algunos fármacos (estatinas).
Además, el papel de los transportadores canaliculares de proteínas está empezando a dilucidarse; los defectos genéticos de estos transportadores pueden facilitar el efecto tóxico de algunos fármacos o sus metabolitos que inhibirían la proteína excretora de sales biliares lo que originaría colestasis «simple» o pura. Otros compuestos (usualmente metabolitos reactivos o conjugados lábiles) pueden alcanzar el canalículo biliar y dañar los colangiocitos de forma directa o a través de una respuesta inmunitaria.
Multitud de factores asociados además de los genéticos, edad, sexo, dieta, tabaco y alcohol, gestación, enfermedad preexistente y consumo simultáneo de otros fármacos pueden interferir en el metabolismo hepático de los medicamentos, bien por actuar como inductores o inhibidores enzimáticos o por alterar los sistemas de detoxificación, al modular (exacerbar o atenuar) el potencial hepatotóxico de un agente8,9.
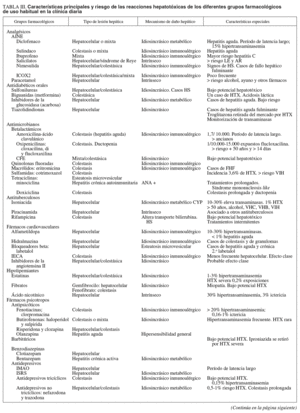
La expresión clinicopatológica de la HTX es muy variada; puede simular cualquier enfermedad hepática conocida. El tipo de lesión dependerá fundamentalmente de la célula hepática predominantemente afectada. Así, la lesión de los hepatocitos puede producir hepatitis aguda o crónica, esteatosis, hepatitis colestásica o tumores; el daño de los colangiocitos desembocaría en la aparición de colangitis aguda o crónica o más raramente colangitis esclerosante; la toxicidad sobre las células endoteliales podría ser causa de enfermedad venooclusiva hepática, peliosis hepática o incluso del desarrollo de un angiosarcoma; y, por último, el ataque de las células estrelladas puede causar fibrosis hepática (tabla I). De todas estas alteraciones las más frecuentes son la necrosis hepatocelular y la hepatitis colestásica.
Como consecuencia de lo expuesto previamente, la significación clínica de la HTX también es muy variable, y comprende desde alteraciones asintomáticas y reversibles en las enzimas hepáticas hasta necrosis hepática masiva e insuficiencia hepática fulminante. La hepatitis aguda ictérica o anictérica es la forma de presentación más frecuente: comprende hasta el 90% de los casos. En cambio, los fármacos son causantes de menos del 1% de los casos de afectación hepática crónica y cirrosis. Los síntomas más frecuentes son la astenia, el malestar general y la ictericia. La presencia de fiebre, exantema cutáneo y eosinofilia en sangre periférica o en el infiltrado inflamatorio hepático son sugestivos de un fenómeno de alergia farmacológica.
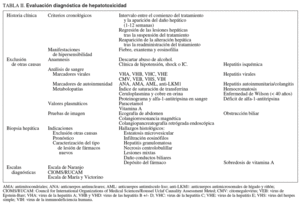
Dado que no existen marcadores específicos de HTX, el diagnóstico clínico puede llegar a ser muy difícil y requiere de una alta sospecha clínica por parte del médico. Este diagnóstico se basará fundamentalmente en la realización de una historia clínica exhaustiva y en descartar otras causas de lesión hepática (tabla II)10.
Aunque es importante tener presente que cualquier fármaco o sustancia ajena al organismo puede ser susceptible de provocar lesión hepática, ciertos grupos farmacológicos como los antibióticos, los antiinflamatorios no esteroideos (AINE) o los analgésicos se incriminan con mayor frecuencia que otros en la aparición de reacciones hepatotóxicas, debido probablemente en mayor medida a su amplísimo consumo que a un más elevado potencial hepatotóxico6. Y al contrario, hay fármacos de uso común como la insulina, la digoxina o la teofilina que no se han imputado de forma consistente en RAH10.
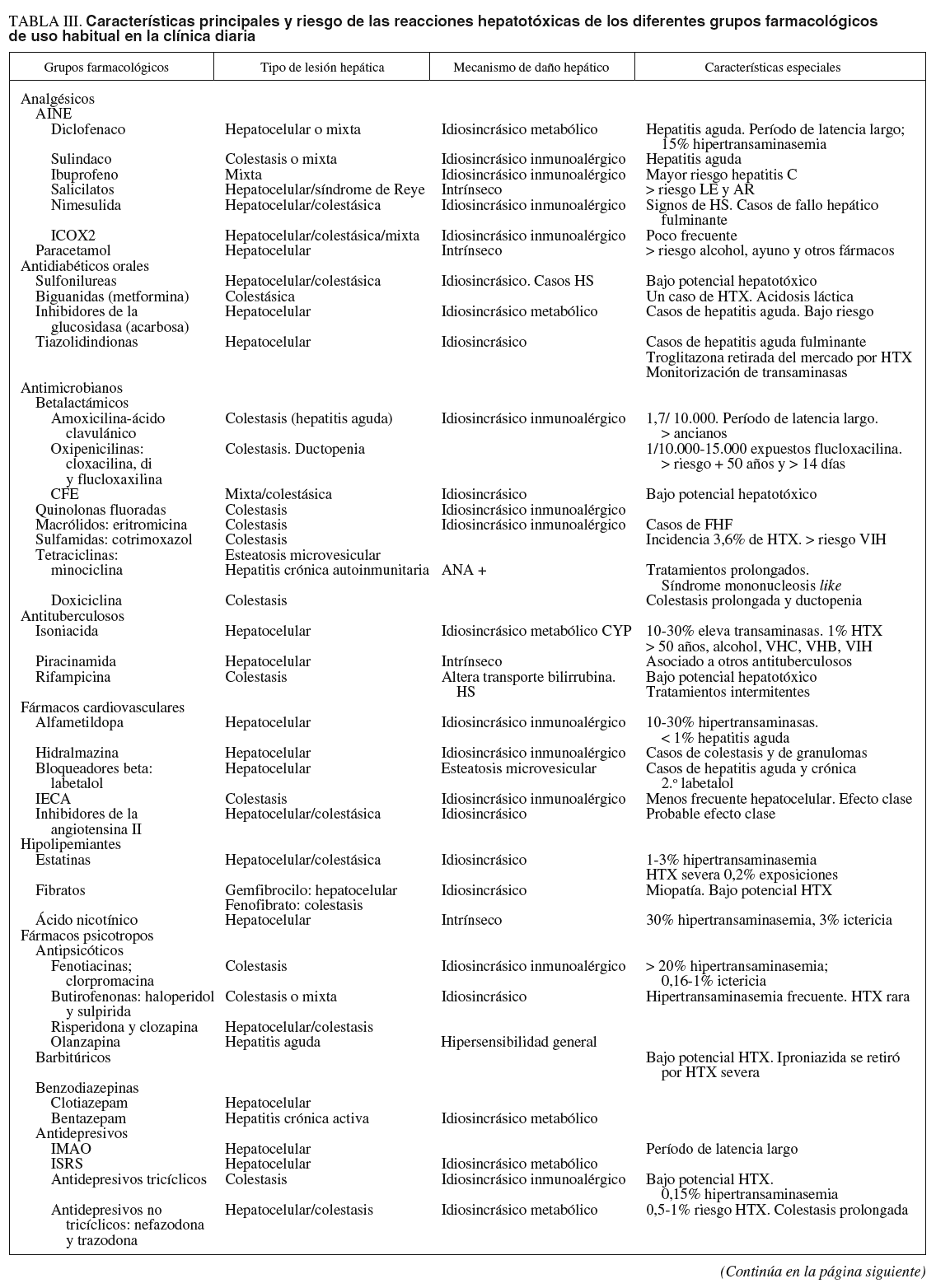
A continuación discutiremos brevemente la evidencia existente en lo que se refiere al desarrollo de HTX con los grupos farmacológicos de uso común en la práctica clínica diaria (tabla III).
FÁRMACOS ANALGÉSICOS
Antiinflamatorios no esteroideos
Los AINE, el grupo farmacológico que con mayor frecuencia se prescribe en la práctica clínica diaria, se han vinculado a la inducción de HTX con una incidencia aproximada de 1 a 10 por 100.000 exposiciones al año11,12. Aunque se han descrito reacciones hepatotóxicas tanto con los AINE clásicos como con los modernos inhibidores selectivos de la ciclooxigenasa-2, el mayor número de incidencias reportadas corresponde a diclofenaco y sulindaco, 2 AINE no selectivos13. Sin embargo, como ya se ha mencionado anteriormente, las figuras de incidencia se correlacionan estrechamente con el consumo del fármaco. Así, en el estudio de Registro Nacional de Reacciones Hepatotóxicas coordinado por 2 de los autores, no se recibió ninguna incidencia de HTX relacionada con sulindaco, lo que sin duda refleja el escaso consumo de este AINE en España6.
Los factores de riesgo posiblemente relacionados con el desarrollo de RAH por AINE son el sexo femenino, la edad mayor de 50 años, el uso concomitante de otros fármacos con potencial hepatotóxico, la presencia de hepatitis C crónica y en algunos casos el tipo de artropatía para la que se prescribe el tratamiento, ya que se ha descrito una mayor frecuencia en pacientes con artritis reumatoide o lupus eritematoso sistémico12.
Las diferencias en la estructura química entre los medicamentos que componen este grupo son muy notorias y ello puede justificar en parte, tanto la heterogeneidad en los mecanismos de HTX como la variabilidad en la expresión clínica que oscila desde elevaciones asintomáticas y transitorias de las transaminasas hasta insuficiencia hepática fulminante. Éste fue el caso de bromfenaco, que se relacionó con más de 50 casos de HTX severa y más recientemente de nimesulida, ambos retirados del mercado farmacéutico recientemente14. El período de latencia medio entre el inicio del tratamiento y el comienzo de la reacción hepática ronda las 12 semanas y el tiempo medio de resolución del cuadro tras su suspensión varía entre 4 y 6 semanas13. La mayoría de los AINE produce una lesión hepatocelular (citolítica) por un mecanismo de idiosincrasia, con la excepción del ácido acetilsalicílico, que causa HTX intrínseca o dependiente de la dosis, particularmente en pacientes con enfermedad de Still15.
El mecanismo de HTX por diclofenaco es idiosincrásico y se produce por la generación de metabolitos activos (n,5-dihidroxidiclofenaco) que ocasionan citotoxicidad directa, estrés oxidativo y lesión mitocondrial16. Hasta el 15% de los sujetos expuestos al fármaco pueden presentar hipertransaminasemia, que puede ser clínicamente significativa en 1-5 de cada 100.000 exposiciones11,17. El tipo de lesión que ocasiona el compuesto varía entre hepatocelular o mixta (intermedia entre hepatocelular y colestásica) y se presenta generalmente en forma de hepatitis aguda. La toxicidad por este fármaco suele tener un período de latencia tardío que varía entre 1 y 3 meses. También se han descrito casos de hepatitis crónica de tipo autoinmunitaria.
La HTX por sulindaco parece obedecer a un mecanismo inmunoalérgico, dado que aparecen signos de hipersensibilidad hasta en un 66% de los pacientes. Se han descrito casos de lesión tanto hepatocelular como colestásica; esta última es más frecuente y secundaria a la inhibición canalicular del transporte de sales biliares. El tiempo medio entre el inicio del tratamiento y la aparición del efecto adverso es de 8 semanas y los casos graves con resultado de defunción además de deberse a fallo hepático fulminante también se pueden producir por reacción de hipersensibilidad general18.
El ibuprofeno se considera una causa rara de lesión hepática en adultos con una incidencia de lesión hepática aguda de 1,6/100.000 pacientes expuestos. Generalmente cursa en forma de hepatitis aguda con patrón mixto. Algunos autores sugieren la posibilidad de que actúe por un mecanismo inmunológico debido a su relación con el síndrome de Stevens-Johnson19,20. Comunicaciones aisladas sugieren que la hepatitis C crónica podría ser una situación de riesgo de HTX por ibuprofeno21.
Los salicilatos pueden provocar necrosis hepática focal dependiente de la dosis, generalmente cuando los valores en sangre sobrepasan los 25 mg/dl22. Parece existir un mayor riesgo de HTX en pacientes con artritis reumatoide y lupus eritematoso sistémico. La aspirina puede provocar el síndrome de Reye si coexiste una infección viral en niños20.
La nimesulida, un inhibidor preferente no selectivo de la ciclooxigenasa-2 (COX-2), se ha retirado del mercado farmacéutico en España debido a su relación con casos de fallo hepático fulminante. La HTX secundaria a este medicamento presenta una incidencia aproximada de 0,1 casos por 100.000 pacientes tratados, cursa en forma de hepatitis aguda en ocasiones acompañada de signos de hipersensibilidad, y con un período de latencia medio de 1-15 semanas, aunque puede llegar a ser de hasta 8 meses23. El hallazgo histológico fundamental es la necrosis centrolobulillar o en puentes23.
Los inhibidores selectivos de la COX-2 raramente se han relacionado con RAH. A pesar de que una revisión de 14 ensayos controlados con celecoxib concluye que el uso de este fármaco presenta un bajo riesgo de lesión hepática, y que es similar al placebo y menor al riesgo secundario a otros AINE, se han publicado varios casos de HTX producida por este medicamento24,25. En estos casos el período de latencia osciló entre 4 días y 4 semanas, predominó la lesión hepatocelular o mixta y la recuperación varió entre 1 y 4 meses tras la suspensión del tratamiento. De igual modo con rofecoxib --recientemente retirado del mercado por sospecha de aumentar la mortalidad por enfermedad cardiovascular-- se han publicado algunos casos de hepatitis26,27.
Paracetamol
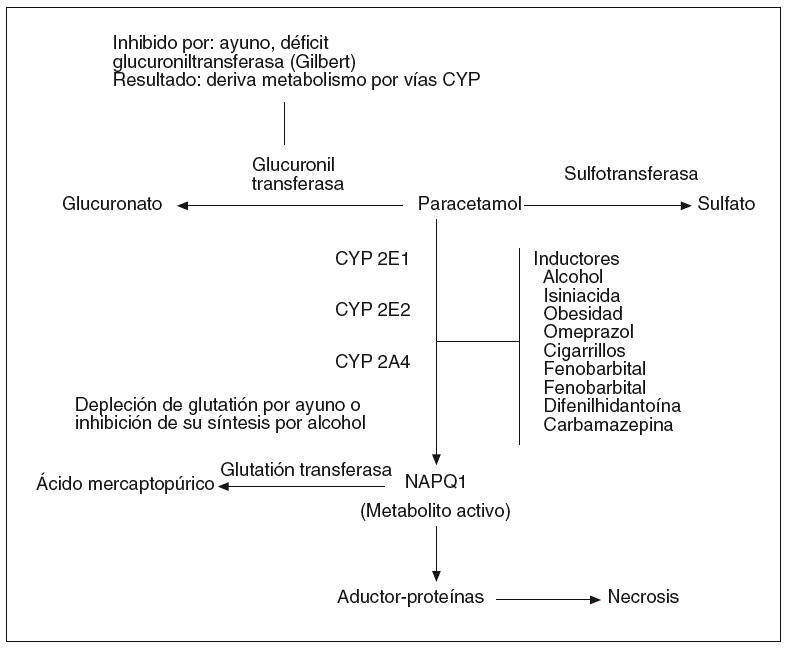
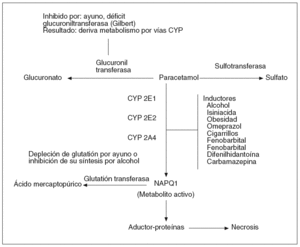
El paracetamol es un analgésico de uso muy extendido con capacidad de producir toxicidad hepática intrínseca o dependiente de la dosis. La intoxicación con paracetamol es la causa del 39% de los casos de fallo hepático agudo en Estados Unidos3. Aunque no sea una práctica extendida en España, en la mayoría de los países la causa más común de intoxicación por este fármaco es el intento de suicidio. El paracetamol se metaboliza mediante conjugación y un 5% utiliza el CYP 2E1 y forma un metabolito tóxico (N-acetil-p-benzoquinoneimina) que es detoxificado por el glutatión hepatocitario. Las dosis elevadas del fármaco que sobrepasen el efecto protector del glutatión, el déficit de este último (etilismo crónico) o el aumento de actividad del CYP 2E1 (fármacos o alcohol) determinarán el incremento del metabolito tóxico que produce necrosis zonal 3 o centrolobulillar. Por lo tanto, los factores que aumentan la susceptibilidad a este efecto adverso son la ingesta crónica de alcohol, la administración concomitante de otros medicamentos (p. ej., fenitoína e isoniacida) y el ayuno (fig. 1)28,29. Cuando la dosis total supera los 7,5 g (mayor de 150 mg/kg) en una toma única o 2 g en etílicos crónicos, hay riesgo de HTX. El indicador analítico más fiable es la determinación de los valores de paracetamol en sangre, lo cual indica según el monograma de Prescott (gráfico semilogarítmico) que se produce lesión hepática grave en el 60% de los pacientes con una concentración del fármaco en sangre por encima de la línea que conecta 150 mg/l a las 4 h y 30 mg/l a las 12 h de la ingesta30. En el caso de los pacientes alcohólicos o con trastornos de la conducta alimentaria, la línea de tratamiento se baja a 100 mg/l a las 4 h y 15 mg/l a las 15 h.
Fig. 1. Metabolismo del paracetamol y posibles mecanismos que incrementan su toxicidad. CYP: citocromo P450; NAPQ: Nacetil-p-benzoquinona-imina.
Los síntomas iniciales tras la sobredosis del medicamento consisten en anorexia, náuseas y vómitos. Los datos analíticos de lesión hepática pueden aparecer a las 48 h de la ingesta y se caracterizan por un aumento importante de las transaminasas que suelen superar las 3.500 U/l5. Es frecuente la aparición de hipoglucemia. La tercera fase se caracteriza por la aparición de ictericia y datos clínicos de fallo hepático que pueden acompañarse de fallo renal que puede producirse por necrosis tubular aguda con hipofosfatemia, fosfaturia, oliguria, anuria y elevación de la creatinina. También puede instaurarse acidosis láctica por hiperlactacidemia y, más raramente, lesión miocárdica con riesgo de arritmia cardíaca e insuficiencia ventricular izquierda.
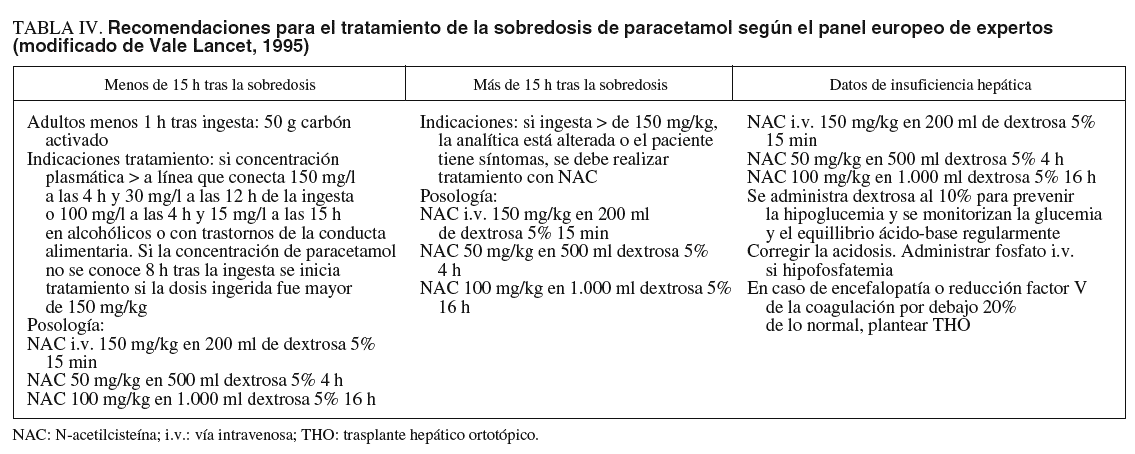
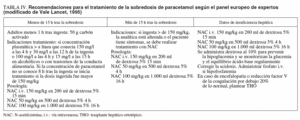
El tratamiento consiste en la administración parenteral de N-acetilcisteína (NAC) durante 36 a 72 h en las primeras 12-24 h de la ingesta del fármaco (tabla IV). Esta sustancia previene el daño hepático mediante la liberación de cisteína, así aumenta la síntesis de glutatión. El tratamiento con N-acetilcisteína puede desencadenar varios efectos adversos en un 10% de los pacientes. Estos efectos pueden estar relacionados con una liberación de histamina relacionada con la dosis y son similares a las reacciones anafilactoides con náuseas, rubefacción, urticaria y prurito. Menos frecuentemente pueden desencadenar complicaciones como angioedema, distrés respiratorio e hipotensión.
FÁRMACOS ANTIMICROBIANOS
Los antibióticos como grupo conllevan una incidencia estimada de HTX de 1-10 por 100.000 prescripciones31. Sin embargo, el tipo de antimicrobiano imputado varía en la bibliografía médica en relación con el período analizado. Así, mientras que entre más de 1.100 reacciones hepatotóxicas comunicadas a la Agencia Estatal Danesa de Farmacovigilancia entre 1978 y 1987, cotrimoxazol (3,6%) y nitrofurantoína (1,5%) aparecían como los fármacos antimicrobianos con mayor frecuencia involucrados en HTX, en el estudio de Registro Nacional de reacciones hepatotóxicas coordinado por 2 de los autores la amoxicilina-ácido clavulánico encabeza en términos absolutos la lista de agentes farmacológicos incriminados en un número más elevado de casos (12,8%)32,33.
Antibióticos betalactámicos
Las penicilinas semisintéticas ampicilina y amoxicilina raramente se han relacionado con el desarrollo de lesión hepatocelular de carácter leve; sin embargo, este riesgo aumenta a 1,7 casos por 10.000 prescripciones con la combinación de amoxicilina con el ácido clavulánico, y se incrementa hasta 1 caso por 1.000 exposiciones en pacientes de edad avanzada con exposición repetida al medicamento31,34. El tipo de lesión más frecuente es la hepatitis aguda colestásica supuestamente producida por un mecanismo de idiosincrasia inmunoalérgica. Una característica especial de la RAH producida por este antibiótico es que puede iniciarse incluso 6 semanas tras la suspensión del ciclo terapéutico y ello dificulta aún más el diagnóstico de HTX. El tiempo medio de resolución del cuadro es de 8 semanas.
Las oxipenicilinas o penicilinas resistentes a la betalactamasa, oxacilina, dicloxacilina y flucloxacilina, se han asociado a la aparición de hepatitis colestásica. La incidencia de RAH secundaria a flucloxacilina se ha estimado en 1 de cada 10.000-15.000 exposiciones, con un mayor riesgo en pacientes mayores de 50 años y en tratamientos de más de 14 días de duración35. El período de latencia medio es de 16 días y las alteraciones pueden persistir de meses a años tras la retirada del medicamento, y se han descrito casos de síndrome de desaparición de conductos biliares o ductopenia.
Se han descrito casos aislados de HTX con lesión de tipo mixto secundaria a las penicilinas de amplio espectro, ticarcilina y piperacilina; es más común la producida por carbenicilina. Al igual que la amoxicilina, la combinación de piperacilina con ácido clavulánico se ha asociado con la aparición de hepatitis colestásica.
Las RAH secundarias a cefalosporinas (CFE) son poco frecuentes, en general autolimitadas y de tipo mixto o colestásico. Aunque estos antibióticos exhiben una estructura similar a las penicilinas con las que pueden tener reactividad cruzada, no parece existir un aumento de riesgo de RAH debidas a CFE en pacientes con episodios previos de HTX inducidos por penicilinas. Las CFE de tercera generación pueden alterar las pruebas de función hepática en un 6% de los pacientes36. La cefalexina se ha asociado a hepatitis granulomatosa y la ceftriaxona puede producir barro biliar por precipitación de las sales de calcio del fármaco al excretarse por la bilis9,37.
Sulfamidas
El cotrimoxazol, tal como se ha mencionado previamente, es el antibiótico que con mayor frecuencia se ha relacionado con la aparición de HTX31. Este fármaco puede provocar desde elevaciones transitorias de las transaminasas hasta hepatitis aguda colestásica. Este tipo de reacción es más frecuente en pacientes con el síndrome de la inmunodeficiencia humana, que es reconocido como un factor de riesgo de HTX por este compuesto, y en los cuales la mortalidad del cuadro es del 10-20%. Menos frecuentemente se han descrito casos de hepatitis crónica y hepatitis granulomatosa.
Macrólidos
La eritromicina puede producir hepatitis colestásica aguda y menos frecuentemente colestasis prolongada y fallo hepático fulminante38. La claritromicina también se ha relacionado con la aparición de colestasis con un mayor riesgo en pacientes de edad avanzada, bajo peso y con dosis del fármaco mayores de 2 g. La roxitromicina puede causar tanto lesión hepatocelular como colestásica y la espiramicina raramente se ha asociado con el desarrollo de hepatitis colestásica o mixta39.
Tetraciclinas
Las tetraciclinas pueden ocasionar esteatosis microvesicular aguda cuyos factores de riesgo son la dosis mayor de 2 g al día, la administración parenteral, el embarazo, la existencia de enfermedad renal basal y el sexo femenino. Se han publicado casos de hepatitis crónica autoinmunitaria secundaria a minociclina y ductopenia con colestasis prolongada debida a doxiciclina40.
Quinolonas
Las fluoroquinolonas de segunda generación (ciprofloxacino, norfloxacino, ofloxacino y pefloxacino) pueden producir elevaciones discretas de transaminasas en el 2-3% de los pacientes, pero se han descrito pocos casos de HTX clínicamente significativa. Sin embargo, 2 antimicrobianos del mismo grupo, el temafloxacino y el trovafloxacino, se han retirado del mercado, el primero por inducción de hemólisis severa asociada a disfunción renal y hepática, y el segundo por haber sido involucrado en numerosos casos de toxicidad hepática con manifestaciones de hipersensibilidad, algunos de ellos de evolución grave41.
Otros antimicrobianos como la nitrofurantoína pueden ocasionar hepatitis crónica activa autoinmunitaria por un mecanismo de idiosincrasia inmunoalérgica, aunque también se han descrito casos de lesión aguda colestásica o hepatocelular.
El 0,5-10% de los fármacos antifúngicos pueden producir elevación transitoria de enzimas hepáticas, se aprecia una mayor incidencia de HTX con los medicamentos itraconazol y ketoconazol. Este último produce una lesión hepática de predominio hepatocelular en 1 de cada 500 prescripciones42. La terbinafina altera las pruebas de función hepática en el 4% de los sujetos expuestos, y se han descrito casos de hepatitis colestásica y de fallo hepático fulminante.
Fármacos antituberculosos
El fármaco antituberculoso con mayor potencial hepatotóxico es la isoniacida, seguida de la pirazinamida y la rifampicina. La isoniacida puede producir elevación de aspartato aminotransferasa en un 10-30% de los pacientes en tratamiento y hepatitis con ictericia en un 1% (2% en mayores de 50 años)43. Además de la edad, otros factores de riesgo son el sexo femenino, el etilismo, la presencia de enfermedad hepática crónica subyacente, la infección por el virus de la hepatitis C y el virus de la inmunodeficiencia humana, la hipoalbuminemia y la tuberculosis diseminada. La lesión hepática que produce este fármaco es la necrosis hepatocelular por un mecanismo de idiosincrasia metabólica.
La HTX que aparece durante el tratamiento antituberculoso combinado clásico (isoniacida, rifampicina y piracinamida) puede ser de 2 tipos. El primero aparece en los 15 primeros días de tratamiento, tiene buen pronóstico y parece secundario a la isoniacida (con la contribución de la rifampicina que actuaría como inductor enzimático). El segundo tipo de lesión consiste en la aparición de lesión tardía (después de 2 meses de tratamiento), tiene peor pronóstico y se piensa que puede ser secundaria a la pirazinamida.
Para la prevención de RAH debida a este tipo de terapias es importante el conocimiento y la detección temprana por parte del médico y del paciente de los posibles síntomas y signos que pueden aparecer en caso de desarrollar una reacción de HTX, la realización de una valoración bioquímica y serológica basal y la monitorización analítica cada 2-4 semanas en los pacientes de riesgo. La suspensión del tratamiento se debe realizar en caso de presentar síntomas de HTX, ante la elevación de transaminasas 5 veces el límite superior de la normalidad o si se produce un incremento de la bilirrubina sérica44.
FÁRMACOS ANTIDIABÉTICOS
Dentro del grupo de antidiabéticos orales tanto la acarbosa, las sulfonilureas, la metformina como los de última generación, las tiazolidindionas, se han implicado en casos de HTX20.
La acarbosa es un fármaco que actúa mediante la inhibición competitiva de la alfa-glucosidasa intestinal, disminuyendo así la absorción de carbohidratos. Este medicamento se ha relacionado con el desarrollo de HTX idiosincrásica de carácter metabólico, cuyo tipo de lesión más frecuente es el hepatocelular. La RAH inducida por este fármaco puede conducir a una hepatitis aguda o crónica y parece tener un período de latencia largo entre el comienzo de su administración y la aparición de la reacción adversa45.
Las sulfonilureas son antidiabéticos orales ampliamente utilizados en el tratamiento de la diabetes mellitus tipo 2. Al inicio de la comercialización de estas sustancias, 2 fármacos de este grupo se retiraron del mercado debido a la aparición de RAH, la carbutamida y la metahexamida. Posteriormente también aparecieron casos de HTX colestásica inducida tanto por clorpropamida --cuya incidencia se redujo con la disminución de las dosis utilizadas-- como por glibenclamida o tolbutamida46. Aunque estas reacciones se han reportado menos frecuentemente con los nuevos compuestos, también se ha descrito la aparición de lesión hepática crónica secundaria a tolazamida y hepatitis aguda producida por gliclazida y glimepirida. En general, parece que la HTX por sulfonilureas responde a un mecanismo idiosincrásico inmunoalérgico que podría estar relacionado con el radical del anillo benceno de la estructura química de estos fármacos.
La metformina es se considera de bajo riesgo hepatotóxico; se han descrito 4 casos de lesión hepática, 3 de hepatitis aguda colestásica idiosincrásica y 1 de colestasis leve47.
Entre los antidiabéticos orales, merecen una mención especial las tiazolidindionas, dado que la primera sustancia comercializada de este grupo terapéutico, la troglitazona, se retiró del mercado debido a reacciones de HTX con una incidencia estimada del 1,9% de los sujetos expuestos48. Las lesiones más frecuentemente descritas eran de tipo hepatocelular o mixto producidas fundamentalmente por un mecanismo de idiosincrasia metabólica. Se han registrado, asimismo, casos de hepatitis fulminante. Los fármacos de segunda generación de este grupo, la rosiglitazona y la pioglitazona, parecen conllevar un menor potencial hepatotóxico que troglitazona. Dado que se han descrito casos de RAH severa secundaria a estos medicamentos (6 casos secundarios a rosiglitazona y 5 inducidos por pioglitazona), hoy día no hay información suficiente para descartar la presencia de efecto-clase en este grupo farmacológico; consecuentemente, se recomienda la monitorización enzimática hepática durante el tratamiento, están contraindicados en pacientes con antecedentes de HTX secundaria a troglitazona y en los que tienen hipertransaminasemia basal49.
FÁRMACOS HIPOLIPEMIANTES
La dislipemia y sus consecuencias cardiovasculares son muy frecuentes en la sociedad actual. Se han descrito casos de HTX con los inhibidores de la CoA reductasa (estatinas), con la niacina y más raramente con los fibratos.
Las estatinas producen una elevación asintomática de transaminasas en el 1-3% de los pacientes, que suele aparecer en los 3 primeros meses de tratamiento, generalmente es dependiente de la dosis y revierte tras la suspensión del compuesto. La frecuencia de HTX grave secundaria a estos fármacos es de 0,2 por 100.000 exposiciones. Se han descrito casos de hepatitis colestásica secundaria a lovastatina y pravastatina y la atorvastatina se ha relacionado con hepatitis aguda y colestasis. Se recomienda la monitorización de las enzimas hepáticas durante el tratamiento con estos fármacos, particularmente tras un incremento de dosis, pero dado que la mayoría de los casos de RAH parecen ser de tipo idiosincrásico estos controles podrían no ser coste-eficaces50. Además parece que los pacientes con hipertransaminasemia basal no tienen mayor riesgo de desarrollar HTX secundaria a este grupo de fármacos51.
El ácido nicotínico puede provocar lesión hepática moderada dependiente de la dosis (dosis mayores de 3 g) en más de un tercio de pacientes. También se han descrito casos de HTX idiosincrásica secundaria a preparados de liberación retardada52. Este fármaco está contraindicado en pacientes con enfermedad hepática subyacente.
El efecto adverso más temido de los fibratos es la miopatía, cuyo riesgo se ve incrementado cuando se combina con las estatinas, por lo que su uso combinado debe realizarse con precaución. Este hecho se debe al importante efecto inhibidor enzimático sobre el CYP de los fibratos, que provoca un aumento de los valores de estatinas. Se han descrito casos de lesión hepatocelular inducida por gemfibrozilo y casos de hepatitis aguda y crónica y ductopenia secundarios a fenofibrato20. Estos medicamentos aumentan el riesgo de colelitiasis.
FÁRMACOS CARDIOVASCULARES
Los fármacos antihipertensivos y antiarrítmicos que requieren monitorización de enzimas hepáticas por su riesgo de causar HTX son el labetalol y la metildopa. Esta última --un antihipertensivo que se utiliza fundamentalmente en el tratamiento de la hipertensión arterial durante la gestación-- puede producir el incremento de transaminasas hasta en el 10-30% de las exposiciones, hepatitis aguda en menos del 1% y, más raramente, se ha relacionado con la aparición de hepatitis crónica, cirrosis, colestasis, esteatosis y hepatitis granulomatosa. La patogenia parece responder a un mecanismo inmunoalérgico18. La hidralazina puede producir una lesión hepatocelular por un mecanismo de idiosincrasia inmunoalérgica y raramente se han descrito casos de colestasis y granulomas hepáticos53.
En general, tanto los antagonistas del calcio como los bloqueadores beta tienen un bajo potencial hepatotóxico20. Incluso hoy día se piensa que la esteatohepatitis que previamente se relacionaba con los antagonistas del calcio pueda producirse realmente por el síndrome de resistencia a la insulina que comúnmente presentan estos pacientes54. Una excepción es el labetalol, que se ha relacionado con la aparición de hepatitis aguda grave, incluidos casos de necrosis hepática masiva55.
Los inhibidores de la enzima de conversión de la angiotensina (IECA), captopril, enalapril, lisinopril y fosinopril, pueden producir colestasis, hepatitis colestásica y más raramente lesión hepatocelular56. Estas alteraciones pueden acompañarse de datos de hipersensibilidad. El período de latencia medio entre el inicio del tratamiento y la aparición del daño hepático es de 14 semanas, y oscila entre una semana y un año. Se ha sugerido la existencia de reactividad cruzada entre distintos IECA (captopril y enalapril), aunque este hallazgo está pendiente de confirmación56.
Los inhibidores de los receptores de la angiotensina II se han relacionado con RAH, tanto de tipo colestásico como hepatocelular, este último más frecuente, cuyo mecanismo patogénico parece corresponder a idiosincrasia metabólica. Irbesartán se ha relacionado con la aparición de hepatitis aguda, candesartán puede ocasionar elevación transitoria de transaminasas o daño hepatocelular y el losartán puede producir lesión hepatocelular57. Es importante señalar que el tasosartán, un fármaco de este grupo con una estructura química similar, se retiró en la fase de desarrollo debido a su elevado potencial hepatotóxico.
La amiodarona es un antiarrítmico que puede producir elevación de las transaminasas en el 15-80% de los pacientes expuestos, que puede ser clínicamente significativa en un 0,6-3% de ellos54. La lesión más frecuente es de tipo hepatocelular con esteatosis y fosfolipidosis, que se produce por un mecanismo intrínseco secundario al depósito del fármaco en el tejido hepático. Es el fármaco que con mayor frecuencia se asocia a esteatohepatitis no alcohólica que puede progresar a cirrosis en el 15-50%, incluso tras la retirada del fármaco58. El riesgo de HTX por amiodarona aumenta con el tiempo de exposición (mayor de 1 año), con la dosis total del medicamento y con la vía de administración (más frecuente tras la infusión intravenosa). Aunque no está clara su utilidad real, se recomienda la monitorización bioquímica de las enzimas hepáticas durante el tratamiento54.
FÁRMACOS PSICOTROPOS
Los fármacos antipsicóticos clásicos, clorpromazina, haloperidol, proclorperazina y sulpirida pueden causar lesión hepática colestásica mediante un mecanismo idiosincrásico. La clorpromazina es uno de los primeros fármacos conocidos como causa de hepatitis colestásica cuyo mecanismo parece ser inmunoalérgico mediado por metabolitos tóxicos. Este neuroléptico se ha relacionado con el desarrollo de ictericia en 0,16-1% de los sujetos expuestos, la cual generalmente aparece a las 5 semanas de tratamiento, se acompaña de la elevación bioquímica significativa de fosfatasa alcalina, síntomas prodrómicos inespecíficos y síntomas de hipersensibilidad en el 70% con anticuerpos antinucleares positivos en un 40% de los pacientes20. Estas reacciones presentan en general buen pronóstico, con desaparición de la clínica en 4-8 semanas tras la suspensión del fármaco, pero en aproximadamente el 7% de los casos puede derivar en colestasis prolongada y en el síndrome de desaparición de los conductos biliares (vanishing bile duct syndrome)30. La clozapina y la risperidona se han asociado con casos de lesión hepática de predominio hepatocelular, algunos de ellos en forma de hepatitis aguda fulminante59. Por último, la olanzapina se ha relacionado con la aparición de hepatitis aguda y acompaña al síndrome de hipersensibilidad general.
En general, se considera que los compuestos que forman parte tanto del grupo de las benzodiazepinas como el de los barbitúricos tienen un bajo potencial hepatotóxico. Las benzodiazepinas que con mayor frecuencia se han relacionado con reacciones significativas de HTX son el clotiazepam y el bentazepam; este último puede provocar lesión hepática crónica60.
En cuanto a los fármacos antidepresivos, la iproniazida, uno de los primeros inhibidores de la MAO, se retiró del mercado por su capacidad para ocasionar lesión hepatocelular mediante un mecanismo de idiosincrasia con una incidencia del 1%, y una mortalidad del 15% en los pacientes que desarrollan ictericia61. Aunque los antidepresivos tricíclicos se asocian a una menor incidencia de HTX que los IMAO (0,5-1% de las exposiciones), también se han relacionado con la aparición de casos de lesión hepática colestásica, con descripciones ocasionales de colestasis prolongadas y ductopenia. El amineptino y la tianeptina provocan una lesión de predominio colestásico mediante un mecanismo inmunoalérgico en pacientes genéticamente predispuestos. La imipramina puede inducir una ictericia colestásica y se han comunicado varios casos de HTX de tipo colestásico o mixto secundaria a amitriptilina un mes tras el comienzo del tratamiento20.
Los inhibidores selectivos de la recaptación de la serotonima (ISRS) pueden producir elevación de transaminasas en el 0,5% de los pacientes, pero el daño hepático clínicamente significativo es de rara aparición y suele ser de tipo hepatocelular reversible que aparece tras un largo período de latencia (semanas-1 año)62.
La nefazodona puede producir fallo hepático agudo caracterizado por la aparición de necrosis centrolobular o submasiva, de carácter idiosincrásico y con un período entre el inicio de la exposición y el comienzo de la clínica que varía de 7 a 28 semanas63. También se han descrito casos de lesión hepatocelular aguda y crónica y colestasis secundarios a la trazodona que puede aparecer tras un período de latencia largo (18 meses).
FÁRMACOS ANTIEPILÉPTICOS
La fenitoína produce lesión principalmente de tipo citotóxico con un aumento importante de las transaminasas, afectación multisistémica y mal pronóstico (mortalidad del 30%)64. En ocasiones se asocia a granulomas y a lesiones anatomopatológicas similares a las de la mononucleosis infecciosa. El mecanismo hepatotóxico es idiosincrásico, no está claro si de carácter inmunoalérgico o metabólico. En algunos pacientes parece relacionado con el déficit de epóxido hidrolasa20.
El ácido valproico ocasiona frecuentemente una elevación de enzimas hepáticas en los primeros 2 meses de tratamiento no necesariamente acompañadas de lesión hepática. El daño hepático es más frecuente (1/500 exposiciones) en menores de 3 años, historia personal o familiar de deficiencias enzimáticas mitocondriales (alteraciones del ciclo de la urea), síndrome de Reye, ataxia de Friedreich y en politerapia20. Este fármaco produce esteatosis microvesicular con necrosis difusa cuyo mecanismo parece corresponder a una idiosincrasia metabólica que puede estar relacionada con la depleción de carnitina, con la consecuente alteración mitocondrial65. Se recomienda la monitorización de las enzimas hepáticas durante el tratamiento con este medicamento.
La implicación de la carbamazepina en casos de HTX suele ser más difícil debido a la administración concomitante de otros medicamentos. Se han descrito casos de lesión granulomatosa, ictericia colestásica y lesión hepatocelular. El mecanismo patogénico parece corresponder a una idiosincrasia metabólica66.
El felbamato --un fármaco indicado en las epilepsias refractarias-- se ha vinculado con casos de fallo hepático agudo (más de 30 casos reportados a la Food and Drug Administration) con una mortalidad del 57%. La frecuencia de daño hepático se ha calculado en 3-4 por 100.000 pacientes expuestos, con un período de latencia de 3-6 meses y con un mecanismo metabólico secundario al metabolito reactivo atropaldehído67. También se han descrito casos de HTX secundaria a la lamotrigina con un período de latencia de 2-3 semanas, más frecuente en pacientes con politerapia y en ocasiones acompañando a un síndrome de hipersensibilidad con fallo multisistémico, para el cual se ha sugerido un mecanismo inmunoalérgico68. Por último, el topiramato se ha relacionado con un caso de fallo hepático que precisó trasplante hepático en un paciente que también tomaba carbamazepina. La biopsia hepática mostraba necrosis centrolobulillar69.