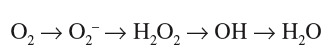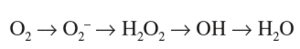INTRODUCCIÓN
La vida en un entorno rico en oxígeno (el elemento más abundante de nuestro planeta) ha supuesto la adaptación de los organismos a la convivencia con esta molécula y con sus derivados, las especies reactivas de oxígeno (ROS [radical oxygen species]), los cuales se han integrado de manera imprescindible en la señalización intra e intercelular. Por citar algunos ejemplos, los ROS son mediadores de funciones celulares esenciales como la expresión de genes, la fosforilación de proteínas, la activación de los factores de transcripción, la síntesis de ADN o la proliferación celular1-3. Sin embargo, los ROS desempeñan un papel bivalente, ya que sobrepasados los límites oxidativos permitidos, estas moléculas se convierten en potentes destructores celulares. Para combatir el potencial citotóxico de los ROS, los seres vivos han desarrollado eficientes sistemas antioxidantes y maquinarias de reparación del daño oxidativo. A pesar de ello, la célula puede ser sorprendida por una excesiva o rápida formación de los ROS. Ello comporta el ataque oxidativo indiscriminado sobre lípidos, proteínas y ADN celular, situación que conocemos como estrés oxidativo.
En los últimos años el estrés oxidativo se ha vinculado al envejecimiento y al desarrollo de variadas afecciones, como son el cáncer, la diabetes mellitus, las enfermedades pulmonares, neurodegenerativas, cardiovasculares, etc.4-7. En la lista de órganos afectados se incluye también al páncreas. En este artículo revisaremos los conocimientos actuales sobre la participación del estrés oxidativo en el desarrollo de la pancreatitis aguda y crónica, y destacaremos los puntos oxidativos de potencial interés terapéutico. A pesar de no conocer aún de forma clara la patogenia de la pancreatitis aguda y crónica, podemos dibujar cada vez con mayor detalle el escenario inflamatorio desdoblado en el páncreas afectado. En este contexto, el estrés oxidativo se perfila como un elemento iniciador y propagador del proceso inflamatorio. Por ello, y considerando que el beneficio hasta ahora obtenido con el tratamiento antioxidante es limitado, los esfuerzos de la terapia antioxidante se dirigen actualmente hacia la identificación y manipulación de vías oxidativas que orquestan los procesos inflamatorios del páncreas.
Para situar el estrés oxidativo en el contexto de la afección pancreática debemos revisar algunos conceptos básicos concernientes a los ROS.
ESPECIES REACTIVAS DE OXÍGENO Y RADICALES LIBRES
¿Qué son?
Los radicales libres son moléculas parcialmente reducidas que poseen un electrón adicional en estado desapareado. Esta configuración electrónica confiere a estas moléculas inestabilidad y fácil reacción con lípidos, proteínas y ácidos nucleicos de su entorno. Como la mayoría de los radicales de interés biológico derivan del oxígeno o del nitrógeno, a éstos se los conoce habitualmente como ROS o especies reactivas de oxígeno. Los principales ROS son el anión superóxido (O2*--) y sus derivados el peróxido de hidrógeno (H2O2) y el radical hidroxilo (HO*--)8.
La primera reducción del oxígeno da lugar al anión superóxido (O2 + e Æ O2*--), una molécula relativamente inestable, con una vida media de milisegundos y un escueto radio de difusión dado su limitado paso a través de los lípidos. Bien espontáneamente o por acción de la enzima superóxido dismutasa, el O2*-- es rápidamente transformado en peróxido de hidrógeno (2O2*-- + 2H+ Æ H2O2 + O2). A pesar de no ser estrictamente un radical libre de oxígeno por carecer de electrones no pareados, el H2O2 puede ejercer como potente oxidante en presencia de metales de transición. Su prolongada vida media y alta capacidad de difusión lipídica convierten al H2O2 en un mediador esencial en la señalización celular. El H2O2 es convertido en agua por la catalasa en los peroxisomas (2H2O2 catalasa Æ H2O + O2) o por la glutatión peroxidasa en el citoplasma (H2O2 + 2GSH glutatión peroxidasa Æ 2H2O + GSSG). Alternativamente, en presencia de metales de transición reducidos (Fe2+ o Cu+), el H2O2 puede reaccionar con el O2*-- y generar radicales hidroxilo (HO*) a través de la reacción de Fenton o Haber-Weiss (O2*-- + H2O2 Æ HO* + HO-- + O2), los cuales son altamente reactivos, poseen una vida media muy corta y la habilidad de reaccionar con cualquier molécula que hallen a su paso.
Por tanto, la formación inicial de O2* despliega una cascada de ROS, algunos de los cuales, como el H2O2, se comportan como moléculas clave en la señalización celular, y otros, como el HO*, son peligrosamente lesivos. En último término, el impacto biológico de estas moléculas estará determinado por la cantidad de ROS, las defensas celulares y la capacidad de adaptación celular.
¿De dónde proceden?
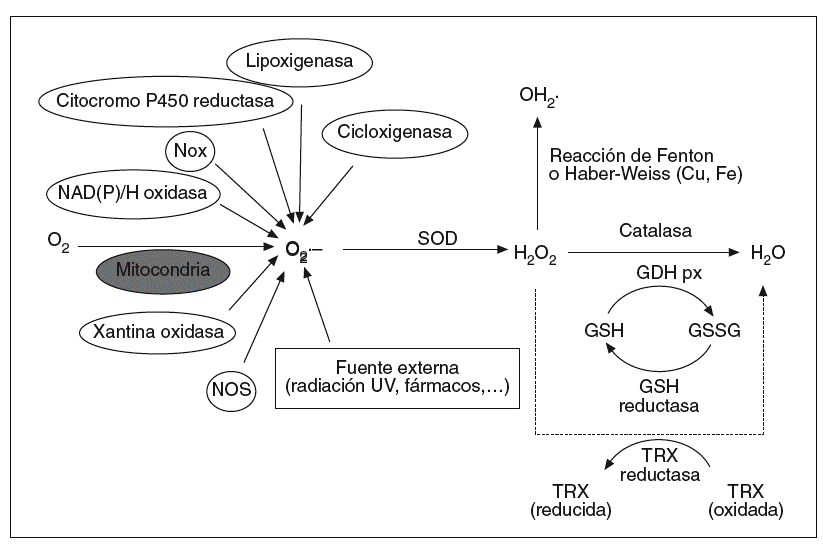
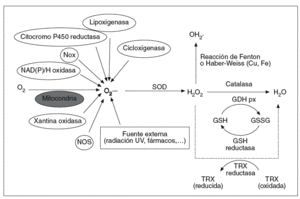
Los ROS presentes en el organismo son mayoritariamente de procedencia endógena, aunque también pueden ser generadas en respuesta a estímulos externos como la luz ultravioleta, la radiación ionizante, fármacos o agentes tóxicos (fig. 1). Como consecuencia del metabolismo celular normal, los organismos aeróbicos están sujetos a la constante producción de pequeñas y controladas cantidades de ROS. En condiciones basales, las células humanas producen unos 2 billones de O2*-- y H2O2 por célula y día, cuya fuente mayoritaria9 son las mitocondrias. Estas organelas consumen el 80-90% del oxígeno celular, el cual reducen a agua para obtener energía en forma de ATP. Aunque la respiración mitocondrial es altamente eficaz, aproximadamente un 2% del O2 consumido es parcialmente reducido a O2*-- y H2O2. Sin embargo, en determinadas circunstancias, como puede ser la isquemia-reperfusión o en situaciones de estrés metabólico, la mitocondria puede convertirse en fuente incontrolada de ROS, hecho que se ha asociado al envejecimiento y al desarrollo de diversas afecciones4 así como al efecto tóxico del alcohol sobre el páncreas10.
Fig. 1. Formación y metabolización celular de las especies reactivas de oxígeno (ROS). Los ROS, como el anión superóxido (O2•–), peróxido de hidrógeno (H2O2) y los radicales hidroxilo (OH•), son generados en respuesta a agentes exógenos o, mayoritariamente, por vías endógenas del metabolismo celular, como la cadena de transporte mitocondrial, la NAD(P)H oxidasa de la membrana citoplasmática, la citocromo P450 reductasa, etc. La superóxido dismutasa (SOD) transforma el O2•– en H2O2, y éste es degradado principalmente a H2O por las enzimas glutatión peroxidasa (GSH px) y catalasa. Mediante la reacción de Fenton o Haber-Weiss, el H2O2 es capaz de formar OH•, un radical altamente reactivo.
Otras fuentes endógenas de O2*-- son la xantina oxidasa (XOD), la lipoxigenasa, la ciclooxigenasa, el citocromo P450 y las cadenas de transporte de electrones halladas en el retículo endoplasmático, en los peroxisomas, en la membrana nuclear y en la membrana citoplasmática2. Entre ellas destaca la NAD(P)H oxidasa de las células fagocíticas por el potencial de producir grandes cantidades de O2*-- ante la defensa contra patógenos y otros agresores11. En el resto de las células no fagocíticas la NAD(P)H oxidasa está representada por las Nox (non phagocytic NADPH oxidase), enzimas productoras de pequeños pulsos constitutivos de O2*-- que participan de forma clave en la señalización celular12.
El concepto de red antioxidante
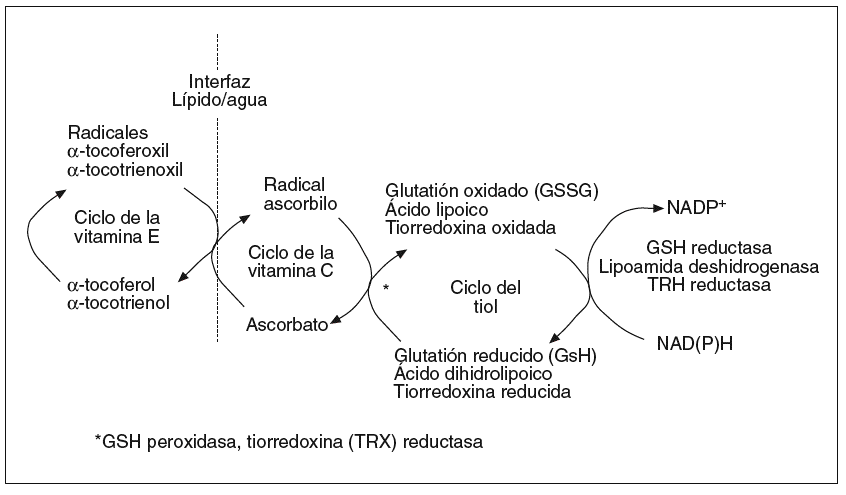
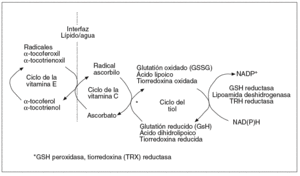
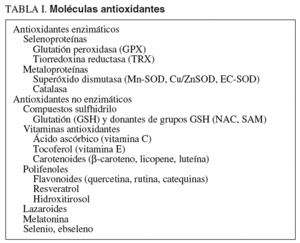
Para mantener el control oxidativo celular el organismo cuenta con un complejo sistema antioxidante basado en el engranaje funcional de compuestos enzimáticos y no enzimáticos (fig. 2; tabla I). Esta estructura se compone de elementos hidrofílicos (vitamina C, ácido ascórbico), lipofílicos (ubicuinol, vitamina E) y tioles (GSH, tiorredoxina, ácido lipoico) cuya interacción es esencial para mantener el equilibrio redox del complejo13. A modo de ejemplo, la forma oxidada de la vitamina E (tocotrienoxil o tocoferoxil) requiere la acción de la vitamina C o, indirectamente, del glutatión y el ácido lipoico, para ser reciclada a su estado antioxidante activo (tocotrienol o tocoferol)14. Este concepto de red descubre la importancia de diseñar tratamientos basados en una interacción de antioxidantes más que en suplementos aislados. Es también importante incidir en la naturaleza lipofílica o hidrofílica de las moléculas antioxidantes, lo cual determina su distribución bien en las membranas o bien en la fracción hidrosoluble celular, donde están destinadas a mantener el equilibrio redox.
Fig. 2. Concepto de red antioxidante. Las organismos celulares cuentan con un complejo sistema antioxidante compuesto por piezas lipo e hidrosolubles. Estas piezas deben estar bien engranadas para mantener en movimiento los circuitos antioxidantes. Los antioxidantes de tipo liposoluble, cuyo arquetipo es la vitamina E, son necesarios para el control oxidativo en las membranas celulares, mientras que los antioxidantes hidrosolubles mantienen el estado redox de las fases acuosas,como el citosol o el espacio extracelular.
ESTRÉS OXIDATIVO EN LA PANCREATITIS AGUDA. ¿CUÁLES SON LAS EVIDENCIAS?
La pancreatitis aguda define un proceso inflamatorio agudo del páncreas donde se observa lesión de las células acinares (vacuolización, necrosis), infiltración leucocitaria (macrófagos, polimorfonucleares), edema intersticial y, en los casos más graves, hemorragia tisular. Su origen se atribuye a la activación prematura local de los gránulos de zimógeno (o proenzimas) que ocasionaría la «autodigestión» del páncreas15-17. Este error inicial supone una agresión directa contra la célula acinar que desata mecanismos inflamatorios locales y sistémicos18,19, en los que el estrés oxidativo participa de forma activa. A continuación recopilamos argumentos experimentales y clínicos que asocian el estrés oxidativo al desarrollo de la pancreatitis aguda.
Estrés oxidativo local en la pancreatitis aguda
Una nutrida lista de datos experimentales demuestra que la pancreatitis aguda, tanto en su forma leve como grave, se acompaña de una enorme y rápida formación local de ROS20-23. En estudios experimentales, la medición directa de ROS en la célula acinar24 o la obtención de parámetros indirectos de lesión oxidativa, como son los productos de peroxidación lipídica (TBARS, dienos conjugados) y proteica (carbonilos) en tejido pancreático22,23, han demostrado que la agresión oxidativa acontece de forma muy temprana en el curso de la enfermedad. De hecho, es posible apreciar cambios oxidativos transcurridos tan sólo 30 min desde el inicio de la agresión pancreática, cuando aún los cambios morfológicos del páncreas (edema, necrosis, infiltración leucocitaria) y la hiperamilasemia no se han desarrollado23. La brevedad con la que ocurren estos cambios oxidativos es un obstáculo difícil de sortear a la hora de plantear tratamientos antioxidantes que frenen la progresión de la pancreatitis.
Un dato indirecto que refleja el impacto oxidativo es el consumo de las reservas antioxidantes pancreáticas, como son el GSH25,26, la glutatión peroxidasa22,27, la superóxido dismutasa22,27 o la catalasa27. De hecho, la maquinaria antioxidante pancreática parece ser determinante en limitar el daño pancreático, como lo sugiere el empeoramiento de la lesión pancreática en ratas cuyo GSH pancreático se ha anulado farmacológicamente23,28 o en ratones que no expresan el antioxidante metalotioneína29. Otro ejemplo es el del alcohol, cuyo efecto oxidativo sobre el páncreas30,31 se cree que podría facilitar la acción lesiva de otras noxas32.
Estudios en humanos confirman también el desarrollo de cambios oxidativos en pacientes con pancreatitis aguda. En estos sujetos puede apreciarse un aumento sérico de superóxido33, de productos de peroxidación lipídica33-35 y proteica36 y un descenso de los valores de vitaminas A, C y E33,35,37,38, de selenio35,39, de glutatión peroxidasa39, de glutatión40, de superóxido dismutasa34 y de grupos sulfidrilo41. Todo ello refleja el gran impacto oxidativo que presentan estos pacientes durante la enfermedad.
Estrés oxidativo sistémico en la pancreatitis aguda
Una de las complicaciones más temidas de la pancreatitis aguda es la afectación sistémica y el consiguiente fallo multiorgánico, en la que pulmón, riñón y sistema cardiovascular son órganos común y peligrosamente afectados42. Esta situación agrava notablemente el curso de la enfermedad, con una mortalidad asociada que se sitúa entre el 30 y el 50%43. A pesar de su gravedad, nuestras posibilidades terapéuticas se reducen a medidas de soporte, como son la hidratación por vía intravenosa, la monitorización del estado hemodinámico y ácido-base, los analgésicos, los antieméticos y los antibióticos.
Aunque se desconoce por qué algunos pacientes desarrollan una afección multisistémica, sabemos que el estrés oxidativo protagoniza un papel importante en la extensión de la enfermedad. Desde el tejido pancreático inflamado se liberan gran variedad de mediadores oxidativos bioactivos con potencial para propagar la lesión a otros órganos19. Éstos son los casos por ejemplo de la XOD y de los 8-isoprostanos. La XOD es una enzima formada a partir de la xantina deshidrogenasa (XDH) en situaciones de hipoxia, isquemia o en presencia de mediadores inflamatorios. Esta enzima produce superóxido durante la oxidación de hipoxantina a xantina y de xantina a ácido úrico. En la pancreatitis aguda ocurre un aumento de la conversión XDH a XOD, y se cree que desde el páncreas inflamado la XOD se libera a la circulación sistémica. Su
llegada al pulmón propiciaría la activación y el reclutamiento de leucocitos y la expresión de moléculas inflamatorias promotoras del fracaso pulmonar44. Otro mediador oxidativo local con efectos sistémicos son los 8-isoprostanos45. Estos lípidos derivados del ataque oxidativo directo al ácido araquidónico poseen propiedades bioactivas de gran interés patogénico (inducen vasoconstricción, liberan endotelina 1, etc.). Su formación y liberación al torrente sanguíneo se han demostrado en la pancreatitis aguda experimental, lo cual se ha relacionado con el deterioro de la función renal asociada a la pancreatitis46.
Consecuencias del estrés oxidativo en la pancreatitis aguda
El entorno oxidativo creado en el tejido pancreático no sólo tiene un efecto citotóxico directo sobre los lípidos, proteínas y ADN, sino que promueve la activación local de factores de transcripción nuclear, cinasas/fosfatasas y la expresión de genes47-52 divulgadores de la respuesta inflamatoria. Entre ellos destaca el factor nuclear-kappa B (NF-kB) por su papel regulador de la expresión génica de numerosos mediadores proinflamatorios. Este factor de transcripción se activa en las células acinares en etapas muy iniciales de la pancreatitis, y ocasiona la expresión de citocinas (factor de necrosis tumoral [TNF] a, interleucina [IL] 1b, IL-6, factor activador de plaquetas), quimiocinas (IL-8, KC, Mob-1) y moléculas de adhesión (moléculas de adhesión intracelular [ICAM], selectinas)47,48. Una prueba de la importante participación de NF-kB en la pancreatitis aguda la aportan Chen et al49 al demostrar el desarrollo de inflamación pancreática y sistémica tras la introducción en el páncreas de una porción activa de NF-kB.
El atractivo «oxidativo» del NF-kB se debe a su susceptibilidad a ser activado por el H2O253 y, por tanto, a ser silenciado con tácticas antioxidantes. De hecho, en condiciones experimentales, la supresión de la activación de NF-kB mediante manipulación génica54 o farmacológica con la utilización de compuestos antioxidantes (N-acetil cisteína47,48,55, curcumina56, superóxido dismutasa55, raxofelast57) ha mostrado resultados favorables consistentes con la reducción de la expresión de citocinas y reducción de la lesión pancreática.
Causantes de la producción de estrés oxidativo en la pancreatitis aguda: leucocitos, endotelio y otros sospechosos
Un implicado clave en la generación local y sistémica de los ROS en la pancreatitis aguda son los leucocitos polimorfonucleares, los cuales disponen de un eficiente sistema oxidativo, la NAD(P)H oxidasa. Desde la circulación sanguínea, estas células son reclutadas en el páncreas en fases tempranas de la enfermedad a través de moléculas de adhesión (p. ej., ICAM-1, p-selectina) presentes en la microvasculatura del páncreas58. Su efecto nocivo queda patente por la atenuación de la lesión pancreática en ratones Knock-out en NAD(P)H oxidasa59. De forma similar, también se consigue una menor gravedad de la lesión pancreática y pulmonar en ratas neutropénicas59-61 o en ratones deficientes en ICAM-161.
El endotelio vascular es otro inculpado (todavía sin cargo demostrado en la pancreatitis) como motor oxidativo durante la inflamación aguda del páncreas. Además de expresar moléculas de adhesión que facilitan la infiltración leucocitaria, estas células poseen una variada maquinaria oxidativa, como la XOD, la sintasa del óxido nítrico o las Nox62, capaz de generar cantidades críticas de ROS durante los procesos inflamatorios.
Otros prooxidantes sospechosos en la pancreatitis aguda son las células acinares, capaces de generar ROS ante una agresión directa63, y las células estrelladas del páncreas (CEP), cuya actividad prooxidativa es bien conocida en las células estrelladas hepáticas64-66.
Terapia antioxidante en la pancreatitis aguda experimental
La lista de antioxidantes probados en la pancreatitis aguda experimental es amplia y variada21. Algunos ejemplos son la N-acetilcisteína47,48,55,67, el polietilenglicol68, el raxofelast --un análogo sintético de la vitamina E57--, compuestos naturales como la curcumina56, enzimas antioxidantes (SOD, catalasa68,69), el alopurinol --inhibidor de la XOD68,70-- o el selenio71. A pesar de la heterogeneidad de todos estos estudios, la mayoría ha demostrado mitigar la lesión pancreática y sistémica y mejorar la tasa de supervivencia.
La realidad clínica
Hasta el momento la experiencia clínica es escasa y poco concluyente. Se ha probado el tratamiento con selenio, un elemento esencial de las llamadas selenoproteínas, como la glutatión peroxidasa (GPX) o la tiorredoxina, cuyas concentraciones séricas están disminuidas en estos pacientes. Estudios realizados por un grupo alemán demuestran que la administración de selenio aumenta la actividad de GPX en sangre72 y mejora el pronóstico de la enfermedad73. Sin embargo, estos datos carecen de grupo control y no han sido verificados por un estudio controlado realizado en 47 pacientes en el que el grupo control con selenio no mostraba una mejora en la morbilidad ni mortalidad74. Se han utilizado sin éxito combinaciones de N-acetilcisteína y s-adenosil metionina (precursores del glutatión)21 o de N-acetilcisteína, ácido ascórbico y selenio74. Cabe citar un reciente estudio controlado y aleatorizado realizado en 84 pacientes en el que la vitamina C a dosis altas (10 g/día, por vía intravenosa) durante los primeros 5 días de la enfermedad aumenta los valores antioxidantes en sangre, disminuye la amilasemia y amilasuria, reduce los síntomas y disminuye el número de complicaciones75.
Hacia dónde encaminar futuras tácticas antioxidantes
La progresiva identificación de mecanismos oxidativos implicados en la pancreatitis aguda está descubriendo novedosas vías intracelulares susceptibles de ser interceptadas. Además, contamos con moléculas antioxidantes de reciente aparición que ya han demostrado su eficacia en otros procesos inflamatorios. No obstante, hemos de afrontar aspectos negativos que actúan en contra de un tratamiento eficaz. Ejemplo de ello es el retraso diagnóstico de la pancreatitis aguda, ya que es durante las primeras horas cuando se desarrollan los cambios oxidativos que encauzan el curso de la enfermedad.
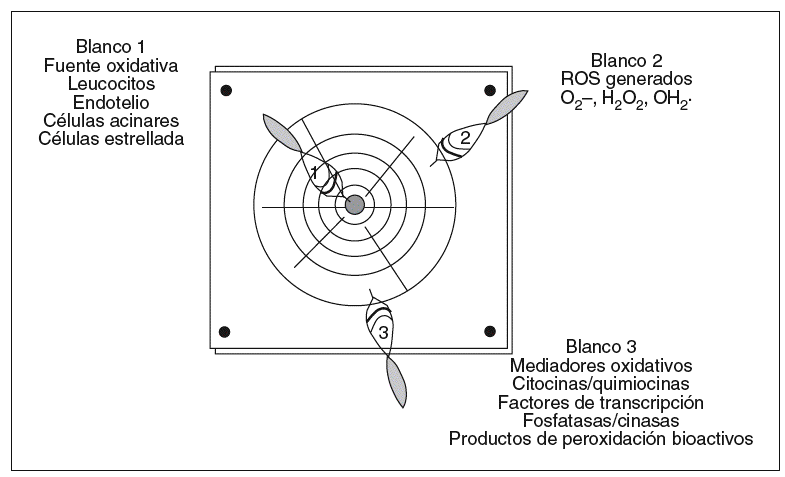
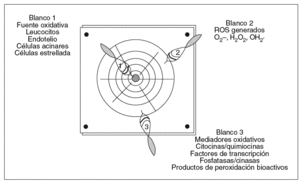
Este objetivo terapéutico suscita 2 cuestiones. La primera, ¿es posible diseñar tratamientos antioxidantes eficaces?, y la segunda, ¿qué estrategia queremos plantear? Tenemos 3 posibilidades a seguir: 1) reducir la formación de ROS; 2) eliminar los ROS formados, o 3) neutralizar los mediadores oxidativos generados (fig. 3).
Fig. 3. Blancos oxidativos con potencial terapéutico en la pancreatitis aguda. Los objetivos terapéuticos encaminados a disminuir el estrés oxidativo en la pancreatitis aguda son 3: a) Impedir la formación de ROS anulando la fuente de origen con inhibidores específicos (p. ej., inhibidores de moléculas de adhesión para impedir el secuestro leucocitario); b) eliminar los ROS ya generados mediante la administración de antioxidantes, y c) contrarrestar los mediadores oxidativos (p. ej., NFkB, TNF-a o isoprostanos) que amplifican la lesión con inhibidores selectivos.
Reducir la formación de ROS
Aquí se plantearían medidas dirigidas directamente contra las fuentes productoras de ROS, como son los leucocitos, el endotelio, las células acinares o las células estrelladas del páncreas. Estas propuestas aún experimentales, como por ejemplo en el uso de compuestos que interfieran en la migración leucocitaria (anticuerpos contra moléculas de adhesión o contra factores quimiotácticos) o que controlen la actividad inducible de la Nox endotelial, requieren por el momento un mayor conocimiento experimental antes de ver su aplicación clínica.
Eliminar los ROS formados
Una vez producida la descarga de ROS, la alternativa terapéutica es potenciar la maquinaria antioxidante del organismo, la cual experimenta una gran merma en el curso de la pancreatitis aguda. Una opción razonable es el aporte exógeno de antioxidantes. Sin embargo, aunque ésta haya sido una maniobra válida en modelos animales, los resultados han sido por el momento poco halagüeños en pacientes con pancreatitis aguda. Para obtener un mejor rendimiento sería importante contar con un conocimiento farmacodinámico más exhaustivo de los compuestos utilizados, como es su distribución tisular, su metabolismo y el microentorno en el que han de actuar. Aún habiendo resuelto este punto, la situación sigue complicada si tenemos en cuenta que muchos compuestos antioxidantes actúan en reacciones de oxidación-reducción que son reversibles y, algunos, como el ascorbato, pueden actuar simultáneamente como antioxidantes y prooxidantes según el entorno76. Además, dado que los ROS son también mediadores imprescindibles en la señalización celular normal, es importante definir la dosis óptima de tratamiento antioxidante que no perturbe el equilibrio redox celular. Una última consideración es recordar la complejidad de la red antioxidante del organismo (fig. 3), lo cual advierte sobre la insuficiencia de la reposición aislada de un elemento antioxidante para restablecer el funcionamiento de un sistema gravemente comprometido.
Como posibilidad prometedora citaremos el reciente desarrollo de miméticos sintéticos de la superóxido dismutasa (SOD) (todavía en fase de ensayo clínico), como por ejemplo el M40403. Entre sus ventajas destaca su gran estabilidad, gran potencia antioxidante y, especialmente, su pequeño tamaño (peso molecular M40403: 483 frente a SOD nativa: 30.000). A diferencia de la SOD nativa, cuyo uso clínico se ha visto acotado por su gran tamaño, breve vida media y antigenicidad por su procedencia bovina, estas nuevas moléculas difunden fácilmente al interior celular y no presentan problemas de inmunización77.
Neutralizar los mediadores oxidativos derivados de la acción de los ROS
Este objetivo iría destinado a anular los intermediarios que propagan o ejecutan la lesión dependiente de los ROS. Un mediador «oxidativo» de especial atractivo en la pancreatitis aguda es el NF-kB. Para su inhibición contamos con fármacos con probada aplicación clínica, como son antioxidantes (p. ej., N-acetilcisteína, ácido a-lipoico, polifenoles, epicatequinas, etc.), inhibidores de la fosforilación y del proteasoma (p. ej., ácido acetilsalicílico, salicilato sódico, bortezomib) o inhibidores de la unión del NF-kB al ADN.
Otros blancos de actuación serían la neutralización de citocinas, quimiocinas, de moléculas de adhesión o de isoprostanos derivados del metabolismo oxidativo del ácido araquidónico. Cabe destacar la emergente terapia en torno a TNF-a, como por ejemplo los anticuerpos anti-TNF-a --infliximab-- o sTNF-R1-Fc --etanercept--, introducida en el tratamiento de la artritis reumatoide o la enfermedad de Crohn. De hecho, infliximab ha mostrado ser beneficioso en un modelo de pancreatitis aguda experimental78.
Terapis considerar las posibilidades que la emergente terapia génica está fraguando. Mediante tecnología recombinante, esta opción permite introducir genes en el genoma de las células diana y así manipular selectivamente los procesos transcripcionales deseados79. Actualmente esta modalidad terapéutica se está explorando activamente en diversas afecciones, especialmente en el cáncer, y cuenta ya con numerosos protocolos clínicos en marcha en todo el mundo. La terapia génica ofrece infinitas posibilidades, hasta el punto que podrá llegar a personalizar el tratamiento deseado con la elección del gen apropiado para cada paciente. En el tema que aquí se aborda, el objetivo sería desarrollar genes que silenciaran la respuesta oxidativa o que potenciaran el sistema celular antioxidante. Pero una vez más, habremos de esperar a que la investigación experimental nos ofrezca resultados adaptables a nuestros pacientes.
ESTRÉS OXIDATIVO EN LA PANCREATITIS CRÓNICA. ALGUNOS INDICIOS ESTELARES
La pancreatitis crónica supone aún hoy en día un desafío médico para cuyo tratamiento sólo contamos con medidas paliativas (analgésicos, enzimas pancreáticas y cirugía). Desafortunadamente, esta enfermedad tiene un curso progresivo que conduce a la destrucción morfológica y funcional del páncreas. Llegados a este punto, la atrofia y la fibrosis glandular son hechos irreversibles. A pesar de que se han identificados numerosos factores de riesgo asociados a la enfermedad80, como son factores toxicometabólicos (alcohol, tabaco, hipercalcemia, hiperlipidemia, fármacos), factores genéticos (mutaciones del gen CFTR, SPINK1), factores obstructivos (páncreas divisum, quistes o tumores periampulares, traumatismo pancreático), factores autoinmunitarios, etc., la patogenia de este proceso es compleja y poco conocida. Sin embargo, sobre la base de estudios clínicos y experimentales, no es aventurado afirmar que el estrés oxidativo participa de forma sustancial en el desarrollo de la enfermedad.
Argumentos oxidativos en pacientes con pancreatitis crónica
La detección de productos de peroxidación lipídica en el tejido81 y en el jugo pancreático82-84 de pacientes con pancreatitis crónica es una prueba fehaciente del estrés oxidativo continuado desarrollado en el páncreas de estos pacientes.
Consecuencia de ello es un consumo exagerado de las reservas antioxidantes que motiva un perfil antioxidante deficiente en estos pacientes, como es la extinción pancreática de glutatión85 o la reducción en sangre de vitaminas A y E, de selenio y de carotenoides86-88.
Aunque no se conocen con certeza las causas del estrés oxidativo pancreático, se piensa que su origen podría tener un condicionante ambiental o genético. Algunos autores sugieren la posibilidad de que es el metabolismo pancreático de factores presentes en la dieta o en el ambiente, como algunos aceites con alto contenido en ácidos grasos, el humo del tabaco, productos petroquímicos o pesticidas, el causante del estrés oxidativo en la propia célula acinar por parte de las enzimas participantes, como son la glutatión transferasa o el citocromo P450 2E189,90. Éste es un hecho bien documentado en el caso del alcohol, causante del 70-80% de los casos de pancreatitis crónica. Una proporción importante del alcohol consumido se metaboliza en el páncreas por el citocromo P450 2E1. De hecho, la expresión en páncreas de esta enzima aumenta notablemente con la administración crónica de alcohol91. Como producto de su actividad metabólica, el citocromo P450 2E1 genera importantes cantidades de ROS65, y esta actividad oxidativa parece ser crucial en el poder fibrogénico del alcohol92,93. Pero la naturaleza de la pancreatitis crónica no parece simplificarse en un solo factor, ya que ¿por qué menos del 10% de los sujetos con hábito enólico severo desarrollan pancreatitis crónica?, ¿o por qué los individuos de raza negra tienen una mayor prevalencia de pancreatitis crónica enólica, en tanto que los sujetos de raza blanca presentan una mayor afectación hepática por el alcohol? Algunos estudios han sugerido que la pancreatitis crónica debe prosperar bajo un estatus oxidativo premórbido, como por ejemplo en individuos con una ingesta antioxidante deficiente94 o con una base genética prooxidativa (polimorfismos en el gen de la glutatión transferasa95 o del citocromo p450 2E196). Una prueba más que relaciona una base genética prooxidante en el desarrollo de la pancreatitis crónica es el amplio déficit de antioxidantes hallado en pacientes con pancreatitis crónica hereditaria86.
Papel del estrés oxidativo en la patogenia de la pancreatitis crónica
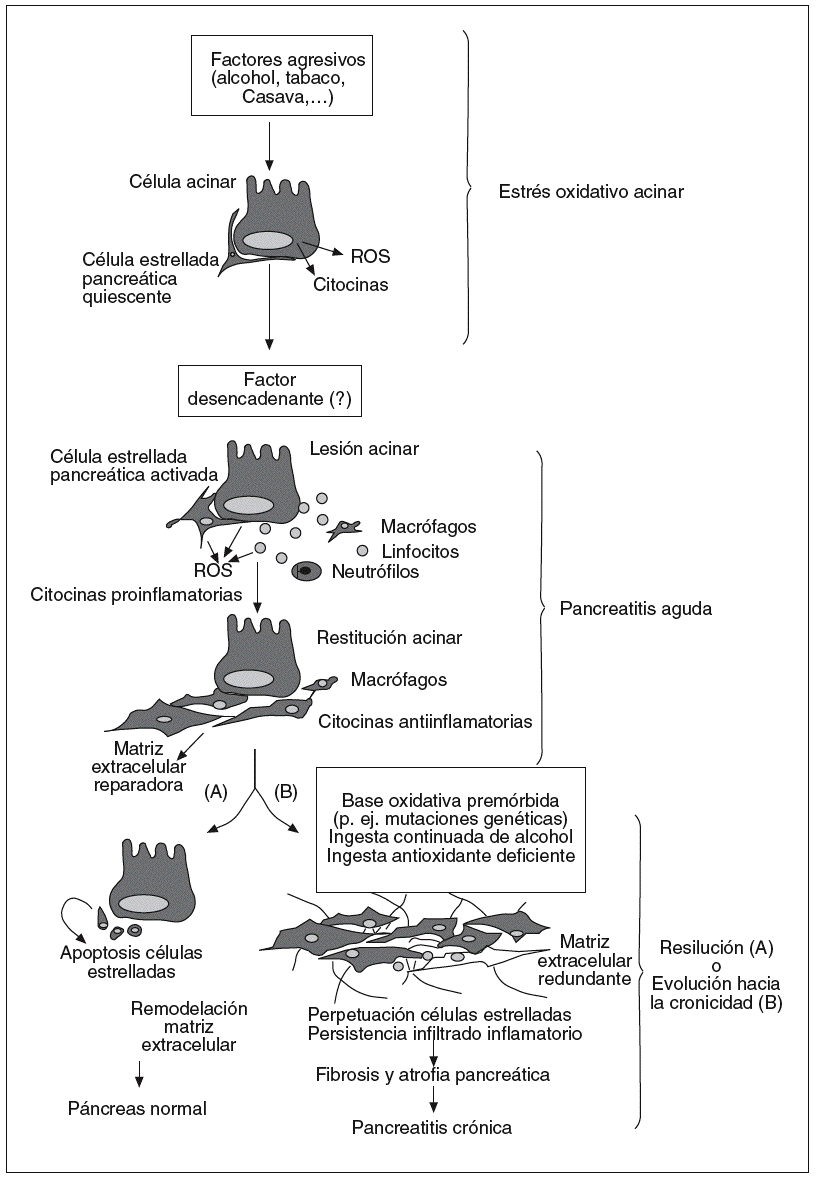
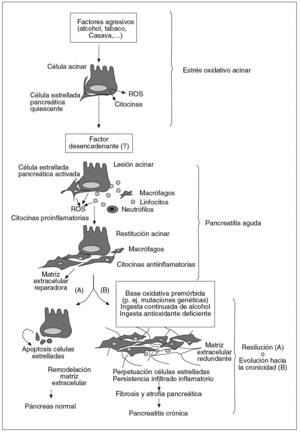
Si trazamos un dibujo de lo que hasta ahora conocemos sobre el desarrollo de la pancreatitis crónica, podemos simplificar el proceso en una secuencia de 3 etapas y, como elemento común de fondo, un ambiente oxidativo que permite y promueve la progresión del proceso (fig. 4).
Fig. 4. Hipótesis oxidativa sobre el desarrollo de la pancreatitis crónica. Este dibujo esquematiza en 3 etapas sucesivas la evolución hacia la fibrosis y atrofia pancreática características de la pancreatitis crónica. En la primera etapa, las células acinares, representantes del 90% del parénquima pancreático, se ven sometidas a una situación de estrés metabólico creado por la exposición a factores agresivos externos. En esta fase las células acinares liberan citocinas y ROS que crean un ambiente oxidativo pancreático, aunque por el momento sin lesiones perceptibles. La segunda etapa corresponde a la respuesta aguda pancreática ante un desencadenante aún no filiado. En la fase inicial de la pancreatitis aguda entran las células inflamatorias en el páncreas, las cuales amplifican la respuesta oxidativa y fomentan la activación de las células estrelladas del páncreas. En la fase final de la pancreatitis el infiltrado inflamatorio es dominado por macrófagos de naturaleza antiinflamatoria y las células estrelladas activadas se dedican a sintetizar matriz extracelular para reparar la lesión. En la última etapa, el páncreas tiene la opción recobrar la integridad tisular mediante eliminación de las células estrelladas activadas y remodelación de la matriz extracelular depositada. Sin embargo, en situaciones de estrés oxidativo continuado derivado, p. ej., de mutaciones genéticas o de la ingesta continuada de alcohol, los macrófagos y células estrelladas permanecen activos en el páncreas, ocasionando un depósito continuado de matriz extracelular que concluirá en la atrofia y fibrosis de la glándula.
En la fase inicial entran en juego factores externos agresivos (alcohol, fármacos) o internos (obstrucción ductal, polimorfismos genéticos) que someten al páncreas, representado por la célula acinar, a una situación de estrés metabólico. El estado oxidativo al que se ve expuesta la célula acinar se cree que es suficiente para que ésta se convierta en fuente de citocinas y quimiocinas. Bajo estas condiciones de estrés oxidativo el páncreas puede permanecer años con una apariencia y función completamente normales.
La segunda fase corresponde a la respuesta aguda pan-
creática iniciada por un detonante aún no definido. Esta fase es fundamental porque da entrada a las células inflamatorias y permite la activación de las células estrelladas que residen en el páncreas en estado quiescente, elementos indispensables para la progresión de la pancreatitis hacia la cronicidad. Podríamos distinguir aquí 2 etapas: una inicial dominada por la infiltración de neutrófilos y macrófagos, activación y proliferación de células estrelladas pancreáticas, secreción de citocinas proinflamatorias (p. ej., TNF-a, factor de crecimiento derivado de las plaquetas, IFN-g) y elevada de formación de ROS, y una segunda etapa de curación de la lesión en la que impera la secreción de citocinas antiinflamatorias y fibrogénicas (p. ej., IL-10, IL-13, factor de crecimiento de transformación b) y la labor reparadora de las células estrelladas activadas. Otra posibilidad válida es que las células estrelladas del páncreas se activen directamente por el estrés oxidativo local sin agresión pancreática previa, lo cual explicaría por qué algunos pacientes debutan con una pancreatitis crónica plenamente establecida sin historia de episodios agudos previos97.
Resuelta la lesión, el páncreas se halla ante un dilema de decisión que abre una tercera fase. Si el proceso de curación sigue su curso normal, el infiltrado inflamatorio y las células estrelladas se eliminan por un proceso de apoptosis y fagocitosis de los cuerpos apoptóticos por parte de los macrófagos, y la fibrosis redundante se remodela con el fin de restituir la arquitectura normal del páncreas. Por el contrario, una situación de lesión crónica (o repetitiva) crea un estado de estrés oxidativo pancreático continuado en el que las células estrelladas del páncreas --beneficiarias de ambientes oxidativos-- mantienen su actividad mitogénica, proinflamatoria y fibrogenia. En este escenario de fibrogénesis la participación de la respuesta inmunitaria es crítica. La persistencia de un infiltrado crónico de células monocíticas, que incluye linfocitos, macrófagos, eosinófilos y células plasmáticas, sostiene la producción de factores de crecimiento, enzimas proteolíticas y citocinas fibrogénicas y ROS que colaboran con las células estrelladas para promover la deposición de la matriz extracelular y la progresiva remodelación y destrucción del parénquima pancreático.
Efecto del tratamiento antioxidante en pacientes con pancreatitis crónica
Aunque la mala digestión y la diabetes mellitus son graves problemas derivados de la pancreatitis crónica, es el dolor abdominal crónico o recurrente el síntoma más preocupante y difícil de controlar en estos pacientes. La enfermedad se manifiesta a menudo como un ataque agudo de dolor abdominal indistinguible de una pancreatitis aguda. Este episodio se suele seguir de una historia de dolor abdominal continuo o en forma de episodios repetidos. No es infrecuente que el uso de analgésicos, incluidos los opiáceos, sea un esfuerzo vano para paliar el dolor, lo que apremia el uso de soluciones quirúrgicas agresivas. Se cree que el dolor abdominal de los sujetos con pancreatitis crónica tiene un origen multifactorial (hipertensión ductal, afectación neural, isquemia). Por ello, en pacientes con dolor intratable las alternativas más utilizadas son la liberación de la presión ductal vía quirúrgica o endoscópica, el bloqueo del plexo celíaco y, en algunos casos, la pancreatectomía parcial o total. Sin embargo, el resultado de estas medidas tan drásticas no es siempre satisfactorio para una enfermedad en teoría de curso benigno, por lo que se persigue desde hace años opciones terapéuticas más conservadoras.
El estrés oxidativo pancreático que presentan estos pacientes ha promovido un continuo interés en la utilización de antioxidantes para controlar el dolor abdominal. Braganza et al98 fueron pioneros en demostrar la importancia de un aporte nutricional antioxidante para la prevención y tratamiento99 de esta enfermedad. Este y otros grupos han validado el beneficio analgésico de los antioxidantes en estudios controlados mediante aporte prolongado de combinaciones de selenio, carotenos, vitamina C, vitamina E y metionina100-102. Un estudio anecdótico llevado a cabo en 3 pacientes demuestra también la reducción del dolor abdominal mediante la administración de proantrocianida, un extracto natural de las semillas de las uvas con capacidad antioxidante103. El alopurinol, un inhibidor de la XOD, se ha probado sin éxito en 13 pacientes con dolor abdominal104.
La búsqueda antioxidante continúa
A semejanza de otros procesos fibrogénicos, como la cirrosis hepática, la fibrosis pulmonar, los queloides, etc., el estrés oxidativo es un factor profibrogénico de capital importancia que promueve el desarrollo y la progresión de la pancreatitis crónica. Parece también claro que los suplementos antioxidantes alivian el dolor abdominal en estos pacientes. Sin embargo, la meta que actualmente podamos plantearnos debe ser más ambiciosa que la simple mejoría sintomática. Con la identificación de las células estrelladas del páncreas como artífices de la fibrosis pancreática105,106 se abren novedosas posibilidades para anular el motor fibrogénico de la enfermedad. Estas células tienen la característica de lucrarse de ambientes oxidativos para proliferar y secretar matriz extracelular. Éste es un hecho ampliamente documentado en las células estrelladas hepáticas, en las que la capacidad proliferativa y fibrogénica es promovida por estímulos oxidativos64-66 y reducida por compuestos antioxidantes como la vitamina E, catalasa65 o 3-galato de epigalocatequina107. En un estudio piloto en pacientes con hepatitis crónica C refractarios a interferón alfa [IFN-a]-2b se demostró que el tratamiento con a-tocoferol (1.200 U/día durante 8 semanas) reduce los parámetros de oxidación en el hígado y en sangre y disminuye la activación de las células estrelladas hepáticas, aunque no consiguió disminuir la fibrosis hepática, posiblemente por la corta duración del tratamiento108. En el páncreas, el estrés oxidativo también parece promover la activación de las células estrelladas. Así lo demuestra un aumento en la proliferación y síntesis de colágeno en CEP en cultivo expuestas a una fuente oxidativa externa109 y una reducción del número de CEP y de fibrosis pancreática en un modelo de pancreatitis crónica en rata tratado con vitamina E110.
Estos datos nos animan a afirmar que la fibrosis ha dejado de ser un proceso estático y se ha convertido en un concepto dinámico con posibilidades de actuación terapéutica111. Una de las claves parece residir en reconocer las vías oxidativas de supervivencia de las células estrelladas pancreáticas que puedan ser interrumpidas por vía farmacológica o, en un futuro, mediante terapia génica.