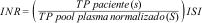El uso de fármacos antiagregantes y anticoagulantes es habitual en pacientes que se realizan un procedimiento endoscópico electivo. Para minimizar el riesgo tanto de hemorragia como de trombosis, es fundamental ofrecer una evaluación individualizada. Para ello, la Societat Catalana de Digestologia (SCD) encargó un documento de consenso con el objetivo de ofrecer unas recomendaciones prácticas basadas en la mejor evidencia disponible y en consenso de expertos.
Material y métodosDiez especialistas en Aparato Digestivo, Cardiología, Hematología y Anestesiología participaron en la elaboración del documento. Se llevó a cabo una revisión no sistemática de la literatura y se aplicó el método Delphi modificado con votación telemática. Las recomendaciones se revisaron y comentaron en cada ronda para llegar a un consenso, aceptándose aquellas que alcanzaron un nivel de acuerdo del 80%.
ResultadosSe evaluaron 16 procedimientos endoscópicos según su riesgo hemorrágico, y se definieron pautas específicas de manejo adaptadas a los distintos grupos de fármacos antitrombóticos. El documento incluye un algoritmo de manejo y tablas de estratificación de riesgo hemorrágico y trombótico.
ConclusiónLas recomendaciones de la SCD integran la evidencia internacional y se adaptan a nuestro entorno sanitario, ofreciendo una herramienta útil para la práctica clínica. Se resalta la necesidad de coordinación multidisciplinaria y de una buena comunicación con el paciente para garantizar la seguridad durante el periodo periprocedimiento.
The use of antiplatelet and anticoagulant drugs is common in patients undergoing elective endoscopic procedures. To minimize both bleeding and thromboembolic risks, an individualized assessment is essential. For this purpose, the Societat Catalana de Digestologia (SCD) commissioned a consensus document aimed at providing practical recommendations based on the best available evidence and expert agreement.
Material and MethodsA panel of 10 specialists from the fields of Gastroenterology, Cardiology, Hematology, and Anesthesiology were involved in the development of the document. A non-systematic review of the literature was conducted using a modified Delphi method through online voting. Recommendations were reviewed and discussed during each round until consensus was reached. Recommendations with ≥80% agreement were accepted.
ResultsA total of 16 endoscopic procedures were assessed based on their hemorrhagic risk, and tailored management guidelines were defined to different groups of antithrombotic agents. The document includes a management algorithm and stratification tables for bleeding and thrombotic risk.
ConclusionThe recommendations developed by the SCD integrate international evidence and are adapted to the local healthcare context, providing a valuable tool for clinical practice. The importance of multidisciplinary coordination and effective communication with the patient is emphasized to ensure safety throughout the periprocedural period.
El uso de fármacos antiagregantes y anticoagulantes es cada vez más habitual en pacientes que requieren de una endoscopia digestiva, ya que se emplean para prevenir eventos trombóticos arteriales y venosos. Sin embargo, estos tratamientos pueden incrementar el riesgo de hemorragia gastrointestinal, especialmente dependiendo del tipo de procedimiento endoscópico y de su indicación. Por ello, es clave considerar cuidadosamente la terapia antitrombótica previa y disponer de pautas claras para su manejo periprocedimiento, con el objetivo de minimizar posibles complicaciones.
Un manejo inadecuado de estos fármacos puede asociarse a una morbimortalidad significativa, de hasta un 2%1. Con el fin de minimizar estos riesgos, se recomienda realizar una evaluación individualizada del riesgo trombótico y hemorrágico, en función tanto del tipo de procedimiento endoscópico como el perfil del paciente. En general, se recomienda mantener la terapia antitrombótica en pacientes con un alto riesgo de trombosis, porque las consecuencias de un evento trombótico en general suelen ser más graves e irreversibles que las de una hemorragia.
Existen diversas guías clínicas como la del Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología, en consenso con múltiples sociedades2, y la guía clínica de la Sociedad Europea de Endoscopia Digestiva (ESGE)3 que ofrecen recomendaciones durante el periodo periprocedimiento. No obstante, su aplicabilidad puede ser limitada en algunos contextos clínicos locales.
Por este motivo, desde la Societat Catalana de Digestologia (SCD) se ha elaborado este documento de consenso con el objetivo de ofrecer unas recomendaciones prácticas y actualizadas basadas en la evidencia científica, y el acuerdo de expertos, sobre la evaluación y manejo de fármacos antitrombóticos en pacientes que se les realicen una endoscopia electiva.
MétodoEste documento de consenso ha sido elaborado por un grupo de expertos de la SCD, basándose en las recomendaciones de la ESGE, la Sociedad Británica de Gastroenterología (BSG) y la Sociedad Americana de Endoscopia Digestiva (ASGE), actualizadas con las nuevas evidencias y adaptadas a nuestro entorno sanitario. Se realizó una revisión no sistemática de la evidencia sin protocolo de búsqueda estructurado ni evaluación sistemática del riesgo de sesgo, para obtener la bibliografía correspondiente a cada sección hasta octubre de 2023. La búsqueda en la base de datos electrónica consultada fue MEDLINE (accediendo a través de PubMed). Los aspectos controvertidos se discutieron de forma telemática para aprobar en consenso y redactar el documento final, que fue revisado por cada uno de los expertos.
Las recomendaciones se evaluaron de manera conjunta entre los miembros del grupo de trabajo, considerando la limitada evidencia científica y la mayoría de los estudios de baja calidad. El consenso se obtuvo utilizando el método Delphi modificado4 a través de una plataforma de votación en línea (Google Forms). La votación se basó en la escala Likert de hasta 5 puntos (1, completamente en desacuerdo; 2, en desacuerdo; 3, ni de acuerdo ni en desacuerdo; 4, de acuerdo; 5, completamente de acuerdo). Participaron 10 expertos, y se realizaron 2 rondas de votación para llegar a un consenso definitivo. Se consideró que una recomendación fue aprobada si ≥ 80% de los expertos puntuaron con un 4 o 5 en la escala de Likert. La primera y segunda ronda se realizaron durante los meses de noviembre y diciembre de 2023 (Anexo. Material suplementario).
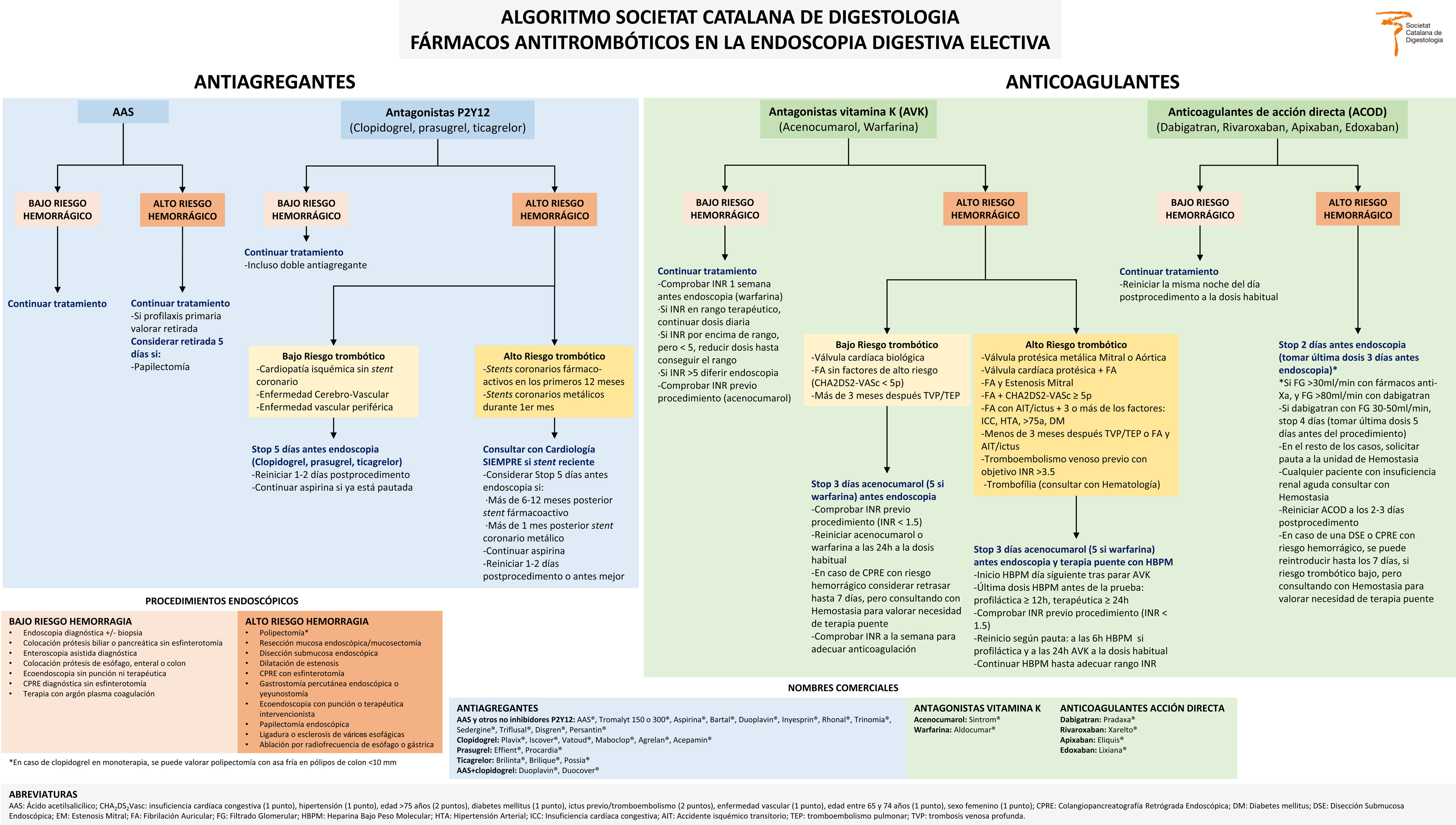
Las recomendaciones principales del grupo de trabajo se resumen en las recomendaciones principales, y el algoritmo propuesto de la SCD en la figura 1.
| RECOMENDACIONES PRINCIPALES |
|---|
| - Se recomienda informar del riesgo hemorrágico y trombótico asociado al procedimiento endoscópico a todos los pacientes tratados con fármacos antitrombóticos.- Se recomienda mantener tratamiento y dosis del ácido acetilsalicílico (AAS), excepto en el caso de la papilectomía endoscópica. En estos casos, se recomienda una retirada cinco días antes del procedimiento, salvo contraindicación (p. ej., stents y/o evento arterial<3 meses).- Los antagonistas P2Y12 (clopidogrel, prasugrel o ticagrelor), en procedimientos de alto riesgo hemorrágico y con bajo riesgo trombótico, se retiran cinco días antes del procedimiento. Siempre se mantiene el AAS si ya está pautado.- Se puede considerar la polipectomía con asa fría de pólipos de colon inferiores a 10mm en pacientes que no se ha retirado el tratamiento con antagonistas P2Y12.- Los antagonistas P2Y12, en procedimientos de alto riesgo hemorrágico y alto riesgo trombótico se recomienda consultar siempre con cardiología, especialmente si se ha colocado un stent coronario reciente (<12 meses).-Los antagonistas P2Y12, en procedimientos de alto riesgo hemorrágico, se reinician uno a dos días después del procedimiento o al día siguiente si el riesgo trombótico es alto.- En pacientes con antagonistas de la vitamina K (AVK), se sugiere comprobar el International Normalized Ratio (INR) previo procedimiento una semana antes, o en su defecto previo procedimiento con un coagulómetro tipo Coagucheck®. Para procedimientos de bajo riesgo de hemorragia, mantener INR dentro del rango terapéutico, y por procedimientos de alto riesgo, obtener un INR <1,5 o considerar terapia puente.- Los antagonistas de la vitamina K, en procedimientos de alto riesgo hemorrágico y bajo riesgo trombótico, se retiran tres días antes el acenocumarol o cinco días en el caso de la warfarina. Posteriormente, se reinicia el acenocumarol y la warfarina al día siguiente de la prueba a la dosis habitual.- En pacientes en tratamiento con antagonistas de la vitamina K y alto riesgo trombótico hay que valorar la terapia puente con heparina. Se puede administrar la heparina de bajo peso molecular (HBPM) profiláctica a las seis horas después del procedimiento. Si no existe contraindicación, a las 24 horas se puede reiniciar de forma simultánea con la heparina, tanto la warfarina como el acenocumarol a la dosis habitual.- En pacientes en tratamiento con anticoagulantes orales de acción directa (ACOD) y procedimientos de bajo riesgo hemorrágico se recomienda no suspender el ACOD.- Se recomienda suspender los ACOD dos días antes en procedimientos de alto riesgo hemorrágico, si filtrado glomerular (FG) >30 mL/min en el caso de los fármacos anti-Xa y si FG> 80 mL/min en el caso de dabigatran. Si dabigatran con FG 30-50mL/min suspender cuatro días antes. En el resto de los casos, solicitar pauta a la unidad de Hemostasia para valorar el momento idóneo de suspensión y el reinicio.- Los ACOD, en procedimientos de alto riesgo hemorrágico y pacientes con insuficiencia renal, se debe consultar con Hemostasia.- Se recomienda reiniciar el ACOD dos o tres días después de un procedimiento de alto riesgo hemorrágico. Se podría posponer el reinicio hasta los siete días en caso de disección submucosa endoscópica o colangiografía retrógrada endoscópica terapéutica, según el riesgo trombótico y hemorrágico y valorando terapia puente con heparina. |
El riesgo de hemorragia varía según el tipo de procedimiento endoscópico que se realice, sea o no con terapéutica. Además, puede requerir de una intervención habitualmente endoscópica para aplicar hemostasia en caso de complicación. Se considera que un procedimiento tiene riesgo alto de hemorragia cuando la probabilidad de sangrado clínicamente significativo es ≥1%5 (tabla 1).
Estratificación del riesgo hemorrágico e intervención en caso de complicación según procedimiento endoscópico
| Procedimientos Alto riesgo | Procedimientos Bajo riesgo |
|---|---|
| • Polipectomía*• CPRE+esfinterotomía• Resección mucosa endoscópica o Disección submucosa endoscópica• Papilotomía endoscópica• Dilatación de estenosis• Terapéutica de várices (ligadura)• Gastrostomía percutánea endoscópica• Ecoendoscopia con punción ni terapéutica intervencionista• Ablación por radiofrecuencia esófago o gástrica | • Procedimientos diagnósticos±biopsia• Colocación de prótesis biliares o pancreáticas• Enteroscopia asistida diagnóstica• Colocación de prótesis de esófago, enteral o colon• Ecoendoscopia sin punción o terapéutica• Terapia con argón plasma coagulación |
Se distinguen dos tipos de hemorragia relacionadas con el procedimiento endoscópico: 1) la hemorragia inmediata o intraprocedimiento, que puede requerir o no de terapia endoscópica y la mayoría es autolimitada, no interfiere con el procedimiento y se resuelve sin intervención cuando finaliza el procedimiento. Este tipo de hemorragia solo se considera un evento adverso cuando altera el procedimiento (se controla la hemorragia pero necesita de un procedimiento adicional para realizar la terapéutica inicial) o le obliga a finalizar (necesidad de transfusión de hemoderivados, la admisión hospitalaria o a un área de vigilancia intensiva o precisa de una cirugía de urgencia o angiografía); y 2) la hemorragia diferida clínicamente significativa, se define como el sangrado que se produce en forma de hematemesis, melena y/o hematoquecia, acompañada de una caída de hemoglobina ≥2g/dL. Este tipo de hemorragia causa una prolongación de la hospitalización, una readmisión hospitalaria, la transfusión de hemoderivados o de una nueva endoscopia (incluso una cirugía o angiografía) para controlar el sangrado y que ocurre en las 24 horas posteriores al procedimiento y hasta un máximo de 30 días después6,7.
Por otra parte, el riesgo de trombosis se asocia a la suspensión temporal del tratamiento antiagregante (tabla 2) o anticoagulante (tabla 3) durante el periodo en que se realiza el procedimiento endoscópico. En estas situaciones debemos considerar la preferencia del paciente y la decisión conjunta con el médico responsable del tratamiento cardiovascular, quien evaluará el riesgo tromboembólico individual del paciente. Las consecuencias de un evento trombótico y las posibles secuelas son más graves que las de una hemorragia. Por ello, de cara al paciente es preferible asumir un cierto riesgo de hemorragia digestiva frente a un evento trombótico, debido a una retirada inadecuada del fármaco8.
Estratificación del riesgo de trombosis por la suspensión de clopidogrel, prasugrel o ticagrelor
| Alto riesgo de trombosis | Bajo riesgo de trombosis |
|---|---|
| • Stents coronarios fármacoactivos durante los primeros 12 meses después de la colocación• Stents coronarios metálicos durante el primer mes después de la colocación | • Cardiopatía isquémica sin stent coronario• Enfermedad cerebrovascular• Enfermedad vascular periférica |
Estratificación del riesgo de trombosis por la suspensión anticoagulantes orales (antagonistas vitamina K)
| Alto riesgo de trombosis | Bajo riesgo de trombosis |
|---|---|
| • Válvula protésica metálica mitral o aórtica• Válvula cardiaca protésica con fibrilación auricular• Fibrilación auricular y estenosis mitral• Fibrilación auricular y CHA2DS2-VASc ≥5 puntos• Fibrilación auricular con AIT/ictus+3 o más de los factores: ICC, HTA> 75a, DM.• Los 3 primeros meses después de un TVP/TEP o fibrilación auricular y AIT/ictus• Tromboembolismo venoso previo con objetivo INR>3,5• Síndromes trombofílicos (consultar hematología) | • Válvula cardiaca biológica• Fibrilación auricular sin factores de alto riesgo (CHA2DS2-VASc <5 puntos)• Más de 3 meses después de una TVP/TEP |
AIT: accidente isquémico transitorio; DM: diabetes mellitus; ICC: insuficiencia cardiaca congestiva; HTA: hipertensión arterial; TVP: tromboembolismo venoso periférico; TEP: tromboembolismo pulmonar.
En pacientes con fibrilación auricular se recomienda iniciar terapia anticoagulante para prevenir complicaciones tromboembólicas como el ictus, la embolia sistémica y la mortalidad. La escala CHA2DS2-VASc permite evaluar el riesgo tromboembólico y determinar la indicación de tratamiento anticoagulante en hombres con una puntuación ≥ 2 puntos y en mujeres con una puntuación ≥ 3 puntos. Esta escala, que valora varios factores cardiovasculares, incrementa el riesgo de ictus a mayor puntuación9 (Anexo. Material suplementario).
Además, una puntuación igual o superior a 5 puntos se considera de alto riesgo trombótico y, por ello, se recomienda realizar una terapia puente con heparina antes de suspender el anticoagulante10.
Un estudio multicéntrico español, observacional y prospectivo, demostró que el riesgo de sangrado relacionado con un procedimiento endoscópico electivo fue similar tanto para los antagonistas de la vitamina K como por los ACOD (6,2 vs. 6,7%), así como el riesgo de eventos tromboembólicos (1,3 vs. 1,5%, respectivamente), con una mortalidad global del 1,4% asociada fundamentalmente a eventos tromboembólicos11.
Fármacos antiagregantesLas plaquetas desempeñan un papel esencial en la hemostasia tras una lesión vascular, pero también son protagonistas en los procesos trombóticos.
Los agentes antiplaquetarios se agrupan en cinco clases principales:
- 1.
Ácido acetilsalicílico (AAS)
- 2.
Antagonistas de P2Y12
- 3.
Inhibidores de la recaudación de adenosina/ inhibidores de la fosfodiesterasa
- 4.
Antagonistas de αIIbβ3
- 5.
Antagonistas del receptor activado por proteasa 1 (PAR1)
El AAS actúa bloqueando el metabolismo del ácido araquidónico, precursor de varias moléculas biológicamente activas, incluyendo la prostaglandina PGE2, la prostaciclina (PGI2) y TxA2, que regulan la activación plaquetaria12. Muchas de las guías internacionales de diversas sociedades de cardiología recomiendan la AAS como prevención secundaria en pacientes con alto riesgo cardiovascular13.
Antagonistas de P2Y12En la práctica clínica habitual se emplean principalmente: (1) las tienopiridinas (ticlopidina, clopidogrel y prasugrel); y (2) los derivados nucleósido-nucleótido (ticagrelor y cangrelor).
Los antagonistas P2Y12 han demostrado eficacia en la prevención de la trombosis arterial en contexto de enfermedad coronaria, ictus y enfermedad arterial periférica14. Ticagrelor y prasugrel tienen mayor efecto en la reducción de eventos aterotrombóticos en comparación a clopidogrel, aunque conllevan un mayor riesgo de hemorragia15.
Inhibidores de la recaptación de fosfodiesterasaEl cilostazol es un derivado de la oxiquinolona que inhibe la PDE3 y posee propiedades antiagregantes plaquetarias y vasodilatadoras16.
El dipiridamol inhibe la captación de adenosina por las células rojas, ejerce una actividad antiplaquetaria estimulando la unión de la denilciclasa a los receptores A2a y A2b.
Antagonistas αIIbβ3Los fármacos antagonistas del receptor integrina αIIbβ3 (abciximab, integrilin y tirofiban) se usan en pacientes con alto riesgo como la angina inestable y el infarto sin elevación de ST que requieren una intervención coronaria percutánea. No obstante, debido al alto riesgo de sangrado y de trombocitopenia asociada, actualmente se reservan en casos específicos en pacientes seleccionados con flujo coronario reducido17.
Antagonistas PAR-1En la actualidad solo se dispone de la aprobación comercial del fármaco Vorapaxar®.
Fármacos anticoagulantesDesde la década de 1940, los fármacos antivitamina K (AVK) se emplean en la prevención y el tratamiento de eventos tromboembólicos. Se caracterizan por un estrecho margen terapéutico y una gran variabilidad inter e intraindividual secundaria a factores genéticos y ambientales18.
Los ACOD surgieron para superar las limitaciones de los AVK. Su efecto se basa en la inhibición de un solo factor de la coagulación por lo que la farmacocinética y farmacodinámica son más predecibles. Esto permite que la dosis administrada sea fija y que, en general, no requieran monitorización.
Fármacos antivitamina KLos AVK ejercen su actividad anticoagulante a través de la inhibición de la subunidad 1 del complejo vitamina K 2,3-epóxido reductasa (VKORC1) a nivel del hepatocito19.
Los principales AVK utilizados son derivados de la 4-hidroxicumarina (warfarina, acenocumarol, fenprocumón) y de la indandiona (fluindiona, anisindiona, entre otros).
FarmacocinéticaLa semivida de los AVK varía considerablemente: acenocumarol (∼8h), warfarina (∼40h), fenprocumón (>60h) y fluindiona (∼31h). Independientemente de la semivida, el tiempo que un AVK necesita para llegar al umbral de anticoagulación está relacionado con la semivida de la hipo-
-carboxilación del factor vitamina K dependiente, que es de 60 horas para la protrombina. Por este motivo, no se llega al rango de anticoagulación deseado hasta los cinco a seis días después del inicio del fármaco18,20.MonitorizaciónLos reactivos para medir el efecto anticoagulante de los AVK presentan variabilidad en sensibilidad, por lo que se introdujo el INR para estandarizar los resultados. Se obtiene de la siguiente fórmula:
TP: tiempo de protrombina; s: segundos; ISI: International Sensitivity Index.
El INR es una ratio que compara el TP del paciente vs. la media del TP de un grupo de al menos 20 individuos sanos, todo elevado al ISI. El ISI es específico de cada reactivo, de cada lote y de cada instrumento.
Anticoagulantes orales directosActualmente hay cuatro ACOD disponibles, agrupados en dos mecanismos de acción distintos21:
Inhibidor directo de la trombina- •
Dabigatran (Pradaxa®): profármaco que necesita una activación para convertirse en fármaco activo. Tiene una vida media corta (siete a 11 horas) pero que en caso de insuficiencia renal se ve prolongada.
- •
Rivaroxaban (Xarelto®): también posee una vida media corta y su excreción es por vía renal.
- •
Apixaban (Eliquis®): como el resto de ACOD, tiene una vida media corta, pero en este caso, la excreción renal es menor.
- •
Edoxaban: también de vida media corta eliminándose el 50% por vía renal.
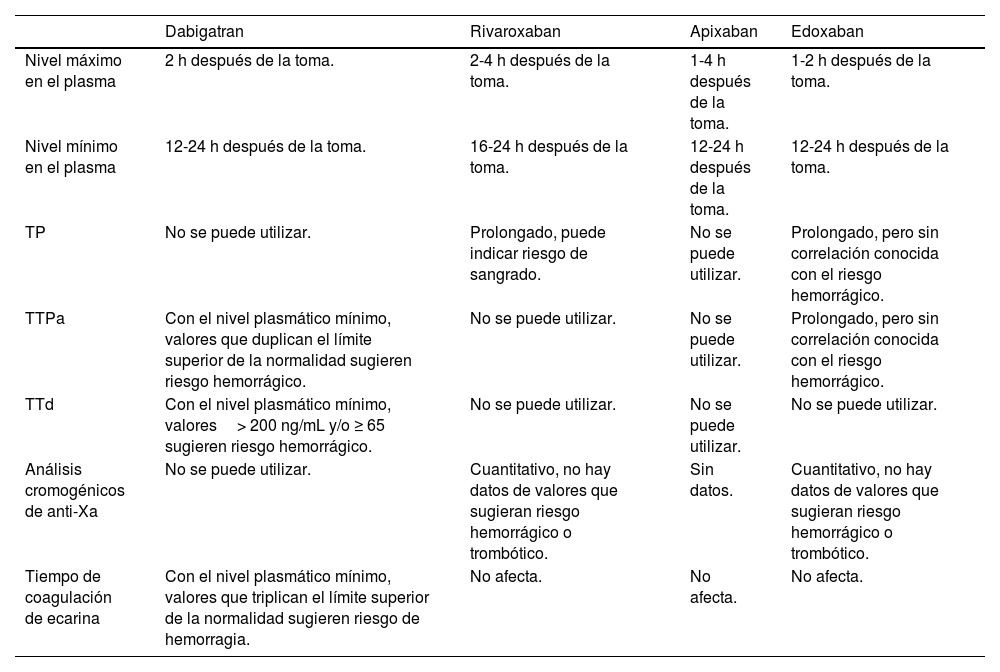
Se disponen de los siguientes tests (tabla 4 resumen):
- 1.
Hemostasia básica: TP y tiempo de cefalina o TTPa
Resumen de la interpretación de las pruebas de laboratorio en pacientes tratados con anticoagulantes orales de acción directa
| Dabigatran | Rivaroxaban | Apixaban | Edoxaban | |
|---|---|---|---|---|
| Nivel máximo en el plasma | 2 h después de la toma. | 2-4 h después de la toma. | 1-4 h después de la toma. | 1-2 h después de la toma. |
| Nivel mínimo en el plasma | 12-24 h después de la toma. | 16-24 h después de la toma. | 12-24 h después de la toma. | 12-24 h después de la toma. |
| TP | No se puede utilizar. | Prolongado, puede indicar riesgo de sangrado. | No se puede utilizar. | Prolongado, pero sin correlación conocida con el riesgo hemorrágico. |
| TTPa | Con el nivel plasmático mínimo, valores que duplican el límite superior de la normalidad sugieren riesgo hemorrágico. | No se puede utilizar. | No se puede utilizar. | Prolongado, pero sin correlación conocida con el riesgo hemorrágico. |
| TTd | Con el nivel plasmático mínimo, valores> 200 ng/mL y/o ≥ 65 sugieren riesgo hemorrágico. | No se puede utilizar. | No se puede utilizar. | No se puede utilizar. |
| Análisis cromogénicos de anti-Xa | No se puede utilizar. | Cuantitativo, no hay datos de valores que sugieran riesgo hemorrágico o trombótico. | Sin datos. | Cuantitativo, no hay datos de valores que sugieran riesgo hemorrágico o trombótico. |
| Tiempo de coagulación de ecarina | Con el nivel plasmático mínimo, valores que triplican el límite superior de la normalidad sugieren riesgo de hemorragia. | No afecta. | No afecta. | No afecta. |
TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activada; TTd: tiempo de trombina diluido.
Adaptado de 30–32.
El TP y el TTPa son dos ensayos coagulométricos que sirven para evaluar la vía extrínseca y la vía intrínseca de la coagulación respectivamente. Estos tests no son lo suficientemente sensibles para establecer una correlación entre la dosis del fármaco y su efecto22,23.
- 2.
Tiempo de trombina (TT)
El TT es un ensayo coagulométrico funcional para la determinación indirecta de la concentración de fibrinógeno y la formación de fibrina. Se ha desarrollado un test modificado: el tiempo de trombina diluido (TTd) o Hemoclot® por los inhibidores directos de la trombina. Este test es insensible para los inhibidores directos Xa23,24.
- 3.
Actividad anti-Xa
Existen múltiples kits comerciales para la determinación de la actividad anti-Xa de las HBPM. Su aplicación para los ACOD ha requerido una validación adicional. Se ha observado que rivaroxaban y apixaban presentan una correlación lineal entre la actividad anti-Xa y el rango esperado en su uso terapéutico. Sin embargo, actualmente se dispone de kits comerciales específicos para los ACOD. Existen tests que podrían utilizarse para medir la concentración de dabigatran en plasma, aunque hay pocos laboratorios que lo realicen22,24.
- 4.
Tiempo de ecarina
Esta prueba se ha utilizado en estudios preclínicos, pero aún no se ha estandarizado23,25.
- 5.
Test de generación de trombina
Se necesitan más estudios para establecer si los tests de generación de trombina permiten obtener resultados reproducibles26,27.
- 6.
Tromboelastografía
Aunque se ha visto una buena correlación entre la prolongación del tiempo de coagulación a concentraciones crecientes de los anticoagulantes habituales, no disponemos de datos con los ACOD.
- 7.
HepTest
No es una prueba específica para la determinación de la actividad anti-Xa, ya que se puede alterar por la presencia de inhibidores de la trombina.
- 8.
Tiempo de coagulación inducido por protrombinasa (PiCT)
De momento, no se trata de un test estandarizado para la monitorización del efecto de los ACOD28,29.
Procedimentos endoscópicosEndoscopia con o sin biopsia, cápsula endoscópica y enteroscopia asistidaEndoscopia diagnóstica con o sin biopsiaEl riesgo de hemorragia para una biopsia endoscópica es muy raro, aproximadamente el 1‰, siendo habitualmente de tipo inmediato y controlable endoscópicamente33.
En un estudio aleatorizado se analizó la seguridad de las biopsias en pacientes tratados con doble antiagregación (AAS y clopidogrel), en lo que no se detectó sangrado significativo en ninguno de los dos fármacos tanto por biopsias de antro como duodenales34.
Tampoco incrementa el riesgo de hemorragia hacer biopsias en pacientes con antiagregantes o anticoagulantes, incluyendo los ACOD. Como se demuestra en un estudio observacional multicéntrico japonés, el riesgo de sangrado después de tomar biopsias gastroduodenales a los 30 días de seguimiento fue nulo tanto para el grupo de pacientes con terapia trombótica sin retirada como en el grupo control. Aunque la mayoría de los pacientes con terapia trombótica tomaban antiagregantes y solamente 19 de los 277 pacientes tomaban ACOD35.
En cambio, en un estudio de cohortes prospectivo italiano, observó un riesgo de hemorragia intraprocedimiento clínicamente relevante pero estadísticamente no significativo, en aquellos pacientes a los que no se les había retirado el ACOD respecto a aquellos a quienes se les había suspendido la mañana del procedimiento, del 5,2% respecto al 1,7% (p=0,23)36.
Por este último motivo, la guía ESGE recomienda la retirada prudencial del ACOD la mañana del procedimiento3. Sin embargo, el sangrado derivado de una biopsia ocurre durante el procedimiento y no impacta en la hemorragia diferida. Por lo tanto, no sería necesario omitir el ACOD, ya que se puede controlar durante la endoscopia.
Cápsula endoscópicaLa cápsula endoscópica es una exploración no invasiva que permite la visualización de todo el intestino delgado. La principal complicación es el riesgo de retención intestinal, siendo alrededor del 2,5% en pacientes con enfermedad de Crohn establecida37.
Por la propia condición como exploración diagnóstica, se considera un procedimiento de bajo riesgo de hemorragia.
Como hecho relevante, el uso de antitrombóticos, tanto antiagregantes como anticoagulantes, se asocia a una mayor prevalencia de hallazgos en la cápsula endoscópica en la hemorragia digestiva de intestino delgado y en el riesgo de resangrado38.
Enteroscopia asistidaEl riesgo de hemorragia para la realización de una enteroscopia es del 0,2-0,3%39. El riesgo de perforación secundario a una enteroscopia de doble balón es del 0,1-0,4%. Este riesgo aumenta a 1,5% si se realiza polipectomía40. Y la dilatación de estenosis del intestino delgado en la enfermedad de Crohn conlleva un riesgo de complicaciones del 5,3% (incluyendo sangrado, perforación y cirugía)41.
En un estudio retrospectivo con 420 pacientes que se realizaban una enteroscopia de doble balón el 13% recibían anticoagulación. La proporción de procedimientos diagnósticos fue del 73% y terapéutica del 35% de los casos. Solo el tiempo de procedimiento y la edad avanzada fueron predictores en el rendimiento diagnóstico42.
Aunque se considera una técnica de bajo riesgo hemorrágico, en la práctica más de la mitad de las exploraciones requerirán terapéutica41. Por este motivo, se confiere un alto riesgo hemorrágico en pacientes con antitrombóticos.
| RECOMENDACIÓN 3 |
|---|
| La enteroscopia diagnóstica se considera un procedimiento de bajo riesgo hemorrágico. En la práctica, más de la mitad de las exploraciones requerirán terapéutica, por lo que es preferible considerarla de entrada como de alto riesgo. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 80%. |
Se considera la polipectomía como un procedimiento endoscópico de alto riesgo de hemorragia (riesgo de hemorragia mayor a los 30 días ≥ 2%) cuando el tamaño del pólipo es ≥ 10mm. No obstante, en los diferentes estudios sobre polipectomía endoscópica, el riesgo de sangrado es variable y se sitúa entre el 0,07 y 3%. Esto se debe a diferencias en las definiciones según el tipo de hemorragia postpolipectomía (HPP) (precoz vs. diferida) o la gravedad (hemorragia menor o mayor) entre los diferentes artículos.
El tamaño del pólipo es el factor asociado más importante para la HPP, con una OR de 2,3. Así, en un estudio realizado con pólipos pediculados, el riesgo de HPP (inmediata o diferida) para 98 pólipos con un tamaño entre 10 y 19mm fue del 3,1%, mientras que la HPP fue del 15,1% en 66 pólipos ≥ 20mm (por cada 1mm que incrementaba el diámetro del pólipo, el riesgo de hemorragia aumentaba un 9%). Se han descrito otros factores como son la edad ≥ 65 años, la enfermedad cardiovascular o renal asociada, la morfología macroscópica de los pólipos (pólipo pediculado o pólipo plano de extensión lateral), la preparación inadecuada del colon, el modo de corte de la corriente electroquirúrgica y el corte o resección involuntaria del pólipo antes de la aplicación de corriente43–45.
- 1.
Polipectomía en pacientes en tratamiento con antiagregantes y/o antiinflamatorios no esteroideos (AINE)
Estudios observacionales en pacientes que se realizan una polipectomía y reciben tratamiento con AAS han demostrado que el uso de antiagregantes y/o de AINE no aumenta el riesgo de HPP46–48.
- 2.
Polipectomía en pacientes en tratamiento con clopidogrel
En un estudio aleatorizado a recibir clopidogrel de forma continua respecto a su retirada siete días antes en pacientes que se realizaba una polipectomía de colon de pólipos <10mm no se observaron diferencias en HPP tanto inmediata como diferida (grupo clopidogrel respecto a control: 3,8 vs. 3,6%), ni tampoco en el número de eventos cardiotrombóticos. No obstante, la gran mayoría se encontraba con tratamiento dual con AAS y el porcentaje de sangrado en el grupo control fue superior si se compara con otros estudios donde el grupo control no reciben tratamiento antiagregante49.
Un metaanálisis con cinco estudios (dos aleatorizados controlados y tres de casos y controles) analizó la incidencia de HPP inmediata y diferida. Se incluyeron 655 pacientes en el grupo de clopidogrel continuado y 6.620 pacientes en el grupo control. El riesgo de HPP precoz no fue significativo (RR 1,57; IC 95%: 0,98-2,51), en cambio, el riesgo de HPP diferida fue significativo en el grupo de continuación de clopidogrel (RR 3,10; IC 95%: 1,60-5,98). No se encontraron diferencias significativas en el número de eventos cardiotrombóticos graves a los 30 días posteriores al procedimiento. Otros factores relacionados con el riesgo de sangrado postpolipectomía como el tamaño del pólipo, la localización, el número de pólipos extirpados, la técnica de polipectomía o la experiencia del endoscopista, no fueron evaluados en este estudio50.
En un estudio multicéntrico aleatorizado que evaluaba la polipectomía con asa fría de pólipos <10mm no se observó un mayor riesgo de sangrado diferido. Se incluyeron 276 pólipos en 107 pacientes aleatorizados a dos grupos: un grupo que suspendió el clopidogrel siete días y lo reinició dos días después de la colonoscopia, pero administrando AAS, y un grupo de intervención en el que se mantenía el clopidogrel o la terapia dual. La principal limitación es que no se consiguió el tamaño muestral por una baja participación de los centros por lo que se tuvo que detener el estudio. Los resultados concluyen que parece seguro la polipectomía con asa fría en pólipos <10mm cuando se continúa clopidogrel, aunque aumenta el riesgo de hemorragia intraprocedimiento, lo que requiere un mayor uso en el número de clips para controlarlo, pero al mismo tiempo evita la hemorragia diferida51.
Por los datos anteriores, se sugiere que la polipectomía con asa fría en pólipos de tamaño <10mm en pacientes en tratamiento con clopidogrel en monoterapia parece una técnica segura.
Es importante recordar que la evaluación periendoscópica de la retirada o no de clopidogrel debe ser basada según el riesgo-beneficio. Aquellos pacientes con una intervención percutánea coronaria reciente, la colocación de stents coronarios o un síndrome coronario agudo es preferible diferir la realización de una colonoscopia.
Como alternativa, y de acuerdo con el médico especialista que pauta el antitrombótico, se podría sustituir temporalmente el clopidogrel por AAS cinco días antes de la colonoscopia.
- 3.
Polipectomía en pacientes en tratamiento anticoagulante
Diversos estudios han examinado los riesgos de la resección de pólipos pequeños en pacientes con tratamiento anticoagulante sin interrupción. Estos pacientes pueden realizarse una colonoscopia de manera segura, pero las guías actuales consideran que la polipectomía es un procedimiento de alto riesgo y, por ello, se recomienda suspender temporalmente la anticoagulación. Esto se debe a que es difícil evaluar exactamente el riesgo de sangrado, ya que depende de varios aspectos, especialmente del tamaño del pólipo y de los valores del INR.
En un estudio retrospectivo con 225 polipectomías de pólipos <10mm, con asa caliente o fría y posterior colocación de clips en todos ellos, 123 pacientes en tratamiento continuo con warfarina mostró un riesgo de hemorragia mayor diferida del 0,8% (un paciente que requirió de transfusión sanguínea) y un riesgo de hemorragia menor del 1,6% (dos pacientes que no requirieron asistencia médica)52.
Otro estudio retrospectivo con 1.177 polipectomías de pólipos <10mm con asa fría, comparó la HPP en pacientes con tratamiento antitrombótico (antiagregantes, anticoagulantes y terapia múltiple) y pacientes sin tratamiento. Se observó un riesgo de hemorragia inmediata global del 5,4%, siendo más significativo en pacientes con warfarina, pero no se encontraron diferencias significativas en el riesgo de hemorragia diferida (0% en ambos grupos)53.
En un ensayo clínico aleatorizado con 159 pólipos en 70 pacientes, en el que se comparó la polipectomía con asa fría respecto a asa caliente de pólipos menores a 10mm sin interrupción de la warfarina, confirmó que la incidencia de HPP tras la resección con asa fría era baja. Se observó una menor incidencia de hemorragia inmediata (5,7 vs. 23,0%) y diferida (0 vs. 14%) en comparación con la polipectomía convencional, respectivamente54.
Finalmente, otro estudio multicéntrico aleatorizado comparó la polipectomía con asa fría respecto asa caliente en pólipos <10mm en pacientes que tomaban ACOD o warfarina sin interrupción (grupo asa fría) respecto a pacientes anticoagulados que recibieron una terapia puente con HBPM (grupo asa caliente). La incidencia de HPP mayor fue del 4,7% en el grupo de asa fría sin interrupción del anticoagulante, y del 12,0% en el grupo asa caliente y terapia puente. Sin embargo, es importante tener en cuenta que, en este estudio, la mayoría de los pacientes no habrían sido considerados para terapia puente con HBPM según las directrices actuales de las diferentes sociedades científicas55.
En cuanto a los ACOD, no hay tantos datos, pero un estudio retrospectivo comparó el riesgo de hemorragia postpolipectomía y riesgo tromboembólico en 218 pacientes que recibían anticoagulantes orales (73 ACOD y 145 warfarina), respecto a un grupo control, ajustado a sexo y edad, en 218 pacientes que no recibían terapia anticoagulante. El riesgo de HPP fue similar entre los ACOD y warfarina y significativamente mayor para ambos en comparación con el grupo control (13,7 vs. 0,9%). Además, el riesgo tromboembólico solo se observó en dos pacientes con warfarina (en uno se suspendió el anticoagulante y el otro recibió terapia puente con HBPM)56. En un estudio retrospectivo de registro japonés con 16.977 individuos que comparaba el riesgo de HPP en pacientes que se realizaban un procedimiento endoscópico de alto riesgo encontraron que los ACOD respecto warfarina se asociaron a un menor riesgo de HPP (9,9 vs. 12,0%, respectivamente), sin diferencias significativas en el riesgo de tromboembolismo o de muerte (4,7 vs. 5,4%)57. En un estudio de cohortes retrospectivo realizado en Hong Kong, se observó que, entre los ACOD, el apixaban se asociaba a un riesgo significativamente menor de HPP (HR ajustado 0,39; IC 95%: 0,24-0,63) y de tromboembolismo que la warfarina. En cambio, tanto dabigatran como rivaroxaban se asociaban a un riesgo más alto de HPP (HR ajustado 2,23 y 2,72, respectivamente) y tromboembolismo en comparación con apixaban58.
| RECOMENDACIÓN 4 |
|---|
| La polipectomía se considera un procedimiento de alto riesgo hemorrágico. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 se recomienda consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente, si alto riesgo trombótico.Excepcionalmente, la polipectomía con asa fría de pólipos de colon <10mm se considera una técnica segura con clopidogrel sin interrupción, pero no es aconsejable con los ACOD.Acuerdo 80%. |
En la resección mucosa endoscópica (RME) de lesiones colorrectales, la hemorragia inmediata es del 3-11% y la hemorragia diferida del 6%59.
Se han descrito varios factores que aumentan el riesgo de hemorragia como son la localización proximal del colon, lesiones de gran tamaño, elevada comorbilidad del paciente y el uso de antitrombóticos60. Existe un modelo de predicción del grupo de Resección Española, el GSEED-RE2, que incluye estas cuatro variables y permite identificar a aquellos pacientes con elevado riesgo de sangrado clínicamente significativos después de una RME61.
Tanto el uso de antiagregantes62 como de anticoagulantes y ACOD63 aumentan el riesgo de hemorragia diferida después de una RME. Además, el uso de clips profilácticos para cerrar el defecto mucoso después de una RME puede ser coste-efectivo en pacientes con antitrombóticos64.
La resección de lesiones en el duodeno implica un mayor riesgo de complicaciones, tanto de hemorragia diferida (20%) como de perforación (13-50%). Por este motivo, se han descrito otras técnicas más seguras e igual de eficaces como son la resección mucosa con técnica Underwater o la polipectomía con asa fría65.
Por consiguiente, la RME se considera como un procedimiento de alto riesgo de hemorragia, sobre todo en pacientes con antitrombóticos, que incrementan este riesgo.
| RECOMENDACIÓN 5 |
|---|
| La resección mucosa endoscópica se considera un procedimiento de alto riesgo hemorrágico. Se recomienda usar un modelo de predicción de riesgo de hemorragia (GSEED-RE2) con el fin de aplicar técnicas de hemostasia a la escara y disminuir el riesgo. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 92%. |
Dos metaanálisis y varios estudios retrospectivos compararon la continuación con la interrupción de la AAS a dosis bajas y no encontraron diferencias significativas en la hemorragia diferida tras una disección submucosa endoscópica (DSE) gástrica66–74. Esto también se observó en el grupo de pacientes con terapia doble antiagregante, donde se continuó solo con la AAS67. Además, la interrupción inadecuada de los agentes antiagregantes se asoció significativamente con un aumento del riesgo de trombosis.
La continuación de la terapia con tienopiridina (clopidogrel o prasugrel) o AAS no aumentó la hemorragia diferida en la DSE gástrica en un estudio retrospectivo71. Sin embargo, un estudio comparativo retrospectivo no aleatorizado encontró que la continuación de cualquier antitrombótico o la transición a la heparina aumentaba el riesgo de sangrado en la DSE gástrica72.
El riesgo de sangrado después de la DSE gástrica aumenta con el número de agentes antiagregantes tomados o cuando los medicamentos antiagregantes se combinan con los anticoagulantes74. Para la DSE de colon, excepto para la AAS sola, los agentes antiagregantes fueron factores de riesgo independientes de hemorragia diferida en un estudio retrospectivo75.
En una gran base de datos nacional que incluía 16.977 pacientes con procedimientos endoscópicos de alto riesgo con anticoagulación oral, se encontró que la DSE del tracto digestivo superior e inferior se asociaba significativamente con el sangrado post-DSE. El riesgo de hemorragia diferida después de una DSE en cualquier lugar fue del 16% en pacientes que tomaban warfarina o ACOD, incluidos aquellos que hacían la terapia puente con heparina57.
En un estudio retrospectivo multicéntrico japonés más reciente, que analizaba 34.455 casos de DSE en lesiones colorrectales (3% recibían ACOD y 1,3% warfarina) se observaron diferencias en cuanto al riesgo de sangrado según el tipo de ACOD y respecto warfarina. Dabigatran (18,3%) se asociaba a un mayor riesgo de hemorragia diferida respecto apixaban (10,08%), edoxaban (7,73%) y rivaroxaban (7,2%). Incluso rivaroxaban fue inferior a warfarina (11,8%). En el análisis multivariado, la terapia puente con HBPM, la localización en recto y un tiempo de procedimiento de> 55 minutos fueron factores de riesgo de hemorragia diferida en el grupo ACOD76.
Se han propuesto modelos predictivos de hemorragia post-DSE que podrían ayudar a optimizar previo al procedimiento a aquellos pacientes que se realizan una disección. En el caso de la DSE gástrica, la puntuación BEST-J, que incluye el uso de antitrombóticos, la localización y el tamaño del tumor77. Asimismo, en el caso de una DSE colorrectal, la puntuación de sangrado de Limoges, que incluye cinco variables como la edad, el uso de antitrombóticos, elevada comorbilidad, el tamaño del tumor y la localización78.
La DSE es un procedimiento de alto riesgo de hemorragia y, por este motivo, a los pacientes que tomen antiagregantes o anticoagulantes, es recomendable realizar tratamiento profiláctico, como el cierre de la escara y/o inhibidores de la bomba de protones en la DSE gástrica. Incluso, en el caso de los ACOD, se puede ampliar el intervalo de tres a siete días después del procedimiento ya que un reinicio antes de las 24-48h supone doblar el riesgo de hemorragia, y siempre considerando a pacientes con un riesgo trombótico bajo36,73.
| RECOMENDACIÓN 6 |
|---|
| La disección submucosa endoscópica se considera un procedimiento de alto riesgo hemorrágico. Se recomienda en pacientes con antitrombóticos el tratamiento profiláctico como el cierre de la escara, y en lesiones gástricas el uso de inhibidores de la bomba de protones. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico. En el caso de ACOD, se recomienda retirarlos dos días antes si la función renal es correcta, o consultar con Hemostasia si presenta insuficiencia renal. La reintroducción de los ACOD se puede ampliar el intervalo valorando el riesgo trombótico y hemorrágico del paciente valorando la necesidad o no de terapia puente con heparina.Acuerdo 92%. |
- 1.
Miotomía endoscópica peroral
El uso de terapia antitrombótica en pacientes que se realizan una miotomía endoscópica peroral (POEM) parece ser seguro según los datos recogidos en centros de alto volumen en Japón y otros centros internacionales79,80.
En un estudio de casos y controles retrospectivo internacional, el riesgo de hemorragia clínicamente relevante después de una POEM fue significativamente más alta en pacientes con antitrombóticos respecto a quienes no los recibían (5,6 vs. 0,8%). Los anticoagulantes y el clopidogrel se interrumpieron temporalmente en todos los casos. El AAS se continuó en un 40,5% de los pacientes sin aumentar el riesgo de sangrado80.
| RECOMENDACIÓN 7 |
|---|
| La miotomía endoscópica peroral se considera un procedimiento de alto riesgo hemorrágico. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%. |
- 2.
Resección transmural (Full-thickness)
El sistema de resección transmural con el kit full-thickness resection device (FTRD) utiliza un clip que podría considerarse hemostático, pero no hay estudios que hayan evaluado exclusivamente la seguridad de la resección en pacientes con antitrombóticos. La revisión de series extensas y un metaanálisis demuestra que el riesgo de sangrado por esta técnica es de aproximadamente el 6%81,82. En cualquier caso, se recomienda considerar como un procedimiento de riesgo elevado de hemorragia hasta que se disponga de mayor evidencia.
| RECOMENDACIÓN 8 |
|---|
| La resección transmural endoscópica se considera un procedimiento de alto riesgo hemorrágico. Se recomienda mantener tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%. |
La hemorragia post-colangiopancretografía retrógrada endoscópica (CPRE) se considera elevada (>1%) cuando se realiza esfinterotomía, no así cuando se efectúa esfinteroplastia o colocación de prótesis biliar o pancreática sin esfinterotomía. La hemorragia puede producirse de forma inmediata, la mayor parte de veces autolimitada, o diferida y hacerse evidente en horas o hasta los siete a 10 días después del procedimiento. La incidencia de hemorragia post-CPRE varía entre 0,3 y 9,6%83, y en la mayoría de los casos son leves84, con una mortalidad del 0,04%. En un metaanálisis con 21 estudios prospectivos y 16.855 pacientes, la hemorragia global posterior a una CPRE fue del 1,3%, siendo la mayoría de grado moderado (71%), grave en 66 casos (0,39%), y mortal en 8 (0,04%); la mortalidad relacionada con la hemorragia fue del 3,54% (IC 1,08–6,00)85.
La guía ESGE sobre los eventos adversos relacionados con la CPRE sugiere que los pacientes deben ser considerados de alto riesgo de hemorragia postesfinterotomía si presentan alguno de los siguientes factores: administración de anticoagulantes, plaquetopenia de <50.000, cirrosis hepática, insuficiencia renal crónica en hemodiálisis, sangrado intraprocedimiento, poca experiencia del endoscopista (<200 CPRE) y canulación fallida con requerimiento de precorte. Además, considera que hay medidas que pueden reducir el riesgo de hemorragia en la CPRE, entre ellas evitar la esfinterotomía antes de la colocación de endoprótesis biliares, y el uso de una corriente mixta en lugar de una corriente de corte puro83.
La mayoría de los estudios que han evaluado el uso de antitrombóticos en la CPRE son retrospectivos, de tamaños muestrales pequeños y con un poder estadístico limitado.
- 1.
CPRE en pacientes en tratamiento con antiagregantes
En un estudio del año 2018 analizó retrospectivamente la seguridad de más de 2.400 CPRE en pacientes con o sin antiagregantes86. La proporción de hemorragia fue del 0,8% en los pacientes no antiagregados; el 4,7% antiagregados con AAS; el 6,3% en los que tomaban otro antiagregante (dipiridamol, cilostazol o tienopiridina) y el 8,3% en los que recibían más de uno. El tipo de antiagregante plaquetario, la combinación de más de uno, y el número de días que se interrumpía previo al procedimiento no se asoció a hemorragia post-CPRE. No obstante, este hallazgo puede ser debido al escaso número de pacientes incluidos en los grupos con un único antiagregante y en múltiples.
Un metaanálisis del año 2022 con seis estudios de cohortes analizó el riesgo de hemorragia postesfinterotomía en pacientes antiagregados en monoterapia87. Se observó un incremento modesto en el riesgo de hemorragia postpapilotomía respecto a los pacientes no antiagregados, con una OR=1,53 (IC 95%: 1,03-2,28) sin heterogeneidad entre los estudios (I2=0%). El número necesario para encontrar un evento adverso, es decir, el número de pacientes que deberían recibir monoterapia antiplaquetaria para que un paciente adicional sufra un episodio hemorrágico postesfinterotomía fue de 185. No obstante, todos los estudios incluidos tenían deficiencias metodológicas dado el pequeño tamaño muestral. En cambio, otro metaanálisis del mismo año que incluía seis estudios observacionales mostró que la proporción de hemorragia post-CPRE no era significativamente superior en los pacientes que recibían doble antiagregación respecto a los que recibían AAS en monoterapia (OR 1,14; IC 95%: 0,46–2,81). El riesgo global de sangrado en pacientes con terapia dual fue del 6%88. Aun así, no se pueden descartar sesgos en los resultados y, por lo tanto, el riesgo de hemorragia con la terapia dual necesita una evidencia más robusta.
Por otro lado, hay una falta de evidencia en el uso específico de los antagonistas P2Y12. A la espera de estudios más amplios y con la adecuada potencia para detectar diferencias, parece razonable tomar precauciones con los pacientes en tratamiento antiagregante que se realizan una CPRE con papilotomía, sobre todo aquellos que reciben antagonistas P2Y12 o doble antiagregación.
- 2.
CPRE en pacientes en tratamiento con anticoagulantes
Un estudio restrospectivo multicéntrico japonés comparó el riesgo de hemorragia post-esfinterotomía en 149 pacientes que recibían tratamiento anticoagulante (warfarina o ACOD) tanto de manera continua como con terapia puente con heparina89. La sustitución de heparina fue un factor de riesgo de hemorragia posterior al procedimiento en los pacientes con ACOD. Por otro lado, no hubo diferencias en la proporción de hemorragias en los que tomaban warfarina de manera continua respecto a warfarina y terapia puente. Además, la proporción de hemorragia postesfinterotomía en pacientes con ACOD continuo fue significativamente inferior respecto a los pacientes tratados con warfarina (0 vs. 16,6% respectivamente). Este estudio iría en la línea de lo que recomiendan las guías de suspender los ACOD, sin terapia puente de heparina, en procedimientos endoscópicos de alto riesgo de hemorragia2,3.
Un estudio retrospectivo unicéntrico español evaluó la incidencia de hemorragia post-CPRE en 797 procedimientos realizados a 588 pacientes con antiagregantes y/o anticoagulantes90. La incidencia global de hemorragia fue del 4,6%, siendo moderada en el 60% de los casos. Además, la hemorragia era más frecuente en pacientes con ACOD respecto al acenocumarol y la HBPM (OR 3,63; IC 95%: 1,01-12,8). Esto se explicaría por el mayor riesgo de hemorragia gastrointestinal que tienen los pacientes con ACOD respecto a la anticoagulación convencional91, pero iría en contra de dos evidencias previas que muestran un riesgo mayor con warfarina respecto a los ACOD89,92.
En cuanto a la heparina profiláctica, un estudio retrospectivo de casos y controles evaluó el riesgo de hemorragia post-CPRE con papilotomía a 369 procedimientos: 151 con anticoagulación profiláctica periprocedimiento (HBPM como profilaxis del tromboembolismo venoso) y 218 sin profilaxis previa93. El riesgo de hemorragia global fue del 4,6%. No se encontraron diferencias con el riesgo de hemorragia (3,3 vs. 5,5%, respectivamente) ni en eventos tromboembólicos a los 30 días entre ambos grupos (profilaxis vs. no profilaxis). En consecuencia, y dadas las limitaciones del propio estudio retrospectivo, no sería necesaria la retirada de la anticoagulación profiláctica por el bajo riesgo de sangrado post-CPRE.
Un estudio retrospectivo de 2018 comparó el tiempo de reintroducción de los anticoagulantes tras una papilotomía en términos de riesgo hemorrágico y trombótico a un total de 96 pacientes94. Los pacientes se dividieron en tres grupos según el tiempo de reintroducción del anticoagulante: muy precoz (<24h), precoz (24-48h) y diferido (>48h). No se encontraron diferencias significativas en la proporción de hemorragia diferida, pero sí se observó un incremento significativo en el número de eventos tromboembólicos en el grupo de reintroducción diferida (0, 0 y 24%, respectivamente).
Un estudio observacional prospectivo que incluyó 644 CPRE en pacientes con tratamiento antiagregante o anticoagulante observó una incidencia de seis eventos trombóticos (0,9%) y de 63 eventos hemorrágicos (9,8%) a los 30 días postprocedimiento95. El manejo terapéutico periprocedimiento de la terapia antitrombótica, de acuerdo o no a las recomendaciones, no se asoció a un mayor riesgo de hemorragia o la aparición de un evento trombótico. No obstante, parece prudente seguir las recomendaciones de las guías clínicas ya que sí existe una asociación entre algunas comorbilidades del paciente como la fibrilación auricular, el tromboembolismo pulmonar recurrente y la valvulopatía reumática que aumentan el riesgo de eventos tromboembólicos.
Teniendo en cuenta la escasa evidencia científica en la literatura médica actual, las principales guías clínicas de la ESGE y la ASGE consideran la CPRE con papilotomía como un procedimiento de alto riesgo hemorrágico, mientras que la colocación de prótesis biliares/pancreáticas o la papiloplastia sin papilotomía como procedimientos de bajo riesgo3,96. Así que, y de acuerdo con la guía ESGE específica para CPRE, se recomienda continuar los fármacos antiagregantes o anticoagulantes en procedimientos de bajo riesgo hemorrágico como la colocación de prótesis biliar sin esfinterotomía o la colangioscopia83. En cambio, en procedimientos de alto riesgo hemorrágico se considera seguro mantener la antiagregación con AAS en todos los casos, independientemente del riesgo hemorrágico y del riesgo trombótico; mientras que se recomienda la retirada de los antiagregantes antagonistas del receptor P2Y12 y de los anticoagulantes (AVK y ACOD). Los días de interrupción y la necesidad de una terapia puente están determinados por el riesgo trombótico, según las recomendaciones generales. En el caso de la CPRE el reinicio óptimo del tratamiento antitrombótico dependerá del riesgo de hemorragia postprocedimiento y de trombosis.
No hay datos para la litotricia mecánica biliar, la colangioscopia o la litotricia electrohidráulica en pacientes que toman antiagregantes plaquetarios o anticoagulantes.
| RECOMENDACIÓN 9 |
|---|
| La colangiopancreatografía retrógrada endoscópica con papilotomía se considera un procedimiento de alto riesgo hemorrágico, mientras que la colocación de prótesis biliares o pancreáticas o la papiloplastia sin papilotomía se considera de bajo riesgo. En el caso de bajo riesgo, se recomienda continuar los fármacos antiagregantes o anticoagulantes. En el caso de considerar alto riesgo hemorrágico (papilotomía o papiloplastia con papilotomía) se recomienda mantener tratamiento antiagregante con AAS; consultar con cardiología si alto riesgo trombótico con los antagonistas P2Y12; la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico, y con los ACOD, la retirada dos días antes si la función renal es correcta. El reinicio óptimo del tratamiento antitrombótico dependerá del riesgo de hemorragia postprocedimiento y de trombosis.Acuerdo 92%. |
La papilectomía endoscópica es el tratamiento de elección para lesiones papilares benignas de hasta 20-30mm de diámetro y hasta 20mm de extensión intraductal. Es un procedimiento complejo que requiere una amplia experiencia en técnicas endoscópicas. La proporción de eventos adversos es alta, en torno a un 25%, siendo la hemorragia la más frecuente (10,6%), la mayoría de las veces de grado leve-moderado97. La mayor parte de las hemorragias se pueden tratar de forma conservadora o mediante técnicas endoscópicas (esclerosis, clips o argón plasma coagulación [APC]), y no requieren transfusión sanguínea. Solo en algunos casos puede requerir embolización arterial o cirugía98,99. Un estudio retrospectivo con 173 pacientes identificó el sangrado intraprocedimiento y el tamaño de la lesión (≥3cm) como factores de riesgo de hemorragia diferida y el cierre con clips como factor protector de riesgo de hemorragia100.
A nivel procedimental, no hay una técnica estandarizada. En el año 2021 se publicó un documento de consenso con expertos internacionales con un total de 47 de los 79 ítems a valorar (59%). Se propuso un diagrama de flujo respecto al proceso diagnóstico a través de la biopsia por endoscopia y las pruebas de imágenes; la evaluación de la lesión y estadificación; los aspectos técnicos del procedimiento endoscópico; medidas para evitar eventos adversos y el seguimiento según el grado histológico101.
Un estudio retrospectivo publicado en 2022 evaluó a 370 pacientes que se realizaban una papilectomía endoscópica, con un riesgo de hemorragia diferida del 14,3%. En el análisis multivariante se asoció el uso de anticoagulantes (OR 4,37; IC 95%: 2,86-5,95) y el sangrado intraprocedimiento (OR 2,22; IC 95%: 1,10-4,40) como factores de riesgo independientes de la hemorragia diferida. En el caso de no presentar sangrado intraprocedimiento, los factores asociados a hemorragia fueron el uso de anticoagulantes y el tamaño del tumor ampular. No se observaron diferencias ni mayor riesgo de sangrado en el caso de los fármacos antiagregantes102.
Hasta la fecha, no se han encontrado estudios en la literatura médica diseñados para evaluar específicamente el uso de fármacos antitrombóticos para esta técnica.
Las guías internacionales (ESGE, ASGE) definen la papilectomía endoscópica como un procedimiento de alto riesgo hemorrágico, con la particularidad de que se recomienda suspender incluso la antiagregación con AAS siempre que el riesgo trombótico individualizado del paciente lo permita (grado de evidencia bajo y recomendación débil). La sociedad de endoscopia digestiva japonesa ha publicado recientemente una guía específica para la papilectomía endoscópica, donde recomienda suspender la AAS tres a cinco días y las tienopiridinas cinco a siete días siempre que el riesgo trombótico sea bajo. Pero en caso de un elevado riesgo trombótico, si no se puede posponer la intervención y de acuerdo con el especialista correspondiente, se puede mantener la AAS o cambiar las tienopiridinas por AAS. Además, a diferencia de las guías occidentales, propone omitir el ACOD el mismo día del procedimiento y reiniciarlo al día siguiente del procedimiento3,96,103,104.
| RECOMENDACIÓN 10 |
|---|
| La papilectomía endoscópica se considera un procedimiento de alto riesgo hemorrágico. Se sugiere suspender cinco días antes el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%. |
- 1.
Ecoendoscopia diagnóstica
La ecoendoscopia o ultrasonografía endoscópica (USE) con punción es una técnica mínimamente invasiva que permite la obtención de muestras para el diagnóstico de diferentes entidades. Las masas sólidas pancreáticas constituyen una de las principales indicaciones, siendo la punción con aguja fina (PAAF) y la punción-biopsia equivalentes en cuanto a la efectividad para obtener un diagnóstico anatomopatológico y también en términos de seguridad, ya que se utilizan agujas del mismo calibre (19G, 22G, 25G). Otras situaciones en las que está indicada la técnica son: lesiones quísticas pancreáticas; estenosis biliares (principalmente las distales y extrínsecas); lesiones subepiteliales del tracto gastrointestinal (en especial, si presentan semiología atípica o dudosa y cuando son mayores de 2cm); el engrosamiento mural difuso esofágico, gástrico o rectal; el estadiaje regional o a distancia en algunos casos de cáncer esofágico, gástrico o rectal; o el estudio de masas mediastínicas, abdominales o hepáticas de origen desconocido105,106.
La USE con punción es una técnica segura, con un número de complicaciones generalmente bajo, particularmente de hemorragia (<1%). Un metaanálisis de 2011 con 10.941 pacientes que se realizaron USE-PAAF, mostró un total de 107 eventos adversos (0,98%), de los cuales la mayoría fueron dolor abdominal y pancreatitis, habitualmente de grado leve y moderado. La hemorragia postprocedimiento se registró solo en 14 pacientes (0,12%)107. En otro metaanálisis publicado en 2020 con 5.330 pacientes en la evaluación diagnóstica y terapéutica de la USE con punción-biopsia, se observó una proporción de eventos adversos del 0,59%, la mayoría por hemorragias leves en lesiones sólidas subepiteliales. En el análisis multivariante, la aguja de 22G como predictor independiente se asoció a un menor riesgo de eventos adversos, así como también a una mayor precisión diagnóstica y de éxito técnico108.
En otro metaanálisis con 5.124 pacientes se evaluó específicamente la morbimortalidad de la USE-PAAF en lesiones quísticas pancreáticas. La proporción global de eventos adversos fue del 2,66%, siendo la pancreatitis (0,92%) y la hemorragia (0,69%) como los más frecuentes, y una mortalidad asociada a la prueba del 0,19%109.
Varios estudios han evaluado el uso de los fármacos antitrombóticos en la USE con punción:
- -
Un estudio prospectivo controlado analizó a 214 pacientes que se realizaron una USE con punción (PAAF o biopsia), comparando los eventos de hemorragia entre los que tomaban AAS/AINE, HBPM y los que no tomaban ningún antitrombótico. No se registraron episodios de sangrado en el grupo AAS/AINE, el 3,7% en el grupo control sin tratamiento y el 33,3% de los que recibían HBPM con una diferencia estadísticamente significativa pero clínicamente no relevante110.
- -
En un estudio retrospectivo con 742 pacientes con USE-PAAF se comparó el riesgo de sangrado entre cuatro grupos de pacientes: 1) sin tratamiento antitrombótico, 2) suspensión completa del tratamiento antitrombótico (antiagregantes o anticoagulantes), 3) continuación de la antiagregación con AAS o cilostazol y 4) pacientes que recibieron terapia puente con heparina (previamente con AVK). La proporción de hemorragia fue del 1% (6/611), 0% (0/62), 1,6% (1/61) y 0% (0/8), respectivamente, sin encontrar diferencias estadísticamente significativas. Todos los episodios de hemorragia (riesgo global: 0,9%) se produjeron intraprocedimiento y solo un caso fue grave, requiriendo tratamiento hemostático111.
- -
Un estudio prospectivo multicéntrico japonés analizó 85 pacientes en tratamiento con antitrombóticos y alto riesgo tromboembólico, de 2.629 pacientes con una USE-PAAF durante el periodo de estudio. El AAS se mantuvo en todos los casos, las tienopiridinas se suspendieron cinco días antes y se sustituyeron por AAS, y la warfarina y los ACOD se suspendieron tres y dos días antes, respectivamente, y en ambos casos se administró heparina endovenosa hasta tres horas antes de la intervención. Un total de dos pacientes (2,4%) presentaron un episodio hemorrágico: uno recibía doble antiagregación con AAS+tienopiridina y el otro, anticoagulación con warfarina. Ninguno de los pacientes del estudio sufrió un evento trombótico112.
- -
Un estudio retrospectivo analizó 908 pacientes tributarios de USE-PAAF, de los cuales 114 (12,6%) recibían tratamiento antitrombótico y 794 (87,4%) no lo recibían. Los primeros se dividieron en tres grupos: los que mantenían el tratamiento, habitualmente AAS o cilostazol en monoterapia; los que lo discontinuaban, ya fueran tienopiridinas, warfarina o ACOD (pacientes de bajo riesgo tromboembólico); y los que realizaban una terapia puente con HBPM por ser considerados de alto riesgo tromboembólico. Globalmente se produjo hemorragia significativa en seis pacientes (0,7%): cuatro en los que recibían antitrombóticos (4/114, 3,51%) y dos en los que no lo recibían (2/794, 0,25%), con una diferencia estadísticamente significativa. De los cuatro que tomaban antitrombóticos, dos fueron del grupo mantener el tratamiento, uno del grupo interrupción y uno del grupo de sustitución por heparina, sin encontrar diferencias significativas entre ellos. Todas las hemorragias fueron leves y fueron tratadas de forma conservadora. Un único episodio trombótico (accidente vascular cerebral) se registró en un paciente en el que se había sustituido el clopidogrel por AAS. Así pues, se observó un mayor riesgo de sangrado en los pacientes con antitrombóticos, pero en ningún caso grave independientemente de si se mantenía o no el antitrombótico113.
- -
Un metaanálisis publicado en 2023 incluyó 12 estudios con pacientes realizados una USE con punción en tratamiento antitrombótico, con un riesgo global de hemorragia del 2%, y de hemorragia mayor del 0,8%. El grupo de pacientes con antitrombóticos mostró un mayor riesgo de hemorragia global (OR 2,12; IC 95%: 1,20-3,83) respecto a los pacientes que no recibían tratamiento. Pero no se determinaron diferencias significativas entre los que mantenían y los que interrumpían el fármaco antitrombótico114.
- 2.
Ecoendoscopia terapéutica
La USE terapéutica está tomando un papel cada vez más importante, sobre todo en el acceso y drenaje al sistema biliar y pancreático cuando la CPRE fracasa o cuando la papila es inaccesible (técnica Rendezvous, drenaje transmural o drenaje anterógrado); pero también para la creación de anastomosis endoscópicas como la gastroenteroanastomosis. El riesgo de hemorragia postprocedimiento reportada en el drenaje biliar guiado por USE está en torno al 4%115–117.
Existen pocos estudios que evalúen la seguridad de los fármacos antitrombóticos para dichos procedimientos:
- -
Un estudio retrospectivo con cinco pacientes anticoagulados, la mayoría con heparina, que se realizaron un drenaje transmural urgente de vesícula biliar en contexto de colecistitis aguda, no reportó ningún evento hemorrágico118. Una revisión sistemática sobre el mismo procedimiento observó que en pacientes con drenaje transpapilar el riesgo de hemorragia fue del 0,65%, siendo del 0% cuando no se practicaba esfinterotomía. Y en el caso de drenaje guiado por USE el riesgo de hemorragia fue del 2,1%, la mayoría no fueron graves y no atribuibles al propio uso del antitrombótico119.
- -
Un estudio retrospectivo de casos y controles con 195 pacientes que se realizaron un drenaje biliar guiado por USE (41 en tratamiento antiagregante y/o anticoagulante y 154 en el grupo control) reportó un riesgo de hemorragia global del 3,6%, sin obtener diferencias entre los dos grupos. Tampoco se observaron eventos tromboembólicos en ambos grupos. La toma de antiagregantes/anticoagulantes no constituyó un factor de riesgo de sangrado (OR 2,96, IC 95%: 0,56-14)120. Así pues, la incidencia de sangrado en pacientes que se realizan un drenaje biliar por USE y que reciben antitrombóticos es baja, incluso de forma continua.
Aunque la evidencia en la literatura médica actual es escasa, y en algunos casos contradictoria, el riesgo de hemorragia global reportado con la USE con PAAF o biopsia se sitúa por debajo del 1%. No obstante, todas las guías principales la clasifican como una técnica de alto riesgo hemorrágico3,96,103. Por dicho motivo, parece claro mantener la antiagregación con AAS en todos los casos y suspender a los antiagregantes antagonistas P2Y12, los AVK y los ACOD de acuerdo con las guías generales y en función del riesgo trombótico. Sin embargo, con los datos presentados anteriormente, parecería razonable mantener los fármacos antitrombóticos de forma individualizada en algunos pacientes con un elevado riesgo trombótico, asumiendo un leve aumento del riesgo hemorrágico.
Actualmente, sin embargo, faltan estudios prospectivos adecuadamente diseñados para hacer una recomendación firme al respecto. Por otro lado, la USE diagnóstica sin punción debe considerarse como una prueba de bajo riesgo hemorrágico. Los procedimientos de USE intervencionista-terapéutica también son considerados de alto riesgo hemorrágico y habría que actuar como tal siempre que se pueda. Aun así, los estudios muestran que según el riesgo trombótico del paciente y la urgencia con la que requiera la intervención (p. ej., drenaje biliar urgente) se puede plantear realizarla sin la retirada de los fármacos antitrombóticos, asumiendo un leve incremento del riesgo hemorrágico postprocedimiento sin mayor gravedad.
| RECOMENDACIÓN 11 |
|---|
| La ecoendoscopia diagnóstica sin punción se considera un procedimiento de bajo riesgo hemorrágico. Se recomienda mantener el tratamiento antiagregante, incluso doble antiagregante. Se recomienda continuar el tratamiento anticoagulante.Acuerdo 92%.La ecoendoscopia con punción aguja fina o la punción-biopsia se consideran procedimientos de alto riesgo hemorrágico. Se recomienda mantener el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%.Se podría mantener el tratamiento antiagregante o anticoagulante de forma individualizada en algunos pacientes con elevado riesgo trombótico, asumiendo un leve aumento del riesgo hemorrágico.Acuerdo 80%.La ecoendoscopia intervencionista-terapéutica se considera un procedimiento de alto riesgo hemorrágico. Se recomienda la retirada del tratamiento antiagregante o anticoagulante según el riesgo trombótico del paciente. Excepcionalmente, según el riesgo trombótico y la urgencia de la intervención (p. ej. drenaje biliar urgente), se podrían mantener los fármacos antitrombóticos asumiendo un leve incremento del riesgo hemorrágico.Acuerdo 80%. |
La revisión de estudios que incluían a más de 100 pacientes con estenosis benignas del tracto digestivo superior ya sea por anastomosis, acalasia, postDSE, eosinofílicas, obstrucción a la salida del gástrico o de etiología mixta, revela un riesgo de sangrado muy inferior al 1%121–130. Una revisión sistemática y metaanálisis de estudios sobre la dilatación endoscópica de estenosis gastroduodenales en la enfermedad de Crohn reveló un riesgo del 2,1% de sangrado por procedimiento131. En un estudio prospectivo de dilatación en 55 pacientes con carcinoma de esófago, no se observó sangrado clínicamente relevante132. La dilatación de estenosis benignas del tracto digestivo inferior, ya sean iatrogénicas o relacionadas con enfermedades inflamatorias, no reveló sangrado significativo en estudios prospectivos o series de casos retrospectivas mayores (con más de 100 pacientes)133–137.
Según la evidencia científica, parece que la dilatación neumática de la acalasia no suele asociarse con episodios relevantes de sangrado, pero sí de perforación (3-9%)138.
La dilatación de estenosis del tracto digestivo superior o inferior parece ser un procedimiento de bajo riesgo, con la excepción de las estenosis intestinales en la enfermedad de Crohn y la dilatación para la acalasia. Sin embargo, no hay datos sobre la dilatación de estenosis en pacientes que toman antiagregantes o anticoagulantes.
De acuerdo con la guía europea (ESGE), se considera la dilatación endoscópica como un procedimiento de riesgo alto en pacientes que toman antitrombóticos.
| RECOMENDACIÓN 12 |
|---|
| La dilatación endoscópica se considera un procedimiento de alto riesgo hemorrágico, especialmente en las estenosis gastrointestinales en la enfermedad de Crohn y la dilatación para la acalasia. Se recomienda mantener el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 88%. |
El riesgo de hemorragia después de la colocación de una prótesis endoscópica es controvertido y difícil de evaluar debido a la heterogeneidad de los estudios, el tipo y diseño del stent, de la localización anatómica y de la indicación (benigna vs. maligna). Con la evidencia actual, se considera que la colocación de una prótesis endoscópica (válido para cualquier localización) tiene un riesgo bajo de hemorragia a los siete días siguientes. Según la revisión de la ESGE, el riesgo de hemorragia de un stent metálico autoexpandible (SEMS) varía según su localización: 1) esófago: del 0% a los primeros siete días y la diferida del 8-9%, 2) duodenal: de <1% a los siete días y 3) colon: del 0-0,5% a los siete días3.
Se asume que los pacientes en tratamiento antiagregante o anticoagulante pueden tener un riesgo más elevado de hemorragia diferida, aunque no hay estudios sobre la colocación de prótesis en pacientes en tratamiento antitrombótico.
Gastrostomía percutánea endoscópicaEl riesgo de hemorragia de una gastrostomía percutánea endoscópica (PEG) es del 1-2,5%139,140. La hemorragia minor, aquella relacionada con la zona de punción y la colocación del tubo de gastrostomía, es autolimitada. En cambio, la hemorragia masiva, que puede afectar a la arteria gástrica, la vena esplénica, la vena mesentérica o incluso producir un hematoma de la vaina de los rectos, es rara.
La PEG parece un procedimiento seguro con antiagregantes. En un metaanálisis con 11 estudios retrospectivos en 6.233 pacientes (3.665 con antiagregantes, la última toma hasta 48h antes del procedimiento) el riesgo relativo de hemorragia con el uso de antiagregantes en la colocación de una PEG respecto al grupo control fue: AAS 1,43 (IC 95%: 0,89-2,29), clopidogrel 1,21 (IC 95%: 0,48-3,04) y con doble antiagregante 2,13 (IC 95%: 0,77-5,91)141.
Existe un mayor riesgo de hemorragia en pacientes con anticoagulantes. En el estudio de Nagata, se observó el 2,0% con warfarina y 1,2% con ACOD57.
En un estudio más reciente con 1.613 PEGs, de las cuales el 95% de los pacientes recibían tratamiento antitrombótico sin interrupción (antiagregantes como anticoagulantes), solo se observaron seis casos de sangrado significativo en toda la cohorte (0,39%). Todos ellos habían recibido HBPM o en combinación con AAS. No se encontraron diferencias entre los diversos tipos de antitrombóticos. La mortalidad relacionada con la PEG fue de cinco casos (0,31%). Los datos indican un mínimo aumento del riesgo de sangrado con la continuidad de la anticoagulación142.
No obstante, la PEG se considera un procedimiento endoscópico de alto riesgo hemorrágico y parece razonable la retirada previa de los antitrombóticos.
| RECOMENDACIÓN 14 |
|---|
| La gastrostomía percutánea endoscópica se considera un procedimiento de alto riesgo hemorrágico. Aunque es una técnica segura en pacientes que mantienen la terapia antitrombótica, con un leve aumento del riesgo de sangrado, parece razonable la retirada previa. Se recomienda mantener el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%. |
El tratamiento con ligadura de las várices esofágicas está indicado para la hemorragia varicosa aguda, la profilaxis primaria, cuando el tratamiento farmacológico presenta contraindicaciones o intolerancia, y en la profilaxis secundaria143. Se ha descrito un riesgo de hemorragia postligadura del 2,3-7,3% secundaria a la úlcera tras la caída de la banda. En el estudio de Dueñas et al.144, en el que se analizaron 521 ligaduras de várices esofágicas a 175 pacientes, el riesgo de hemorragia postligadura fue del 4,6%, asociado a una función hepática avanzada o la presencia de un carcinoma hepatocelular, y una mortalidad del 24%. La colocación de menos de seis bandas elásticas por sesión parece reducir el riesgo de hemorragia.
No existe evidencia en pacientes antiagregados con clopidogrel en el tratamiento de las várices esofágicas. En pacientes con AVK que se realizan una ligadura endoscópica no hay diferencias en el riesgo de hemorragia respecto a pacientes sin anticoagulantes145. En un estudio retrospectivo con 553 ligaduras, la anticoagulación con HBPM no mostró una asociación significativa con hemorragia postligadura. Se registraron seis casos de hemorragia postligadura sin diferencias entre los pacientes que recibían heparina respecto a los no anticoagulados (3,8 vs. 1,6%, p=0,29)146. En un estudio retrospectivo con 32 pacientes con cirrosis y anticoagulados por una trombosis portal que se habían realizado una terapia de ligadura de várices electiva, en tres casos (9%) presentaron una hemorragia postligadura. Ninguno de ellos supuso un shock hemorrágico o la muerte. Los factores que se asociaron a hemorragia postligadura fueron la profilaxis secundaria y la cirrosis descompensada previamente147.
El tratamiento con ligadura de las várices esofágicas se considera un procedimiento de alto riesgo hemorrágico. La poca evidencia con antiagregantes antagonistas P2Y12 y las complicaciones secundarias a una hemorragia por hipertensión portal hacen razonable la retirada previa del tratamiento antitrombótico a los pacientes que se realizan a una ligadura programada (no urgente).
| RECOMENDACIÓN 15 |
|---|
| El tratamiento endoscópico de las várices esofágicas se considera un procedimiento de alto riesgo hemorrágico. Se recomienda mantener el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.Acuerdo 90%. |
El riesgo de hemorragia tras una ablación por radiofrecuencia en pacientes con esófago de Barrett es del 1%. Pero cuando se asocia la terapia ablativa con la RME de lesiones nodulares o lesiones planas con irregularidades, el riesgo de eventos adversos aumenta hasta cuatro veces148.
Existe un riesgo de hemorragia cuando se realiza radiofrecuencia para tratar pacientes con una ectasia vascular gástrica antral. En una revisión sistemática de 10 artículos (la mitad series de casos) en 72 pacientes, se observó un 4,2% de eventos adversos menores y ninguno mayor. En uno de los artículos analizados, a dos de los 21 pacientes del estudio (9,5%) presentaron una hemorragia aguda menor y una úlcera superficial149.
No existe evidencia en terapia ablativa con argón plasma coagulación por diversas indicaciones en pacientes con antitrombóticos, excepto la descripción de series de casos150.
De acuerdo con la guía europea, las terapias ablativas, especialmente la radiofrecuencia en esófago y estómago, se consideran de alto riesgo hemorrágico y hay que tener en consideración con el uso de antiagregantes como anticoagulantes3. En el caso de terapias con argón plasma coagulación se considera una técnica segura y de bajo riesgo hemorrágico96,151.
| RECOMENDACIÓN 16 |
|---|
| La terapia ablativa, especialmente la radiofrecuencia en esófago y estómago, se considera un procedimiento de alto riesgo hemorrágico. Se recomienda mantener el tratamiento antiagregante con AAS. En el caso de los antagonistas P2Y12 consultar con cardiología si alto riesgo trombótico. Se recomienda la retirada previa del tratamiento anticoagulante, o terapia puente si alto riesgo trombótico.La terapia con argón plasma coagulación se considera un procedimiento de bajo riesgo hemorrágico. Se recomienda mantener la antiagregación simple, la doble y cualquier tratamiento anticoagulante.Acuerdo 86%. |
No existe mucha evidencia de cuál es el tiempo óptimo para reiniciar los fármacos antitrombóticos después de un procedimiento endoscópico. Hay que evaluar el riesgo hemorrágico del procedimiento y el riesgo trombótico de manera individualizada para cada paciente con el fin de decidir cuándo reiniciarlos y minimizar las complicaciones. La mayoría de las guías clínicas recomiendan tan pronto como sea posible una vez se confirme la hemostasia endoscópicamente, dado el riesgo tromboembólico de la retirada de estos fármacos.
En el estudio multicéntrico español no se encontraron diferencias en la reintroducción precoz de los anticoagulantes, tanto por los AVK como por los ACOD, y que el reinicio a las primeras 48h después del procedimiento parece seguro, pero los datos no son extrapolables a procedimientos de alto riesgo hemorrágico11. En cambio, en el estudio italiano avisa de no reiniciar los anticoagulantes de manera precoz a lo recomendado por la guía europea en procedimientos de alto riesgo de hemorragia ya que conlleva un mayor riesgo de sangrado36.
Una buena práctica clínica que mejora la calidad de la endoscopia es ofrecer la información escrita y verbal sobre el cambio de pauta, el reinicio y el riesgo de sangrado del procedimiento. Incluir en el informe de la endoscopia, o en un documento aparte, un plan de seguimiento detallado del reinicio de los fármacos antitrombóticos (por ej. especificar el fármaco con el día y momento del reinicio) disminuye los errores médicos, posibles reprogramaciones y de eventos adversos152,153.
A continuación, se detallan las recomendaciones en función del tipo de fármaco antitrombótico y del riesgo hemorrágico del procedimiento:
AAS
- -
Procedimientos de bajo riesgo de hemorragia: se recomienda mantener el tratamiento.
Acuerdo 100%.
- -
Procedimientos de alto riesgo de hemorragia: se recomienda mantener el tratamiento. Si la AAS está pautada como profilaxis primaria se puede valorar la retirada. A excepción de la papilectomía endoscópica y dependiendo del riesgo trombótico, se recomienda suspender la AAS cinco días antes del procedimiento, salvo contraindicación (p. ej., stents y/o evento arterial <3 meses), y reiniciar a las 48-72 horas después del procedimiento.
Acuerdo 92%.
INHIBIDORES P2Y12
- -
Procedimientos de bajo riesgo de hemorragia: se recomienda mantener el tratamiento, incluso si terapia dual con AAS.
Acuerdo 96%.
- -
Procedimientos de alto riesgo de hemorragia y de bajo riesgo trombótico: se recomienda retirar cinco días antes de la prueba y reiniciar a las 24-48h después del procedimiento. Continuar con la AAS si ya está prescrita. En el caso de una CPRE, se puede considerar reiniciar hasta siete días después si existe un riesgo elevado de hemorragia postprocedimiento, pero con bajo riesgo trombótico.
Acuerdo 94%.
- -
Procedimientos de alto riesgo de hemorragia y de alto riesgo trombótico: se recomienda consultar con cardiología. Se puede considerar la interrupción del antiagregante si: se ha colocado un stent coronario fármacoactivo>12 meses, o la colocación de un stent coronario metálico sin recubrimiento>1 mes. Se recomienda continuar siempre con AAS si ya se está tomando. Se recomienda reiniciar el tratamiento antiagregante a las 24-48h, o al día siguiente si el riesgo trombótico es alto.
Acuerdo 98%.
ANTAGONISTAS DE LA VITAMINA K
- -
Procedimientos de bajo riesgo de hemorragia: se recomienda mantener el tratamiento anticoagulante. Comprobar la semana antes de la endoscopia el INR o, en su defecto, previo al procedimiento mediante coagulómetro tipo Coagucheck®. Si se encuentra en rango, continuar la dosis diaria. Si el INR se encuentra en rango, pero <5, reducir la dosis hasta conseguir rango. En el caso de INR>5 se recomienda diferir la endoscopia.
Acuerdo 92%.
- -
Procedimientos de alto riesgo de hemorragia y de bajo riesgo trombótico: se recomienda suspender tres días el acenocumarol o cinco días la warfarina antes del procedimiento. Asegurar que el INR es <1,5. Posteriormente, se reinicia el acenocumarol y la warfarina a las 24h después de la prueba a la dosis habitual.
Acuerdo 86%.
- -
Procedimientos de alto riesgo de hemorragia y de alto riesgo trombótico: se recomienda suspender tres días el acenocumarol o cinco días la warfarina antes del procedimiento y considerar la terapia puente con heparina. Iniciar HBPM al día siguiente de la suspensión y omitirla el día de la prueba (la última dosis de HBPM es de ≥12h si dosis profiláctica o ≥24h si dosis terapéutica antes de la prueba). El mismo día del procedimiento se puede administrar HBPM profiláctica a las 6h de la prueba. Si no existe contraindicación, reiniciar a las 24h tanto el acenocumarol como la warfarina solapadas con la heparina. Continuar con HBPM hasta adecuar el INR en rango terapéutico.
Acuerdo 92%.
En el caso de una CPRE, si presenta un riesgo elevado de hemorragia, se puede considerar la posibilidad de retrasar el reinicio del tratamiento hasta siete días postprocedimiento. En estos casos, se recomienda consultar con Hemostasia para valorar necesidad de terapia puente con HBPM.
Acuerdo 82%.
ANTICOAGULANTES DE ACCIÓN DIRECTA
- -
Procedimientos de bajo riesgo de hemorragia: se recomienda no suspender el ACOD. Se recomienda reiniciar la noche del mismo día de la prueba a la dosis habitual.
Acuerdo 98%.
- -
Procedimientos de alto riesgo de hemorragia: se recomienda suspender dos días el ACOD (tomar la última dosis tres días antes de la endoscopia). En el caso de dabigatran con aclaramiento de creatinina de 30 - 50mL/min se recomienda suspender cuatro días el ACOD (tomar la última dosis cinco días antes). En caso de que el paciente presente insuficiencia renal se recomienda consultar con Hemostasia. Se recomienda reiniciar el ACOD a las 24-48h después del procedimiento.
Acuerdo 86%.
En el caso de una DSE o una CPRE, si existe un riesgo elevado de hemorragia, considerar la posibilidad de retrasar el reinicio del tratamiento hasta siete días postprocedimiento, pero valorando el riesgo trombótico. En estos casos, se recomienda consultar con Hemostasia para valorar necesidad de terapia puente con HBPM.
Acuerdo 86%.
ConclusionesEn resumen, los pacientes que se realizan cualquier procedimiento endoscópico y que toman fármacos antiagregantes y/o anticoagulantes requieren una evaluación del riesgo de hemorragia según el procedimiento y una planificación individualizada de estos fármacos antes y después de la endoscopia. Es importante recordar que la evidencia en la mayoría de las recomendaciones es baja o muy baja y, por lo tanto, la decisión de suspender los antitrombóticos puede aumentar el riesgo de eventos tromboembólicos. En consecuencia, es preferible buscar un equilibrio adecuado entre el riesgo de sangrado y el riesgo de trombosis.
FinanciaciónEl presente documento no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasEl presente trabajo corresponde a una revisión no sistemática basada en estudios previamente publicados y no involucra la recopilación de datos de pacientes ni sujetos humanos. Por lo tanto, no ha sido necesaria la aprobación por parte de un Comité de Ética o de la obtención de un consentimiento informado.
Conflicto de interesesLos autores declaran no tener conflictos de interés.