El tratamiento de la enfermedad inflamatoria intestinal (EII) puede aumentar el riesgo de infección. La inmunización es parte del manejo integral de la atención de estos pacientes. El objetivo de este estudio es describir la prescripción y adherencia a la vacunación en pacientes con EII e identificar los posibles factores asociados a esta.
MétodosEstudio analítico, descriptivo, transversal en pacientes de un Programa de EII de Chile, entre abril y junio de 2019. A los pacientes se les solicitó responder un cuestionario acerca de la adherencia a la vacunación. La información de las vacunas se obtuvo del Registro Nacional de Inmunizaciones. Se realizó análisis estadístico descriptivo y de asociación (χ2; p<0,05).
ResultadosSe incluyeron 243 pacientes con EII (148 colitis ulcerosa [CU], 86 enfermedad de Crohn [EC] y 9 EII no clasificable). Solo 6 pacientes (2%) recibieron el esquema de inmunización completo. Las vacunas con los mayores porcentajes fueron contra la influenza (67%), virus hepatitis B (40%), neumocócica 13-valente (34%) y neumocócica 23-polisacárida (16%), siendo las dos primeras más frecuentes en EC vs. CU (p≤0,05). La administración de la vacuna contra la influenza ha aumentado significativamente, alcanzando un 67% el 2019. La encuesta mostró que el 23% no ha sido inmunizado con ninguna vacuna, principalmente por falta de tiempo, falta de prescripción médica y el alto costo económico.
ConclusionesEn esta cohorte, aunque las tasas de vacunación son más altas que las reportadas previamente, la adherencia al programa de inmunización debe mejorar, siendo consideradas desde el diagnóstico por el equipo multidisciplinario.
Inflammatory Bowel Disease (IBD) treatment may increase the risk of infections. Vaccines are part of the comprehensive IBD patient care. The aim of this study was to describe indications and adherence of immunizations in IBD and identify possible associated factors.
MethodsA cross-sectional, analytic study was conducted in patients from an IBD Program of a tertiary center in Chile, between April – June 2019. Patients were asked to answer a vaccine survey and information also was obtained from the National Immunization Registry. Descriptive and association statistic were used (χ2; p<0.05).
ResultsA total of 243 patients were included (148 ulcerative colitis (UC), 86 Crohn's disease (CD) and 9 non-classifiable IBD). Only six patients (2%) of IBD patients received a complete immunization schedule. The highest vaccine rates were against influenza (67%), hepatitis B virus (40%), 13-valent pneumococcal (34%) and 23-polysaccharide pneumococcal (16%). The influenza vaccine rate has significantly increased, reaching 67% in 2019. The survey showed that 23% of patients have not been immunized with any vaccine, mainly due to lack of time, lack of medical prescription and high cost.
ConclusionsIn this cohort, although vaccination rates are higher than previously reported, adherence to IBD immunization program would be improved, being considered since diagnosis by the multidisciplinary team.
La enfermedad inflamatoria intestinal (EII), que abarca principalmente a la enfermedad de Crohn y la colitis ulcerosa (CU), son enfermedades gastrointestinales crónicas caracterizadas por períodos alternos de recaída y remisión. Recientemente, se ha demostrado el aumento en la incidencia y prevalencia de la EII en Latinoamérica y el Caribe1, similar a lo observado hace algunas décadas en países desarrollados2. Aunque en Chile no contamos con datos, estudios realizados en centros terciarios confirman un aumento en el número de casos y hospitalizaciones durante los últimos años3,4. Por otra parte, el tratamiento de la EII ha tenido en las últimas décadas un avance sustancial tras la incorporación de la terapia biológica (anti-TNF, antiintegrinas, anti p40 IL12/23) y moléculas pequeñas5. Si bien estos fármacos son efectivos en controlar la actividad de la enfermedad logrando la remisión clínica y endoscópica en una proporción de pacientes, también pueden incrementar el riesgo de infecciones o reactivación de enfermedades latentes6,7, dado que afectan el sistema inmune humoral y celular6.
Se ha propuesto un cribado sistemático de infecciones, y un esquema de inmunizaciones en todo paciente con EII, más aún en aquellos que recibirán terapia inmunomoduladora (tiopurínicos/metotrexato), biológicos o moléculas pequeñas5,6,8–10. El momento ideal para realizar la inmunización es al diagnóstico6,10, independientemente de la gravedad al inicio, ya que la evolución de la enfermedad y su tratamiento pueden variar con el tiempo. Es importante considerar que el estado de inmunosupresión secundario a los fármacos puede interferir en la eficacia de la inmunización o contraindicar la administración de aquellas constituidas por agentes vivos. Vacunas con virus vivo atenuado, como es el caso de la vacuna herpes zoster virus, trivírica, varicela y fiebre amarilla, están contraindicadas en caso de inmunosupresión severa5,8–10. Este grupo incluye a aquellos pacientes con EII que se encuentren en tratamiento con prednisona≥20mg/día por más de 2 semanas; inmunomoduladores; terapia biológica y moléculas pequeñas.
Si bien existen diferentes esquemas de inmunización publicados5,6,8–10, la prescripción de vacunas en pacientes con EII sigue siendo aún baja11–15. Un estudio realizado en Canadá mostró que solo el 61% de los pacientes con EII mencionó haber recibido la vacuna de la influenza y un 10% la vacuna antineumococo13. Por otra parte, un estudio realizado recientemente en Francia, que incluyó 199 pacientes con EII, muestra porcentajes de inmunización aún menores contra influenza (34%) y aunque el porcentaje de vacuna contra neumococo fue mayor (38%), este aún es bajo14. Entre los factores que contribuyen a esta baja tasa de inmunización destaca el escaso conocimiento de los gastroenterólogos sobre inmunización en EII, la falta de educación que reciben los pacientes sobre las vacunas y su rol, percepción errónea de la seguridad de las vacunas en pacientes inmunocomprometidos y miedo a los eventos adversos secundarios13–18.
El objetivo de este estudio es describir las prescripciones y la adherencia a las inmunizaciones en pacientes con EII e identificar los posibles factores asociados a esta, comparándolo con las recomendaciones de la literatura, con el fin de verificar si las pautas de vacunación se están aplicando y cumpliendo correctamente en nuestra población.
Pacientes y métodosEstudio observacional, descriptivo, transversal y analítico, realizado en pacientes con EII atendidos en el Programa de EII de Clínica Las Condes durante el período abril-junio de 2019.
Los pacientes con diagnóstico confirmado de EC, CU o EII no clasificable, con seguimiento anual en el Programa de EII de Clínica Las Condes, fueron invitados a contestar un cuestionario breve donde se evaluaron los siguientes puntos: prescripción por equipo tratante de vacuna contra la influenza durante el último año, sugerencia de otras vacunas del programa de inmunizaciones en EII, administración de las mismas, y en caso negativo, razones de no adherencia. La información de las vacunas administradas se obtuvo del Registro Nacional de Inmunizaciones. Se incluyeron en el análisis las siguientes vacunas: influenza, neumocócica 13-valente, neumocócica 23-polisacárida, difteria-tétano-pertussi, hepatitis A, hepatitis B, virus del papiloma humano, meningocócica, varicela zoster, herpes zoster vivo, sarampión y fiebre amarilla. Para la vacuna contra la influenza, con fines comparativos, se evaluó la información de la inmunización recibida los años 2017, 2018 y 2019.
Las variables demográficas (edad, género y sistema de cobertura en salud) y clínicas (diagnóstico, clasificación de Montreal, años de evolución de la enfermedad, años de ingreso al Programa de EII, tratamiento actual y tratamiento al momento de recibir vacunas) fueron obtenidas del Registro con fines de Investigación de pacientes con EII de Clínica Las Condes, el cual fue aprobado por el Comité de Ética local en abril de 2012.
Se definió como un esquema de inmunización completa la administración de las vacunas contra la hepatitis A, hepatitis B, influenza (dentro del último año), neumocócica 13-valente, neumocócica 23-polisacárida, virus papiloma (todo paciente entre 11-26 años) y herpes zoster (todo paciente≥50 años).
Este estudio fue aprobado por el Comité de Ética de la institución y se realizó manteniendo los principios de la Declaración de Helsinki.
Análisis estadísticoLos resultados del estudio fueron analizados mediante el software R Commander. Las variables categóricas se analizaron a través de frecuencia absoluta y porcentual. Las variables continuas se describieron con medidas de tendencia central y dispersión según la distribución de los datos (promedio y desviación estándar si siguieron una distribución normal y rango intercuartílico si no siguieron una distribución normal). Las variables continuas se compararon usando Mann-Whitney o t-test según fuese la distribución. Para variables categóricas se utilizó frecuencia relativa porcentual y para el análisis estadístico comparativo chi-cuadrado. Se determinó como significación estadística un valor de p≤0,05.
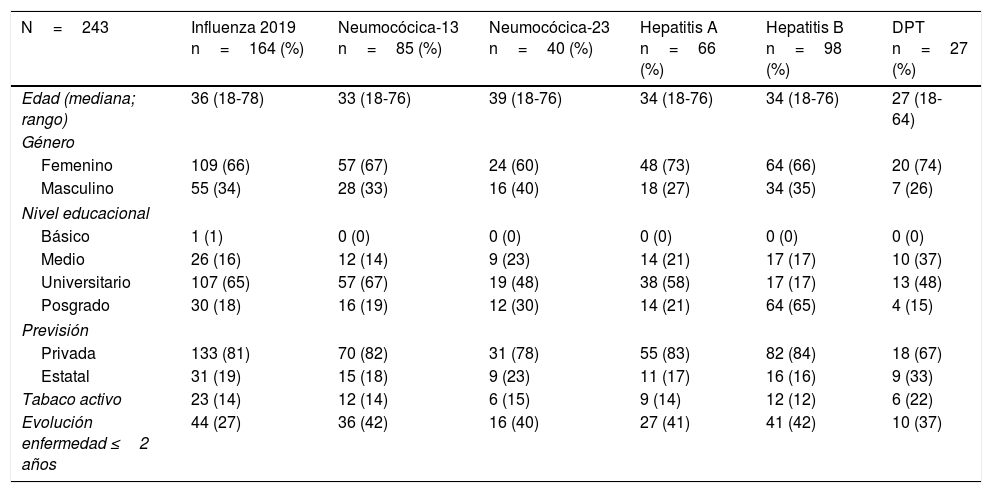
ResultadosUn total de 243 pacientes con EII (correspondientes al 53% del total de pacientes evaluados en el Programa de EII durante el período abril-junio de 2019) respondieron la encuesta de vacunas; no hubo exclusiones por datos incompletos. Los datos demográficos y clínicos de los pacientes incluidos en el estudio se presentan en la tabla 1. Ciento cuarenta y ocho pacientes con diagnóstico de CU, 86 de EC y 9 con EII no clasificable fueron incluidos en el análisis. La mayoría eran mujeres (68%), con una mediana de edad de 36 años (rango 18-78), y una mediana de duración de la enfermedad de 5 años (rango 0-49). La mayoría de los pacientes tenían un sistema de salud privado (82%) y con estudios universitarios completos (83%). De los encuestados, un 22% de los pacientes se encontraban en terapia inmunomoduladora (tiopurínicos/metotrexato) y el 24% con terapia biológica (43% de los pacientes con EC y 12% con CU). Un 64% del total de pacientes con terapia biológica se encontraban en tratamiento combinado con algún tiopurínico o metotrexato.
Características demográficas y clínicas de los pacientes con enfermedad inflamatoria intestinal incluidos en el estudio
| N=243 | N (%) |
|---|---|
| Edad (mediana; rango) | 36 (16-78) |
| Género | |
| Femenino | 151 (62,1) |
| Masculino | 92 (37,9) |
| Nivel educacional | |
| Básico | 1 (0,4) |
| Medio | 37 (15,2) |
| Universitario | 51 (21) |
| Posgrado | 154 (63,4) |
| Previsión | |
| Privada | 198 (81,5) |
| Estatal | 44 (18,1) |
| Sin información | 1 (0,4) |
| Tabaco | |
| Activo | 31 (12,8) |
| Exfumador | 41 (16,9) |
| Hijos≤6 años | 50 (20,6) |
| Diagnóstico | |
| Colitis ulcerosa | 148 (61) |
| Enfermedad de Crohn | 86 (35) |
| EII no clasificable | 9 (4) |
| Años de enfermedad (mediana; rango) | 5 (0-49) |
| Clasificación de Montreal | |
| CU (extensión) | |
| Extensa | 68 (46) |
| Izquierda | 41 (28) |
| Proctitis | 34 (23) |
| Sin información | 5 (3) |
| EC (localización) | |
| Ileon | 14 (16) |
| Ileocolónica | 29 (34) |
| Colon | 38 (44) |
| GI superior | 1 (1) |
| Sin información | 5 (6) |
| EC (fenotipo) | |
| Inflamatorio | 58 (67) |
| Estenosante | 3 (3) |
| Fistulizante | 1 (1) |
| Perianal | 17 (20) |
| Sin información | 24 (28) |
| Tratamiento | |
| Terapia biológica | 58 (24) |
| Inmunomoduladores | 53 (22) |
| 5-ASA | 102 (42) |
| Prednisona | 4 (2) |
| Budesonida | 6 (2) |
| MAC | 1 (0) |
| Sin tratamiento | 19 (8) |
5-ASA: 5 aminosalicilatos; CU: colitis ulcerosa; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; GI: gastrointestinal; MAC: medicina alternativa y complementaria.
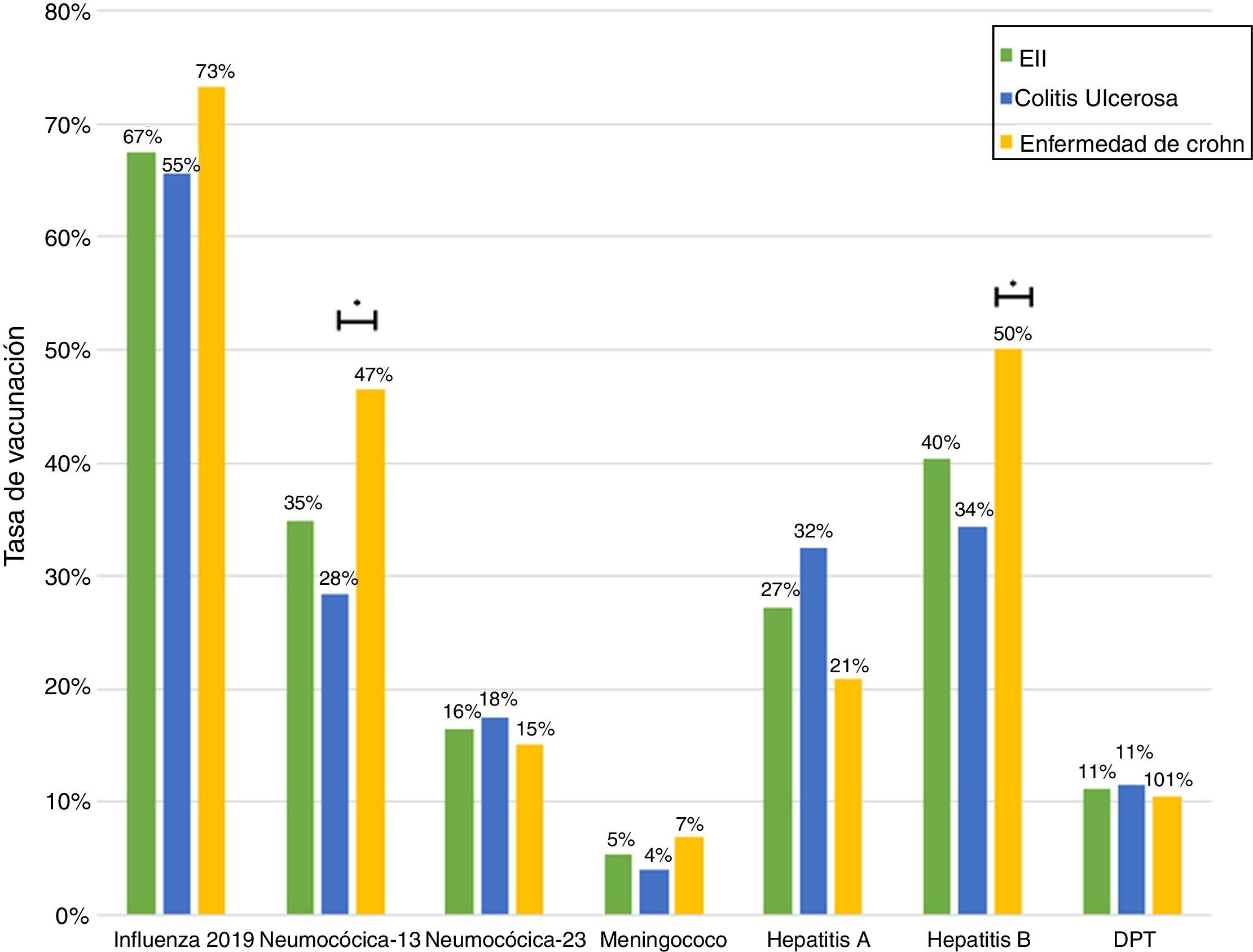
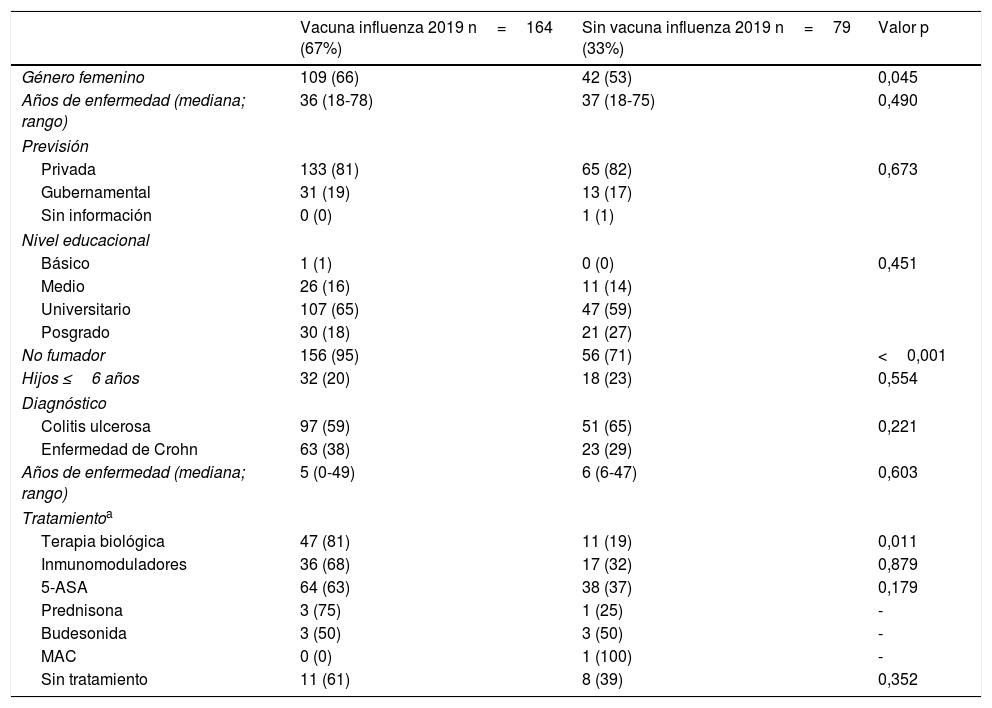
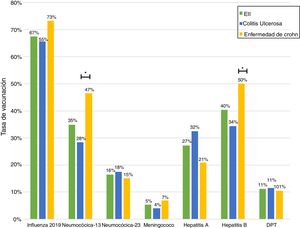
Solo 6 pacientes (2%) recibieron el esquema de inmunización completo: 3 de ellos se encontraban en tratamiento combinado de terapia biológica y azatioprina, los otros 3 solo en tratamiento con 5-ASA. Las vacunas con los mayores porcentajes de administración fueron contra el virus hepatitis B en 98 pacientes (40%), siendo más frecuente en pacientes con EC vs. CU (50% vs. 34%, p=0,019), neumocócica 13-valente se administró en 83 pacientes (34%), siendo más frecuente en EC vs. CU (47% vs. 28%, p=0,005); neumocócica 23-polisacárida en 39 pacientes (16%), sin diferencias significativas entre EC y CU (15% vs. 18%, p=0,627). Solo 18 pacientes (7,4%) han recibido ambas vacunas contra el neumococo. En relación con la vacuna virus papiloma y herpes zoster, esta se administró en 10 y 7 pacientes, respectivamente. El porcentaje de administración de las diferentes vacunas y las características demográficas y clínicas por tipo de vacuna recibida se muestran en la figura 1 y tabla 2, respectivamente.
Características demográficas y clínicas por tipo de vacuna recibida en pacientes con EII
| N=243 | Influenza 2019 n=164 (%) | Neumocócica-13 n=85 (%) | Neumocócica-23 n=40 (%) | Hepatitis A n=66 (%) | Hepatitis B n=98 (%) | DPT n=27 (%) |
|---|---|---|---|---|---|---|
| Edad (mediana; rango) | 36 (18-78) | 33 (18-76) | 39 (18-76) | 34 (18-76) | 34 (18-76) | 27 (18-64) |
| Género | ||||||
| Femenino | 109 (66) | 57 (67) | 24 (60) | 48 (73) | 64 (66) | 20 (74) |
| Masculino | 55 (34) | 28 (33) | 16 (40) | 18 (27) | 34 (35) | 7 (26) |
| Nivel educacional | ||||||
| Básico | 1 (1) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Medio | 26 (16) | 12 (14) | 9 (23) | 14 (21) | 17 (17) | 10 (37) |
| Universitario | 107 (65) | 57 (67) | 19 (48) | 38 (58) | 17 (17) | 13 (48) |
| Posgrado | 30 (18) | 16 (19) | 12 (30) | 14 (21) | 64 (65) | 4 (15) |
| Previsión | ||||||
| Privada | 133 (81) | 70 (82) | 31 (78) | 55 (83) | 82 (84) | 18 (67) |
| Estatal | 31 (19) | 15 (18) | 9 (23) | 11 (17) | 16 (16) | 9 (33) |
| Tabaco activo | 23 (14) | 12 (14) | 6 (15) | 9 (14) | 12 (12) | 6 (22) |
| Evolución enfermedad ≤2 años | 44 (27) | 36 (42) | 16 (40) | 27 (41) | 41 (42) | 10 (37) |
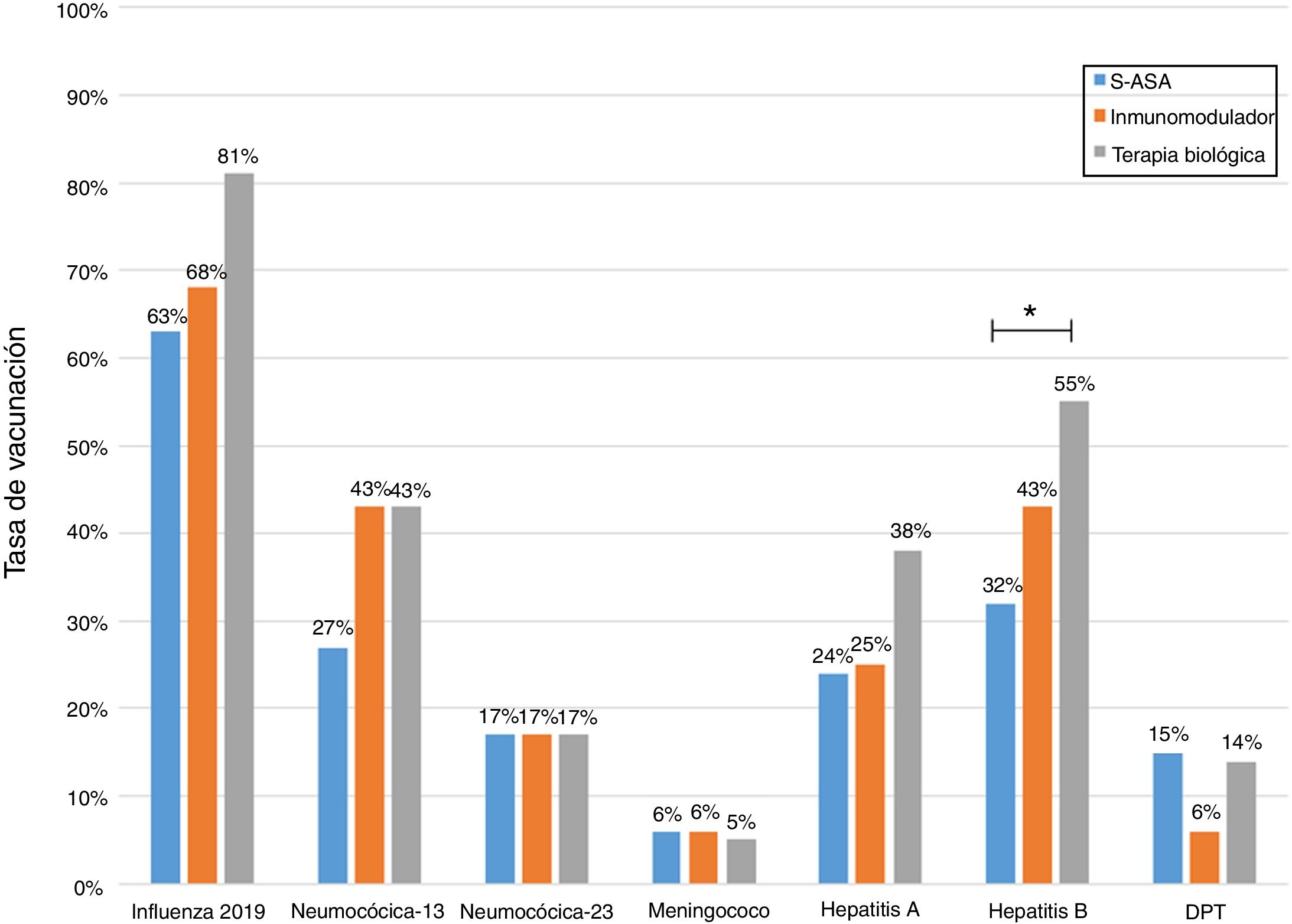
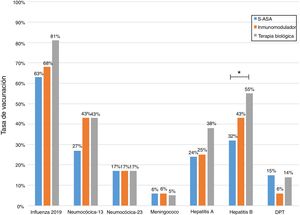
Al analizar las tasas de inmunizaciones por grupo de fármacos, se observa que el porcentaje de vacunados contra la hepatitis B es significativamente mayor en el grupo que se encuentra en terapia biológica. Para la vacuna neumocócica 13-valente, solo se observó una tendencia a ser administrada con mayor frecuencia en pacientes en tratamiento con inmunosupresores o biológicos (fig. 2).
Al revisar el Registro Nacional de Inmunizaciones, 40 pacientes recibieron una vacuna virus vivo atenuada, incluso 3 de ellos recibieron más de una vacuna. La inmunización recibida fue 17 contra la fiebre amarilla, 17 contra sarampión, 7 contra herpes zoster y 2 contra varicela zoster. Siete de ellos (18%) se encontraban en tratamiento inmunosupresor al momento de su administración (un paciente con esteroides, 4 con tiopurínicos/metotrexato y 2 con terapia combinada con anti-TNF e inmunomoduladores), ninguno de ellos recibió más de una vacuna virus atenuado.
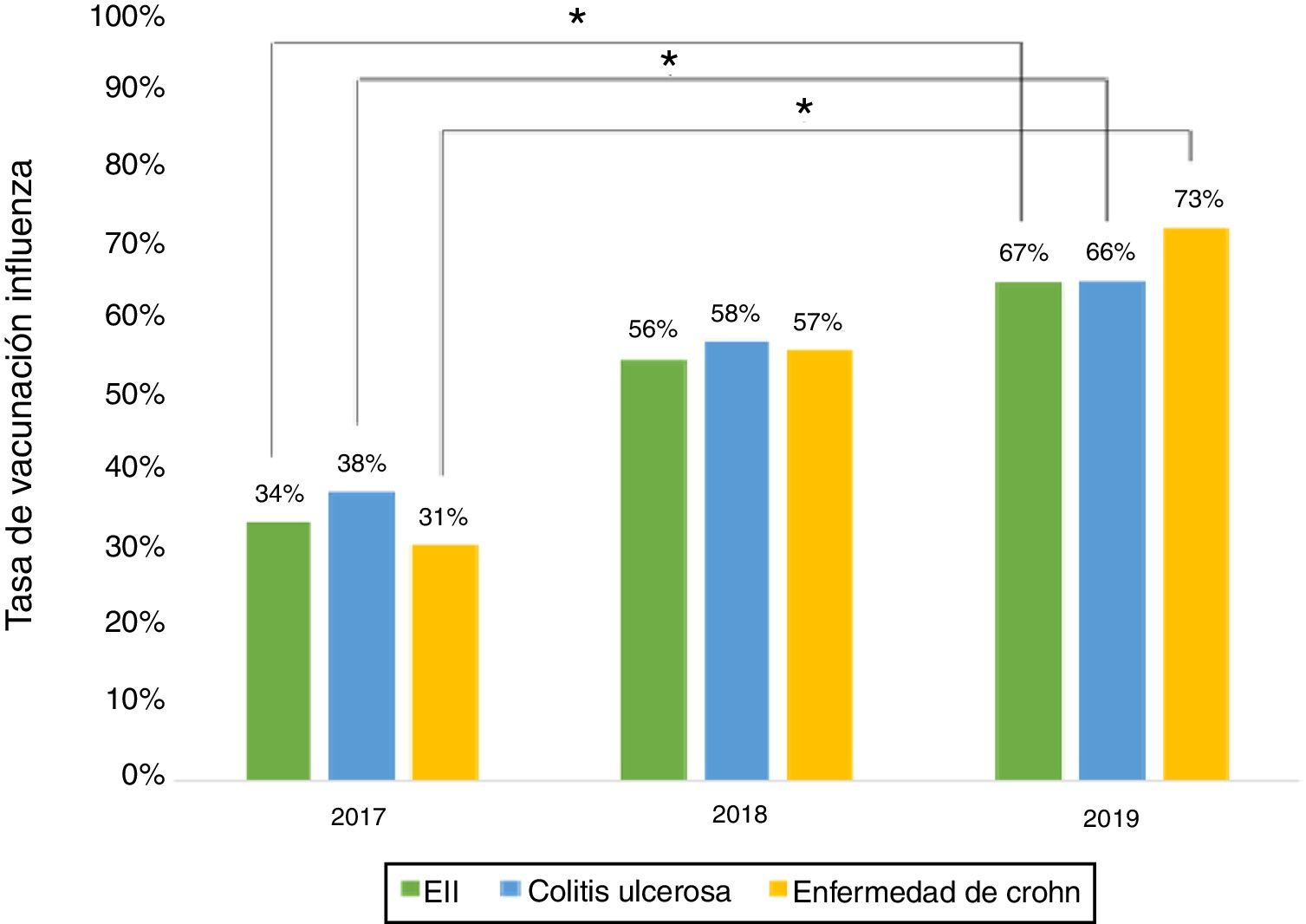
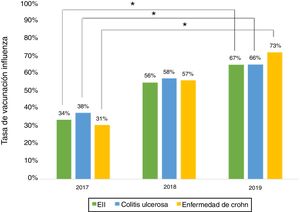
Vacuna influenzaEn relación con la administración de la vacuna influenza durante el 2019, los datos demográficos de los pacientes se muestran en la tabla 3. El porcentaje de vacunación fue mayor en mujeres que en hombres (66% vs. 53%, p=0,045), pacientes no fumadores (95% vs. 73%, p≤0,001) y en tratamiento con terapia biológica (81% vs. 19%, p=0,011). Al evaluar la de inmunización contra la influenza realizada los años 2017, 2018 y 2019, se aprecia que el porcentaje de pacientes vacunados ha aumentado significativamente tanto en EC como en CU (fig. 3).
Análisis univariado de las características demográficas y clínicas que podrían afectar las tasas de vacunación de influenza en pacientes con EII
| Vacuna influenza 2019 n=164 (67%) | Sin vacuna influenza 2019 n=79 (33%) | Valor p | |
|---|---|---|---|
| Género femenino | 109 (66) | 42 (53) | 0,045 |
| Años de enfermedad (mediana; rango) | 36 (18-78) | 37 (18-75) | 0,490 |
| Previsión | |||
| Privada | 133 (81) | 65 (82) | 0,673 |
| Gubernamental | 31 (19) | 13 (17) | |
| Sin información | 0 (0) | 1 (1) | |
| Nivel educacional | |||
| Básico | 1 (1) | 0 (0) | 0,451 |
| Medio | 26 (16) | 11 (14) | |
| Universitario | 107 (65) | 47 (59) | |
| Posgrado | 30 (18) | 21 (27) | |
| No fumador | 156 (95) | 56 (71) | <0,001 |
| Hijos ≤6 años | 32 (20) | 18 (23) | 0,554 |
| Diagnóstico | |||
| Colitis ulcerosa | 97 (59) | 51 (65) | 0,221 |
| Enfermedad de Crohn | 63 (38) | 23 (29) | |
| Años de enfermedad (mediana; rango) | 5 (0-49) | 6 (6-47) | 0,603 |
| Tratamientoa | |||
| Terapia biológica | 47 (81) | 11 (19) | 0,011 |
| Inmunomoduladores | 36 (68) | 17 (32) | 0,879 |
| 5-ASA | 64 (63) | 38 (37) | 0,179 |
| Prednisona | 3 (75) | 1 (25) | - |
| Budesonida | 3 (50) | 3 (50) | - |
| MAC | 0 (0) | 1 (100) | - |
| Sin tratamiento | 11 (61) | 8 (39) | 0,352 |
5-ASA: 5 aminosalicilatos; EII: enfermedad inflamatoria intestinal; MAC: medicina alternativa y complementaria.
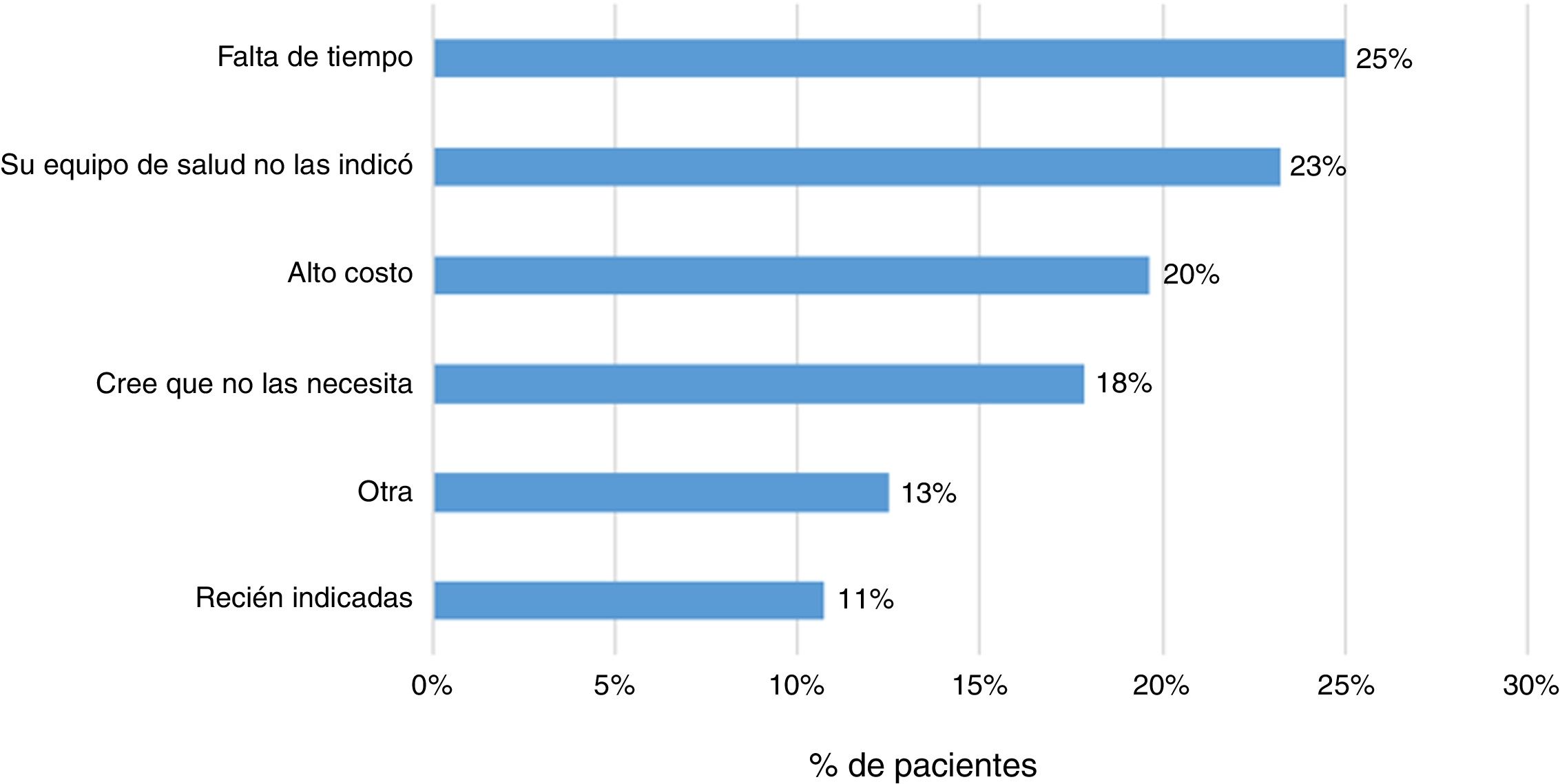
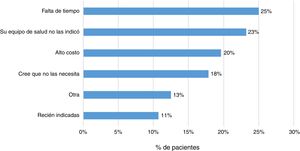
El 83% (202 pacientes) señaló que su médico tratante le había prescrito la vacuna contra la influenza y un 79% alguna otra vacuna. Por otra parte, el 23% (57 pacientes) respondió no haber recibido ningún tipo inmunización. Las principales razones señaladas por los pacientes fueron la falta de tiempo (25%), la falta de prescripción médica (23%) y el alto costo económico de estas (20%) (fig. 4).
DiscusiónEl uso de distintas terapias, ya sea esteroides, inmunomoduladores, terapia biológica y/o moléculas pequeñas, tiene un riesgo de desarrollar infecciones, siendo este de grado variable según el fármaco19, las cuales potencialmente pueden ser prevenidas con un adecuado esquema de inmunización5,6,8–10. Se ha demostrado en varios estudios un mayor riesgo de infecciones fulminantes y mortalidad por hepatitis B, varicela y neumococo en pacientes con EII inmunosuprimidos20–23. Se recomienda la vacunación de rutina de los pacientes con EII, con la excepción de las vacunas que contienen virus vivos atenuados, las cuales deben evitarse en inmunocomprometidos5,6,8–10. Se ha sugerido realizar una evaluación de las inmunizaciones al diagnóstico con el fin de indicar todas aquellas vacunas que estén pendientes9,10. Por otro lado, se debe enfatizar que un adecuado esquema de inmunizaciones, y la adherencia a este, se considera un indicador de calidad de atención en pacientes con EII24,25.
Nuestros resultados muestran un déficit significativo en los esquemas de inmunización en pacientes con EII, con porcentajes de vacunación que van del 66% para la vacuna influenza al 5% para la vacuna meningocócica, esta última en población de riesgo5,6,8–10. Estos hallazgos son similares a lo referido en otros estudios11,26. Se ha sugerido que todos los pacientes con EII deben recibir ambas vacunas, idealmente primero la vacuna neumocócica 13-valente y 2 meses después la neumocócica 23-polisacárida con un refuerzo de esta última a los 5 años9,10. En nuestro estudio, solo el 7,4% recibió ambas vacunas contra el neumococo. Por otra parte, frecuencias aún más bajas de vacunación contra la influenza han sido mostradas en otros estudios, como reportan Loubet et al., donde solo el 34% de los pacientes la recibieron14. Finalmente, otros han señalado que el 45% de los pacientes con EII tenían completo el esquema de vacunación13. En nuestro estudio solo 6 (2%) pacientes recibieron un esquema de inmunización con todas las vacunas recomendadas.
Se ha demostrado en varios estudios que el nivel de información de los pacientes acerca de su enfermedad es deficiente27,28, e incluso un 58% de los pacientes refirieron tener una información inadecuada acerca de la necesidad de vacunarse contra la influenza y el neumococo14. Por otra parte, hay déficit en los conocimientos del equipo tratante acerca de las vacunas y hay incertidumbre en los pacientes sobre las indicaciones de estas16–18. Sin duda estas dos variables deben ser consideradas, dado que son predictoras de una adecuada adherencia a los esquemas de inmunización y otras intervenciones preventivas en pacientes con EII26,29. En el estudio de Malhi et al.13, solo el 54% de los pacientes en terapia biológica recordaban haber discutido la necesidad de vacunación antes de iniciar esta estrategia terapéutica y solo el 60% recibió la indicación de vacunarse contra la influenza. En nuestro estudio se observa que pacientes en terapia biológica presentaron un mayor porcentaje de vacunación antiinfluenza versus los pacientes con otros fármacos. Esto podría estar relacionado con el mayor número de atenciones y por lo tanto mayor exposición con el equipo del Programa, lo cual podría determinar un mejor nivel de educación30 y el hecho de que haber recibido esta vacuna sea requisito para poder acceder a la Ley 20.850 («Ley Ricarte Soto»), beneficio estatal que permite a los pacientes con EII acceder a la terapia biológica anti-TNF.
En relación con el porcentaje de vacunación de acuerdo al diagnóstico, nuestros resultados mostraron que la administración de la vacuna contra virus de la hepatitis B y la neumocócica 13-valente fueron más frecuentes en pacientes con EC vs CU, similar a lo descrito en otros estudios15. El mayor porcentaje de administración de estas vacunas en la EC se podría explicar por el mayor número de pacientes con esta patología en tratamiento con terapia biológica y con ello un mayor número de atenciones por parte del equipo tratante. Es importante considerar que, en nuestro país, la Ley 20.850 entró en vigencia para los pacientes con EC en enero de 2017 y para CU en julio de 2019, lo que pudo haber influido en el mayor porcentaje de pacientes con EC tratados con estos fármacos.
El porcentaje de vacunación contra la influenza aumentó de manera significativa del 2017 al 2019, alcanzando un 66% este último año. Esta alza se podría relacionar con la educación realizada a los pacientes y con el rol de las recientes campañas nacionales de vacunación contra la influenza. Situaciones similares han sido señaladas en otros estudios15.
Se ha demostrado que hay conceptos erróneos sobre la seguridad de las vacunas y la necesidad de una mayor educación de los pacientes con EII13. En nuestro estudio, 40 pacientes recibieron una vacuna virus vivo atenuado, 7 de los cuales (18%) se encontraban en tratamiento inmunomodulador. En el estudio de Malhi et al., el 70% de los pacientes en tratamiento inmunomodulador nunca recibieron la instrucción de que esta vacuna estaba contraindicada13. Esto pese a que las guías y revisiones sobre inmunización en pacientes con EII son claras en señalar que las vacunas con virus atenuado están contraindicadas en pacientes en terapia con este tipo de fármacos5,6,8–15.
Finalmente, se evidencia que el 23% de los pacientes no han sido inmunizados con ninguna vacuna. Las principales razones referidas por los pacientes fueron la falta de tiempo, la falta de prescripción médica y el alto costo económico de estas. Se ha señalado que la incertidumbre sobre la indicación, efectividad de estas y eventos adversos secundarios son factores que pueden llevar a una mala adherencia al esquema de inmunización13,14.
Nuestro estudio tiene ciertas fortalezas; al ser un estudio transversal y mostrar la experiencia de un centro terciario con un Programa de EII establecido, proporciona una visión de la práctica clínica diaria con una variedad de etapas de evolución tanto de la EC como de la CU y con estrategias terapéuticas distintas. Esta experiencia local se evaluó en el 53% de los pacientes en seguimiento en nuestro Programa de EII, lo cual permite comparar nuestros resultados con otros estudios. Finalmente, para evitar el sesgo de memoria, limitación al momento de realizar estudios retrospectivos que incluyan encuestas, se revisó el Registro Nacional de Inmunización para obtener información acerca de la vacunación de cada paciente. Por otra parte, sabemos que existen también limitaciones; es un estudio realizado en un centro terciario, lo que implica probablemente pacientes con mayor gravedad, mayor porcentaje de tratamiento inmunomodulador y/o terapia biológica. Por lo tanto, la percepción de la inmunización puede no reflejar lo que ocurre en la población general de EII atendida en otros centros a nivel nacional.
En conclusión, nuestro estudio sugiere que los programas de inmunización en pacientes con EII son aún deficitarios. Dado que los tratamientos actuales y las futuras estrategias terapéuticas ponen en riesgo a estos pacientes, resulta fundamental la educación de ellos y del equipo tratante, con el fin de mejorar la adherencia a los programas de vacunación. El equipo tratante debe desempeñar un papel activo en la atención integral de los pacientes con EII.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.