La enfermedad de Crohn representa una enfermedad compleja en la que, a pesar de que la mayoría de pacientes presenta inicialmente un patrón inflamatorio, una proporción importante desarrolla complicaciones como estenosis, fístulas o abscesos, o incluso perforaciones. Estas lesiones aumentan progresivamente a lo largo del tiempo y están asociadas a un riesgo más elevado de cirugía y hospitalización. A pesar de que su manejo ha mejorado considerablemente con la introducción de terapias biológicas, especialmente los agentes anti-TNF, estas siguen constituyendo un reto para los diferentes profesionales involucrados en su manejo.
Las fístulas que no afectan a la región perianal (entero-entéricas, entero-urinarias o entero-cutáneas) requieren una estrategia multidisciplinar, combinando un enfoque tanto médico como intervencionista o quirúrgico. Su tratamiento comprende desde las medidas de soporte generales hasta el uso de antibioterapia o, con relativa frecuencia, terapias avanzadas. A pesar de esto, en casos de ciertas complicaciones sépticas o refractarias al tratamiento médico, el drenaje percutáneo o el tratamiento quirúrgico siguen siendo esenciales en su manejo.
Aunque estas lesiones tienen un impacto importante, la evidencia sobre las mejores estrategias en este contexto, así como la eficacia y la seguridad de las diferentes terapias en estos pacientes, siguen siendo limitadas, destacando la ausencia de recomendaciones específicas en las guías actuales. Este documento tiene como objetivo proporcionar una visión integral sobre la enfermedad de Crohn fistulizante no perianal, abordando aspectos epidemiológicos, clínicos y terapéuticos desde una perspectiva multidisciplinar.
Crohn's disease consists on a complex condition where, despite most patients initially present with an inflammatory behavior, a significant proportion develop complicated lesions such as strictures, fistulas, abscesses, or even perforations. These lesions progressively increase over time and are associated with a higher risk of surgery and hospitalization. Despite significant advances in their management after the introduction of biological therapies, particularly anti-TNF agents, these complications continue to pose challenges for the multiple professionals involved in their care.
Fistulas that do not involve the perianal region (entero-enteric, entero-urinary, or entero-cutaneous) require a multidisciplinary strategy that combines medical, interventional, and surgical approaches. Their treatment ranges from general supportive measures to the use of antibiotics or, frequently, advanced therapies. Nevertheless, in cases of certain septic complications or those refractory to medical treatment, percutaneous drainage or surgical intervention remains essential.
Although these lesions have a significant impact, evidence regarding the best strategies in this context, as well as the efficacy and safety of different therapies in these patients, remains limited. This is highlighted by the absence of specific recommendations in current guidelines. The objective of this document is to provide a comprehensive overview of non-perianal fistulizing Crohn's disease, addressing its epidemiological, clinical, and therapeutic aspects from a multidisciplinary perspective.
La enfermedad de Crohn (EC) constituye una patología inflamatoria crónica con importantes retos tanto para su diagnóstico como para su manejo, ya que con relativa frecuencia se asocia a lesiones complicadas como consecuencia de un daño intestinal que se acumula progresivamente a nivel intestinal1. A pesar de que la mayoría de los pacientes presentan al diagnóstico un patrón inflamatorio según la clasificación de Montreal2, se ha estimado que en hasta cuatro de cada diez pacientes pueden detectarse ya signos de daño intestinal en los primeros meses tras el diagnóstico, lo que se relaciona con un mayor riesgo de cirugía y hospitalizaciones a largo plazo3. La prevalencia de estas complicaciones relacionadas con la enfermedad aumenta gradualmente a lo largo del tiempo, si bien las tasas más altas se describieron en los años en que los fármacos biológicos aún no estaban disponibles4,5.
Dentro de estas complicaciones, el concepto de EC penetrante incluye diferentes lesiones, como las fístulas o los abscesos, así como la perforación intestinal. En el caso de las fístulas, estas se definen como trayectos que comunican entre sí dos asas intestinales (fístula entero-entérica), un asa con otros órganos o vísceras (fístula entero-urinaria) o incluso con la piel (fístula entero-cutánea). La complejidad propia de la EC, junto con la clasificación de su comportamiento, dificultan la valoración de la progresión de la enfermedad, teniendo en cuenta que hasta el 85% de las lesiones penetrantes intraabdominales coexisten con estenosis6.
La disponibilidad de un número cada vez mayor de terapias avanzadas (tanto agentes biológicos como pequeñas moléculas) ha permitido alcanzar un mejor control de la enfermedad e incluso una reducción en la tasa de pacientes que desarrollan enfermedad penetrante, especialmente gracias a los agentes anti-factor de necrosis tumoral (TNF)7. A pesar de esto, una proporción importante de pacientes todavía desarrolla estas lesiones, requiriendo en muchos casos algún tipo de intervención quirúrgica o procedimiento para el drenaje de colecciones8, habiendo experimentado también todas estas técnicas grandes avances en los últimos años. Dentro de la aproximación actual al tratamiento médico en estos casos, se considera que, generalmente, los pacientes con una EC complicada deben ser tratados con una estrategia más intensiva en comparación con aquellos sin ella. Sin embargo, la evidencia sobre su eficacia y seguridad en estos casos sigue siendo limitada. Esto se refleja, por ejemplo, en la ausencia de recomendaciones al respecto en las guías de la European Crohn's and Colitis Organisation (ECCO) de tratamiento de la EC9. Por tanto, el objetivo de este documento es proporcionar una visión actualizada de la enfermedad fistulizante no perianal, incluyendo tanto aspectos epidemiológicos y clínicos, como de su manejo con una perspectiva tanto médica como intervencionista o quirúrgica, ya que todas ellas están estrechamente relacionadas en este escenario.
Epidemiología de la enfermedad fistulizanteEn una de las primeras descripciones de la enfermedad realizada por Crohn en 1941 ya se describió que más de la mitad de los pacientes presentaban fístulas10. Esto ha cambiado drásticamente, ya que el comportamiento fistulizante se describe en un 7% de los pacientes recién diagnosticados actualmente en España11, pero esta proporción parece variable en gran medida en función de múltiples factores, como el momento histórico analizado (era pre o post-biológica), la población en la que se evalúe o la duración de la enfermedad.
La incidencia de este patrón fistulizante también se ha visto influida en función de la clasificación utilizada en los diferentes estudios. La clasificación de Viena categorizaba el comportamiento de la EC en tres tipos: penetrante, estenosante o «no fistulizante ni penetrante», incluyendo la enfermedad perianal en la primera categoría12. Esta clasificación se actualizó en 2005 con la denominada clasificación de Montreal, a partir de la cual ya se diferencia la enfermedad fistulizante luminal de la enfermedad perianal en dos categorías distintas2. Teniendo en cuenta estos aspectos, en 2002 se publicó uno de los primeros estudios poblacionales de la cohorte de Olmsted (Minnesota, EE.UU.), el cual describió la historia natural de la EC aplicando la clasificación de Viena. En ella, Schwartz et al.4 reportaron una incidencia de fístulas del 35% durante el periodo comprendido desde 1970 hasta 1995, siendo la mayoría de estas fístulas perianales (54%), el 24% entero-entéricas y el 9% recto o ano-vaginales. La incidencia acumulada de fístulas en esta cohorte se estimó en un 33% a los 10años, y en un 50% a los 20años desde el diagnóstico4. Excluyendo la enfermedad perianal (de acuerdo con la clasificación de Montreal), estudios posteriores han descrito una incidencia del patrón fistulizante entre el 3 y el 23% en el momento del diagnóstico5,8,13-17. En contraste con los datos más recientes de España o de otros países de nuestro entorno, otras cohortes epidemiológicas de referencia, como la de las Islas Feroe, que destacan por su aumento progresivo de la incidencia, no han descrito ningún caso de enfermedad fistulizante al diagnóstico14, poniendo de relieve la importancia de la contextualización de los datos epidemiológicos a la hora de caracterizar la enfermedad. Asimismo, más allá de la formación de fístulas y abscesos, también se ha descrito el riesgo de perforación dentro del fenotipo fistulizante18,19, con una incidencia acumulada del 3% y 18% a los 5años del diagnóstico20.
En datos procedentes de la cohorte de Olmsted entre los años 1970 y 2004, y ya utilizando la clasificación de Montreal, se describió que el 14% de los pacientes al diagnóstico muestran un patrón penetrante, mientras que en cohortes más recientes, como la Epi-IBD, este dato se observa en un 8% de los casos5,8. Esta proporción aumenta progresivamente en todas ellas, siendo aún mayor en aquellos pacientes con estenosis (11%) en comparación con los que tienen un patrón inflamatorio (4%)8. A más largo plazo, aunque con datos obtenidos durante la era prebiológica, se ha estimado que la proporción de pacientes con enfermedad fistulizante puede aumentar hasta un 32% pasados 30años5. A pesar de que los estudios iniciales no encontraron cambios significativos respecto al desarrollo de una enfermedad fistulizante con el uso de los primeros inmunosupresores20,21, la incorporación de diferentes terapias avanzadas, así como su uso más precoz, han cambiado la historia natural de la EC. En base a los datos más recientes, podríamos esperar que el uso precoz de terapias biológicas, especialmente anti-TNF, puedan alterar esta evolución y prevengan esta progresión, aunque disponemos aún de evidencia limitada en este sentido7,22,23.
La edad al diagnóstico de la EC es uno de los factores que se ha relacionado con un incremento del riesgo de desarrollar un fenotipo fistulizante, siendo mayor en los pacientes diagnosticados antes de los 40años20,24, e incrementándose a medida que la edad es menor5. Algunos factores ambientales, como el tabaquismo, también se han relacionado con esta complicación25-27, mientras que la actividad física podría tener un efecto protector25. Por otro lado, la actividad de la enfermedad inflamatoria intestinal en forma de brotes26 o la presencia de úlceras profundas en la enfermedad cólica28 se han relacionado con un incremento del riesgo de presentar un patrón fistulizante. En cuanto a la localización de la enfermedad, algunos estudios han relacionado la afectación ileal con el desarrollo de fístulas17,29, mientras que otros no han observado diferencias en este sentido30. También se ha descrito un incremento del riesgo en aquellos pacientes con anticuerpos anti-Saccharomyces cerevisiae (ASCA) positivos en cualquier momento de la historia natural de la enfermedad, incluyendo su detección antes del diagnóstico17,31,32. También se ha relacionado este fenotipo con determinadas mutaciones en el gen NOD2; no obstante, este hallazgo sigue siendo controvertido33-35. En este sentido, hay que considerar la complejidad del modelo genético, el gran número de posibles genes candidatos, así como los factores ambientales que pueden modular su efecto. Estudios más recientes también han observado un riesgo diferente de desarrollar fenotipo fistulizante en función de la etnia y de factores migratorios, especialmente en poblaciones que proceden del sur de Asia y que migran a países occidentales36. En cambio, dentro del registro ENEIDA se ha observado que los pacientes nacidos fuera de España presentan una menor frecuencia de complicaciones estenosantes, mientras que no se han detectado diferencias en el riesgo de enfermedad penetrante37.
Además de todos estos aspectos, por su comportamiento más agresivo, las complicaciones penetrantes determinan de por sí un mayor riesgo de hospitalización8, cirugía13,15,16,24,29 y recurrencia de la enfermedad tras la cirugía38. Son aspectos de gran relevancia que se deben tener en cuenta a la hora de planificar la estrategia global y multidisciplinar de tratamiento en estos pacientes y que se cubrirán en este documento.
Características clínicasClínicaEl origen las fístulas intraabdominales se debe a la progresión transmural del proceso inflamatorio, pudiendo producir dos tipos de fístulas: internas y externas. Las fístulas internas comunican dos vísceras (incluyendo el mesenterio) entre sí, mientras que las fístulas externas o entero-cutáneas comunican una víscera con la piel. Estas últimas son poco frecuentes (prevalencia del 0,3%)39,40, y pueden aparecer tanto espontáneamente (sobre una zona de piel íntegra) como en el lecho de una herida quirúrgica (frecuentemente asociadas a dehiscencias de anastomosis), ocasionando habitualmente un importante impacto negativo tanto en la calidad de vida del paciente como sobre el manejo global de la enfermedad. En la tabla 1 se muestra un esquema que resume los diferentes tipos de fístulas. La presentación clínica vendrá condicionada por las vísceras involucradas y de si existen flemones o abscesos asociados41, lo que se revisará a continuación.
Tipos y clasificación de las fístulas
| Fístulas internas | Fístulas externas (entero-cutáneas) |
|---|---|
| Entero-entéricas | Espontánea |
| Íleo-ileal | Posquirúrgica |
| Íleo-cecal/cólica | |
| Íleo-sigmoidea | |
| Entero-duodenal | |
| Entero-gástrica | |
| Colo-duodenal | |
| Colo-gástrica | |
| Entero-urinarias | |
| Entero-vesical | |
| Entero-ureteral | |
| Entero-uretral | |
| Colo-vesical | |
| Entero-genitales | |
| Recto-vaginal | |
| Ano-vaginal | |
| Trayecto sinusal | |
| Posquirúrgica |
Fuente: adaptada de Hinojosa del Val J.E., Maroto Arce N. Conductas de actuación en la enfermedad inflamatoria crónica intestinal, 7.a edición, 2021.
Las fístulas entero-entéricas que conectan segmentos próximos entre sí suelen ser asintomáticas y no es habitual que tengan repercusión en el estado nutricional del paciente. Sin embargo, las fístulas que comunican tramos del intestino delgado proximales con otros más distales suelen tener mayor débito y generan un by-pass, y, por tanto, mayor riesgo de diarrea, pérdida de peso, hipoalbuminemia y/o malabsorción42.
De esta manera, las fístulas íleo-ileales y las íleo-cólicas suelen ser paucisintomáticas o incluso asintomáticas. Sin embargo, las fístulas íleo-sigmoideas (frecuentemente con el sigma libre de actividad inflamatoria), colo-gástricas o colo-duodenales pueden provocar desnutrición y pérdida de peso, además de diarrea y/o vómitos41. En las colo-gástricas, que habitualmente afectan al colon transverso distal e involucran la curvatura mayor del estómago, los pacientes pueden estar asintomáticos o pueden presentar diarrea, náuseas, halitosis, pérdida de peso, desnutrición y/o borborigmos, ocasionando incluso deshidratación y esteatorrea en algunos casos. Los vómitos fecaloideos son casi patognomónicos, pero solo se presentan en un tercio de los pacientes43. En el examen físico podremos observar también un efecto masa44,45. Las fístulas colo-duodenales suelen afectar al colon transverso proximal y la tercera porción duodenal46, habitualmente son asintomáticas o asocian síntomas inespecíficos como diarrea y dolor abdominal, o más específicos como vómitos fecaloideos y signos de malabsorción y malnutrición. De nuevo, los vómitos fecaloideos son muy específicos, pero solo aparecen en un 2% de los pacientes.
b. Fístulas entero-urinariasDentro de este tipo de fístulas, las entero-vesicales son las más frecuentes (alrededor del 90%), seguidas por las uretrales (6%) y ureterales (1%)47. Las fístulas entero-vesicales suelen originarse en el íleon hasta en el 64-80% de los casos y son más frecuentes en varones (las mujeres están más protegidas por la barrera entre el útero y la vagina) y en el hemiabdomen derecho48,49. Los síntomas más frecuentes son la neumaturia (68-77%), la disuria (64%), la fecaluria (28-50%), el aumento de la frecuencia urinaria (45%), las infecciones del tracto urinario de repetición (32-45%), el dolor abdominal (33%) y la salida de orina a través del recto (9%)47-51.
c. Fístulas entero-genitalesLas fístulas recto-vaginales son las más frecuentes dentro de este grupo, y suelen proceder del tercio inferior del recto hasta la mitad inferior de la vagina, cerca del introito, o del tercio medio hasta la mitad superior de la vagina. Los síntomas habituales de las fístulas recto-vaginales y ano-vaginales son el paso de heces o gases a través de la vagina, con secreciones malolientes y en ocasiones purulentas, o dispareunia52, aunque hasta un 20% de las mismas pueden ser asintomáticas.
Las fístulas entero-uterinas o entero-salpingueales son excepcionales, pueden presentar clínica similar a la de las fístulas recto-vaginales o ano-vaginales, pero en otras ocasiones los síntomas son totalmente inespecíficos, como dolor abdominal y malestar general, por lo que se requiere una alta sospecha para su diagnóstico.
d. Fístulas externasLas fístulas externas se originan habitualmente en segmentos ileales o cólicos (alrededor del 67% y 23%, respectivamente), y en dos tercios de los pacientes pueden mostrar signos de actividad luminal o abscesos intraabdominales asociados53. Aproximadamente el 51% son espontáneas y el 49% posquirúrgicas, teniendo las primeras un mejor pronóstico en términos de cierre de la fístula53. Este tipo de trayectos se caracterizan por el paso de contenido intestinal hacia la superficie de la piel dando lugar a cambios inflamatorios asociados, y en situaciones de fugas de alto débito pueden provocar alteraciones hidroelectrolíticas, malabsorción y deshidratación54.
e) Masa inflamatoria y abscesoEl flemón y el absceso son complicaciones en las que es esperable detectar una fístula asociada, aunque en ocasiones esto no puede identificarse mediante las pruebas de imagen seccional. Ambos suelen aparecer adyacentes a un segmento intestinal con actividad inflamatoria, y su localización más habitual es el hemiabdomen derecho debido a su relación con el íleon. Asimismo, deben considerarse también en pacientes con cirugías recientes55, y se han relacionado con fístulas tanto internas como externas por igual56. En un tercio de los pacientes producen clínica típica de dolor abdominal, fiebre, escalofríos y/o una masa palpable. En función de la localización esto puede modificarse, como en los abscesos que afectan al músculo psoas, que pueden dar lugar a dolor en el flanco, cadera, muslo o rodilla ipsilateral o incluso dificultad para la deambulación57. Sin embargo, la gran mayoría de los abscesos y flemones pueden presentarse sin clínica asociada (salvo la propia derivada de la actividad luminal) o con síntomas inespecíficos, de ahí la gran importancia de mantener una alta sospecha y realizar las pruebas necesarias para su diagnóstico. Existen ciertas características clínicas y analíticas en estos pacientes, como son la presencia de anemia, leucocitosis, incremento de la proteína C reactiva (PCR), aumento de la urea, edad joven, enfermedad perianal asociada y el tratamiento biológico activo, que nos permiten incrementar nuestra sospecha diagnóstica58,59, mientras que la influencia de los corticoides es controvertida58,60. De todas ellas, la existencia de una PCR elevada es el parámetro que más se ha relacionado con la probabilidad de presentar un absceso intraabdominal.
RecomendaciónAnte la gran heterogeneidad clínica asociada a la enfermedad fistulizante, incluyendo sus complicaciones, como los abscesos, se requiere un alto índice de sospecha para su diagnóstico. Ante la complejidad de estas lesiones es necesaria una caracterización detallada mediante pruebas de imagen seccional.
Evaluación radiológica de la enfermedad penetranteDefinición y detección de lesiones penetrantesPara la optimización del manejo tanto diagnóstico como terapéutico de las lesiones penetrantes en la EC es importante utilizar una terminología homogénea y estandarizada que facilite la comunicación entre especialidades, ya que la radiología es una herramienta esencial para la evaluación clínica de estos pacientes y la planificación quirúrgica, en caso necesario. Para ello, existen diferentes documentos de consenso u opiniones de expertos en la literatura que han tratado de homogeneizar la nomenclatura utilizada en este contexto. En la tabla 2 se recogen las definiciones radiológicas de las diferentes lesiones que pueden encontrarse en el contexto de la EC con patrón fistulizante.
Definiciones estandarizadas de las lesiones relacionadas con la enfermedad de Crohn fistulizante
| Lesión | Definición | Consideración |
|---|---|---|
| Fístula | Estructura tubular que se origina en la pared intestinal con líquido y/o gas en su interior mostrando una captación periférica de contraste intravenoso | Se dividen en simples (trayecto extraentérico único que conecta con otro segmento intestinal) o complejas (múltiples trayectos extraentéricos que afectan a múltiples estructuras) |
| Trayecto sinusal | Defectos de la pared intestinal de terminación ciega que surgen de la superficie serosa y se extienden hacia el mesenterio perientérico sin conectar con otra estructura | |
| Masa inflamatoria (flemón) | Lesión inflamatoria mesentérica adyacente a asas intestinales inflamadas, cuyos bordes suelen estar mal definidos y que presenta aumento de la señal (RM), atenuación (TC) o aspecto hipoecoico (ecografía), respectivamente, sin presentar contenido líquido en su interior | No se consideran lesiones drenables percutáneamente |
| Absceso | Presenta características de señal o atenuación del líquido. Muestran un realce capsular tras la inyección de contraste intravenoso o bien aumento del registro Doppler en la ecografía | Puede contener gas en su interior |
En este escenario clínico, las técnicas de imagen seccional tienen un papel fundamental en la detección y determinación de la extensión de las lesiones penetrantes, que pueden mostrar trayectos complejos, afectando a diferentes segmentos del tracto digestivo, así como otros órganos o la piel61-63. Por este motivo, su papel es esencial para el enfoque médico-quirúrgico de estas lesiones, tal y como se recoge en el algoritmo de tratamiento propuesto en la figura 1. En la literatura, tanto la tomografía computarizada (TC) como la resonancia magnética (RM) y la ecografía intestinal han mostrado buena sensibilidad para la detección de fístulas y colecciones63. Aunque la precisión diagnóstica de dichas técnicas puede variar en función de la complejidad y la extensión de las lesiones, de forma general la TC o la RM son preferibles para detectar fístulas intraabdominales o pélvicas frente a la ecografía, dada su mayor capacidad de ofrecer información relativa a la pelvis o en planos abdominales profundos64,65.
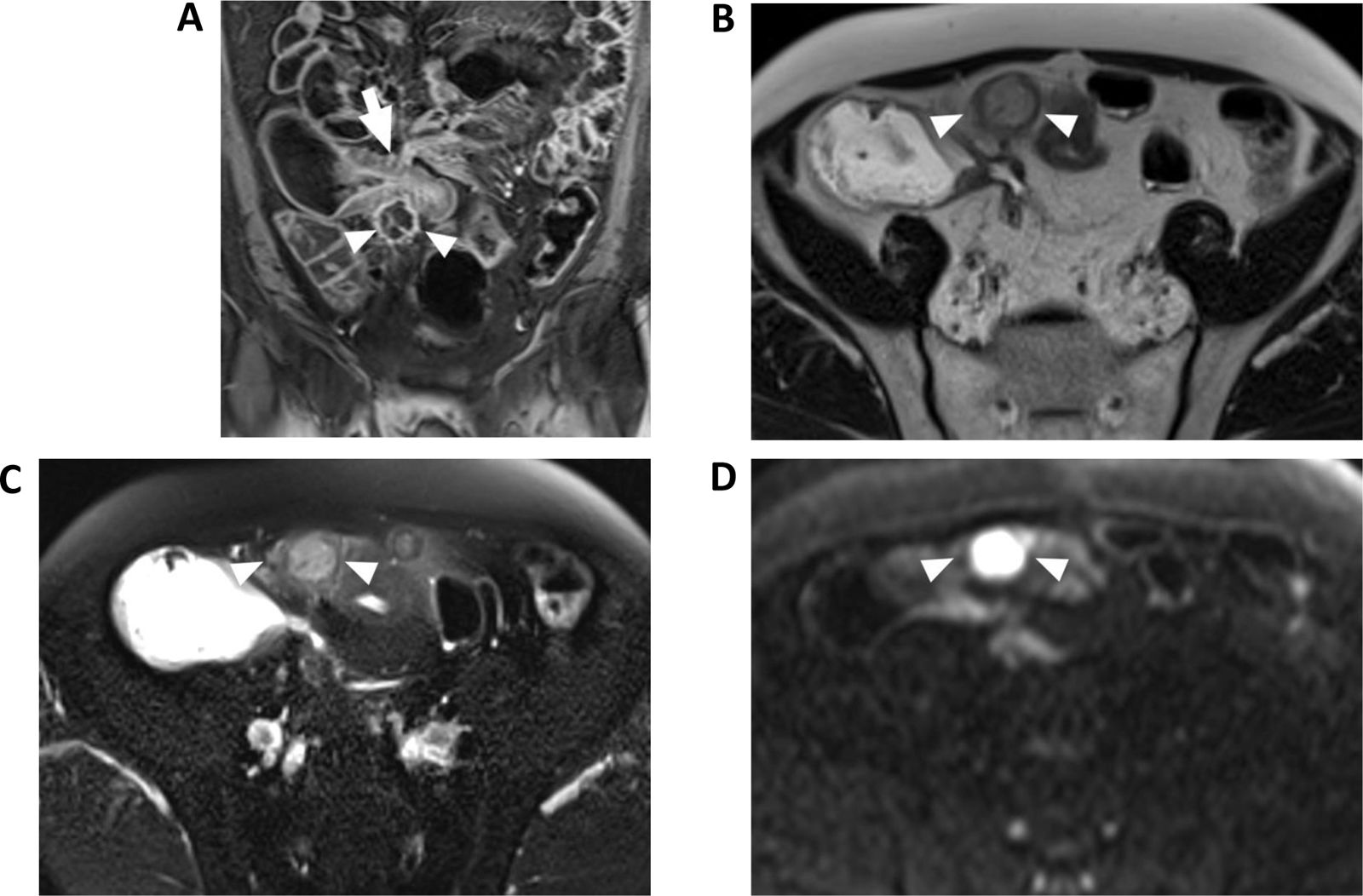
Cuando se diagnostica una fístula interna es importante describir con detalle el tipo de fístula, que estará definido por el punto de origen y el órgano afectado (por ejemplo, entero-entérica, entero-urinaria o entero-genital; ver la tabla 1). De forma similar, en el caso de masas inflamatorias o colecciones es importante que el radiólogo indique en el informe la localización y el tamaño de estas. En el caso de una colección, también debe describirse la proporción de volumen estimado que está ocupada por líquido, así como la presencia de tabiques y la viabilidad de colocar un drenaje guiado por técnicas de imagen seccional66,67 (fig. 2). Es importante indicar también si se identifica una fístula asociada a esta colección y, en el caso de estar presente, su tipo, ya que esto podría influir sobre la actitud médico-quirúrgica y la probabilidad de resolución de la misma68. La inyección de contraste endoluminal en el interior de la colección también podría ayudar a identificar trayectos fistulosos que no son visibles radiológicamente por estar enmascarados por los cambios inflamatorios circundantes69.
Enterografía por RM de un paciente con enfermedad de Crohn con una colección abdominal asociada a una estenosis ileal. A)Imagen T1 con supresión de la señal grasa en plano coronal tras la inyección de contraste intravenosa. Se puede identificar una colección bien delimitada y con hiperrealce de su pared de 24mm (puntas de flecha) asociada a una estenosis con signos inflamatorios (flecha). B,C)Imagen T2 en plano axial sin (B) y con (C) supresión de la señal de la grasa donde se puede identificar la colección (puntas de flecha) cuyo contenido muestra características líquidas, aunque de menor señal que el contraste oral del intestino. D)Imagen en difusión en el plano axial que muestra la colección que presenta una alta intensidad de señal (puntas de flecha) debido a la marcada restricción de la difusión característica de las colecciones.
En los casos en que la manifestación del patrón penetrante sea en forma de perforación70, la TC sería la técnica radiológica más rápida y sensible para detectar neumoperitoneo y, por tanto, debería ser considerada la prueba de elección ante la sospecha clínica de perforación71. La ecografía intestinal o la RM en manos expertas también podrían identificar la presencia de gas libre, pero no se consideran las técnicas de elección en este escenario.
RecomendaciónDentro de la valoración de las lesiones fistulizantes, recomendamos que se incluya una evaluación radiológica detallada que utilice una terminología homogénea, lo que permitirá una mejor valoración multidisciplinar. La TC y la RM son las exploraciones de elección en este contexto por su mayor capacidad de ofrecer un mapa anatómico detallado, aunque la ecografía intestinal podría utilizarse en algunos casos o en centros seleccionados. En caso de plantear una exploración que permita tanto la caracterización del tipo de fístula como el drenaje de colecciones/abscesos, recomendamos priorizar el uso de la TC y la ecografía.
Aproximación inicial y perspectiva de manejo multidisciplinarLas complicaciones fistulizantes son complicaciones potencialmente graves y con capacidad para afectar en gran medida la calidad de vida del paciente que las presenta. Su manejo debe orientarse en función de varios puntos clave, incluyendo la localización, los segmentos intestinales o los órganos afectados, la presencia o no de complicación infecciosa (esto es, un absceso intraabdominal), la actividad inflamatoria luminal de la EC, así como la presencia de una estenosis asociada. La EC es ya de por sí una enfermedad de gran complejidad, y la presencia de enfermedad penetrante intraabdominal (así como también la afectación perianal) contribuye a la dificultad que supone su manejo en el día a día. Por todo ello, la presencia de complicaciones penetrantes obliga a que la enfermedad deba ser abordada de manera muy detallada y con perspectiva interdisciplinar. Esto comienza por un adecuado diagnóstico y valoración completa mediante pruebas radiológicas (ver sección «Evaluación radiológica de la enfermedad penetrante»). Posteriormente, el tratamiento requiere la participación coordinada de gastroenterólogos, cirujanos y radiólogos intervencionistas, e incluso, en función de las zonas anatómicas afectadas, puede ser necesaria la participación de otras especialidades médicas, como endocrinología/nutrición, o quirúrgicas, como urología o ginecología.
Dentro del manejo inicial, en el caso de confirmar la presencia de actividad luminal, uno de los objetivos fundamentales debe ser lograr la remisión de la actividad inflamatoria, ya que la presencia de lesiones fistulizantes es en el fondo consecuencia del propio proceso inflamatorio en la pared intestinal (fig. 1). Dentro del arsenal terapéutico disponible, los corticoides siguen siendo una herramienta fundamental en el control agudo de la enfermedad. Sin embargo, en el contexto de un paciente con enfermedad fistulizante, estos deberían utilizarse con cautela, ya que los corticoides representan un importante factor de riesgo para el desarrollo de infecciones. Esto conlleva, por ejemplo, que los pacientes bajo tratamiento con corticoides sistémicos presentan abscesos de mayor tamaño que aquellos que no los están recibiendo72. Por tanto, su uso debería limitarse y utilizarse únicamente en casos seleccionados, siempre que no existan complicaciones sépticas.
RecomendaciónEn la enfermedad fistulizante simple (no complicada), con actividad luminal asociada y sin indicación de cirugía a corto plazo, recomendamos el uso de corticoides sistémicos con el objetivo de controlar la actividad inflamatoria. En el resto de situaciones, el uso de corticoides debería limitarse, priorizando el control de la sepsis abdominal y el inicio precoz de terapias avanzadas con fármacos biológicos.
a. NutriciónEl soporte nutricional adecuado es fundamental, entre otras cosas, para prevenir complicaciones posquirúrgicas asociadas a la desnutrición73. Los pacientes que presentan EC activa, con una complicación fistulizante, asociada o no a proceso séptico, es muy probable que cumplan criterios clínicos de malnutrición, por lo que deberían ser evaluados siempre desde el punto de vista nutricional. Además, los nuevos criterios Global Leadership Initiative on Malnutrition (GLIM) de malnutrición establecen la inflamación como una etiología muy relevante a considerar en la malnutrición, por lo que la importancia en este tipo de procesos es mayor si cabe74. Para una primera evaluación se pueden utilizar diferentes herramientas de cribado, como el Malnutrition Screening Tool (MST)75, el Malnutrition Universal Screening Tool (MUST)76 o el Mini Nutritional Assessment Short Form (MNA-SF)77, pero no existe ninguna herramienta específicamente validada en pacientes con enfermedad inflamatoria intestinal. Aquellos pacientes con un test de cribado positivo o que vayan a ser sometidos a una cirugía deberían ser derivados a un especialista en nutrición clínica. Clásicamente se recomendaba el reposo intestinal completo para reducir el débito de contenido enteral a la fístula, pero algunos estudios, aunque de pequeño tamaño, han señalado que el uso de nutrición enteral, preferiblemente de absorción en segmentos proximales, podría reducir el riesgo de cirugía y de complicaciones posquirúrgicas78-80.
En las últimas recomendaciones de la Sociedad Europea de Nutrición (ESPEN) se recomienda el uso de nutrición parenteral total o parcial en pacientes con fístulas proximales o de alto débito, si bien se recomienda tratar de mantener la vía oral de manera simultánea81. En cuanto al tipo de fórmula que se debe utilizar por vía parenteral, no existe evidencia para poder recomendar un tipo específico, por lo que se sugiere utilizar fórmulas estándar.
RecomendaciónEn todos los pacientes con EC activa y complicaciones fistulizantes, asociadas o no a un proceso séptico, recomendamos una evaluación desde el punto de vista nutricional. Esto es de especial relevancia en pacientes con un test de cribado nutricional positivo o que vayan a ser sometidos a una cirugía. La vía de nutrición recomendada de forma general es la enteral, aunque la nutrición parenteral total o parcial debe considerarse en pacientes con fístulas proximales o de alto débito.
b. AnticoagulaciónLa enfermedad inflamatoria intestinal, especialmente en fases de actividad o en relación con ingresos hospitalarios, supone un importante factor de riesgo protrombótico82. Por tanto, los pacientes ingresados debido a complicaciones fistulizantes deben recibir anticoagulación a dosis profilácticas para prevenir complicaciones trombóticas, al igual que en el resto de situaciones que requieran ingreso hospitalario. Además, no hay datos que sugieran que esta anticoagulación aumente el riesgo de sangrado83. No obstante, hay que tener en cuenta la probabilidad de necesitar procedimientos invasivos de cara a suspender la anticoagulación con tiempo suficiente para reducir posibles complicaciones hemorrágicas. Por ello, el uso de heparina de bajo peso molecular a dosis profilácticas se considera la alternativa de elección en este contexto84. En el caso de procedimientos invasivos o quirúrgicos, el tratamiento con heparina a dosis profiláctica debería suspenderse 12horas antes, mientras que si la dosis es con efecto anticoagulante, este período debe ser de 24horas.
RecomendaciónTodos los pacientes ingresados debido a complicaciones fistulizantes deben recibir anticoagulación a dosis profilácticas con heparina de bajo peso molecular.
c. Decisión multidisciplinarPor todos los múltiples motivos previamente expuestos, la EC fistulizante supone un reto tanto diagnóstico como terapéutico. Una comunicación fluida entre los diferentes especialistas es fundamental para lograr los mejores resultados en cada paciente, entre los cuales deberían estar implicados, al menos, gastroenterólogos, cirujanos, radiólogos y personal de enfermería.
En muchas ocasiones el escenario en donde se encuentran estos pacientes es el ámbito ambulatorio, pudiendo plantearse un control de la sepsis y la optimización del paciente progresivos. En esta situación, la entero-RM sería la técnica radiológica de elección, debido a su mayor sensibilidad para detectar fístulas. En los casos en los que es necesario un ingreso, si estos pacientes no tienen una indicación quirúrgica inicial es esperable que sean tratados en planta de hospitalización de Digestivo. Por ello, al ingreso es recomendable consultar y revisar conjuntamente la situación del paciente junto con el equipo de cirugía general, lo que permitirá consensuar la actitud durante la hospitalización desde el inicio. Igualmente, es necesario disponer de pruebas de imagen apropiadas. Ante la sospecha de una complicación intraabdominal, todo paciente debe ser evaluado mediante un estudio radiológico seccional que, dentro del escenario agudo, es habitualmente una TC abdomino-pélvica. En función de la experiencia del radiólogo y de la disponibilidad, podría realizarse una ecografía intestinal, que podría aportar datos de interés como relaciones anatómicas y, en el caso de presentar una colección, la posibilidad de drenaje percutáneo. La RM podría ser una buena alternativa dada su mayor capacidad de definir este tipo de lesiones, pero es una técnica que no suele estar disponible en el momento agudo.
Una vez realizada esta valoración inicial se podrá conocer ya si nos encontramos ante una enfermedad fistulizante simple o compleja, definida por la presencia de trayectos múltiples o asociados a un flemón o absceso. A continuación se revisará la evidencia y las recomendaciones en cada uno de estos escenarios, siendo esencial en todos ellos mantener una aproximación multidisciplinar, ya que el riesgo de complicaciones sépticas o la necesidad de requerir un drenaje percutáneo o intervención quirúrgica es elevado. Por tanto, en estos casos la comunicación estrecha y un trabajo conjunto coordinado resultan esenciales para mejorar el pronóstico de estos pacientes.
RecomendaciónTodos los pacientes con lesiones fistulizantes deben ser priorizados y valorados dentro de una unidad multidisciplinar. Esto proporcionará una visión global pero también detallada del paciente, pudiendo de esta manera individualizar e integrar tanto la visión médica como quirúrgica.
Enfermedad fistulizante «simple»Tratamiento médico con inmunomoduladoresa. TiopurinasEl papel de las tiopurinas (azatioprina y mercaptopurina), así como el de otros inmunosupresores, en el tratamiento de la EC fistulizante no perianal ha sido poco estudiado en ensayos clínicos85-88. No hay estudios prospectivos con estos fármacos que hayan evaluado específicamente pacientes con este tipo de complicaciones. Solo disponemos de datos que proceden de estudios que incluyen pacientes con ambos tipos de fístulas (perianal y luminal) o de series con un número limitado casos. A pesar de la evidencia limitada en monoterapia, se ha observado que su uso combinado con biológicos, independientemente del tipo, parece aportar un beneficio al reducir la probabilidad de cirugía en la EC fistulizante, probablemente por aumentar los niveles del fármaco biológico, especialmente con infliximab, o por generar un efecto sinérgico beneficioso cuando existe un proceso inflamatorio intestinal más grave89.
En las fístulas entero-entéricas, entero-cólicas, gastro-entéricas o gastro-cólicas, las tiopurinas han demostrado utilidad, aunque las tasas de respuesta (parcial o completa) descritas son muy variables, del 0 al 100%, y con estudios con un tamaño muestral muy pequeño (en general, menos de 10 pacientes)87. En una revisión sistemática de siete estudios que incluyeron un total de 14 fístulas de pacientes tratados con tiopurinas, el 65% mostraron una respuesta (43% de forma parcial y 22% completa)87,88. Dentro de las fístulas entero-vesicales, las tiopurinas en combinación o no con antibióticos en 99 fístulas produjeron una respuesta global en el 39% de los casos (15% parcial y 24% completa)87,88. Para las fístulas recto-vaginales, las tiopurinas han mostrado cierta utilidad, con una tasa de respuesta global del 50% (42% parcial, 8% completa) en base a una experiencia limitada en 12 casos90,91.
b. AnticalcineurínicosLa ciclosporina se ha evaluado principalmente en el manejo de las fístulas recto-vaginales. En este contexto ha demostrado ser muy eficaz durante la fase de inducción, con un 89% de mejoría (45% parcial, 45% completa)92,93. Desafortunadamente, las tasas de recidiva son elevadas (38% de todas las pacientes que respondieron), incluso con el uso simultáneo de otros inmunomoduladores, lo que podría justificarse en parte por los bajos niveles de ciclosporina durante la fase de mantenimiento92.
Existe también información procedente de ensayos clínicos94 y de su uso en la práctica clínica95,96 que muestran datos favorables con el uso de tacrolimus en la enfermedad fistulizante a nivel perianal. De forma similar a la ciclosporina, tacrolimus también ha mostrado resultados prometedores en las fístulas recto-vaginales, con una tasa de respuesta global del 75% (25% parcial y 50% completa), aunque en series muy limitadas de pacientes97,98. En cambio, la información disponible sobre su uso en fístulas internas es anecdótica, limitándose a una serie de casos con cuatro pacientes con fístulas internas tratados con tacrolimus y aminosalicilatos, en la que se observó una mejoría, en algún caso incluso tras haber sido también refractarios a infliximab99.
RecomendacionesNo recomendamos el uso de fármacos inmunomoduladores como terapia de primera elección en la enfermedad fistulizante. El uso de las tiopurinas en monoterapia no se recomienda, mientras que los inhibidores de calcineurina podrían considerarse en casos seleccionados como terapia puente o en ausencia de otras alternativas.
Inhibidores de JAKRespecto a las fístulas entero-cutáneas, no hay estudios que evalúen la eficacia de los inmunosupresores clásicos para su tratamiento, pero se está evaluando el uso de inhibidores JAK en esta indicación. Un subanálisis de los estudios de registro de upadacitinib, incluyendo un número muy limitado de pacientes con fístulas entero-cutáneas, muestra que este fármaco es más efectivo que el placebo especialmente en la enfermedad fistulizante perianal, logrando la resolución completa del drenaje en casi la mitad de los casos después de la inducción y manteniéndolo en aproximadamente el 18% de los pacientes a las 52 semanas100.
RecomendacionesLos inhibidores JAK como upadacitinib han mostrado resultados prometedores en las complicaciones fistulizantes, principalmente en la enfermedad fistulizante perianal, por lo que podrían considerarse en el futuro como una alternativa válida en caso de fracaso al tratamiento biológico, aunque la evidencia en otros tipos de fístulas es aún muy limitada.
BiológicosLas terapias biológicas, y en particular los fármacos anti-TNF, son las terapias médicas con una mayor evidencia de eficacia en la EC fistulizante no perianal. Estas lesiones, al considerarse una forma más evolucionada de la EC, deben tratarse dentro de una estrategia top-down o más intensiva, dado que el riesgo de complicaciones y de progresión de la enfermedad es elevado. Sin embargo, los datos publicados que confirman la eficacia de los biológicos también revelan que es necesaria la combinación de diferentes terapias médicas y, aun así, en muchas ocasiones no puede evitarse la cirugía.
Un estudio retrospectivo y observacional francés evaluó la eficacia de los agentes anti-TNF en 156 pacientes con enfermedad fistulizante interna (43% entero-entérica, 4% entero-vesical, 41% con absceso asociado y el 29% con trayectos múltiples). Tras 1, 2 y 5años de seguimiento, el 83%, el 64% y el 51% de los pacientes seguían libres de cirugía, respectivamente. Además, estos autores observaron que la proporción de pacientes que lograban cerrar la fístula aumentaba progresivamente durante el tratamiento (15%, 32% y 44%, respectivamente)101. Sin embargo, en un estudio posterior realizado en Japón en una cohorte de 93 pacientes con enfermedad penetrante (77% entero-entérica o entero-colónica, 17% entero-vesical y 5% entero-vaginal) tratados también con anti-TNF, la tasa de cierre de las fístulas a los 5años era algo menor (27%), con una tasa de cirugía similar (47%)102. La serie que hasta la fecha ha proporcionado más evidencia en este contexto procede del registro ENEIDA, en donde se pudieron analizar 760 pacientes (51% entero-entéricas, 30% entero-cólicas) que habían recibido diferentes fármacos biológicos, en su mayoría anti-TNF (88%), pero también hay datos con el uso de otras dianas de tratamiento89. Entre los pacientes tratados con agentes anti-TNF, aproximadamente un tercio (32%) requirieron cirugía. De forma global, se observó una reducción del número de trayectos fistulosos o el cierre de la fístula en el 31% de los pacientes, mientras que en el 11% de los casos se observaron nuevos trayectos o un empeoramiento de los que ya estaban presentes al inicio del tratamiento. En el 24% de los pacientes los trayectos fistulosos se cerraron tras una media de 15meses de tratamiento biológico, sin diferencias entre los distintos fármacos, disminuyendo significativamente esta probabilidad pasados más de 2años de tratamiento89.
La evidencia con dianas diferentes a anti-TNF sigue siendo limitada para esta indicación. Dentro del estudio BIOSCOPE, la tasa de cirugía entre los pacientes tratados con vedolizumab o ustekinumab fue del 41% y del 24%, respectivamente89. Al comparar los resultados entre las diferentes dianas, la probabilidad acumulada de permanecer libre de cirugía a 1, 3 y 5años de seguimiento fue del 81%, del 72% y del 67% para anti-TNF, del 82%, del 70% y del 70% para ustekinumab, y del 73%, del 64% y del 64% para vedolizumab, respectivamente. Los datos de otro estudio retrospectivo que comparó la eficacia de vedolizumab y ustekinumab también muestran que ustekinumab podría ser una mejor opción en la enfermedad fistulizante refractaria a anti-TNF103. Esta misma tendencia se ha observado en un estudio canadiense posterior que ha analizado la eficacia de ustekinumab en ambas formas fistulizantes (perianal y abdominal), confirmando la eficacia a largo plazo de este fármaco observada en series previas104.
En los casos de enfermedad fistulizante complicada con abscesos, los datos preliminares han mostrado que la terapia anti-TNF podría ser una opción adecuada105, siendo posteriormente confirmados con los datos del estudio prospectivo MICA, que evaluó la efectividad de adalimumab en este contexto106. Los resultados muestran que el 74% de pacientes sin exposición previa a biológicos pueden beneficiarse del tratamiento con adalimumab tras 24semanas, definiendo este éxito como la ausencia de corticoides tras la semana12, recurrencia del absceso, resección intestinal, recidiva clínica y elevación de PCR106. Cabe destacar que en esta cohorte (n=117) la mayoría de los abscesos afectaban al íleon terminal (90%), eran únicos (81%), se localizaban en fosa ilíaca derecha o pelvis (45% y 37%, respectivamente) y tenían un tamaño medio de 29mm. A pesar de estas características, es destacable que únicamente el 9% de abscesos fueron drenados, no realizándose principalmente por el pequeño tamaño, seguido de la dificultad de acceso. A pesar de que el tamaño del absceso no se relacionó con una menor eficacia del tratamiento, el drenaje y la duración de la enfermedad tenían un impacto negativo, mientras que los cambios inflamatorios en la grasa mesentérica se relacionaron con mejores resultados.
De forma global, en el resto de los estudios que han evaluado los factores predictivos de respuesta en la enfermedad fistulizante, parece que los pacientes con una enfermedad menos extensa, un menor número de fístulas y una carga inflamatoria menos marcada muestran mejores resultados. Por el contrario, los pacientes con lesiones más complejas, incluyendo un mayor número de trayectos fistulosos o complicaciones adicionales, como abscesos o estenosis distales, tienen una mayor probabilidad de requerir cirugía89,101. En el estudio BIOSCOPE se observó además que el uso de inmunosupresores concomitantes a los anti-TNF podía mejorar los resultados y reducir el riesgo de cirugía, mientras que el hábito tabáquico empeoraba el pronóstico89.
Existen otras formas fistulizantes, como son las fístulas entero-cutáneas, donde, si bien la cirugía suele tener el papel predominante, los fármacos biológicos también pueden tener algún papel. Aunque los datos hasta ahora han sido limitados, una cohorte de GETAID incluyó a 48pacientes que recibieron fármacos biológicos anti-TNF, en su mayoría infliximab. El cierre de la fístula se consiguió en un tercio de los casos a los 3meses de tratamiento, y en el 17% al final del seguimiento; pero a pesar de este beneficio, alrededor de la mitad de los pacientes (54%) precisaron una intervención quirúrgica tras una mediana de 16meses107. En una cohorte similar en nuestro entorno se describieron tasas de respuesta más bajas tras el tratamiento con infliximab o adalimumab (13%), con un 46% de pacientes que precisaron tratamiento médico-quirúrgico108. El estudio ECUFIT, realizado también en el seno del registro ENEIDA, evaluó el manejo y el pronóstico de las fístulas entero-cutáneas con una tasa global de cirugía del 69%, logrando la mayoría de los pacientes el cierre de la fístula gracias a una intervención quirúrgica53. No obstante, un subgrupo de pacientes puede beneficiarse del tratamiento médico, fundamentalmente fármacos anti-TNF. Excluyendo los pacientes sometidos a cirugía inmediata, aproximadamente una tercera parte de los pacientes consiguen una curación completa de este tipo de lesiones complicadas gracias al tratamiento biológico.
En cuanto a las fístulas entero-genitales, un estudio de GETAID analizó la eficacia de los fármacos anti-TNF en 131 pacientes, reportándose los resultados tras un año de tratamiento, donde el 37% de los pacientes presentaron un cierre clínico completo de la fístula, el 22% una respuesta parcial y el 41% ninguna respuesta109. Existe todavía una menor evidencia sobre el uso de los biológicos en las fístulas entero-urinarias: una pequeña serie multicéntrica que evaluó 33pacientes tratados con anti-TNF observó que el 45% de pacientes alcanzaba una remisión sostenida sin necesidad de cirugía tras un plazo aproximado de 3años110.
RecomendaciónLos agentes anti-TNF son el tratamiento biológico de elección en las complicaciones fistulizantes, mientras que los datos con otras dianas son aún muy limitados. Recomendamos las estrategias de tratamiento biológico combinado con tiopurinas, especialmente en aquellas basadas en anti-TNF. Alternativamente, el uso de ustekinumab es una alternativa adecuada en estos casos.
Manejo de los abscesos y complicaciones sépticasa. Tratamiento médicoLa presencia de un absceso intraabdominal asociado a una EC fistulizante representa un reto terapéutico, ya que supone la combinación de un cuadro séptico simultáneo a un proceso inflamatorio. Esta actividad inflamatoria necesitará en algún momento el inicio de un tratamiento inmunosupresor o biológico, pero la presencia de una complicación infecciosa supondrá una contraindicación al menos relativa hasta que esta no se encuentre controlada.
Para ello, será necesario tener en cuenta factores como la disponibilidad de medios para el control de la infección, la localización y la accesibilidad del absceso para realizar un drenaje percutáneo, el estado general del paciente, la comorbilidad y el riesgo quirúrgico, así como la historia previa de la propia EC. Uno de los factores fundamentales que van a condicionar la estrategia de tratamiento será el tamaño del absceso. Las guías de Sociedad Mundial de Cirugía de Urgencias (WSES) sobre tratamiento de abscesos asociados a diverticulitis sitúa en los 4-5cm el punto de corte para optar por un manejo intervencionista111. Aunque estos datos se obtienen de una patología diferente a la enfermedad inflamatoria intestinal, son las únicas guías que establecen recomendaciones acerca del manejo en función del tamaño del absceso, ya que no existen indicaciones al respecto en las últimas guías de la ECCO73. En otro estudio del registro ENEIDA ha podido comprobarse que el tratamiento antibiótico puede ser equivalente a las técnicas intervencionistas en abscesos de menos de 30mm, mientras que, por encima de los 50mm, la tasa de resolución completa con cirugía es superior a las demás opciones (79% para la cirugía, 31% para el drenaje radioguiado y 26% para la antibioterapia)72.
En la práctica, el primer paso debe ser un adecuado control del foco infeccioso mediante el empleo de antibióticos intravenosos de amplio espectro. Existen muy pocos datos acerca de esta situación en concreto, por lo que muchas actuaciones derivan de la evidencia proveniente de abscesos intraabdominales asociados a diverticulitis aguda o a complicaciones posquirúrgicas. Los abscesos intraabdominales son casi siempre polimicrobianos, siendo los microorganismos más frecuentemente aislados Escherichia coli, Streptococcus spp., Enterococci, Candida y anaerobios112,113, siendo algo menos frecuente el aislamiento de enterobacterias en pacientes que reciben corticoides113 y pudiendo observar hasta en un 7,6% microorganismos multirresistentes112, por lo que es necesario utilizar regímenes antibióticos con cobertura de amplio espectro. Aunque no existen ensayos clínicos específicamente diseñados para este escenario en particular, la pauta debe cubrir principalmente la familia Enterobacteriaceae, cocos grampositivos y anaerobios114. La pauta que en general se ha asociado a una mayor efectividad en lograr la resolución de los abscesos en EC es la combinación de ciprofloxacino (400mg/12horas) y metronidazol (500mg/8horas), observando peores resultados con otros regímenes basados en carbapenem (OR: 0,40; IC95%: 0,20-0,77) o en piperacilina-tazobactam (OR: 0,47; IC95%: 0,23-0,96)72. Teniendo en cuenta toda la evidencia, la Surgical Infection Society recomienda monoterapia con ertapenem o moxifloxacino, o el uso de cefotaxima/ceftriaxona o ciprofloxacino junto con metronidazol en aquellos pacientes menos graves (recomendación grado 1A). Los regímenes con piperacilina-tazobactam, imipenem-cilastatina, meropenem, cefepima junto con metronidazol se recomiendan como terapia empírica para pacientes más graves (recomendación grado 1A), utilizando aztreonam con metronidazol y vancomicina en caso de alergia a betalactámicos114. En aquellos pacientes graves que no reciban piperacilina-tazobactam o imipenem-cilastatina debería considerarse la cobertura de enterococos y añadir en ellos tratamiento con ampicilina o vancomicina114.
De forma general, para todos ellos se recomienda iniciar el tratamiento por vía intravenosa, y la duración recomendada en este escenario es de al menos 4semanas111. El cambio de la posología a vía oral en el momento del alta no se relaciona con una mayor tasa de cirugía en comparación con la intravenosa, y eso podría hacerse con una transición a amoxicilina-ácido clavulánico, ciprofloxacino con metronidazol, moxifloxacino, cefalosporina con metronidazol o trimetoprim-sulfametoxazol también con metronidazol114. No obstante, la vía intravenosa parece asociarse a menores tasas de reingreso115, por lo que el uso de la vía oral se debería individualizar y ser una opción especialmente en aquellos pacientes menos graves.
RecomendaciónLos pacientes con abscesos intraabdominales deben recibir antibioterapia por vía intravenosa, siendo de elección el uso de ciprofloxacino combinado con metronidazol, aunque con alternativas como la combinación de cefalosporinas y metronidazol o la monoterapia con piperacilina-tazobactam o carbapenemes. La duración del tratamiento debe ser de al menos 4semanas, pudiendo secuenciarse a vía oral de cara al alta, especialmente en los pacientes menos graves y con una respuesta adecuada a la pauta intravenosa.
b. Manejo radiológicoAdemás del tratamiento de soporte inicial y la antibioterapia indicada en la sección anterior, los pacientes con este tipo de complicaciones deben discutirse dentro de un entorno multidisciplinar64. En función de las características del absceso podrá considerarse la necesidad de un drenaje percutáneo como tratamiento principal o como puente a una intervención quirúrgica, que debe realizarse de forma personalizada atendiendo a las características del paciente, a la situación clínica y a las lesiones inflamatorias. La posibilidad de realizar un drenaje percutáneo guiado por imagen representa una alternativa mínimamente invasiva al drenaje quirúrgico que ha demostrado ser efectiva en la resolución de las colecciones abdominales o pélvicas que se desarrollan tanto en el contexto de un brote de actividad inflamatoria luminal, como por complicaciones postoperatorias57,64,116-118, aunque algunas series han descrito mayor riesgo de estoma si no se acompaña de una intervención posterior119. Es necesaria una coordinación estrecha entre los diferentes equipos, ya que en aquellos pacientes en los que se plantea el drenaje percutáneo como puente a una intervención, esta parece tener peores resultados (en términos de recurrencia del absceso) en aquellos en los que se realizan ambas en un período corto (<2semanas)120.
El drenaje percutáneo de las colecciones guiado por imagen puede realizarse mediante TC o ecografía. La decisión de utilizar una técnica u otra depende de la experiencia del radiólogo y de la disponibilidad de la técnica, así como de la localización de las colecciones. En general, la ecografía se reserva para las colecciones más superficiales, ya que evita utilizar radiaciones ionizantes, así como en pacientes pediátricos121-123, mientras que la TC se utiliza para guiar el drenaje de colecciones profundas abdominales o pélvicas, ya que dicha técnica permite una mejor visualización tanto de los límites de estas colecciones como del extremo del drenaje124.
En general, la colocación de un drenaje percutáneo guiado por técnicas de imagen se considera un procedimiento de riesgo moderado125. La evaluación específica del riesgo de hemorragia y las consideraciones del uso de hemoderivados u otros agentes hemostáticos deben individualizarse en función del paciente. Para llevarlo a cabo de forma segura, se recomienda que el valor de INR sea inferior a 1,5 y considerar transfusión de plaquetas antes del procedimiento en caso de un valor de plaquetas inferior a 50.000126.
En el informe del procedimiento es importante indicar el calibre del drenaje utilizado, la posición del extremo distal del drenaje dentro de la cavidad, el volumen de contenido aspirado, si se ha remitido material para análisis microbiológico112,113, así como indicaciones post-procedimiento, como son las necesidades de realizar lavados con suero en caso de contenido muy espeso. La complicación más frecuente reportada en la literatura derivada del mismo es el dolor local, aunque la principal complicación mayor es el sangrado por lesión de vasos que rodean la colección o estén en el trayecto de colocación del drenaje127. Las principales complicaciones del procedimiento suelen aparecer durante las primeras horas post-procedimiento, por lo que es recomendable realizar una monitorización de estos pacientes y disponer de entornos asistenciales donde se pueda controlar a los pacientes y actuar de forma adecuada en caso de complicaciones.
Cuando la colección no es accesible al drenaje percutáneo, se puede recurrir a la intervención endoluminal (por ejemplo, transgástrica), aunque estos procedimientos suelen requerir un alto nivel de especialización y, por lo tanto, su uso no está generalizado.
RecomendaciónEl drenaje percutáneo de abscesos guiado por ecografía o TC debe indicarse en aquellas lesiones mayores de 30mm, mientras que en las mayores de 50mm la cirugía ofrece mejores resultados. La elección de esta estrategia como tratamiento único o como puente a una intervención debe individualizarse en función del paciente y de la historia previa de la enfermedad. Si se sigue de una intervención, esta se debe realizar de forma semielectiva en un plazo de al menos 2semanas.
Manejo quirúrgico de la enfermedad de Crohn fistulizante abdominala. Estudios preoperatorios y optimización del pacienteComo se mencionó previamente en la sección «Manejo de los abscesos y complicaciones sépticas», los pacientes con EC deben ser estudiados detalladamente y por un equipo multidisciplinar ya antes de indicarse una cirugía, de manera que en el momento que se lleve a cabo la intervención el paciente se encuentre en el mejor estado general posible desde todos los puntos de vista. Esta optimización mejorará los resultados de todo el proceso, incluyendo la recuperación del paciente. Dentro de este proceso de optimización, consideramos importante destacar:
- -
Evaluación del estado nutricional, considerando la necesidad de realizar una terapia de suplementación ya sea por vía enteral o parenteral128.
- -
La optimización debe ser multidimensional, pudiendo ser de utilidad ofrecer un contacto con pacientes que presenten la misma enfermedad antes de una cirugía129.
- -
En caso de presentar el paciente exposición a corticoterapia prolongada (>20mg/día de prednisolona por más de 6semanas)73, evaluar la posibilidad de realizar una retirada progresiva, ya que dicho tratamiento crónico ha sido asociado a un aumento de la morbilidad del tratamiento quirúrgico130.
- -
Control de la sepsis asociada a colecciones abdominales secundarias a enfermedad penetrante, lo cual nos permitirá contemporizar la situación clínica del paciente y así diferir la cirugía hasta que el paciente se encuentre en la mejor condición posible73,131. El adecuado drenaje de los abscesos permitirá evitar la cirugía urgente en un número importante de pacientes73.
- -
La realización de estudios de imagen seccional (entero-TC o entero-RM) es de vital importancia para planear la cirugía. Estos estudios están orientados a diagnosticar la presencia de enfermedad estenosante asociada, así como el número y el tipo de fístulas en los distintos segmentos del intestino (proximal y distal), y estos deben ser interpretados por médicos con experiencia en la lectura de imágenes de pacientes con EC (ver sección «Evaluación radiológica de la enfermedad penetrante»).
- -
La utilización de un protocolo ERAS(Enhanced Recovery After Surgery) en este tipo de pacientes podría ser beneficioso, aunque todavía faltan estudios para confirmar dicha utilidad132.
La indicación más frecuente de cirugía en EC abdominal son las complicaciones de la propia enfermedad (estenosis y/o fistulas), las cuales pueden asociarse a grandes masas inflamatorias que involucran segmentos de colon e intestino delgado con colecciones intermedias asociadas. Todo esto genera una distorsión de los planos quirúrgicos (embriológicos) que habitualmente se utilizan para realizar este tipo de intervenciones. En el caso de optar por un abordaje laparoscópico, siendo las fístulas de la región íleo-cecal a otros órganos las más frecuentes, se colocarán con más frecuencia trócares simulando el abordaje de una colectomía derecha estándar, según el hábito del cirujano. Es importante efectuar una exploración completa del abdomen, que es más fácil con laparoscopia y se puede grabar, describiendo todas las lesiones identificadas de forma detallada y adquiriendo imágenes cada vez que sea posible, para facilitar la interpretación de los hallazgos de cara a una nueva cirugía, complicaciones, tratamiento postoperatorio, etc.133. Es fundamental, además, explicar detalladamente y con claridad cada procedimiento que se ha llevado a cabo, de forma estructurada134.
Por todo esto, la presencia de grandes masas inflamatorias, que en ocasiones incluyen órganos tan diversos como intestino delgado proximal, íleon terminal, colon derecho y colon sigmoide, entre otros, puede influir en que el cirujano no opte por un abordaje mínimamente invasivo. Sin embargo, de forma general el abordaje laparoscópico es de elección en este tipo de pacientes, cualquiera que sea el escenario73. Esto ha sido ampliamente descrito en la bibliografía135,136, y depende principalmente de la experiencia del grupo quirúrgico para poder realizar la cirugía por esta vía.
RecomendaciónSe recomienda el abordaje mínimamente invasivo cuando se considere una intervención quirúrgica por una EC fistulizante compleja, siendo preferible la vía laparoscópica, siempre que sea técnicamente posible.
c. Resección ileocecal por EC fistulizanteLa afectación del área ileocecal es la más frecuente en la EC, y puede asociarse a trayectos fistulosos que involucren otros órganos11. En base al compromiso transmural que implica que el meso intestinal y, por tanto, la cara mesentérica, se encuentre afectada por la enfermedad (a diferencia de la colitis ulcerosa), esto hace más factible encontrar un plano de disección respetado a nivel lateral (cara anti-mesentérica) (fig. 3). De esta manera, la actitud más recomendable para el abordaje de este tipo de pacientes consiste en movilizar en bloque de lateral a medial, y realizar esta movilización en bloque con cualquier segmento de intestino delgado que pudiera estar adherido al íleon terminal-ciego, técnica que ha sido propuesta por diferentes grupos137,138. Se recomienda además prestar especial atención a la correcta identificación y liberación del duodeno del plano de disección, ya que este puede encontrarse involucrado dentro de la masa inflamatoria. Otros grupos, sobre todo aquellos que realizan anastomosis intracorpóreas, realizan esta maniobra con instrumentos de energía. A la hora de realizar la ligadura vascular y del meso intestinal, nuevamente debemos considerar que la EC está asociada a un compromiso transmural que provoca un efecto de inflamación del mismo, asociándose a un mayor riesgo de sangrado postoperatorio. Por esta razón, la ligadura del meso intestinal se puede realizar a nivel extracorpóreo, con puntos de sutura reabsorbible con la finalidad de prevenir dicho sangrado postoperatorio. Por otro lado, otros grupos, sobre todo aquellos que realizan anastomosis intracorpórea, realizan dicha ligadura de forma laparoscópica utilizando elementos de energía (Ligasure™, bisturí armónico, etc.).
RecomendaciónEl abordaje lateral para pacientes con EC ileocecal fistulizante podría presentar una ventaja sobre el abordaje medial. Se debe prestar particular atención a la preservación del duodeno y a realizar una adecuada ligadura de los vasos sanguíneos para prevenir hemorragias postoperatorias.
d. Realización de minilaparotomía y ostomíaA la hora de realizar una laparotomía, ya sea para convertir la cirugía de mínimamente invasiva a convencional o bien habiendo comenzado la cirugía por vía abierta, nuestra sugerencia es la de realizar laparotomías en estos casos siempre a nivel de la línea media. En pacientes con EC, el objetivo de esta recomendación es proteger áreas de la pared intestinal en las que pueda ser necesario ubicar una posible ostomía. Debemos recordar aquí el curso crónico de la EC y la probabilidad de cirugías repetidas en algunos pacientes a lo largo de la vida. En el caso de necesitarse una ostomía, se recomienda también que estas sean realizadas cercanas a la línea media, de preferencia a nivel de los músculos rectos del abdomen.
e. Actitud frente a la realización de una ostomíaEn el apartado «Nutrición» de la sección «Aproximación inicial y perspectiva de manejo multidisciplinar» se ha desarrollado con detalle la situación del déficit nutricional y las consecuencias de la EC fistulizante, a lo que debe sumarse que en muchas ocasiones estos pacientes son operados en contextos de urgencia, sin un margen suficiente para una conseguir optimización ideal, y a lo que debe sumarse que pueden encontrarse bajo corticoterapia durante un tiempo prolongado previo a la intervención. Todo esto impacta en la decisión que debe tomar el cirujano de realizar una anastomosis primaria o de plantear una ostomía, y que debe ser tomada previamente a la cirugía, basando la misma en todos los parámetros y considerando tanto los aspectos médicos como quirúrgicos revisados en este documento. Dentro de estos factores debemos incluir algunos como la presencia de anemia, hipoalbuminemia o hipoproteinemia, o la incapacidad de una reducción adecuada (idealmente por debajo de los 20mg/día de prednisolona73) o completa de la dosis de corticoides, que deben hacernos pensar en realizar una ostomía transitoria.
Cuando la cirugía se indica por una EC fistulizante limitada a la región íleo-cecal, en el caso de decidir no realizar una anastomosis primaria, debe tenerse en cuenta que el cabo distal de colon transverso no se comporta como lo hace normalmente en aquellos pacientes que son operados por otras urgencias que impiden la realización de una anastomosis primaria. Esta consideración se realiza más por el mal estado general del paciente que por la enfermedad en sí, ya que el colon transverso no suele mostrarse afectado. Por todo lo discutido hasta este punto, sugerimos que dicho cabo distal no sea abandonado en la cavidad abdominal, pudiendo ser susceptible de sufrir una dehiscencia de la sutura, con las consecuencias que esto tiene, sino abocado hacia el exterior junto con la ileostomía o colocado en el tejido celular subcutáneo (maniobra que, además, facilitará una posterior reconstrucción del tránsito) (fig. 4).
Imagen ilustrando la confección de una ileostomía en un paciente operado por EC fistulizante en el cual el cabo distal de colon se aboca al tejido celular subcutáneo, previniendo complicaciones si este se abre durante el postoperatorio, y a su vez facilitando la posterior cirugía de reconstrucción del tránsito intestinal en un segundo tiempo.
En el caso de una laparotomía, esta debería plantearse próxima a la línea media y teniendo en cuenta la probabilidad de intervenciones repetidas. En los pacientes con una resección íleo-cólica y que no se realice una anastomosis primaria, se recomienda que el extremo distal colónico se aboque a una ostomía o al tejido celular subcutáneo.
f. Tratamiento de fístulas íleo-sigmoideasCon relativa frecuencia, pacientes con EC avanzada presentarán trayectos fistulosos entre el íleon distal y el sigma. El tratamiento de esta situación tiene algunos aspectos particulares que deben ser considerados. Primero, se debe aclarar que, habitualmente, estas fistulas suelen ser secundarias a enfermedad ileal y no a afectación a nivel del colon, por lo cual el tratamiento en el sigma puede y debe ser lo más conservador posible. Teniendo en cuenta este precepto, en pacientes sin actividad en el sigma, el tratamiento de elección para la fistula vendrá condicionado por la ubicación del trayecto fistuloso. En pacientes con trayecto fistuloso que afecta el borde anti-mesentérico sería recomendable realizar un desbridamiento y rafia simple asociado a la resección íleo-cecal (considerando en estos pacientes preparación colónica). En cambio, en pacientes con trayecto fistuloso en el borde mesentérico recomendamos realizar una sigmoidectomía y anastomosis primaria asociada a la resección íleo-cecal.
g. Tratamiento de las fístulas entero-cutáneasDentro de las lesiones fistulizantes, este tipo de fístulas comprenden lesiones complejas que afectan a la pared abdominal, por lo que, independientemente de la causa, el abordaje de este tipo de complicaciones siempre requiere un equipo multidisciplinar, incluyendo cirujanos, enfermeras, radiólogo intervencionista, gastroenterólogo, nutricionista y estomaterapeutas40,139. Lo primero que se debe hacer ante una fístula entero-cutánea es categorizarla según el débito diario de la fístula, pudiendo ser de bajo (menos de 200ml/día), moderado (200-500ml/día) o alto débito (más de 500ml/día)139. Una vez categorizada la fístula, esta debe ser adecuadamente caracterizada utilizando pruebas de imagen que sean interpretadas por un radiólogo con experiencia, ya que esto permitirá determinar la complejidad de la lesión, la presencia de complicaciones locales (flemón o absceso asociados) o estenosis, así como los segmentos de intestino involucrados, y si en estos se observan cambios inflamatorios o su relación con la anastomosis quirúrgica.
Al tratar pacientes con fístulas entero-cutáneas, el manejo inicial incluye la resucitación con fluidos, el manejo médico de cualquier desequilibrio del medio interno que exista, y a su vez, se puede considerar reducir el débito de la fístula con medicación (inhibidores de la bomba de protones, loperamida, somatostatina, octreótido, lanreótido)140. La nutrición por vía enteral (preferida) y/o parenteral también juega un papel fundamental.
En algunos casos con fístulas entero-cutáneas proximales de alto débito, el uso de «fistuloclisis» puede ser una alternativa que asegure una nutrición adecuada. Este procedimiento consiste en utilizar el orificio de la fístula para administrar la alimentación enteral directamente, y ha sido reportado con éxito en algunas series141. Independientemente del procedimiento, en todos los casos se deberá hacer un seguimiento estrecho del recuento calórico diario y del estado nutricional por un equipo especializado, para adecuar así el aporte suplementario de forma individualizada.
El cierre de la fístula se logra en la mayoría de casos (84%), consiguiéndose habitualmente mediante cirugía53. De todas formas, en algunos casos el manejo conservador podría ser suficiente y alcanzar el cierre espontáneo de la fístula142. Es más probable que este cierre se consiga en las fístulas espontáneas y/o con bajo débito, pero la disponibilidad de los tratamientos biológicos ha cambiado el manejo de estas complicaciones en las últimas décadas, según se ha revisado ya en secciones previas53. Algunos de estos pacientes, especialmente aquellos sin un foco séptico activo, con candidatos al uso de fármacos biológicos, principalmente anti-TNF53,107,108, especialmente en pacientes con actividad inflamatoria activa secundaria a la enfermedad107,108. La probabilidad de cierre de estas fístulas ha aumentado significativamente en los últimos años, pero el uso o la combinación de una aproximación quirúrgica con un tratamiento biológico deben realizarse dentro de una evaluación individualizada y en equipos multidisciplinares53,107.
También se ha ensayado la terapia con células madre mesenquimales, las cuales se inyectan localmente en el sitio de la fístula y promueven el cierre de la misma143. Por último, la mayoría de los pacientes requerirán una intervención quirúrgica como tratamiento definitivo de este tipo de fístulas. Previo a esto, se debería optimizar al paciente, controlar la sepsis y asegurar que el estado nutricional sea adecuado. Debido a la complejidad de estos casos, estas cirugías deberían ser realizadas en centros con experiencia en el manejo de este tipo de lesiones.
RecomendaciónEl tratamiento de las fístulas íleo-sigmoideas y entero-cutáneas representa un desafío tanto para clínicos como para cirujanos. En todos los casos, el abordaje multidisciplinar, realizado preferentemente en centros con experiencia, debe incluir un énfasis especial en la adecuada estadificación de la enfermedad y la optimización preoperatoria de los pacientes, lo que podría asociarse a mejores resultados de forma global.
ConclusionesLa EC fistulizante es una complicación frecuente a lo largo de la historia natural de la enfermedad. A pesar de que el diagnóstico y el manejo de la enfermedad han mejorado considerablemente en las últimas décadas, este hallazgo sigue constituyendo un reto tanto diagnóstico como terapéutico. Esto se debe a los diferentes tipos y a la complejidad de las fístulas, que, junto con la historia previa de la enfermedad y la evaluación en el momento del desarrollo de la complicación fistulizante, van a condicionar la aproximación mediante tratamiento médico, drenaje percutáneo o cirugía. Por tanto, el manejo de las complicaciones fistulizantes exige una colaboración estrecha entre diferentes especialidades, ya que en la mayoría de ocasiones el éxito del tratamiento va a requerir una combinación de medidas dirigidas al control tanto de la sepsis como de la actividad inflamatoria, así como del estado nutricional del paciente con el objetivo de mejorar el pronóstico de la enfermedad a largo plazo.
FinanciaciónIRL recibe financiación a través de una beca del Gobierno Vasco-Eusko Jaurlaritza (N.o 2020111061 y 2023222006).
Conflicto de interesesIRL ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Adacyte, Alfasigma, Biogen, Chiesi, Faes Farma, Ferring, Fresenius Kabi, Galapagos, Johnson&Johnson, Eli Lilly, Mirum Pharmaceuticals, Merck, Pfizer, Roche, Takeda y Tillotts Pharma; financiación para investigación por parte de AbbVie.
DCD ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Chiesi, Ferring, Faes Farma, Janssen, Takeda y Tillotts Pharma.
JR ha recibido financiación para participar en actividades formativas o como consultor para Takeda, Ferring, Agomab, Boehringer Ingelheim, Alimentiv, Lument, Gilead; financiación para investigación por parte de AbbVie.
MC ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Adacyte, Chiesi, Ferring, Janssen, Takeda, Tillotts Pharma, Pfizer, Kern, Gilead y Dr. Falk.
RFI ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Adacyte, Chiesi, Casenrecordati, Falk, Ferring, Faes Farma, Janssen, Kern, MSD, Pfizer, Shire Pharmaceuticals, Roche, Takeda y Tillotts Pharma.
MI ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Chiesi, Janssen, Kern, MSD, Pfizer, Eli Lilly y Takeda.
MBA ha recibido financiación para acudir o participar en actividades formativas o como consultor para Pfizer, MSD, Takeda, AbbVie, Kern, Janssen, Fresenius Kabi, Galapagos, Alfasigma, Eli Lilly, Tillotts Pharma, Faes Farma, Chiesi y Adacyte.
AGC ha recibido financiación para acudir o participar en actividades formativas o como consultor para Pfizer, MSD, Takeda, AbbVie, Kern, Janssen, Fresenius Kabi, Galapagos, Alfasigma, Eli Lilly, Tillotts Pharma, Faes Farma, Chiesi y Adacyte.
LM ha recibido financiación para acudir o participar en actividades formativas, como consultor o ha recibido financiación para investigación por parte de MSD, AbbVie, Takeda, Janssen, Pfizer, Biogen, Galapagos, Kern Pharma, Eli Lilly, Otsuka Pharmaceuticals, Tillotts, Dr. Falk Pharma, Ferring, Medtronic y General Electric.
IO ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Pfizer, Takeda, Janssen, Kern Pharma y Faes Farma; ha recibido financiación para investigación por parte de AbbVie y Faes Farma.
FRM ha recibido financiación para acudir o participar en actividades formativas o como consultor para AbbVie, Johnson&Johnson, Kern Pharma, Pfizer, Eli Lilly, Takeda, Ferring, Faes Farma, Tillotts Pharma y Dr. Falk Pharma.
YZ ha recibido apoyo para asistencia a conferencias, honorarios como ponente, apoyo para investigación y honorarios de consultoría de AbbVie, Adacyte, Alfasigma, Almirall, Amgen, Boehringer Ingelheim, Dr. Falk Pharma, Faes Pharma, Fresenius Kabi, Ferring, Galapagos, Janssen, Johnson&Johnson, Kern, Lilly, MSD, Otsuka, Pfizer, Sanofi, Shire, Takeda y Tillotts Pharma.
GP y NA declaran no tener conflictos de intereses relacionados con este trabajo.