A pesar de los avances farmacológicos, la estenosis en la Enfermedad de Crohn (EC) sigue siendo un problema importante que obliga en un alto porcentaje de pacientes a realizar tratamientos endoscópicos y/o quirúrgicos. No existen en la actualidad índices clínicos o herramientas diagnósticas que nos permitan predecir qué pacientes desarrollarán esta complicación, y actualmente cuando una estenosis se diagnostica, suele estar ya bien establecida y clínicamente relevante. El papel actual del tratamiento farmacológico se limita a tratar la inflamación y una vez que existe una fibrosis importante, las únicas opciones terapéuticas son las endoscópicas y/o quirúrgicas. Para poder establecer un correcto algoritmo terapéutico y con base en la evidencia científica disponible en este momento, el grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) ha decidido realizar este documento de posicionamiento sobre el tratamiento de la estenosis en la EC. Este documento abarca los tres abordajes terapéuticos mencionados, médico, endoscópico y quirúrgico. Se establecen recomendaciones y algoritmos terapéuticos que nos permitan ayudar a elegir la opción más adecuada en función de las características de la estenosis y del paciente.
Despite pharmacological advances, strictures in Crohn's disease (CD) continues to be an important problem that leads in a high percentage of patients to undergo endoscopic and/or surgical treatments. There are currently no clinical scores or diagnostic tools that allow predicting which patients will develop this complication, and when a stricture is diagnosed, it is usually already well established and clinically relevant. The current role of pharmacological treatment is limited to treat inflammation and once there is significant fibrosis, the only therapeutic options are endoscopic and/or surgical. To establish a correct therapeutic algorithm and based on the current scientific evidence available, the Spanish Group Working on Crohn's Disease and Ulcerative Colitis (GETECCU) has decided to conduct this position statement on the treatment of strictures in CD. This document embraces the three mentioned therapeutic approaches, medical, endoscopic and surgical. Recommendations and therapeutic algorithms are established to help us to choose the most appropriate option based on the characteristics of the stricture and the patient.
La estenosis es una de las complicaciones más frecuentes en pacientes con enfermedad de Crohn (EC), que precisa habitualmente de un abordaje combinado de tratamiento médico, quirúrgico y/o endoscópico1–4. Se produce como consecuencia de la inflamación crónica transmural con la posterior remodelación tisular que cursa con hipertrofia de células mesenquimales con hiperplasia y fibrosis. Se localiza más frecuentemente en íleon terminal y en la anastomosis ileocólica o de recto. Se considera clínicamente relevante cuando se produce un estrechamiento persistente de la luz intestinal con dilatación pre-estenótica pero sobre todo ante la presencia de síntomas obstructivos.
Las estenosis aparecen en un tercio de los pacientes después de 10 años del diagnóstico de la enfermedad. En aquellos que precisan de una resección ileal, más del 50% necesitarán de una nueva intervención quirúrgica después de 15 años. Más del 40% de los pacientes intervenidos presentarán reaparición de la sintomatología obstructiva después de cuatro años, hecho que puede condicionar la necesidad de una nueva resección intestinal y con esto la posibilidad, a largo plazo, de padecer un síndrome de intestino corto. Las estenosis son más frecuentes en la EC que en la colitis ulcerosa y en la enfermedad limitada en el intestino delgado que en el colon exclusivamente (64 vs. 5%, respectivamente)1–3.
Las diferentes opciones terapéuticas deberían ser consideradas en función del grado de inflamación y fibrosis. A pesar de que una estenosis en la EC no es puramente inflamatoria ni fibrótica, cuando existe un componente inflamatorio importante, el tratamiento médico es la primera opción terapéutica. En cambio, la resección quirúrgica debería reservarse solo para aquellas estenosis fibróticas irreversibles. El tratamiento endoscópico es una buena alternativa a la cirugía en este tipo de estenosis fibróticas, el cual presenta una tasa similar de eficacia, pero con menos complicaciones asociadas5.
Para poder establecer un correcto algoritmo terapéutico y basado en la actual evidencia científica disponible, GETECCU ha decidido realizar este documento de posicionamiento sobre el tratamiento de la estenosis en la EC. Dicho documento abarca los tres abordajes terapéuticos mencionados: médico, endoscópico y quirúrgico.
Tratamiento médico de las estenosis en la enfermedad de CrohnClásicamente el tratamiento de las estenosis en la EC se basaba en esteroides, reposo intestinal y, en caso de no respuesta, resección intestinal. Por otro lado, los avances en el tratamiento médico de la EC en estos últimos 20 años han ido encaminados a tratar y disminuir la inflamación. De todas formas, y a pesar de los avances en nuevos tratamientos médicos, las únicas opciones terapéuticas en las estenosis de predominio fibrótico siguen siendo la cirugía o bien tratamientos endoscópicos6,7. Las estenosis se han considerado como una consecuencia inevitable de la inflamación a largo plazo en pacientes no respondedores a terapias antiinflamatorias. La fibrosis asociada a la enfermedad inflamatoria intestinal (EII) se ha considerado como un proceso irreversible que con frecuencia ocasiona obstrucciones intestinales. Probablemente este paradigma cambiará en los próximos años con el advenimiento de nuevas terapias antiinflamatorias que consigan cambiar el curso natural de la enfermedad, pero también con el desarrollo de terapias anti-fibróticas.
¿Qué debemos tener en cuenta antes plantear cualquier tratamiento en una estenosis en la EC?Es importante tener una valoración completa de la enfermedad del paciente y por supuesto de la estenosis. Para ello es fundamental disponer de una analítica completa con parámetros inflamatorios (Proteína C-Reactiva [PCR], velocidad de sedimentación globular (VSG), fibrinógeno, calprotectina fecal) y de una técnica de imagen reciente (preferiblemente enteroRM, alternativamente enteroTC) que permita valorar la extensión de la enfermedad y aporte datos sobre la longitud y el tipo de estenosis.
Para valorar los síntomas obstructivos del paciente se puede utilizar una escala que ya ha sido utilizada y validada en algunos estudios y que permite tener una idea más objetiva de los mismos8,9. Es indispensable mantener una correcta nutrición del paciente, incluso valorando la necesidad de nutrición enteral, y a pesar de no existir una evidencia científica al respecto, parece razonable recomendar una dieta sin fibra o pobre en fibra (solamente con fibra insoluble) con abundante ingesta hídrica.
¿Es el tratamiento médico una opción terapéutica que debemos plantearnos ante la presencia de una estenosis en un paciente con EC?Un aspecto importante cuando se evalúa una estenosis es valorar el grado de inflamación en la zona de la estenosis mediante pruebas de imagen. Los signos de inflamación en la tomografía computarizada (TC) o en la resonancia magnética (RM) son el signo del peine (congestión de los vasos rectos), el engrosamiento de la pared intestinal y el hiperrealce de contraste10. Si se confirma la presencia de inflamación concomitante, se debe intentar inicialmente una terapia antiinflamatoria, que podría disminuir el edema de la pared con una posterior reducción del grosor de la misma y así intentar aliviar los síntomas obstructivos11,12. El tratamiento con corticosteroides como fármaco inductor seguido de inmunosupresores o biológicos si se produce corticodependencia, sería el primer paso que seguir en todos los centros que tratan pacientes con EII.
Los agentes anti-TNF como infliximab y adalimumab han demostrado ser eficaces en inducir y mantener la remisión en la EC. Su utilidad o uso en el manejo de lesiones estenosantes es controvertido. Algunos estudios apuntan que los anti-TNF podrían reducir la tasa de desarrollo de estenosis si el tratamiento se inicia de manera precoz, aunque por otro lado la curación rápida de las úlceras se ha relacionado con la posibilidad de formación de estenosis, e incluso en algunos estudios encuentran que los anti-TNF presentan un riesgo aumentado de provocar estenosis a largo plazo13,14.
El registro TREAT y el estudio ACCENT no demostraron que el tratamiento con infliximab estuviera asociado a un mayor riesgo de obstrucción intestinal en aquellos pacientes con patrón estenosante en la inclusión15,16. De manera más específica, existen datos procedentes de algunos estudios que han demostrado que los anti-TNF son útiles en este escenario e incluso podrían revertir lesiones estenosantes, aunque la mayoría de estos estudios son retrospectivos y con un número reducido de pacientes17–21. Recientemente, se ha publicado un estudio multicéntrico retrospectivo de GETECCU en EC estenosante. El tratamiento con anti-TNF fue efectivo en un alto porcentaje de pacientes a corto plazo22. Datos muy similares son los obtenidos en otro estudio de cohortes observacional multicéntrico prospectivo (CREOLE), sobre los efectos de la terapia de inducción y mantenimiento con adalimumab23. No hay datos sobre el uso de inmunomoduladores, vedolizumab u otros biológicos para este tipo de complicaciones. En la tabla 1 se resumen aquellos estudios clínicos que han evaluado el tratamiento con anti-TNF en la EC estenosante.
Estudios clínicos que han evaluado el tratamiento con anti-TNF en las estenosis de la EC
| Autor | Tipo de estudio | n | Tipo de anti-TNF | Respuesta |
|---|---|---|---|---|
| Pallota17 | Prospectivo | 15 | Infliximab | Tras una media de 38 meses: 53% regresión completa de la estenosis |
| Pelletier18 | Retrospectivo | 18 | Infliximab | Semana 8: Respuesta completa en 55%/ Respuesta parcial en 39% |
| Alloca21 | Retrospectivo | 51 | Infliximab (37,2%) y adalimumab (62,8%) | 61% evita la cirugía tras una media de seguimiento de 15,7 meses |
| Campos20 | Retrospectivo | 84(41 con anti-TNF) | 19 Infliximab22 (Infliximab en comboterapia) | Semana 12:29% Anti-TNF monoterapia35% Anti-TNF combo terapia(Respuesta a corto plazo definida como mejoría de los síntomas obstructivos entre la semana 12 y 24) |
| Rodríguez-Lago22 | Retrospectivo | 262 | Infliximab (54%)Adalimumab (46%) | Semana 24: 87%Semana 52:73%40 meses: 26%(No esteroides, no nuevos biológicos ni inmunosupresores, no cirugía ni dilatación endoscópica) |
| Bouhnik23 | Prospectivo | 94 | Adalimumab | Semana 24: 64% éxito (No esteroides, no cirugía ni dilatación endoscópica) |
Anti-TNF: anticuerpos anti factor de necrosis tumoral.
Actualmente se están evaluando nuevas dianas terapéuticas enfocadas en la inhibición de la fibrosis basándose en los avances en otras patologías como la fibrosis pulmonar, renal y hepática y la esclerodermia4. Sin embargo, hoy en día la fibrosis sigue siendo un problema clínico no resuelto en la EC y aún no disponemos de un tratamiento efectivo dirigido a tratar la fibrosis intestinal.
¿A qué pacientes con EC estenosante debemos plantear el tratamiento médico?Basándose en los resultados del estudio francés CREOLE, se puede intentar diseñar un sistema de puntuación que nos ayude a predecir la eficacia de la terapia anti-TNF en la EC estenosante (tabla 2). Se asignó 1 punto a todas las variables menos a la presencia de dilatación pre-estenótica menor o igual de 29 mm a la que se asignó 2 puntos. Para los sujetos con más de 4 puntos, la probabilidad de que adalimumab fuera eficaz fue del 88%, y únicamente del 6% con menos de 2 puntos23. A pesar de que no está validado, y en espera de su validación y simplificación, sí que se podrían tener en cuenta algunos de estos criterios para tomar una decisión más objetiva entre tratamiento médico o quirúrgico-endoscópico.
Factores asociados con la eficacia del tratamiento con anti-TNF en una estenosis del intestino delgado en la EC
| Factores |
|---|
| Uso de inmunosupresoresCorta duración de los síntomas obstructivosLongitud de la estenosis (< 12 cm)Diámetro máximo proximal a la estenosis menor de 29 mmHipercaptación en la fase tardía de T1 en la RMAusencia de enfermedad fistulizante concomitante |
RM: resonancia magnética.
Por otro lado, también nos pueden ayudar los resultados de algunos estudios que han evaluado qué factores se asocian a cirugía en pacientes con EC estenosante. La presencia de síntomas obstructivos, un índice Crohn's Disease Activity Index (CDAI) mayor a 220, ser fumador activo y una duración de la enfermedad menor a tres años en el momento del diagnóstico de la estenosis son factores asociados a mayor riesgo de cirugía. Tener más de tres o cuatro factores se asocia a un riesgo de cirugía mayor del 73 y 100%, respectivamente24. En esta misma línea y más recientemente, un estudio ha evaluado de manera retrospectiva pacientes que tenían una estenosis ileal según criterios radiológicos por RM. Se identificaron unos factores asociados a cirugía y se creó un modelo de riesgo que denominaron BACARDI (tabla 3). La presencia de cada una de estas variables se puntuaba con 1 punto, a excepción de la dilatación pre-estenótica que se puntuaba con 2 puntos, con un riesgo elevado de cirugía con más de 4 puntos. Pero al igual que en el estudio CREOLE, este modelo no está aún validado25.
¿La localización de la estenosis influye en la eficacia del tratamiento médico?A pesar de que la mayoría de los estudios que han evaluado la eficacia de los anti-TNF en el tratamiento de los pacientes con EC y estenosis han incluido sobre todo pacientes con estenosis a nivel ileal22,25, a priori el tratamiento médico se debería intentar en todas aquellas estenosis de intestino delgado, independientemente de la localización. La heterogeneidad de los estudios y la menor prevalencia de estenosis altas no nos permite realizar recomendaciones sólidas con base en su localización específica a lo largo del intestino delgado. Las estenosis de colon, sin embargo, se presentan con una menor frecuencia que las estenosis de intestino delgado y se asocian a una menor respuesta al tratamiento médico22. Además, ante una estenosis de colon no debemos olvidar el riesgo de displasia o cáncer, por lo que deberíamos individualizar cada caso y optar por un abordaje endoscópico o quirúrgico sobre todo en aquellos casos en que la estenosis no se puede sobrepasar.
Con relación a las estenosis de la anastomosis, éstas presentan características morfológicas y radiológicas distintas debido a los cambios posquirúrgicos y a la posibilidad de un intestino dilatado crónicamente que puede no normalizarse después de la resección26. En el estudio CREOLE se incluyeron pacientes con estenosis de la anastomosis ileocólica y no se observó que éstas fueran un factor de riesgo para el fracaso del tratamiento médico23. A pesar de ello, no disponemos de series extensas que hayan evaluado específicamente la eficacia del tratamiento médico en estenosis de las anastomosis. Además, su accesibilidad y habitualmente corta extensión las convierten en muy buenas candidatas al tratamiento endoscópico frente al médico.
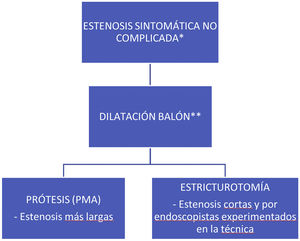
Tratamiento endoscópico de las estenosis en la enfermedad de CrohnDilatación con balónActualmente, la dilatación endoscópica con balón (DEB) es el tratamiento endoscópico de elección en la EII. Los últimos metaanálisis publicados, basados todos en estudios observacionales no controlados, han demostrado que la DEB en pacientes seleccionados es una alternativa segura y eficaz a la cirugía, con una tasa de éxito global que oscila entre el 58 y el 80,8%, y una tasa de complicaciones del 2,8-6,4%27–30. Hasta la fecha, estos estudios tienen varias limitaciones debido a la heterogeneidad en la técnica endoscópica utilizada y las diferencias en los factores que pueden influir en la seguridad y eficacia del procedimiento, con pocos estudios que incluyan más de 100 pacientes31–34. En el momento actual disponemos de la información obtenida de un ensayo clínico (PROTDILAT) que compara esta técnica endoscópica con otra alternativa endoscópica (prótesis) y que aporta una evidencia más firme sobre su eficacia y seguridad en la EC, y sobre qué factores contribuyen a su éxito9. A pesar de ello, faltan ensayos clínicos bien diseñados que comparen la DEB con otras alternativas endoscópicas y que se realicen sobre todo en situaciones menos favorables a la dilatación, como por ejemplo en estenosis más largas. Por otro lado, es importante remarcar que, aunque la mayoría de los datos disponibles proceden de estudios realizados en centros de referencia de EII, sabemos que en la actualidad la DEB es una técnica segura y eficaz independientemente del nivel de complejidad asistencial donde se realice34, lo que marca una diferencia notable con la cirugía, donde los resultados obtenidos en centros terciarios son significativamente mejores35. Aun así, faltan aún más estudios que nos permitan comparar la DEB con la cirugía en términos, no sólo de eficacia y seguridad, sino también de calidad de vida del paciente.
Factores relacionados con el éxito terapéutico de la DEBEn la tabla 4 se resumen los resultados obtenidos en los cuatro metaanálisis recientemente publicados y los factores relacionados con el éxito terapéutico que se han reportado en cada uno de ellos. Cuando hablamos de DEB hay dos conceptos importantes a tener presente: 1). El éxito técnico se define cuando se puede pasar con el endoscopio a través de la estenosis una vez realizada la DEB. 2). El éxito terapéutico se define cuando se resuelven los síntomas obstructivos a largo plazo, establecido en algunas guías como estar libre de cirugía al año de seguimiento36.
Resumen de los últimos metaanálisis publicados de la dilatación endoscópica con balón
| Pacientes(N) | DEB(N) | Estudios (N) | Éxito técnico% | Eficacia clínica (%) | Complicaciones (perforación) (%) | Cirugía/seguimiento | Factores relacionados | |
|---|---|---|---|---|---|---|---|---|
| Morar201528 | 1.089 | 2.664 | 25 | 90 | 70,2 | 6,4* (3%) | 20,2%/19,7 meses** | - |
| Navaneethan201629 | 1.163 | - | 24 | 89 | - | 4* (3%) | 27%/15-70 meses | Longitud estenosis ≤ 4 cm*** |
| Bettenworth201730 | 1.463 | 3.213 | 33 | 89 | 80,8 | 2,8 (-) | 42,9%/24 meses | Longitud estenosis ≤ 5 cm |
DEB: dilatación endoscópica con balón.
La longitud de la estenosis es el factor más determinante en el éxito de la DEB27,29,30,34. En la mayoría de los estudios publicados se ha intentado definir una longitud de la estenosis a partir de la cual se pueda determinar si la DEB va a tener éxito o no, definida casi siempre como de 4 cm27,29. Lo importante no es establecer una longitud concreta, sino saber que cuanto menor sea la longitud de la estenosis mayor será el éxito de la dilatación, de tal modo que cuando dilatamos estenosis muy cortas (< 2-2,5 cm) su eficacia será próxima al 100%9. Tanto así que se ha observado que cada centímetro que aumenta la longitud de la estenosis, la probabilidad de cirugía incrementa un 8%30. Además, es importante tener presente que muchas veces la longitud reportada por una prueba de imagen es significativamente mayor que la visualizada endoscópicamente. Por lo tanto, no debemos excluir la posibilidad de dilatar estenosis más largas puesto que si miramos los porcentajes de éxito de la DEB en estenosis > 4 cm en los diferentes estudios publicados, veremos que están en torno al 60-70%34, superiores a la mejor tasa de éxito de la mayoría de las otras técnicas endoscópicas.
¿Existe alguna diferencia entre una estenosis de la anastomosis o estenosis de novo?Hay discrepancia en la literatura sobre si el tipo de estenosis (anastomosis vs. de novo) constituye un factor que determine el éxito o el fracaso de la DEB. En el momento actual, tenemos suficiente evidencia que nos sugiere que el verdadero factor determinante en este caso vuelve a ser la longitud de la estenosis. La mayoría de las estenosis de la anastomosis son estenosis muy cortas, lo que probablemente ha constituido un sesgo en la mayoría de los estudios previos (casi todos retrospectivos) que nos ha llevado a pensar que dilatar estenosis de la anastomosis era mejor que dilatar estenosis de novo. En el único ensayo clínico aleatorizado disponible hasta la fecha, así como en el último metaanálisis publicado, se corrobora el hecho de que la DEB es igual de efectiva, independientemente del tipo de estenosis (anastomosis vs. de novo), y que el verdadero factor determinante es la longitud de la misma9,30.
¿Qué otros factores se han relacionado con el éxito de la DEB?Se han reportado otros factores relacionados con el éxito de la DEB que no se han corroborado de forma constante en la mayoría de los estudios publicados. Entre estos factores tenemos: ser fumador activo37, no recibir tratamiento anti-TNF en el momento de la dilatación34, la duración de la EC, los niveles de PCR38, utilización de tratamiento combinado con inmunosupresores y biológicos39, la dilatación pre-estenótica40 y la intensidad de los síntomas obstructivos9,40. Todos ellos parecen ser expresiones diferentes de un mismo fenómeno y que traducen una enfermedad más grave o avanzada. La optimización del tratamiento médico previo a la realización de la DEB puede mejorar los resultados de la misma y reducir o evitar la necesidad de sucesivas dilataciones39. Además, a pesar de que la presencia de inflamación en la zona de la estenosis no es una contraindicación para realizar una DEB, una inflamación significativa podría aumentar el riesgo de eventos adversos graves34,41. Por lo tanto, se debería optar por una intensificación acelerada del tratamiento médico de cara a optimizar los resultados de la DEB en caso de ser necesaria.
La obtención de un éxito técnico durante la DEB también es importante de cara a tener un éxito terapéutico30,34. La tasa de éxito técnico se relaciona con la utilización de balones de mayor diámetro (> 12 mm)34,42. La elección del tamaño del balón también debe ponerse en una balanza con la seguridad del paciente, dado que se pueden obtener iguales tasas de respuesta clínica con balones de menor diámetro34.
En la tabla 5 se resumen las características ideales de una estenosis para realizar una DEB
¿Deberíamos dilatar estenosis en pacientes asintomáticos?Aunque se trata de una técnica segura, puede conllevar complicaciones potencialmente muy graves como la perforación. En un consenso internacional reciente publicado durante el año 2020 por el Global Interventional Inflammatory Bowel Disease Group, se recomienda la dilatación de estenosis asintomáticas encontradas de forma incidental en el curso de una endoscopia de seguimiento. Esta afirmación está basada en un solo estudio retrospectivo donde se observaba que aquellos pacientes que tenían una dilatación pre-estenótica en las técnicas de imagen tenían más posibilidades de acabar operándose tras una DEB40. En este mismo estudio, la presencia de síntomas obstructivos también se relacionaba con mayor probabilidad de fracaso de la DEB, pero solo se realizaban pruebas de imagen en aquellos pacientes con una enfermedad más grave y, por lo tanto, aquellos que tenían síntomas obstructivos. Otro escenario donde se podría plantear una dilatación en un paciente asintomático sería en aquellas situaciones en que explorar el resto del intestino para valorar la actividad de la enfermedad, sea importante con vistas a establecer un tratamiento médico. En resumen y de forma general, solo recomendamos dilatar aquellas estenosis que sean sintomáticas, pero sin retrasar la realización de la DEB una vez el paciente empiece a presentar síntomas obstructivos.
¿Es la DEB una técnica segura? ¿En qué hospitales puede o debe realizarse?La DEB es una técnica segura. Se consideran como complicaciones mayores la perforación y la hemorragia clínicamente significativa o que precise de tratamiento endoscópico para su resolución. El porcentaje de complicaciones mayores en el conjunto de los estudios publicados oscila entre el 2 y el 3%27–30 y en la mayoría de los casos son perforaciones. Se ha relacionado la probabilidad de perforación con la utilización de balones de mayor diámetro32,43 y con la presencia de inflamación significativa en el lugar de la estenosis34,41.
La selección del diámetro del balón, como se ha comentado anteriormente, tiene que sospesarse entre conseguir un éxito técnico y la seguridad del paciente. La DEB puede repetirse, y de hecho en la mayoría de los estudios el éxito terapéutico no se obtiene con una única DEB32,34. Por lo tanto, el éxito de la dilatación no es imprescindible alcanzarlo en una sola sesión. A pesar de la no existencia de evidencia científica sólida que muestre que una dilatación secuencial y progresiva disminuya el riesgo de complicaciones, parece prudente y lógico realizarlo de esta manera, anteponiendo la seguridad a una eficacia inmediata.
Por otro lado, a pesar de estar reportado en pocos estudios, parece que la presencia de inflamación significativa en el lugar de la estenosis podría aumentar el riesgo de perforación34,41. En muchos estudios no comentan el nivel de inflamación de la estenosis en el momento de la dilatación pudiendo, por lo tanto, estar este factor infravalorado. En el último metaanálisis publicado, la inflamación en el lugar de la estenosis no se relacionó con un incremento en la tasa de perforación30.
Un punto controvertido es la seguridad en aquellos pacientes con tratamiento concomitante con corticoides. Solo en un estudio se relacionó el tratamiento activo con corticoides sistémicos con un aumento de la probabilidad de perforación44 y documentos de consenso recientes sobre el tratamiento endoscópico de las estenosis en la EII desaconsejan su uso36. En este único estudio solo encontraron seis eventos adversos graves y cuatro fueron perforaciones, estando estos pacientes en tratamiento activo con corticoides y con inflamación significativa en el lugar de la estenosis44. Es difícil, por tanto, sacar conclusiones sólo con cuatro pacientes, además la presencia de inflamación en el lugar de la estenosis hubiera podido influir en el riesgo de perforación, tal y como se ha reportado en otros estudios34,41. Por todo ello, no creemos que se pueda afirmar que los corticoides por sí solos constituyen un factor de riesgo de perforación, y lo que sí que es claramente recomendable es tratar la inflamación subyacente, intensificando el tratamiento médico, antes de realizar una DEB.
Hay poca evidencia científica para poder determinar en qué tipo de hospital puede o debe realizarse una DEB. La mayoría de los estudios publicados están realizados en centros de referencia de EII. En 2019 se publicó un estudio realizado en nuestro entorno, promovido por GETECCU, con la participación de 19 hospitales de todo el territorio nacional y con diferentes niveles de complejidad asistencial, en el que se analizaron casi 200 pacientes y más de 400 DEB, y no se encontraron diferencias en cuanto a la eficacia y la seguridad entre hospitales terciarios y secundarios34. Datos también corroborados en el ensayo clínico comparativo sobre el tratamiento endoscópico de la estenosis en la EC, del mismo grupo de investigadores del estudio anterior (PROTDILAT)9. Dichos estudios ponen de manifiesto que la DEB es una técnica con gran reproducibilidad en un entorno de práctica clínica habitual, y lo que es más importante, marca una clara diferencia con la cirugía, en la que no sólo hay diferencias de eficacia sino también de complicaciones y mortalidad, entre hospitales terciarios y hospitales de menor complejidad35,45.
¿La DEB funciona igual en estenosis del tracto digestivo alto?La afectación del tracto digestivo alto por EC está poco reportada y el desarrollo de estenosis en este segmento del tubo digestivo se estima que es aproximadamente del 4%46, aunque se cree que la verdadera incidencia podría ser mucho mayor, aproximadamente del 19%, si se hicieran endoscopias digestivas altas de forma rutinaria en pacientes con EC47. El fenotipo más frecuente en esta localización es el estenosante y en la mayoría de las ocasiones es en forma de una sola estenosis, aunque la proporción de pacientes con más de una estenosis puede llegar a ser de hasta el 30% en algunas series46. Actualmente hay muy pocos estudios que evalúen la eficacia de la DEB en estenosis del tracto digestivo alto. Recientemente se ha publicado un metaanálisis con una eficacia de la DEB del 70% con un periodo de seguimiento corto (mediana de 23 meses) y con una tasa de complicaciones mayores global del 3% y, por tanto, con resultados similares al resto de las localizaciones48.
¿Es efectiva y segura la dilatación con enteroscopia asistida con balón en estenosis del intestino delgado?Aquellas estenosis situadas más allá de la válvula ileocecal y que no se llegan a alcanzar con un colonoscopio convencional, podrían ser tributarias de realizar un tratamiento endoscópico con enteroscopia asistida con balón. Inicialmente se desarrolló el enteroscopio asistido con doble balón, siendo modificado posteriormente a enteroscopio asistido con balón único49,50, y desde hace poco con la aparición del enteroscopio espiral51. Existe una revisión sistemática reciente con metaanálisis, donde se utiliza mayoritariamente el enteroscopio asistido con doble balón52. Se obtuvo una alta tasa de éxito técnico (en torno al 90-94,9%), con una eficacia clínica a corto plazo del 82,3%. Se observaron un 5,3% de complicaciones mayores y con una recurrencia sintomática del 48,3%. Por tanto, podemos concluir que la DEB mediante enteroscopia asistida con balón es una herramienta eficaz y segura en el tratamiento de las estenosis de intestino delgado, pero que al igual que con el resto de DEB, en un porcentaje no despreciable de pacientes se precisará de re-dilatación y de cirugía.
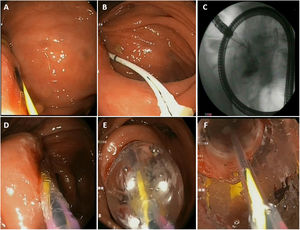
¿Cuáles son los aspectos prácticos durante el procedimiento de la DEB? (fig. 1)¿Es necesaria la fluoroscopia?No es imprescindible para realizar una DEB, pero sí recomendable. Hay que tener en cuenta que las estenosis en la EC pueden ser complejas y localizarse en segmentos intestinales con grandes incurvaciones. La fluoroscopia ayuda a un mejor estudio de la estenosis, asegura un correcto paso de la guía y ayuda a detectar posibles complicaciones inmediatas.
Aspectos prácticos de la dilatación endoscópica con balón. A) Paso de la guía por la estenosis. B y C) Introducción de un balón de Fogarty e inyección de contraste. D y E) Inserción e inflado progresivo del balón neumático. F) Visualización de la dilatación de la estenosis a través del balón neumático.
La mayoría de los balones de dilatación comercializados en nuestro entorno vienen con guía rígida, por lo que es recomendable retirarla y utilizar una guía larga de punta blanda, hidrofílica, que se introducirá primero antes de pasar el balón. Están descritas perforaciones con la guía en patología colónica maligna previa a la colocación de una prótesis metálica.53.
Introducir un catéter o un balón de Fogarty sobre la guía e inyectar contraste para caracterizar mejor la estenosis (ver figura 1, foto B y C)La inyección de contraste a través de un catéter introducido sobre la guía nos puede ayudar a estimar, en el momento de la DEB, la longitud real de la estenosis y aporta información sobre las características de ésta (angulación, tortuosidad, fístulas, etc.).
Dilatación secuencial y progresiva (ver figura 1, foto D y E)La elección del diámetro del balón que se va a utilizar dependerá del diámetro de la estenosis, y por tanto en estenosis muy estrechas, se debería empezar con balones de menor diámetro y probablemente no se podrá llegar en una misma sesión al diámetro deseado. El colonoscopio estándar tiene un diámetro de unos 12 mm, por lo que normalmente el éxito técnico se consigue con balones mayores a 12 mm.
Durante la dilatación intentar visualizar la estenosis a través del balón (ver figura 1,foto F)Se consigue aproximando el balón a la punta del endoscopio y realizando un apoyo suavemente sobre él vigilando no desplazarlo. Esto nos ayudará a tener un mayor control del procedimiento y a detectar posibles complicaciones de forma precoz.
Utilizar el balón parcialmente hinchado en la punta del endoscopio para sobrepasar la estenosis una vez realizada la DEB
Es útil para evitar lesionar la mucosa de la estenosis dado que la superficie del balón es menos traumática que la punta del endoscopio.
¿Qué consideraciones post-procedimiento se deberían tener en cuenta?Después de una DEB el paciente debe mantenerse en observación en una zona de recuperación post-endoscopia durante un mínimo de una a dos horas con el objetivo de detectar posibles complicaciones tempranas. En caso de sospecha de perforación se debe iniciar tratamiento antibiótico de forma precoz y realizar una prueba de imagen (TC) para confirmarla.
Una vez realizada la DEB se recomienda que el paciente realice una dieta pobre en fibra y con hidratación abundante. Es importante monitorizar los síntomas en días posteriores para poder detectar complicaciones tardías y revalorar la clínica obstructiva por si se necesitase de un nuevo tratamiento endoscópico.
¿Dilatación endoscópica con balón vs. cirugía?Existen pocos estudios comparativos que evalúen directamente el tratamiento endoscópico de las estenosis con la cirugía y todos ellos son estudios restrospectivos54–57. En general, tanto para estenosis de novo como para estenosis de la anastomosis, la resección quirúrgica tiene mejores resultados en cuanto a mayores intervalos de tiempo libre cirugía que la DEB55–57. En uno de estos estudios se valoran los efectos adversos sin encontrar diferencias en la tasa de complicaciones mayores entre los dos tratamientos56. En cambio, en otro de los trabajos el porcentaje de efectos adversos es significativamente mayor para la cirugía vs. la dilatación (32,2 vs. 4,7%)57. No existen estudios que comparen el efecto de ambos tratamientos en la calidad de vida de los pacientes.
Con relación a la estricturoplastia quirúrgica también existen pocos estudios que la comparen directamente con la DEB y son también estudios retrospectivos54. Tal y como sucede con la resección quirúrgica, la estricturoplastia consigue mayores intervalos libres de una nueva cirugía respecto a la DEB. En un metaanálisis publicado en 2010 donde se analizaron un gran número de estudios (40 sobre estricturoplastia y 23 sobre DEB), la mediana de complicaciones mayores entre los dos grupos fue del 11 y 3%, respectivamente, y las tasas de recurrencias fueron similares, pero con menor tiempo de aparición para la DEB58.
Tratamiento endoscópico con prótesisLa evolución tecnológica de las prótesis en los últimos años junto a su clara efectividad en el tratamiento de las estenosis malignas de tracto gastrointestinal, ha permitido su uso en patología benigna de cualquier origen y localización, entre las cuales se encuentra la EC. Inicialmente se diseñaron prótesis metálicas autoexpandibles (PMA) no cubiertas para su uso en la patología maligna colónica como tratamiento paliativo sin intención de retirarse. Dada su efectividad en dicha indicación, posteriormente se crearon PMA totalmente recubiertas para poder extraerse y ser, por tanto, utilizadas en patología benigna intestinal. Hoy en día se dispone de una gran variedad de prótesis por lo que respecta a su tamaño, forma, material y recubrimiento (totalmente cubiertas, parcialmente cubiertas, copa ancha y asimétricas, biodegradables, plástico, metálicas, etc.) algunas de las cuales ya han sido diseñadas específicamente para estenosis benignas intestinales y pueden ser colocadas a través del canal de trabajo (son los llamados stents tipo Through The Scope [TTS]).
¿Qué evidencia científica tenemos sobre el uso de las prótesis metálicas autoexpandibles en la EC?La información respecto a la eficacia y seguridad de las PMA en el tratamiento de estenosis en la EC ha sido hasta hace poco limitada y reportada en publicaciones muy recientes8,9,59–65. Las primeras experiencias que se encuentran en la literatura sobre el uso de PMA en la EC están publicadas en forma de casos clínicos59. Dada la amplia heterogeneidad del tipo de pacientes incluidos, del tipo de prótesis utilizadas y siendo en la mitad de los casos como un tratamiento puente a la cirugía, se hace difícil la extracción de conclusiones sólidas.
En la tabla 6 se muestran las series más relevantes de pacientes tratados con PMA.
Resumen de las series más relevantes de pacientes con enfermedad de Crohn reportados en la literatura tratados con prótesis metálicas autoexpandibles
| Autor / Año | N° pacientes | Localización | Longitud | Tratamiento previo | Tipo de stent | Éxito técnico/ clínico (tasa) | Tiempo permanencia stent | Evolución |
|---|---|---|---|---|---|---|---|---|
| Levin 201260 | 5 | Anastomosis IC | < 6 cm | DEB(2 pacientes) | PMANC | Sí (100%) / Sí (80%) | 3 s-9 años | Asintomático en 4/5 pacientes |
| Attar 20128 | 11 | Anastomosis IC (9 pacientes) / íleo terminal (2 pacientes) | 1-4 cm | DEB(9 pacientes) | PMATC | Sí (90%) / Sí (36%) | 1-28 días (8 stents ME) | Asintomático en 4/11 pacientes ≥ 1 año. 2 complicaciones |
| Branche 201261 | 7 | Anastomosis IC | < 5 cm | DEB | PMAPC | Sí (100%) / Sí (71,4%) | 1 s | Asintomático en 5/7 pacientes, media seguimiento 10 meses |
| Loras 201262 | 17 | Anastomosis IC (10 pacientes) / colon (7 pacientes) | < 8 cm | DEB (14 pacientes) | PMAPC (4) / PMATC (21) | Sí (92%) / Sí (64.7%) | Media 28 días (1-112) (13 stents ME) | Asintomático en 11/17 pacientes, media seguimiento 67 s. 1 complicación |
| Das 202064 | 21 | Anastomosis (19 pacientes) / de novo (2 pacientes) | ≤ 6 cm | - | PMAPC | Sí (95.8%) / Sí (81% IT /54% PP) | 1 s (3 stents ME) | Asintomático en 13/16 pacientes, seguimiento 3-50 meses |
| Andújar 20209 | 39 | Anastomosis (16 pacientes) / de novo (23 pacientes) | ≤ 9 cm (mean 4 cm) | - | PMATC | Sí (92%) / Sí (51%) | Media 2 días (38 stents ME) | Asintomático en 20/39 pacientes, seguimiento 12 meses. 1 complicación |
| Attar 202065 | 46 | Anastomosis (34 pacientes) /de novo (12 pacientes) | < 5 cm | DEB (36 pacientes) | PMAPC | Sí (100%) / Sí (58.7%) | 1 s (5 días en 2 pacientes; 3 stents ME proximal) | Asintomático en 27/46 pacientes, media seguimiento 26 meses. 5 complicaciones |
IC: íleo-colónica; DEB: dilatación endoscópica con balón; PMATC: prótesis metálica autoexpandible totalmente cubierta; PMANC: prótesis metálica autoexpandible no cubierta; PMAPC: prótesis metálica autoexpandible parcialmente cubierta; ME: migración espontánea; ITT: intención de tratamiento; PP: por protocolo; s: semanas.
En el año 2012 se publican las primeras series cortas de pacientes. De estas series destacan la reportada por Attar et al. con 11 pacientes tratados con PMA totalmente cubiertas8. Se obtuvo un éxito clínico bajo, y de forma general, la migración espontánea del stent fue la norma. De estos mismos autores anteriores y dados los malos resultados obtenidos en cuanto a la migración de las prótesis, se publicó posteriormente una experiencia inicial con PMA parcialmente cubiertas y diseñadas específicamente para la EC (Hanarostent stent; M.I. Tech, Seoul, Korea HRC-20-080-230). Un alto porcentaje de pacientes permaneció asintomático sin observarse ningún caso de migración ni adherencia de la prótesis61. En ese mismo año se publicó la hasta entonces serie más larga de pacientes reportada tratados con PMA, obteniendo un elevado éxito clínico a pesar de ser, la mayoría de los pacientes, refractarios a la DEB62.
En 2020 se han publicado dos estudios retrospectivos64,65 en los que utilizan el mismo tipo de prótesis descrita previamente y diseñada específicamente para la EC (PMA parcialmente cubierta)61. En ambos estudios se obtienen tasa de éxito similares, en torno al 54-58%, sin complicaciones importantes y reduciéndose considerablemente la tasa de migración.
Solamente existe un estudio en forma de ensayo clínico aleatorizado realizado hasta el momento, donde se compara la eficacia de las prótesis (PMA totalmente cubierta; de 20 mm de diámetro TaeWoong©;Niti-STM S Enteral Colonic Stent, 6-10 cm; Gimpo-si, South Korea) y la dilatación con balón en 80 pacientes, estudio PROTDILAT y pendiente de publicación9. Los resultados confirman que ambos procedimientos son eficaces y seguros en el tratamiento de las estenosis (tanto postquirúrgicas como de novo) mostrando una clara superioridad terapéutica la DEB sobre las PMA (80,5 vs. 51,3%; remisión de la sintomatología obstructiva al año de seguimiento). Sin embargo, en el subanálisis de los pacientes con estenosis más largas (> 3 cm) las diferencias entre los dos procedimientos desaparecieron (DEB: 66,7% vs. PMA: 63,6%). Además, en este estudio se demostró que la DEB es significativamente más coste-efectiva que la colocación de una prótesis (DEB: 1.212,41 euros vs. PMA: 3.615,07 euros).
¿Qué evidencia científica tenemos sobre el uso de las prótesis biodegradables en la EC?En general, las prótesis biodegradables poseen una baja fuerza para revertir las estenosis y tampoco parecen ofrecer claras ventajas en cuanto a su uso en estenosis esofágicas y colónicas66,67. Además, no parecen muy esperanzadores los resultados en la EC. Se han reportado un total de dos casos y dos series cortas de pacientes68–71. En la primera de ellas, se incluyó un total de 11 pacientes con estenosis cortas en diferentes localizaciones68. A pesar de la dificultad en calcular la eficacia global del procedimiento por los datos reportados en el artículo, se puede estimar una eficacia global en torno al 50% de los casos con un tiempo de seguimiento corto. Adicionalmente a estos resultados se debe tener en cuenta las dificultades técnicas para acceder a las estenosis más proximales, para las cuales se precisó de la creación de un sistema de introducción tipo sobretubo de balón para la inserción del stent por radiología. En la segunda serie con un total de seis pacientes, solamente en uno de ellos (20%) se consiguió el éxito terapéutico70.
¿Qué papel pueden tener las prótesis en el tratamiento de la estenosis en la EC?Las PMA son las únicas prótesis que parecen haber demostrado tener algún papel en el algoritmo terapéutico de la estenosis en la EC, en contra de lo reportado con las prótesis biodegradables. En resumen y de forma general dado los resultados de los estudios más recientes, está claro que las prótesis no deberían considerarse de primera opción en el tratamiento de las estenosis de la EC. En este contexto la DEB presenta una tasa de éxito muy elevada y además es más coste-efectiva. En vista de la evidencia científica actual las prótesis podrían tener un papel en aquellos casos refractarios a un tratamiento endoscópico previo con DEB, en casos en que la DEB no haya sido posible o en aquellas estenosis de mayor longitud y así intentar evitar o alargar una futura intervención quirúrgica.
El futuro pasa claramente por la mejoría en el diseño de los stents adaptados específicamente para la EII o para estenosis benignas, que mejoran la fuerza radial y también evitan una migración temprana de las mismas.
Estricturotomía endoscópicaLa estricturotomía endoscópica (EE) consiste en realizar una incisión con un bisturí a nivel de la circunferencia de la estenosis. Las incisiones con esta técnica del tracto digestivo superior se empezaron a utilizar inicialmente en el ámbito de la canulación de la vía biliar y en el tratamiento de las estenosis del esófago72,73. Actualmente se reconoce su utilización generalizada para estenosis en el esófago, el píloro, el duodeno, el intestino delgado distal, el colon y el anorrecto, así como en la ileostomía y el reservorio ileal74.
¿Cuál es la indicación adecuada para realizar una estricturotomía?Se consideran susceptibles de realizar la EE sola o combinada con la DEB en los pacientes con estenosis cortas refractarias que previamente hayan tenido una respuesta pobre o parcial a la dilatación. No se dispone de series amplias que comparen o permitan establecer indicaciones concretas en cada situación. Es necesario individualizar en cada paciente, según el tipo de estenosis y su localización, para poder elegir la opción más adecuada. No existen datos prospectivos y aleatorizados al respecto, y solamente se disponen de estudios retrospectivos en los que la elección del método de tratamiento endoscópico utilizado se ha basado únicamente en los criterios del médico responsable75,76.
¿Cómo se realiza el procedimiento?Para realizar la incisión de la EE se suelen utilizar herramientas como el bisturí puntiforme needle-knife con alambre recto, habitualmente usado para realizar los «pre-cortes» en las colangio-pancreatografías retrógradas endoscópicas o bisturís con alambres rectos con protección en su extremo con cerámica aislada, IT-Knife, o con la punta en garfio, Hook-Knife, entre otros. Los cortes pueden realizarse con una disposición radial en varios puntos de la circunferencia de la estenosis o en una disposición circunferencial, seccionando tramos de la circunferencia. Algunos autores colocan clips hemostáticos de forma rutinaria en los cortes radiales para mantener abierta la incisión tratada y así evitar la retracción durante el proceso de cicatrización (en estos casos se denomina al procedimiento como estricturoplastia)75,76. Es aconsejable realizarla por endoscopistas experimentados y habituados al manejo de los bisturís, lo que conlleva una importante diferencia con la DEB.
¿La estricturotomía es efectiva? ¿Qué ventajas aporta? ¿Es preferible a la dilatación endoscópica?A diferencia de la DEB, donde la fuerza se realiza en todos los puntos de la circunferencia de la estenosis por igual, la incisión permite elegir el punto de corte y la profundidad de este, minimizando el riesgo de perforación. Este aspecto es especialmente útil en las estenosis íleo-anales reduciendo el riesgo de dañar la pared anterior o el esfínter anal, como podría ocurrir con la dilación neumática77. Por el contrario, requiere de mayor destreza y experiencia con este tipo de instrumentos, lo que la hace claramente menos reproducible en todos los centros.
Solo existe un estudio retrospectivo publicado en que se compara con la DEB, pero con dificultad para poder extraer conclusiones por el diseño del estudio y el menor tiempo de seguimiento de los pacientes tratados con EE76.
Dada la escasa evidencia científica, la dificultad técnica y la ausencia de estudios comparativos con la DEB, la EE no se puede considerar como la técnica de primera elección en caso de estenosis cortas en la EC.
¿Es segura la estricturotomía endoscópica? ¿Cuáles son las complicaciones más frecuentes?Según lo reportado, parecería que la EE tendría un menor riesgo de perforación que la DEB al controlar el punto y la profundidad de la lesión en todo momento. Por el contrario, las hemorragias postprocedimiento que requieren ingreso o trasfusión sí que son mayores que con la DEB. En un total de 272 procedimientos en 85 pacientes, un 0,4% presentó perforación que requirió cirugía y 3,4% hemorragia significativa75. Esta hemorragia suele ser un sangrado tardío a los cuatro días posteriores al procedimiento como consecuencia de las ulceraciones creadas por la electro-incisión.
Si la comparamos con la cirugía, la EE podría ser una alternativa más segura en pacientes con estenosis refractarias a la DEB5.
Inyección intralesional de fármacosCon la intención de mejorar la eficacia a largo plazo de la DEB se han estudiado técnicas de inyección local de sustancias para intentar mejorar el curso natural de la cicatrización de la estenosis tras la dilatación.
CorticoidesLa inyección de corticoides en procesos cicatriciales se inició en el campo de la dermatología obteniendo buenos resultados78. En el campo de la digestología se ha utilizado desde hace tiempo para el tratamiento de las estenosis esofágicas refractarias de diversas etiologías, con resultados beneficiosos79,80. En los últimos 20 años se han recogido diferentes experiencias de la respuesta de la inyección intralesional de corticoides (IIC) para el tratamiento de estenosis en pacientes con EC.
¿Cuál es el mecanismo de acción de los corticoides sobre la estenosis?Parece que su capacidad se basa en el hecho de interferir en la síntesis de colágeno, de fibrosis y de los procesos de cicatrización crónica. De la misma forma actúan disminuyendo la cicatrización fibrótica que ocurre después de la dilatación81. También se ha sugerido que la triamcinolona previene la reticulación del colágeno que da como resultado la retracción de la cicatriz, de modo que, si la cicatriz se distiende y se inyecta corticoides en ella, presumiblemente no se producirá la retracción del proceso de cicatrización82.
¿Qué técnica, tipo y dosis?El corticoide más utilizado y referenciado es la triamcinolona, debido a su rápido inicio de acción y su efecto prolongado de unas tres a cuatro semanas83–86. También se han utilizado preparaciones de betametasona y dexametasona a diferentes concentraciones85.
La dosis total de triamcinolona administrada en cada sesión varía entre 40-100 mg, en diferentes concentraciones. Una pauta estándar sería diluir la suspensión del vial de 40 mg (Trigon Depot®, 40 mg/mL), en una solución salina de 2-5 mL y distribuirla en alícuotas de 0,5-1 mL, para ser administradas en cada punto de inyección.
Se realiza una inyección profunda con una aguja de escleroterapia de 5 mm de largo y se administran habitualmente en los cuatro cuadrantes, en el borde anal de la estenosis y entre cuatro y seis pinchazos más tras realizar la dilatación a lo largo de la estenosis, si es técnicamente posible y dependiendo de la longitud de esta.
¿La inyección de corticoides mejora los resultados de la DEB?Existen tan sólo dos estudios aleatorizados y controlados frente a placebo con un número reducido de pacientes. Uno de ellos realizado en población pediátrica en un solo centro, demostró que el uso intralesional de triamcinolona conseguía una reducción del tiempo de redilatación y de cirugía frente al placebo87. El otro estudio, realizado en adultos de diferentes centros, se interrumpió prematuramente por la aparición de una complicación y con resultados peores en el grupo de corticoides83. A pesar del escaso tamaño muestral de este último estudio ha sido considerado como referencia de la mayoría de guías y consensos internacionales, influyendo en que la American College of Gastroenterology y la British Society of Gastroenterology desaconseja el uso rutinario de inyección intralesional de esteroides36,88,89.
El resto de los estudios disponibles son trabajos retrospectivos y no controlados, y donde parecería que la IIC pudiera aportar una mejoría de los resultados en asociación con la DEB85,90.
Por lo tanto y, en resumen, no hay evidencias sólidas que avalen el uso de ICC en la EII.
Anti-TNFEl efecto antiinflamatorio a largo plazo del infliximab puede ser efectivo si se administra a nivel local como refleja algún estudio que, aunque con escaso número de pacientes, han mostrado la efectividad de la inyección intralesional de infliximab en fístulas perianales91,92.
Existen solamente tres trabajos publicados en la literatura donde se ha utilizado el infliximab en el tratamiento de la estenosis en la EC93–95. El número total de pacientes es muy limitado (n = 11) y también varía la dosis de infliximab administrada (de 30 a 120 mg), así como los resultados obtenidos (éxito del 100% a los 12 meses con necesidad de retratamiento, a 0% a los cuatro meses) por lo que se hace difícil realizar recomendaciones sólidas sobre su uso en este contexto. Existe solamente un estudio controlado aleatorizado todavía no publicado, en que se compara la DEB sola vs. asociada a la inyección de adalimumab (estudio CSAI)96. Dadas las características del estudio no se consiguió llegar al número de pacientes necesarios y, por tanto, los resultados de éste son poco valorables, aunque parecería que la inyección de este fármaco tampoco aportaría ningún beneficio a la dilatación96.
En la figura 2 se muestra un algoritmo terapéutico del manejo endoscópico de las estenosis en la EC.
Manejo quirúrgico de la enfermedad de Crohn estenosanteLa finalidad principal de la cirugía en la EC estenosante es el restablecimiento de la calidad de vida relacionada con la salud (supresión del dolor, recuperación de la tolerancia oral, recuperación de la vida laboral y social) ya desde el postoperatorio inmediato mediante la restitución de la continuidad intestinal con mínima morbilidad postoperatoria. En segundo lugar, se debe intentar prevenir la recurrencia posterior y minimizar las potenciales resecciones futuras.
¿En qué circunstancias se debe intervenir un paciente con una estenosis por EC?El 75% de los pacientes con un patrón estenosante precisarán cirugía a lo largo de su vida97. Entre un 6 y un 16% de los casos se presentarán con una complicación aguda que requiera de tratamiento quirúrgico urgente98,99. El tratamiento médico es efectivo en aquellas estenosis con predominio del componente inflamatorio100, y por ende éstas no deben ser intervenidas a no ser que se compliquen y no respondan al manejo médico (hemorragia digestiva baja, perforación, fistulización, plastrón, etc.)101. Serán candidatas a tratamiento quirúrgico aquellas estenosis fibrocicatriciales sintomáticas que hayan fracasado al tratamiento conservador médico o endoscópico (estenosis con repercusión nutricional, con dilatación pre-estenótica > 30 mm, asociadas a anemia sin otra causa que la justifique) y las estenosis asintomáticas con sospecha o riesgo de malignización101.
La localización de la estenosis no cambiará la indicación de cirugía.
¿Cuándo una oclusión intestinal debe intervenirse con carácter urgente y cuándo de forma electiva?La forma más frecuente de presentación consiste en una clínica suboclusiva larvada, como consecuencia del progresivo fracaso al tratamiento médico, con poca repercusión sistémica y que permitirá programar una cirugía de forma electiva. La presencia de una obstrucción intestinal aguda debe tratarse inicialmente con medidas conservadoras (ayuno, hidratación endovenosa y sonda nasogástrica). Como se ha comentado con anterioridad, se deberá valorar el uso de corticoides, en función del riesgo potencial de cirugía99. En casos de obstrucción intestinal parcial que no responde a la terapia médica, la cirugía generalmente se puede programar (urgencia diferida) después de que el paciente esté optimizado (nutrición, inmunosupresión, tratamiento de sepsis, si fuera el caso)99,101,102.
La cirugía de urgencia está indicada en casos raros de obstrucción intestinal completa o ante la sospecha de una isquemia intestinal o una peritonitis103.
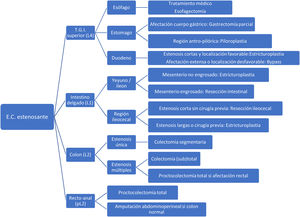
La cirugía es la opción preferida en pacientes con EC ileocecal localizada (estenosis cortas no tributarias a tratamiento endoscópico), con síntomas obstructivos, pero sin evidencia significativa de inflamación activa102.
Es muy importante el balance entre los beneficios del tratamiento médico y los riesgos de demorar una cirugía. Las decisiones se deben someter al comité multidisciplinar ya que ambas opciones, médica y quirúrgica, son igual de válidas como se ha demostrado en el estudio LIRIC104.
Ante una estenosis por EC ¿cuándo debemos resecar y cuándo realizar una estricturoplastia quirúrgica?- Resección: es la técnica quirúrgica más empleada (55% ileocecales y 48% intestino delgado), estando indicada en estenosis cortas (en región ileocecal, intestino delgado y colon) en pacientes naïve a la cirugía, en presencia o sospecha de una transformación neoplásica, en displasia no resecable endoscópicamente (colon), en hemorragia, en recidivas anastomóticas y en aquellas situaciones donde no se pueda realizar otra técnica quirúrgica por las condiciones locales (mesenterio muy engrosado, síndrome adherencial importante, afectación de otras vísceras). De preferencia la resección incluirá el mesenterio, siempre que éste se encuentre afecto (engrosado). El problema aparece cuando se deben practicar varias resecciones intestinales a lo largo de la evolución de la enfermedad (recidivas) o cuando hay que practicar grandes resecciones, con la consecuente pérdida de la función intestinal y finalmente con el riesgo de un síndrome de intestino corto. Por este motivo las resecciones deben ser limitadas y sólo resecar aquel segmento intestinal que presenta la complicación, en este caso la estenosis12. Para evitar resecciones masivas, puede combinarse con las estricturoplastias.
La reconstrucción del tránsito intestinal tras la resección, puede realizarse con anastomosis manuales o mecánicas, término-terminales o latero-laterales. Éstas deben ser amplias y permitir su fácil exploración endoscópica (diagnóstica/terapéutica). Parece que las anastomosis latero-laterales y las mecánicas tienen menos dehiscencia de sutura que las término-terminales y las manuales102. Estudios publicados recientemente apuntan a realizar una anastomosis antimesentérica término-terminal funcional tipo Kono-S105. Los principales resultados de las resecciones son: morbilidad del 15%, reintervenciones del 0-9%, mortalidad del 0,9%, laparotomía del 0,2%106, recurrencia clínica, endoscópica y quirúrgica del 34-40%, 70-100% y 28-45%, respectivamente, así como un total de re-resecciones del 25-35%107.
En presencia de una recidiva anastomótica se realizará una resección de la misma en aquellos casos que no se pueda practicar una estricturoplastia108.
- Estricturoplastia: es la técnica quirúrgica por la cual se aumenta el diámetro de la luz intestinal, sin necesidad de realizar ninguna resección. Es una alternativa eficaz y segura a la resección intestinal, con morbimortalidad similares y menores tasas de recurrencia. Está indicada cuando técnicamente es factible, en las siguientes situaciones: (a) estenosis sintomática sin perforación, fístula o sospecha de malignidad, (b) afectación difusa del intestino delgado con múltiples estenosis (afectación multifocal, afectación extensa de un largo segmento intestinal), (c) estenosis en un paciente que ha sido sometido a una resección previa del intestino delgado o que tiene síndrome del intestino corto, (d) rápida recurrencia de la estenosis, (e) en recidivas anastomóticas y (f) desnutrición. No se aconseja realizar estricturoplastias en el colon por el riesgo de transformación maligna a nivel de la estenosis. En el caso de inflamación grave del mesenterio o del intestino delgado puede ser técnicamente difícil de realizar.
La longitud de la estenosis determinará el tipo de estricturoplastia a realizar109 (tabla 7).
Tipo de estricturoplastias en función de la longitud de la estenosis
| Tipo de estricturoplastias | Longitud estenosis |
|---|---|
| Convencionales tipo Heineke-Mikulicz (HM): HM, Judd, Moskel-Walske-Neumayer, Doble HM, Ileocecal HM | < a 10 cm |
| Procedimientos intermedios: Finney, Jaboulay, HM-Finney, Selvaggi, Finney ileocólico | Entre 10-25 cm |
| Enteroenterostomías: estricturoplastia de Michelassiestricturoplastia de Poggioliestricturoplastia de Sasakiestricturoplastia de Hotokezakaestricturoplastia ileocólica laterolateral isoperistáltica | > 25 cm |
Los resultados obtenidos respecto las estricturoplastias son: morbilidad del 5-23%, recurrencia global del 28-45%, recurrencia quirúrgica del 23-52%, y reintervención a cinco y 10 años del 30 y 75%, respectivamente108.
En presencia de una recidiva anastomótica se realizará de elección, tanto en intestino delgado como en colon, siempre en ausencia de sospecha de malignidad108.
¿En las estenosis de colon es suficiente con una resección segmentaria o es imperativo realizar resecciones más extensas?La evidencia disponible indica que la colectomía segmentaria y la colectomía abdominal total son comparables con respecto al riesgo de recurrencia y de estoma permanente, pero con un tiempo de recurrencia menor para las resecciones segmentarias110,111.
- -
Resección segmentaria: está indicada en estenosis únicas y cortas (< 20 cm) siendo el resto del colon normal. Es la resección preferible en localizaciones proximales (ascendente y transverso) sin afectación distal (rectoanal)102. Se debería intentar incluir en la resección el mesocolon. No se debe realizar en presencia de displasia, ya que por lo general la displasia suele ser multifocal.
- -
Colectomía (sub)total con anastomosis ileo-rectal en 1 o 2 tiempos (CT-AIR): técnica indicada cuando hay afectación de varios segmentos del colon o en la parte distal asociada (colon descendente y sigma)102. El recto y el ano deberían estar respetados y esto sucede entre el 25 y el 50% de los pacientes con afectación colónica. El paciente no debería presentar incontinencia fecal previa a la intervención.
- -
Proctocolectomía total con ileostomía terminal: Esta técnica sería de elección ante la afectación multifocal de rectosigma y/o enfermedad perianal.
La laparoscopia, siempre que sea posible, debe ser la vía de abordaje de elección en la cirugía de la EC. Se ha demostrado que reduce la morbilidad, disminuye la estancia hospitalaria, las adherencias y las hernias incisionales, mejorando los resultados cosméticos101. El cirujano será quien decidirá la vía de abordaje de cada paciente. La cirugía mínimamente invasiva no ha demostrado reducir las tasas de recidiva en comparación con la cirugía convencional112.
¿Tiene algún papel el bypass intestinal en la EC estenosante?Un bypass es un procedimiento quirúrgico que crea un desvío o conducto alternativo, que funciona como un puente entre dos partes. Esta técnica crea un asa ciega, lo que podría conllevar mayor riesgo de sobrecrecimiento bacteriano y empeoramiento de la enfermedad. La no resección de la enfermedad implica riesgo de progresión, sangrado y perforación, así como de malignización. Por todo ello debe ser una técnica de recurso en las afecciones de intestino delgado y colon. En el caso de la afectación del tracto gastrointestinal superior, la causa más frecuente de indicación quirúrgica es la estenosis (83%)113. La gastroyeyunostomía con vagotomía114 (la más frecuentemente realizada), está indicada en la afectación gástrica (antro) y duodenal. Posee una baja morbilidad, con altas tasas de síndrome de dumping, retraso del vaciado gástrico y de úlcera marginal a largo plazo, así como de re-obstrucción115. La vagotomía no es obligatoria, deberá individualizarse cada caso y debe evitarse en pacientes con diarrea crónica, intestino corto o antecedentes de resección de la válvula ileocecal115. El bypass ileocólico se practica como una cirugía de rescate en pacientes que presentan una afectación intestinal extensa que no permite una resección limitada y que la realización de un estoma conllevaría un alto débito con los consecuentes problemas de deshidratación y desnutrición, permitiendo así mejorar las condiciones generales del paciente e iniciar un tratamiento efectivo para mejorar la enfermedad116. También puede utilizarse como puente a la cirugía, para mejorar las condiciones generales del paciente.
En la figura 3 se muestra un algoritmo terapéutico del manejo quirúrgico de las estenosis en la EC.
Recomendaciones GETECCU 2021 sobre el tratamiento de la estenosis en la ECTratamiento médico- 1.
Antes de plantear cualquier tratamiento en una estenosis, es importante realizar una valoración completa de la enfermedad del paciente y de la estenosis con analítica con parámetros inflamatorios, prueba de imagen para valorar la extensión de la enfermedad y de la estenosis, así como escala de síntomas obstructivos.
- 2.
Es indispensable mantener una correcta nutrición del paciente, incluso valorando la necesidad de nutrición enteral y recomendar una dieta sin fibra o pobre en fibra (fibra insoluble) con abundante ingesta hídrica.
- 3.
Ante una oclusión intestinal aguda y si se confirma la presencia de un componente inflamatorio relevante a nivel de una estenosis se debería añadir tratamiento médico que disminuya el edema y mejore los síntomas obstructivos. Este tratamiento bien puede ser inicialmente con esteroides o agentes anti-TNF.
- 4.
En pacientes que presentan una estenosis de intestino delgado asintomáticos o bien con episodios de dolor sugestivos de suboclusión intestinal, se puede plantear tratamiento médico con anti-TNF siempre que cumplan algunos criterios clínicos predictivos de buena respuesta al tratamiento médico:
- -
Corta duración de los síntomas obstructivos
- -
Longitud de la estenosis < 12 cm
- -
Dilatación proximal a la estenosis menor de 29 mm
- -
Presencia de hipercaptación en la fase tardía de T1 en la RM
- -
Ausencia de enfermedad fistulizante
- 5.
La presencia de dilatación previa a la estenosis mayor a 30 mm disminuye la probabilidad de respuesta a un tratamiento médico.
- 6.
Las estenosis de colon, en el caso de no conseguir sobrepasarlas endoscópicamente y dado el riesgo de displasia, serían tributarias de tratamiento endoscópico o quirúrgico.
- 7.
Si una estenosis de la anastomosis es corta y accesible, es preferible el tratamiento endoscópico al tratamiento médico.
- 1.
La DEB es la técnica endoscópica de elección para estenosis cortas en la EC. Cuanto menor sea la longitud de la estenosis mejor será el resultado de la DEB.
- 2.
No hay diferencia entre dilatar estenosis de la anastomosis y estenosis de novo. El verdadero factor determinante del éxito de la dilatación es la longitud de la estenosis.
- 3.
Es aconsejable no retrasar la realización de la DEB una vez el paciente inicia sintomatología obstructiva, además de hacer una intensificación acelerada del tratamiento médico, ya que los pacientes con enfermedades más graves y/o avanzadas tienen peores resultados.
- 4.
La obtención de un éxito técnico de la DEB predice el éxito terapéutico, el cual está directamente relacionado con el diámetro del balón utilizado.
- 5.
La DEB es una técnica segura, pero hay que contraponer la seguridad con el objetivo de conseguir un éxito técnico, sobre todo a la hora de escoger el diámetro de los balones a utilizar.
- 6.
Es recomendable tratar la inflamación subyacente en el lugar de la estenosis antes de una DEB con el objetivo de optimizar su resultado y evitar posibles complicaciones.
- 7.
La DEB es una técnica reproducible en un entorno de práctica clínica habitual y, a diferencia de la cirugía, no parece haber diferencias con relación a su eficacia y seguridad entre hospitales de diferente complejidad asistencial.
- 8.
Aunque hay poca evidencia, la DEB en las estenosis del tracto digestivo alto tiene una eficacia moderada con un buen perfil de seguridad y puede constituir una alternativa a la cirugía.
- 9.
La DEB mediante enteroscopia asistida con balón es una herramienta eficaz y segura en el tratamiento de las estenosis de intestino delgado.
- 10.
A nivel técnico, cuando se realiza una DEB es aconsejable utilizar fluoroscopia, usar una guía larga con punta blanda, introducir un catéter o un balón de Fogarty sobre la guía a través de la estenosis e inyectar contraste, realizar una dilatación secuencial y progresiva, durante la DEB visualizar la estenosis a través del balón y sobrepasar la estenosis con el balón parcialmente hinchado en la punta del endoscopio.
- 11.
La cirugía (tanto resección como estricturoplastia) presenta un mayor intervalo libre de nueva cirugía respecto a la DEB. La DEB presenta un mejor perfil de seguridad respecto a la cirugía sobre todo cuando se evalúan en un entorno de práctica clínica habitual.
- 12.
Las PMA son las únicas que parecen tener alguna utilidad en contra de las prótesis biodegradables.
- 13.
Las PMA no deberían considerarse de primera opción en el tratamiento endoscópico de las estenosis en la EC.
- 14.
Las PMA podrían tener un papel en aquellos casos refractarios a un tratamiento endoscópico previo con DEB, en casos en los que la DEB no haya sido posible o en aquellas estenosis de mayor longitud.
- 15.
Dada la escasa evidencia científica, la dificultad técnica y la ausencia de estudios comparativos con la DEB, la EE no se considera la técnica de primera elección en caso de estenosis en la EC.
- 16.
Se consideran susceptibles de realizar la EE sola o combinada con la DEB en pacientes con estenosis cortas refractarias que previamente hayan tenido una respuesta pobre o parcial a la dilatación.
- 17.
La EE se debe realizar por endoscopistas expertos en la utilización de bisturís, lo que limita un uso generalizado en la mayoría de los hospitales.
- 18.
La evidencia científica respecto la inyección de sustancias en las estenosis en la EC, tanto el uso de corticoides como anti-TNF, es muy escasa y no permite realizar una recomendación sólida al respecto, aunque no parece a priori que aporten un claro beneficio.
- 1.
Serán candidatas a tratamiento quirúrgico aquellas estenosis fibrocicatriciales sintomáticas que hayan fracasado al tratamiento conservador médico o endoscópico (estenosis con repercusión nutricional, con dilatación preestenótica > 30 mm, asociadas a anemia sin otra causa que la justifique) y las estenosis asintomáticas con sospecha de malignización.
- 2.
La presencia de una obstrucción intestinal aguda debe tratarse inicialmente con medidas conservadoras (ayuno, hidratación endovenosa y sonda nasogástrica).
- 3.
La cirugía de urgencia está indicada en casos inusuales de obstrucción intestinal completa o ante la sospecha de una isquemia intestinal o una peritonitis.
- 4.
Las resecciones deben ser limitadas y sólo resecar aquel segmento intestinal que presenta la estenosis.
- 5.
La resección es la técnica quirúrgica más empleada y está indicada en estenosis cortas (en región ileocecal, intestino delgado y colon), en pacientes naïve a la cirugía, en presencia o sospecha de una transformación neoplásica, de displasia no resecable endoscópicamente (colon), de hemorragia, en recidivas anastomóticas y en aquellas situaciones donde no se pueda realizar otra técnica quirúrgica por las condiciones locales.
- 6.
La reconstrucción del tránsito intestinal tras la resección, puede realizarse con anastomosis manuales o mecánicas, término-terminales o latero-laterales.
- 7.
Se recomienda realizar una anastomosis antimesentérica término-terminal funcional manual o una anastomosis mecánica latero-lateral, debiéndose evitar el resto de configuraciones.
- 8.
La estricturoplastia quirúrgica es de elección en presencia de una estenosis larga en un paciente naïve quirúrgico, en estenosis cortas en pacientes con antecedentes de resección intestinal, en estenosis de cualquier longitud en pacientes con riesgo de intestino corto y en presencia de enfermedad multifocal de intestino delgado. También está indicada en recidivas de estricturoplastias y en una recidiva anastomótica tanto en intestino delgado como en colon, siempre en ausencia de sospecha de malignidad.
- 9.
La colectomía segmentaria (estenosis únicas) y la colectomía (sub)total (estenosis múltiples) para el tratamiento de la enfermedad de Crohn del colon son comparables con respecto al riesgo de recurrencia y de estoma permanente.
- 10.
La laparoscopia, siempre que sea posible, debe ser la vía de abordaje de elección en la cirugía de la EC.
Este documento de posicionamiento no ha recibido ninguna financiación para su elaboración.
Conflicto de interesesCarme Loras ha sido ponente o ha recibido financiación para investigación de Boston Scientific.
Miriam Mañosa ha sido ponente, consultor y ha recibido financiación para investigación de MSD, AbbVie, Janssen, Kern Pharma, Takeda, Gillead, Pfizer, Ferring, Faes Farma, Shire harmaceuticals, Dr. Falk Pharma, Chiesi and Adacyte.
Xavier Andújar no tiene conflicto de interés.
Vicente Sánchiz no tiene conflicto de interés.
Marc Martí-Gallostra ha sido ponente por AbbVie y Takeda. Profesor del Máster de enfermería colorrectal de Coloplast.
Yamile Zabana ha sido ponente o ha recibido financiación para investigación de AbbVie, MSD, Ferring, Amgen, Janssen, Pfizer, Dr. Falk Pharma, Tillots, Galapagos.
Ana Gutiérrez ha sido ponente o ha recibido financiación para investigación de AbbVie, MSD, Kern, Ferring, FAES, Amgen, Roche, Sandoz, Janssen, Pfizer, Dr. Falk Pharma, Tillots, Galapagos.
Manuel Barreiro-de Acosta ha sido ponente, consultor y ha recibido financiación para investigación de MSD, AbbVie, Janssen, Kern Pharma, Celltrion, Takeda, Gillead, Celgene, Pfizer, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Gebro Pharma, Adacyte and Vifor Pharma.