En las 2 últimas décadas la ventilación mecánica no invasiva (VNI) se ha consolidado como estrategia inicial para el abordaje de la insuficiencia respiratoria en el paciente crítico adulto y pediátrico.
ObjetivosIdentificar los factores de riesgo y estrategias preventivas para disminuir la incidencia de lesiones cutáneas asociadas a dispositivos clínicos (LESADIC) relacionadas con la VNI, así como el tratamiento más eficaz para las lesiones que no se han podido evitar.
MetodologíaRevisión en las bases de datos MEDLINE, CINAHL y Cochrane de estudios publicados en los últimos 10años para llegar al consenso mediante panel de expertos.
ResultadosLos conocimientos acerca de cómo medir la talla correcta de máscara y la protección de la piel con apósitos de espuma o hidrocoloides son factores relacionados con la incidencia de LESADIC, pues condiciona el grado de presión-fricción y cizalla que la interfaz ejerce sobre la piel. La interfaz que menos LESADIC causa y es mejor tolerada es la máscara facial. Cuando hay lesiones, lo primero es retirar la interfaz que provoca presión sobre la piel dañada, recomendando como alternativa el casco Helmet®, tratar la infección, gestionar el exudado y estimular piel perilesional.
ConclusionesLa máscara de elección es la facial, siempre con uso de apósitos de espuma o hidrocoloides en el puente nasal. Evaluar el estado de la piel debajo la interfaz y arnés entre las 4h (recomendable) y 11h (máximo). Valorar la estrategia de rotación de la interfase a las 24h si la VNI sigue siendo necesaria de forma continuada.
In the last two decades, non-invasive mechanical ventilation (NIV) has been consolidated as an initial strategy for the management of respiratory failure in critical adult and paediatric patients.
ObjectivesTo identify risk factors and preventive strategies to reduce the incidence of skin lesions associated with clinical devices (LESADIC) related to NIV, as well as the most effective treatment for injuries that cannot be avoided.
MethodologyReview in the MEDLINE, CINAHL and Cochrane databases of studies published in the last 10years to reach consensus through an expert panel.
ResultsKnowledge about how to measure correct mask size and protection of the skin with foam or hydrocolloids dressings are factors related to the incidence of LESADIC, as it conditions the degree of pressure-friction and shear that the interface exerts on the skin. The interface that causes fewer LESADIC and is better tolerated is the face mask. When there are injuries, the first thing is to remove the interface that causes pressure on damaged skin, recommending a Helmet® hood as an alternative, treating the infection, managing the exudate and stimulating perilesional skin.
ConclusionsThe mask of choice is the facial, always using foam or hydrocolloid dressings on the nasal bridge. Evaluate the condition of the skin under the interface and harness every 4hours (recommended) and 11hours (maximum). Evaluate the rotation strategy of the interface at 24hours if the NIV is still needed on an ongoing basis.
En las 2 últimas décadas el uso de la ventilación mecánica no invasiva (VNI) se ha triplicado1, consolidándose como estrategia inicial para el abordaje de la insuficiencia respiratoria tanto en adultos como en pediatría2-4. Sin embargo, la aplicación de la VNI sigue asociándose a la aparición de lesiones cutáneas relacionadas con los dispositivos clínicos que se utilizan durante la terapia5-8. Una reciente revisión bibliográfica de 62 ensayos clínicos6 mostró una incidencia de lesiones cutáneas entre el 2 y el 50%, si bien esta aumentaba al 100% pasadas 48h de VNI. Esta variabilidad en la incidencia puede explicarse porque solo el 45% de los estudios revisados aportaban datos relacionados con la incidencia de complicaciones, entre otras las lesiones cutáneas. Anteriormente, una revisión de Gay5 encontró una incidencia del 10-20%. Estudios unicéntricos9 han encontrado incidencias del 7% en pacientes tratados con VNI por un período >72h o del 1,7% con uso mayoritario de la máscara facial, sin especificar tiempo de contacto con esta10.
Las lesiones producidas por el uso de las interfases y/o arneses para la VNI se clasifican dentro del grupo lesiones asociadas a dispositivos clínicos (LESADIC), usados estos con objetivos diagnósticos o terapéuticos, y en las que la lesión tiene la misma configuración que el dispositivo.
En adultos representan un tercio del porcentaje total de úlceras por presión (UPP)11 y las relacionadas con la VNI suponen entre el 10 y el 17% de las LESADIC12,13. En el paciente crítico pediátrico, las UPP relacionadas con dispositivos respiratorios tienen una prevalencia del 60,1% y, de ellas, el 78,8% están vinculadas específicamente con la modalidad continuous positive airway pressure (CPAP)14.
El manejo de la interfaz, selección, colocación y adecuación de la talla se relaciona con el éxito o fracaso de la VNI, así como con la incidencia de LESADIC9,15,16. Además, condiciona el grado de confort del paciente, motivo frecuente de suspensión de la VNI, y el nivel de fugas, que se relaciona con la sincronización paciente-ventilador, factor de riesgo de fracaso de la terapia especialmente en pacientes con insuficiencia respiratoria crónica agudizada6. Cabrini et al.17 detectaron que en el 42% de los pacientes ingresados en salas de hospitalización la VNI fracasaba por manejo inadecuado de la interfaz, siendo el equipo de enfermería el mayor responsable por estar a pie de cama las 24h del día monitorizando la evolución de la terapia.
El objetivo del presente documento es realizar una síntesis basada en la evidencia científica sobre los factores de riesgo y estrategias preventivas para disminuir la incidencia de LESADIC relacionadas con la VNI, así como consensuar el tratamiento más eficaz para las lesiones que no se han podido evitar.
Justificación de la necesidad de elaborar el documentoDado que todavía no existe la interfaz ideal (mínimas fugas, no traumática pero estable, no deformable, no alergénica, con mínimo espacio muerto, de bajo coste y disponible en diversas tallas), tampoco el sistema de sujeción óptimo para su correcta colocación y mantenimiento (fácil de poner y quitar, transpirable, compatible con diversas interfases, reutilizable)15 ni consenso de cuál ha de ser el mejor método como barrera para proteger la piel18,19, es necesario identificar qué estrategias pueden prevenir las lesiones cutáneas asociadas a la interfaz y el arnés.
Del mismo modo, y según todo lo expuesto anteriormente, es necesario que las sociedades científicas vinculadas al paciente crítico, con independencia de la unidad donde este se encuentre ingresado (por ejemplo, cuidados intensivos o semicríticos, servicios de urgencias, reanimación posquirúrgica, atención extrahospitalaria, entre otros), con la ayuda de las sociedades expertas en la prevención y tratamiento de las UPP, consensuen recomendaciones básicas para el cuidado de la piel de los pacientes tratados con VNI.
Objetivos principales y secundarios- 1.
Identificar los mecanismos que se relacionan con la aparición de lesiones cutáneas durante la VNI, en el paciente adulto y en el paciente pediátrico.
- a)
Describir los factores de riesgo para el desarrollo de lesiones cutáneas asociadas a la presión-cizalla y fricción provocada por la interfaz.
- b)
Identificar otros posibles elementos diferentes de la interfaz que puedan originar lesiones cutáneas durante la VNI (arnés, por ejemplo).
- a)
- 2.
Consensuar medidas preventivas para prevenir dichas lesiones cutáneas asociadas a la VNI, en el paciente adulto y en el paciente pediátrico.
- 3.
Enumerar recomendaciones para la protección de la piel ante la presión-cizalla y fricción de dispositivos asociados a la VNI.
- 4.
Identificar el tratamiento más adecuado para tratar las lesiones cutáneas asociadas a la VNI, en el paciente adulto y en el paciente pediátrico.
Profesionales que atienden al paciente crítico: enfermeras, médicos (intensivistas, anestesistas, neumólogos, urgenciólogos), fisioterapeutas respiratorios.
Población de estudioPaciente agudo hospitalizado (unidades de cuidados intensivos o semicríticos, reanimación posquirúrgica, urgencias) o tratado en la atención prehospitalaria urgente.
No consideramos en este documento los pacientes con VNI domiciliaria porque sus condiciones basales son muy diferentes de las del paciente crítico, que se encuentra en un estado de hipoperfusión periférica y a menudo presenta alteraciones metabólicas que comprometen gravemente su capacidad para protegerse frente a lesiones cutáneas.
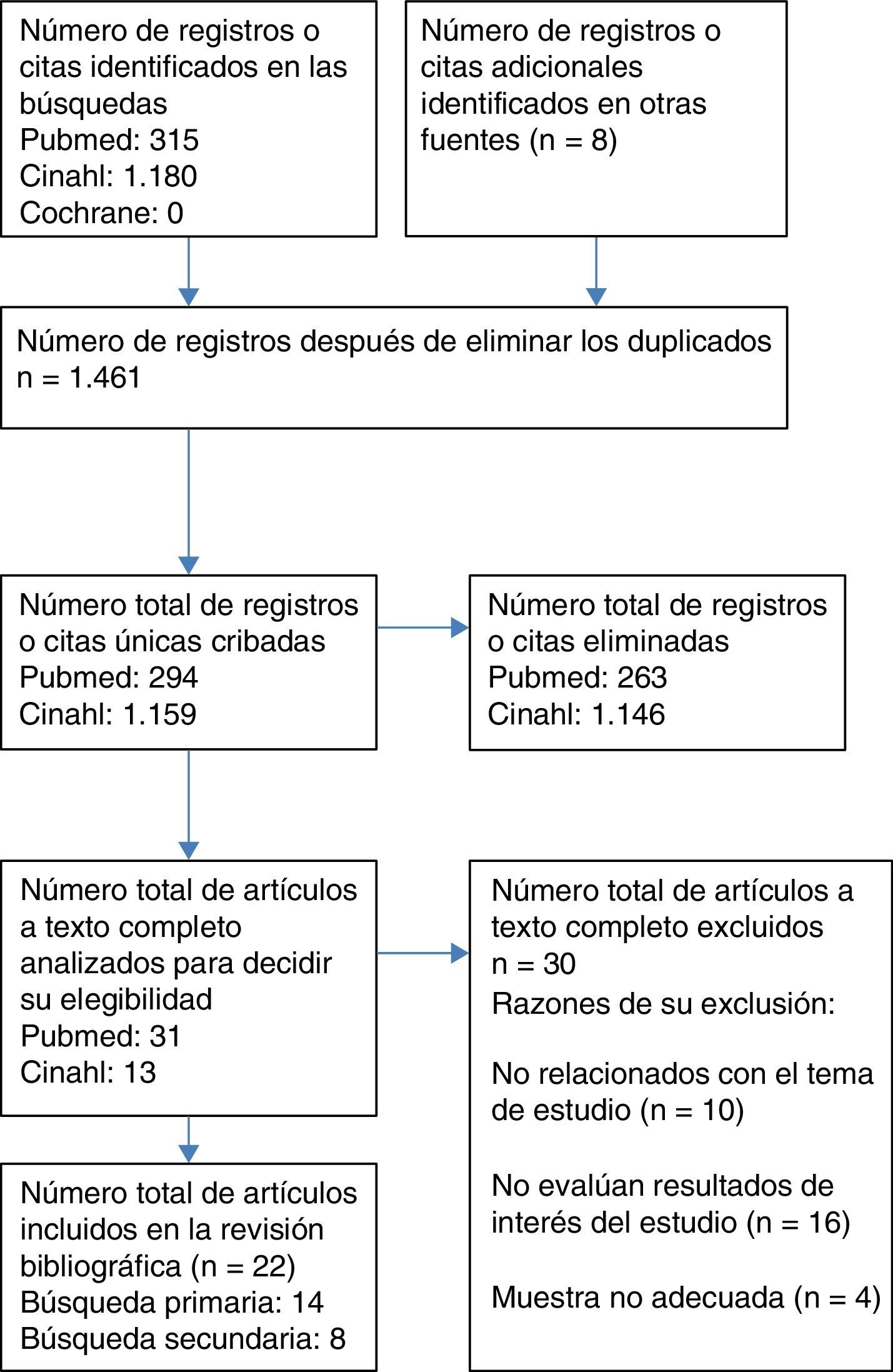
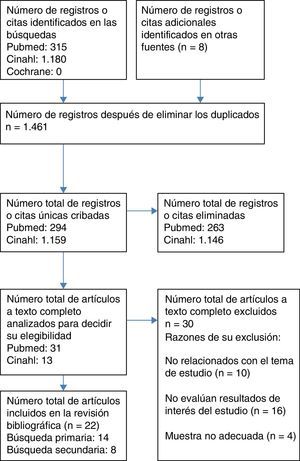
Recursos utilizadosSe completó en fecha 1 de agosto de 2016 una revisión bibliográfica de forma independiente por los 4 revisores del estudio, en las bases de datos MEDLINE (vía PubMed), CINAHL y The Cochrane Library, cuyo proceso de selección de artículos consta en el diagrama de flujo del paciente adulto (fig. 1). Los filtros utilizados fueron artículos publicados los últimos 10años (2006-2016), sin limitación a priori del idioma, seleccionando para adultos de 19 o más años y para pediátricos de 0 a 18años. Los siguientes términos fueron utilizados para la búsqueda de literatura científica relacionada:
Pressure ulcers AND noninvasive ventilation.
Friction injuries OR moisture-associated skin damage OR skin lesions OR pressure ulcer AND mechanical ventilation.
Mask OR interface AND lesions AND noninvasive ventilation complications.
Friction injuries OR moisture-associated skin damage OR skin breakdown OR pressure ulcer AND mask OR interface.
Término MESH: masks/adverse effects.
Adicionalmente, se realizó una búsqueda inversa a partir de las referencias bibliográficas de los estudios seleccionados que, junto con otras fuentes no identificadas a partir de la revisión, constituyen los artículos citados como revisión secundaria en la figura 1.
Tipo y número de fuentes bibliográficas consultadasEl número total de artículos seleccionados fue de 30, clasificados según:
- -
Factores de riesgo identificados (tabla 1, material suplementario): estado de la piel, tiempo de exposición a la interfaz, número aplicaciones de la VNI y tiempo total de cada aplicación, horas totales VNI, tipo de interfaz, tipo de ventilador/programación ventilador, experiencia del equipo.
- -
Estrategia preventiva propuesta (tabla 1, material suplementario): uso de apósitos, uso de cojines hinchables en la interfaz, estrategia de rotación de la interfaz, tipo y colocación de la interfaz, escala de valoración del riesgo y frecuencia de la valoración, tiempo de descanso entre aplicaciones de la VNI.
- -
Tratamiento propuesto para las lesiones (tabla 2, material suplementario).
- -
Se siguió la misma metodología para la revisión bibliográfica del paciente pediátrico, incluyendo finalmente 8 artículos, cuyo diseño y contenido se describen en la tabla 3 (material suplementario), clasificados de la misma manera que en el paciente adulto.
De los 30 estudios revisados, 3 generan evidencia nivelib (ensayo clínico aleatorizado), 2 de niveliia (ensayo clínico no aleatorizado) y 16 de niveliii oiv (estudios no experimentales y/o panel de expertos). De los restantes, 5 son casos clínicos, 3 revisiones bibliográficas y uno guía clínica: uso de la VNI en la enfermedad pulmonar obstructiva crónica20, que en los aspectos que concierne a las lesiones cutáneas solo expone recomendaciones de grado C.
Metodología utilizada para la formulación de las recomendacionesDada la variabilidad en el nivel de evidencias, no se utilizará la guía GRADE, sino que las recomendaciones se basarán en el consenso de un panel de expertos, con revisión posterior por los comités científicos y/o grupos de trabajo de las sociedades de cuidados al paciente crítico (SEEIUC, SECIP) del Grupo Nacional para el Estudio y Asesoramiento en Úlceras por Presión y Heridas Crónicas (GNEAUPP) y de la Asociación Internacional de Ventilación No Invasiva.
Metodología de trabajoLa búsqueda bibliográfica se ha realizado de forma independiente por los revisores del estudio, compartiendo online los documentos seleccionados y siendo la comunicación por email y videoconferencia las más usadas.
Contenido del documentoDefinición y epidemiología de las lesiones cutáneas asociadas a la ventilación mecánica no invasivaLa definición de UPP ha evolucionado a lo largo de los años, siendo la más actual (2014) la del GNEAUPP21,22: «Una lesión localizada en la piel y/o el tejido subyacente por lo general sobre una prominencia ósea, como resultado de la presión, o la presión en combinación con las fuerzas de cizalla. En ocasiones, también pueden aparecer sobre tejidos blandos sometidos a presión externa por diferentes materiales o dispositivos clínicos». Las UPP se clasifican atendiendo a la profundidad de los tejidos afectados, estableciendo el GNEAUPP21 5 categorías y el National Pressure Ulcer Advisory Panel (NPUAP) y el European Pressure Ulcer Advisory Panel (EPUAP)23 6, al añadir la categoría de «no estadificable» a las 5 previas (tabla 1).
Clasificación de las úlceras por presión
| Categoría | Definición |
|---|---|
| Categoría I: eritema no blanqueable | Piel intacta con enrojecimiento no blanqueable (llenado capilar) de un área localizada generalmente sobre una prominencia ósea, aunque también puede aparecer sobre tejidos blandos sometidos a presión externa por diferentes materiales o dispositivos clínicos |
| Categoría II: úlcera de espesor parcial | Pérdida de espesor parcial de la dermis, que se presenta como una úlcera abierta poco profunda con un lecho de la herida normalmente rojo-rosado y sin la presencia de esfacelos |
| Categoría III: pérdida total del grosor de la piel | Pérdida completa del tejido dérmico. La grasa subcutánea puede ser visible, pero no estructuras más profundas. La profundidad de esta categoría varía según la localización anatómica y la presencia de tejido adiposo subcutáneo, siendo poco profundas en zonas sin su presencia (puente de la nariz) o muy profundas en su presencia |
| Categoría IV: pérdida total del espesor de los tejidos | Pérdida total del espesor del tejido con hueso, tendón o músculo expuesto. Su profundad también varía en función de la zona anatómica y el tejido subcutáneo adiposo que contenga |
| Lesión de tejidos profundos | Área localizada con forma más irregular (generalmente no tan redondeada como el resto de lesiones por presión), que presenta por lo general un doble eritema, el segundo más oscuro (color púrpura o marrón) y dentro del primero, que pueden estar desplazadas entre 30-45° de las crestas óseas |
| Inclasificable: profundidad desconocida (incluida solo en la clasificación de NPUAP) | Pérdida completa del tejido dérmico, con la presencia en el lecho de la úlcera de esfacelos y/o escara, que hasta que no sea desbridado no permite conocer la verdadera profundidad, por lo que no se puede clasificar. Cuando se desbrida el esfacelo o tejido necrótico presente, observaremos una úlcera de categoríaiii o iv |
Los pacientes con dispositivos clínicos tienen 2,4 veces más riesgo de desarrollar UPP que los pacientes que no llevan dichos dispositivos24. En consecuencia, los portadores de VNI son susceptibles de padecer LESADIC, siendo las principales fuerzas implicadas en la aparición de dichas lesiones la presión, la fricción y la cizalla. Junto con las lesiones cutáneas asociadas a la humedad (LESCAH), «lesión localizada en la piel que se presenta como una inflamación y/o erosión de la misma, causada por la exposición prolongada a diversas fuentes de humedad con potencial irritativo para la piel», se enmarcan dentro del nuevo paradigma de lesiones relacionadas con la dependencia21,22,25.
Las LESADIC se clasifican según el tipo de dispositivo clínico que las ha causado26:
- -
Dispositivos respiratorios: tubo endotraqueal, máscara oronasal, gafas de oxígeno, cánula de traqueotomía.
- -
Líneas vasculares: catéter venoso central, periférico, para hemodiálisis, arterial, para medir la presión intracraneal, epidural.
- -
Dispositivos en el sistema gastrointestinal/genitourinario: sonda naso/orogástrica, tubo de enterostomía, catéter urinario, sistema de colección fecal.
- -
Dispositivos para monitorización: conectores de presión arterial, cables de electrocardiograma, sonda del pulsioxímetro.
- -
Dispositivos para prevención de riesgos: medias de compresión antitrombótica, sujeciones mecánicas.
Las LESADIC tienen una prevalencia de entre 8,8-40%11,13,24,26,27. El problema añadido de las LESADIC es que se detectan cuando ya están en un grado avanzado. El 74% de ellas se detectan en estadioiii oiv, mientras que en úlceras no asociadas a dispositivos clínicos el porcentaje de lesiones en estos estadios es del 54%24. Solo se detectan un 5% de LESADIC en estadioi comparado con un 20% en lesiones no asociadas a dispositivos clínicos13.
Un 70% de las LESADIC se presentan en la cara anterior del cuello, barbilla, área occipital o nariz, mientras que solo un 8% de las lesiones no asociadas a dispositivos clínicos lo hacen en dichas regiones24. Entre las LESADIC predominan las lesiones en el puente nasal y son de mayor gravedad (categoríaii oiii). Según Diez et al.28, la incidencia de lesiones en la nariz es del 5 al 20%. Les siguen las lesiones en mejillas, frente y barbilla, pero mayormente son eritema o categoríai. Pueden afectar las mucosas, por lo que se debe evaluar periódicamente el estado de las mucosas, al igual que el de la piel, que están en contacto con el dispositivo clínico26. En el paciente pediátrico la lesión más común también es en el puente de la nariz (39%), seguido de la mejilla izquierda (30%), la derecha (18%) y la barbilla (3%)8,29.
Fisiopatogenia de las lesiones cutáneas asociadas a la ventilación mecánica no invasivaEn las LESADIC la lesión es producida por la presión que ejerce el dispositivo sobre la piel y la mucosa del paciente, causando isquemia tisular y compromiso en el aporte de oxígeno y nutrientes a los capilares, así como deficiente eliminación de las sustancias de desecho metabólico, las cuales se acumulan y son causa de vasodilatación a nivel local. Eso contribuye a la formación de edema y, por tanto, aumento de la presión sobre los vasos sanguíneos, generando todavía más edema e isquemia. El edema aumenta por sí mismo el riesgo de lesión porque tensa la piel y la convierte en más frágil. Las úlceras se desarrollan por la presión aplicada sobre piel y tejido exacerbado por los ciclos de isquemia-reperfusión con formación de toxinas radicales libres. La lesión puede producirse con tan solo un ciclo de 2h de isquemia8.
Además, el dispositivo clínico aumenta la sudoración por debajo de su superficie de apoyo, provocando microcambios climáticos que pueden macerar la piel y aumentar el coeficiente de fricción, siendo causa esto de que las capas epidérmicas se remuevan y conviertan la piel en más susceptible a los efectos de la presión12.
La otra fuerza causante de LESADIC es la fricción, cuando 2 superficies en contacto se mueven en la misma dirección, pero en sentido contrario oponiéndose una de ellas (dispositivo clínico) a la otra (piel)21,30. La fricción puede ser de 2 tipos: estática o dinámica22. En la estática, cuando el dispositivo se ha colocado con demasiada presión, ejerce una fuerza contra la piel del paciente que, junto con la gravedad, produce un efecto de cizalla. En la dinámica, el dispositivo se desliza desde su posición inicial (favorecido por la sudoración, la humedad de la condensación del aire en el dispositivo, dispositivo mal fijado), encontrando la resistencia de la piel.
Consideraciones especiales de las lesiones asociadas a la ventilación mecánica no invasiva en el paciente críticoEn el paciente crítico, además de los efectos ya comentados de presión, fricción, cizalla y humedad, existen otros factores de riesgo para el desarrollo de lesiones cutáneas asociadas a la VNI31,32, como:
- -
Inestabilidad hemodinámica: incrementa la respuesta inflamatoria a nivel local, con ello más edema e isquemia tisular. Un indicador es el tiempo de presión arterial media <60-70mmHg32.
- -
Fármacos vasoactivos: implican vasoconstricción y, por lo tanto, disminución de la perfusión a tejidos distales como la piel.
- -
Nutrición deficiente: la falta de proteínas altera la presión oncótica y facilita la formación de edema tisular.
- -
Duración de la ventilación mecánica: se asocia a inmovilidad, disminución de consciencia por uso de sedantes y analgésicos, incontinencia y riesgo de lesiones asociadas a la humedad. Se relaciona además con problemas hemodinámicos y respiratorios que conllevan deficiente oxigenación tisular.
La duración de la ventilación mecánica se ha identificado con un riesgo 10% superior de sufrir úlceras33. Según el estudio de Nijs et al.34, los factores de riesgo relacionados con el desarrollo de úlceras en el paciente crítico son:
- •
Durante las primeras 24h de ingreso:
- -
Dopamina <5μg/kg/min (OR: 6,05; IC95%: 1,88-19,54).
- -
Antecedentes clínicos de patología vascular (OR: 4,51; IC95%: 1,99-10,24).
- -
Hemodiálisis (continua o intermitente) (OR: 3,77; IC95%: 1,03-13,86).
- -
- •
Durante las primeras 48h de ingreso:
- -
Antecedentes clínicos de patología vascular (OR: 2,85; IC95%: 1,29-6,3).
- -
Hemodiálisis (continua o intermitente) (OR: 9,43; IC95%: 3,01-29,51).
- -
Ventilación mecánica (OR: 4,82; IC95%: 1,74-13,36).
- -
Finalmente, se considera que el riesgo de lesión por alteración del estado basal de la piel puede depender de factores como edad avanzada, niveles bajos de hemoglobina y de albúmina, alteración de la fórmula leucocitaria, déficit de vitaminaD y administración de corticoesteroides, todas ellas condiciones habituales en el paciente crítico13,35,36.
Respecto al paciente crítico pediátrico, además de los factores de riesgo ya mencionados, cabe destacar: bajo peso al nacer, edad gestacional y estancia en UCI prolongada14,18,37, así como que los niños menores de 2años tienen más riesgo de sufrir úlceras por presión18.
Medidas preventivas para las lesiones cutáneas asociadas a la ventilación mecánica no invasivaMedidas preventivas generalesSegún la NPUAP23, debe considerarse a cualquier persona que lleve un dispositivo clínico como paciente con potencial riesgo de desarrollar una UPP. Recomienda inspeccionar la piel de debajo de los dispositivos clínicos como mínimo 2 veces al día para visualizar posibles lesiones, y más frecuentemente en aquellos en contacto con fluidos o con presencia de edema.
La identificación del riesgo del paciente a padecer una UPP, mediante una escala validada en pacientes críticos, tanto adultos como pediátricos (por ejemplo, la de Braden), debería ser aplicada inmediatamente en el ingreso y a intervalos regulares (o ante la presencia de algún cambio) a todos los pacientes para la clasificación de su riesgo31,38.
Rondinelli39 observó que los pacientes críticos con LESADIC que puntuaban más bajo en la subescala de Braden «Friction and Shear» (traducida al español como «Roce y peligro de lesiones») tenían un riesgo 2,5 veces superior de padecer una LESADIC (IC95%: 1,12-5,53).
Medidas preventivas para lesiones cutáneas por la presión/cizalla-fricciónPreviamente a la implementación de la VNI, es necesaria la aplicación de apósitos de cura basada en ambiente húmedo (CAH) para disminuir las fuerzas de presión y fricción8,12,20,28,31,36,40-44. Weng35 demostró que el uso de un apósito de CAH frente a no utilizarlo mejoraba la incidencia de lesiones durante la VNI (53,3% vs 96,7%, p<0,001). Aunque no existe evidencia de la superioridad de un apósito sobre otro, estos disminuyen la presión y la fricción, evitando el desplazamiento de la máscara por la humedad o por el peso de la gravedad, con lo que se facilita una óptima sincronización paciente-ventilador sin tener que apretar en exceso la máscara contra la piel45. Además, los apósitos proporcionan mayor confort al paciente46.
Otras estrategias recomendadas para disminuir la presión de la interfaz sobre la piel son: 1)dejar pasar 2 dedos entre el arnés y la piel de la cara47; 2)colgar el circuito del ventilador en un soporte para evitar el desplazamiento de la máscara15, o 3)incrementar el nivel de presión positiva en modalidades de presión positiva continua en la vía aérea (CPAP) que funcionan con sistemas no mecánicos como Whisperflow36. En modalidades mecánicas, el nivel de presión positiva inspiratoria en la vía aérea y de presión positiva espiratoria en la vía aérea no se ha relacionado con la incidencia de lesiones cutáneas41.
En el paciente crítico pediátrico es importante elegir la mascarilla del tamaño adecuado según la cara del paciente y realizar un ajuste correcto de las cintas de sujeción de la interfase mediante el velcro8,48.
Medidas preventivas para el control de la humedadLa NPUAP23 recomienda mantener la piel que se encuentra bajo los dispositivos clínicos limpia y seca. La aplicación de un producto barrera no irritante puede ayudar a mantener la piel seca, pues la micropelícula que forma sobre la piel puede evitar el contacto de la humedad externa con la piel49. Sin embargo, faltan estudios sobre diferentes tipos de barreras para la piel que permitan un consenso sobre la mejor opción19.
Se recomienda el uso de apósitos de CAH que no gelifiquen para gestionar la humedad cutánea, que macera la piel y la convierte en más frágil8,12,35.
Medidas preventivas asociadas a la interfase y/o ventiladorSelección de la interfazLa colocación adecuada de la interfaz es de vital importancia para el éxito de la implementación de la VNI. Una mala sujeción de la interfaz puede aumentar la fuga no intencionada y con ello la asincronía paciente-ventilador, incrementando el autociclado y los esfuerzos respiratorios ineficaces. En cambio, una sujeción excesiva puede aumentar el riesgo de lesiones en la piel, provocando molestias en el paciente e intolerancia a la terapia, que si es grave puede conllevar la retirada de la VNI50,51. Por ello, es imprescindible formar al personal sanitario en el manejo de las interfases (selección de la talla y colocación adecuada)52. El Royal College of Physicians20 recomienda usar los medidores de talla que llevan incorporados los envoltorios comerciales de algunas máscaras.
La máscara de elección debe ser la facial (cubre ojos, nariz y boca), porque provoca menos lesiones8,10,19,20,28,40,41, menos dolor en el puente nasal10,53 y es mejor tolerada por los pacientes40,54, aunque en algunos provoca claustrofobia53.
Según Raurell-Torredà et al.51, la máscara facial fuga menos que la oronasal, con lo cual las enfermeras la aprietan menos contra la cara del paciente.
Las lesiones asociadas con la máscara facial aparecen casi siempre en el puente nasal10 por los problemas de adaptación a las distintas formas de la nariz, faltando más tallas diversas de la interfaz o un material elástico que se adapte a las narices prominentes o curvadas. Por ello, es recomendable proteger el puente nasal con apósitos (espuma o hidrocoloides) para disminuir la presión, la fricción o la humedad por el contacto de la interfaz sobre esta zona delicada.
Como máscara de elección en segunda opción (para rotar los puntos de presión y evitar los efectos adversos de una máscara en particular) se recomienda:
- •
El casco Helmet® en:
- -
Pacientes sin dientes o prótesis que no se adaptan por cambios anatómicos durante la estancia hospitalaria, o bien bajo nivel de consciencia que no permite el uso de la prótesis por seguridad del paciente.
- -
Pacientes que mueven inconscientemente la barbilla (habitual en pacientes con diagnóstico de Alzheimer o Parkinson, por ejemplo).
- -
Pacientes con barba que no se puede afeitar por indicación del paciente y/o familia.
- -
Pacientes con lesiones cutáneas en puente nasal, mejillas o barbilla.
Se debería escoger el casco Helmet36,47 en su nueva versión, que se fija con collar rígido y no brazales en axilas. Respecto el modelo anterior, este casco tiene menor espacio muerto y funciona con doble circuito, por lo que reduce el riesgo de reinhalación y permite mejor sincronización paciente-ventilador en modalidad de presión de soporte o asistida controlada por presión, siempre con PEEP elevada55.
- -
- •
La máscara oronasal (cubre nariz y boca):
- -
En pacientes sin los problemas descritos en el párrafo previo.
- -
En pacientes que tengan propensión a la claustrofobia o poco colaboradores que rechazan la máscara facial como primera opción.
- -
Respecto a la máscara oronasal, cuidado en no hinchar excesivamente los cojines porque evitaremos precisamente la función para la que se incorporan en algunos modelos de máscara, facilitar la adaptación a la cara del paciente36. Algunos autores defienden el uso de interfases con soporte en la frente para disminuir la presión sobre el puente nasal28.
En lo concerniente al paciente pediátrico, a pesar de que la máscara de elección debe ser la facial porque se relaciona con menos lesiones comparada con la oronasal y la nasal, cabe destacar la existencia de una interfase nasal «Sleep Weaver» cuyo material es de tela19, pero de la que hay poca experiencia reportada.
Sujeción de la interfazAl igual que con las zonas de contacto de la máscara con la piel, cuando el arnés se aprieta sobre áreas que están edematosas (con más riesgo de isquemia tisular) debería protegerse dicha piel con apósitos que distribuyan la presión y absorban la humedad12. Debe inspeccionarse la zona occipital con la misma frecuencia con la que se evalúa el estado de la piel, ya que con frecuencia se olvida en las LESADIC56. En el caso del casco Helmet® deben protegerse las zonas de contacto del collar rígido con la piel con espumas para disminuir la presión.
Selección del ventiladorMediante una escala Likert del 1 al 4, siendo 1 el paciente relajado y confortable y 4 el paciente con agitación e incapacidad para mantener bien colocada la máscara, en los niveles 3 o 4, es decir, pacientes poco colaboradores, usar para la terapia ventiladores específicos de VNI, que se manejan mejor y se adaptan más rápido a los cambios en el volumen de fuga57,58.
En unidades habituadas al manejo de ventiladores convencionales de UCI debe formarse el equipo asistencial en el concepto tolerancia a la fuga antes de iniciarse en la VNI, porque si no se tiende a apretar en exceso la máscara contra la cara del paciente, provocando intolerancia a la misma y rechazo del paciente a la terapia51.
Tiempo de exposición a la interfazSea cual sea la interfaz elegida, la primera valoración de la piel y mucosas afectadas por el dispositivo (interfaz y arnés) debería realizarse durante las primeras 2-4h de inicio de la VNI, coincidiendo con la valoración respiratoria y gasométrica que debe hacerse para evaluar la efectividad de la terapia20. En caso de que el paciente no tolere la retirada de la interfaz, o en caso de que haya prescripción médica de no retirar el dispositivo24, el equipo multidisciplinar debería revalorar la indicación de intubación traqueal y ventilación mecánica invasiva, porque la demora en la identificación de los signos y síntomas de fallo de la VNI se asocia a una mayor mortalidad1,59,60. Si se decide continuar con la VNI, debe reevaluarse el estado de la piel y las mucosas cada 4h si el paciente lo tolera a nivel respiratorio y gasométrico8,14,19,42,43,61,62.
En el caso de los pacientes que necesitan VNI continua, teniendo en cuenta que el tiempo máximo de utilización de una interfaz sin descanso son 11h56, y en particular en aquellos pacientes que presentan inestabilidad durante la recolocación de la interfaz, debe retirarse la máscara y dejar reposar piel y mucosas en un intervalo entre 4h (recomendable) y 11h (de riesgo). Se recomienda retirar la interfaz como mínimo 10min para garantizar la oxigenación40, siendo deseable 30min, para comprobar si el enrojecimiento desaparece o se debe considerar úlcera de categoríai56.
Los apósitos no evitan las lesiones en pacientes con más de 12h de exposición continua a la interfaz, por lo que deberán alternarse interfases diferentes para rotar los puntos de presión y en particular si la interfaz de elección ha sido la oronasal. Si la máscara elegida fue la facial total o el casco Helmet®, podrá continuarse con la misma, reevaluando piel y mucosas cada 4h si es posible, máximo a las 12h, respetando los descansos comentados63.
Después de las primeras 24h de VNI debe valorarse la rotación de la interfaz, porque aumenta considerablemente el riesgo de lesión41, aunque debería individualizarse esta decisión en función del estado de la piel, la tolerancia del paciente a la interfaz y la previsión de horas de VNI.
Tratamiento de las lesiones cutáneas asociadas a la ventilación mecánica no invasivaLa revisión de la literatura con respecto al tratamiento de las lesiones cutáneas asociadas a la VNI recoge 2 artículos que exponen un total de tres casos clínicos con terapéuticas distintas42,64 y una guía de práctica clínica donde se establecen, entre otras, directrices generales de prevención y tratamiento para las lesiones relacionadas con dispositivos clínicos23 (tabla 2, material suplementario).
Clasificación-categorización de lesionesAnte la aparición de UPP y otras lesiones relacionadas con la VNI se recomienda su identificación y clasificación utilizando el sistema de clasificación-categorización de lesiones relacionadas con la dependencia del GNEAUPP21, con la excepción de las lesiones en la mucosa, ya que este sistema no se puede utilizar para categorizar las UPP que asientan en dicho tejido.
ValoraciónEnmarcada en una valoración integral del individuo con lesiones cutáneas, la valoración de la lesión ha de realizarse una vez detectada, siendo revalorada al menos semanalmente y dejando constancia documental de dicha evaluación. En estas circunstancias, y aprovechando los cambios de apósito, es recomendable la observación de la UPP u otra lesión en busca de signos que indiquen la necesidad de un cambio en el tratamiento (deterioro del tejido, retroceso en su evolución, aumento del exudado, signos de infección u otras complicaciones).
Es necesario valorar y documentar las características físicas de la lesión, destacando principalmente: localización, categoría, tamaño, tipo de tejido(s), color, piel perilesional, bordes, exudado y olor. Otras características a considerar, sobre todo en personas de piel oscura, son la existencia de calor y sensibilidad en la piel, cambios en la consistencia del tejido y presencia de dolor.
Seguimiento de la lesiónEl proceso de curación de las lesiones ha de ser monitorizado de forma adecuada, utilizando para ello herramientas válidas y fiables (escalas PUSH, DESIGN-R o RESVECH 2.0, por ejemplo), sustentadas además en el juicio clínico del profesional experto65.
DolorDe forma específica, es preciso valorar la presencia de dolor causado por la herida o su tratamiento, estableciendo las medidas adecuadas dirigidas a su correcto abordaje.
Tratamiento de la heridaEl cuidado de las heridas asociadas a la VNI, al igual que las de otra causa, se basa en la preparación del lecho, implicando el control tanto del tejido no viable como de la infección o inflamación y el exudado, así como la estimulación de los bordes epiteliales mediante distintas intervenciones:
LimpiezaLa úlcera y la piel circundante han de ser limpiadas en cada cambio de apósito, utilizando agua potable o suero salino fisiológico. Puede considerarse el uso de determinadas soluciones limpiadoras ante la presencia de infección o sospecha de la misma. En todos los casos es conveniente aplicar la presión adecuada de limpieza sin dañar el tejido o introducir las bacterias dentro de la herida.
DesbridamientoSe recomienda desbridar el tejido desvitalizado de las UPP utilizando el(los) método(s) de desbridamiento adecuado según el estado general de la persona, el lecho de la herida y los objetivos generales de la atención. El desbridamiento solo debe realizarse cuando exista una adecuada perfusión de la herida y se tengan los conocimientos y habilidades adecuados para su realización. Es preciso considerar pormenorizadamente todas las ventajas y desventajas de las distintas opciones de desbridamiento, dadas las localizaciones habituales de las lesiones ocasionadas por la VNI y sus posibles repercusiones estéticas.
Abordaje de la infecciónEs necesario valorar y planificar el manejo de la carga bacteriana/infección local, de la lesión ante la presencia de tejido de granulación friable en la misma, ausencia de signos de cicatrización durante 2 semanas, mal olor, incremento del tamaño, aumento del dolor, aumento del eritema y/o calor en la perilesión, aumento y/o cambios en el exudado y/o incremento del tejido necrótico en el lecho.
Uso de apósitos para el tratamientoExiste una gran variedad de apósitos en el mercado, cuya exposición escaparía de los objetivos de este documento. Ante la ausencia de evidencia concreta para recomendar un apósito sobre otro en el tratamiento de las lesiones ocasionadas por la VNI, la elección terapéutica debe basarse en el conocimiento del producto por parte del profesional, en la evidencia disponible, tanto interna como externa, en las características del paciente y en la fase específica de la lesión dentro del proceso de cicatrización. Los criterios a valorar a la hora de seleccionar un apósito(s) pasan por su capacidad para mantener el lecho de la herida con la humedad adecuada, la necesidad de abordar la carga bacteriana, la naturaleza y el volumen del exudado, el estado del tejido del lecho ulceral, el estado de la piel periulceral, el tamaño de la lesión, la profundidad y ubicación, la presencia de túneles y/o cavitaciones y la compatibilidad con los dispositivos clínicos utilizados.
Consideraciones generalesNo podemos obviar que el tratamiento de estas lesiones resulta complejo, ya que ha de compatibilizarse el cuidado de las mismas con la utilización mantenida de los dispositivos que las han ocasionado. Por ello, como complemento al tratamiento y abordaje local de estas heridas originadas por la acción de la presión, fricción y/o cizalla como consecuencia del uso de la VNI, debe insistirse en el mantenimiento de las distintas medidas preventivas expuestas previamente (en relación a la interfase y ventilador, sistemas de sujeción, alivio de presiones, etc.).
Del mismo modo deben continuarse implementando, manteniendo y evaluando las distintas intervenciones de valoración del riesgo y de la piel, control de la presión, cizalla y fricción, control de la humedad, y control de los factores coadyuvantes, dirigidas a prevenir la aparición de otras lesiones relacionadas con la dependencia.
ConclusionesLos autores del documento, con el respaldo de las sociedades científicas que lo avalan, recomiendan:
- •
La máscara facial como interfaz de elección. Solo en caso de claustrofobia se debería seleccionar la oronasal. En pacientes con LESADIC, considerar el uso del casco Helmet® para evitar el efecto presión y cizalla de la interfaz sobre la piel dañada cuando es necesario continuar con la VNI.
- •
Valorar el uso del casco Helmet® en sustitución de la máscara facial en pacientes que mueven la barbilla de forma inconsciente.
- •
Proteger la piel del puente nasal con apósitos de espuma de poliuretano y adhesivo de silicona (para disminuir la presión y la fricción) o apósitos hidrocoloides, cuando solo hay riesgo de fricción, como es el caso de la máscara facial y las zonas de roce con el arnés.
- •
Identificar con la escala Braden el riesgo de UPP en el ingreso y a intervalos regulares (o ante la presencia de algún cambio en el estado general del individuo).
- •
Evaluar el estado de piel y mucosas a las 2-4h de inicio de la VNI, coincidiendo con la valoración hemodinámica y respiratoria, para decidir si está siendo efectiva la terapia.
- •
En caso de continuar con la VNI, evaluar la piel cada 4h (recomendable), máximo a las 11h (de riesgo).
- •
A las 24h de VNI valorar la estrategia de rotación de la interfase, porque los apósitos dejan de ser protectores de posibles lesiones.
- •
Seguir las indicaciones consensuadas en las guías clínicas para la limpieza, desbridamiento y uso de apósitos en el tratamiento de las LESADIC.
Los autores declaran no tener ningún conflicto de intereses.
Este manuscrito ha sido avalado por las siguientes sociedades científicas: Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC); Grupo Nacional para el Estudio y Asesoramiento en Úlceras por Presión y Heridas Crónicas (GNEAUPP); Sociedad Española y Fundación Española de Cuidados Intensivos Pediátricos (SECIP); Asociación Internacional de Ventilación No Invasiva. Documento reconocido de interés profesional por el GNEAUPP.