El estudio surgió de la necesidad de mejorar el control del dolor en los pacientes postoperados de cirugía cardíaca.
ObjetivosConocer el grado de dolor que experimentan los pacientes intervenidos de cirugía cardíaca en las primeras 24h de estancia en la unidad de cuidados intensivos (UCI) con perfusión continua de dexmedetomidina (Dex) como coadyuvante analgésico, así como el grado de sedación y la necesidad de opiáceos como analgesia de rescate.
Material y métodosEstudio unicéntrico, observacional, descriptivo, llevado a cabo desde abril de 2016 hasta septiembre de 2017. Se incluyeron pacientes mayores de 18 años intervenidos de cirugía cardíaca, extubados en sala quirúrgica y portadores de perfusión continua de Dex. Se evaluó el grado de dolor mediante la escala visual analógica (EVA), durante las primeras 24h del postoperatorio inmediato desde el ingreso en la UCI, y la sedación, mediante la escala de sedación y agitación de Richmond (RASS), tan solo mientras durara la perfusión de Dex.
ResultadosSe incluyeron 109 pacientes. Los resultados obtenidos fueron que la media de dolor experimentado durante las primeras 24h fue de 0,47, con una desviación típica (DT) de 1,25; la media del dolor máximo experimentado fue de 3,58 con un rango de 0 a 8, y el RASS medio fue de −0,68 (DT: 0,80). Un 44,04% de los pacientes precisaron opiáceos de rescate, aunque solo un 7,32% de ellos presentaban un dolor severo mayor de 6.
ConclusionesLos pacientes con perfusión de Dex presentan un grado de dolor leve aunque un pequeño porcentaje, no por ello despreciable, tiene un dolor severo.
This study arose from the need to improve all tasks related to monitoring pain in post cardiac surgery patients.
ObjectivesChecking and quantifying the pain suffered by patients undergoing cardiac surgery in the first 24hours of their stay in the intensive care unit (ICU), treated with Dexmedetomidine (Dex) as analgesic adjuvant, as well as their degree of sedation and the need for opiates such as rescue analgesia.
Material and methodsUnicentric study, observational, descriptive, from April 2016 to September 2017. Both genders, all adult, undergoing cardiac surgery, operating theatre-extubated and Dex continuous infusion carriers. Pain degree level was evaluated by the Visual analogue Scale of Pain (VAS), from immediately post-surgery until 24hours from ICU entry and sedation degree, by the Richmond Sedation Agitation Scale (RASS), only while the Dex infusion lasted.
Results109 patients were included. The results obtained showed that the average pain suffered by patients during the first 24hours was .47 with standard deviation (SD) of 1.25; the average maximum pain experienced was 3.58 with a range of 0 to 8 and the RASS average was −.68 (SD: 0,80). In addition, 44.04% of the patients needed rescue opiates, although only 7.32% showed severe pain greater than 6.
ConclusionsThe Dex infusion patients showed mild levels of pain, however, a small percentage, who must be taken into account, suffered severe pain.
La cirugía cardiovascular es una especialidad de la medicina que se ocupa de los trastornos y enfermedades del sistema cardiocirculatorio que requieren una terapéutica quirúrgica. Dicha intervención quirúrgica representa un proceso agresivo para el paciente, que comporta dolor. El dolor postoperatorio es un dolor de carácter agudo, y el objetivo de la enfermera es reducir o eliminar el dolor y la sensación de malestar del paciente.
¿Qué aporta?Es el primer estudio realizado en España que observa y describe el manejo del dolor en el postoperatorio inmediato de cirugía cardíaca en pacientes extubados y con perfusión de dexmedetomidina. Los resultados demuestran que la dexmedetomidina aporta una buena sedoanalgesia para el manejo del dolor, siendo este mínimo.
Implicaciones del estudioEl estudio describe y demuestra que los pacientes postoperados de cirugía cardíaca portadores de perfusión de dexmedetomidinay extubados perciben un grado de dolor leve. Estudios como este permiten una mejora del uso de opiáceos disminuyendo así su administración.
La cirugía cardíaca ha experimentado un desarrollo espectacular en estos 10 últimos años, por lo que ofrece mejores resultados, gracias a diversos factores como son: mejoras y afianzamiento en las técnicas diagnósticas (cateterismos cardíacos), perfeccionamiento en la técnica quirúrgica (formación del equipo quirúrgico), diseño y fabricación de prótesis valvulares, mejoras en las técnicas de circulación extracorpórea (CEC), y por último, la calidad de la atención postoperatoria, no solo material sino personal, tanto del equipo médico como de las enfermeras, que representan en sí a quienes más tiempo permanecen a pie de cama tras la intervención1.
Según la Asociación Internacional para el Estudio del Dolor (IASP, por sus siglas en inglés), se define el dolor como una experiencia sensitiva y emocional desagradable, asociada a una lesión tisular real o potencial2.
El dolor postoperatorio es un dolor de carácter agudo que traduce la respuesta a la agresión quirúrgica. Tiene unas características propias que lo diferencian del dolor crónico, por ser predecible y autolimitado en el tiempo. El objetivo del tratamiento del dolor postoperatorio es reducir o eliminar el dolor y la sensación de malestar del paciente, con un mínimo de efectos secundarios o adversos, con los métodos más económicos3.
Un deficiente e inadecuado control del dolor durante el postoperatorio puede dar lugar a complicaciones de la función ventilatoria, comportando una mecánica ventilatoria deficiente, causante en muchas ocasiones de atelectasia pulmonar, una complicación muy frecuente en los pacientes postoperados de cirugía cardíaca4-6.
Las complicaciones circulatorias causadas por el dolor, junto con las respiratorias, son una de las causas más importantes de morbimortalidad postoperatoria. También encontramos complicaciones a nivel metabólico, endocrino, inflamatorio y sobre la hemostasia4-6.
Hasta el 2015, los pacientes de cirugía cardíaca del Centro Médico Teknon Quirón-Salud (CMT) ingresaban en la unidad de cuidados intensivos (UCI) intubados, y la extubación se realizaba a las 10-16h del ingreso en la unidad. La sedación habitual era una perfusión de propofol, combinada casi siempre con una perfusión de fentanilo o mórfico. Los pacientes, además, precisaban analgesia convencional para combatir el dolor postextubación; eso derivó en un inicio de tolerancia y movilización tardío que podía comportar complicaciones como la trombosis venosa y el tromboembolismo pulmonar, características de la inmovilización, así como un aumento de la morbilidad derivada de las complicaciones de la intubación prolongada, como las infecciones, ansiedad y delirio, y del uso de los opioides; la más severa de ellas, la depresión respiratoria4,7-12.
Desde el año 2015, en el CMT, a los pacientes intervenidos de cirugía cardíaca se les realiza la técnica fastrack, un factor fundamental que garantiza un corto tiempo de recuperación postoperatoria y, con ello, una disminución de la estancia clínica y sus costes, enfocada a la rápida extubación en la cirugía (de 1 a 6h poscirugía), incluso directamente en la sala quirúrgica sin presentar una morbilidad significativa13. En nuestro caso casi todos los pacientes son extubados en sala quirúrgica. En la mayoría de los casos, los pacientes son portadores de una perfusión intravenosa continua de dexmedetomidina (Dex), además de la analgesia convencional prescrita y un elastómero de ropivacaína a nivel local de la esternotomía. También se prescribe analgesia de rescate desde el ingreso en UCI —cabe destacar que en el CMT no existe protocolo de analgesia para este tipo de cirugías—, así como un manejo de líquidos restringido, para así poder asegurar durante el postoperatorio una adecuada mecánica ventilatoria y una movilización temprana del paciente, que permite acortar la estancia en UCI y en el hospital5,13. Este avance se expresa en que el paciente operado de cirugía cardíaca no está más de 2 o 3 días en la UCI, para pasar posteriormente a la planta de hospitalización.
Hasta la utilización de Dex y, en consecuencia, la llegada de los pacientes extubados, se perdía una herramienta fundamental para la cuantificación del dolor, es decir, la referida por el paciente. Su capacidad de comunicación estaba abolida, por lo que nos debíamos apoyar en herramientas indirectas (escalas conductuales); en nuestro caso, la escala de Campbell. Hay que tener en cuenta que la falta de especificidad de los signos en este tipo de escalas puede conllevar que sean malinterpretadas y habitualmente son infraestimadas por parte del personal involucrado en su cuidado. Teniendo en cuenta que el dolor produce importantes efectos adversos, que altera la evolución de los pacientes, su identificación y control suponen un aumento de la calidad en la atención del paciente crítico14-16.
La Dex es un agonista selectivo de los receptores alfa-2 que se ha demostrado que proporciona sedación y analgesia, con mínima depresión respiratoria, indicado para pacientes que requieren un nivel de sedación no más profundo que despertarse en respuesta a la estimulación verbal, que corresponde a un grado de entre 0 a −3 en la escala de sedación y agitación de Richmond (RASS)4,17,18.
El uso de Dex nos permite obtener una sedación continua con estabilidad respiratoria, brindando una sedoanalgesia efectiva4,7,9,13,19-25.
En nuestra unidad los pacientes llegan de quirófano con perfusión continua de Dex en una concentración de 4μg/ml. Dicha perfusión va a una dosis inicial de 0,7μg/kg/h que se aumenta o disminuye en función del estado hemodinámico y del estado de sedación (RASS) del paciente. La duración de la perfusión de Dex es prescrita por el facultativo teniendo siempre en cuenta a qué hora iniciará la tolerancia oral, ya que se considera una sedación leve.
La enfermera desempeña un papel importantísimo en la cirugía cardíaca, como una pieza más de ese gran rompecabezas, constituido desde que el paciente ingresa en el hospital hasta que se va de alta a su domicilio. El paciente en situación postoperatoria de la cirugía cardíaca debe ser vigilado extremadamente, con control de signos clínicos, control del dolor y valoración de la sedación.
El presente estudio surgió de la necesidad, por parte de las enfermeras, de mejorar el control del dolor en este tipo de pacientes. Realizamos una valoración del dolor que experimentaron los pacientes intervenidos de cirugía cardíaca en las primeras 24h de estancia en UCI, con perfusión continua de Dex como coadyuvante analgésico. El objetivo principal era conocer el grado de dolor de los pacientes postoperados de cirugía cardíaca. Además, como objetivos secundarios nos planteamos conocer el grado de sedación de los pacientes y la administración de opiáceos como analgesia de rescate.
Nuestra hipótesis era que los pacientes con perfusión intravenosa de Dex tienen un grado de dolor leve y en consecuencia no precisan opiáceos.
Material y métodosDiseño: Estudio cuantitativo, observacional, descriptivo y unicéntrico.
Ámbito: Realizado desde abril del 2016 hasta septiembre del 2017, en la UCI polivalente del CMT.
Criterios de inclusión: Pacientes mayores de 18 años intervenidos de cirugía cardíaca de revascularización con injerto venoso y/o arterial, sustitución y/o reparación de válvula, combinación de ambas (revascularización y valvular), cirugía de aorta ascendente, defectos septales y resección de mixoma auricular, con esternotomía media y apoyo de CEC que ingresaron extubados y con perfusión de Dex.
Criterios de exclusión: Todos los pacientes que ingresaron en UCI, intubados y a todos los que llegaron extubados y sin perfusión de Dex.
Cálculo del tamaño y selección de la muestra: Según la Sociedad Española de Cirugía Torácica (SECTCV) se realizaron 19.772 cirugías cardíacas mayores con apoyo de CEC en 2016 en España26. Considerando este dato como el tamaño de la población que queremos estudiar, con un nivel de confianza del 95% y un margen de error del 5%, el tamaño de la muestra a estudiar es de 109 pacientes.
Variables del estudioVariables independientes: la dosis de la Dex y las horas de duración de esta, así como la administración de opiáceos.
Variables dependientes: la valoración del dolor y el nivel de sedación.
Para la valoración del dolor se usó la escala visual analógica (EVA). Es una herramienta de valoración subjetiva de cada individuo que consta de un valor máximo de 10 relacionado con el dolor máximo experimentado y un mínimo de 0 relacionado con la ausencia del dolor. La valoración se hace mediante una escala métrica visual, de 0 a 10, indicando al paciente que señale el valor del dolor. En la escala EVA se podrían cuantificar como 0 ausencia de dolor; leve, 1-3; moderado, 4-6; y severo, >62.
Para la valoración de la sedación se usó la escala RASS. Esta escala se basa en la observación e interacción con el paciente, valorando como 0 al paciente alerta y tranquilo, en orden creciente de agitación, siendo el máximo +4 (combativo y violento); y en orden decreciente la sedación, llegando hasta −5 (ausencia de respuesta)27.
Los valores de la escala EVA y RASS fueron obtenidos por las enfermeras de la unidad, responsables del paciente, que están familiarizadas y entrenadas para realizar correctamente la valoración de las mismas.
Variables relacionadas con el paciente: demográficas (edad, sexo), tipo de cirugía cardíaca, tiempo de estancia en UCI.
ProcedimientoSe realizó una búsqueda exhaustiva sobre las variables a estudiar y una revisión bibliográfica, desde febrero de 2016 hasta septiembre de 2017, en las bases de datos Medline vía Pubmed, Cuiden y Google Scholar. Se llevaron a cabo búsquedas adaptadas a las diferentes bases de datos utilizadas, usando los descriptores «cardiac surgery/cirugía cardíaca», «pain/dolor», «dexmedetomidine/dexmedetomidina», «sedation/sedación», «analgesia/analgesia», «opiate/opiáceo», combinándolos entre ellos con el operador booleano «and», excluyendo del estudio la población pediátrica y neonatal.
Posteriormente se confeccionó una hoja de recogida de datos donde extrapolamos todas aquellas variables que necesitábamos (ver material adicional).
En la primera hoja se recogieron datos sociodemográficos tales como edad, sexo, índice de masa corporal (IMC), antecedentes, que obtuvimos de la historia clínica informatizada mediante el programa informático Tesis® instalado en la UCI, que complementamos las investigadoras con el fin de facilitar la recogida de datos.
En la segunda hoja se creó un horario de 24h donde se recogieron hora por hora todas aquellas variables que tenían que ver con el dolor y la sedación del paciente, tales como el EVA, RASS, dosis por hora de Dex, analgesia pautada y opioides de rescate. Hay que tener en cuenta que en nuestra unidad no existe protocolo de analgesia y variaba según la pauta médica; aun así todos los enfermos tenían pautado paracetamol, metamizol y/o dexketoprofeno alternos como analgesia convencional y metadona o cloruro mórfico como analgesia de rescate.
En el momento del ingreso de un paciente, tras confirmar que se cumplían los criterios de inclusión, la enfermera de guardia era la encargada de ir registrando los datos de la segunda hoja durante las primeras 24h de ingreso.
Posteriormente, se almacenaban en una carpeta ubicada en la unidad y eran transferidas semanalmente por las investigadoras a la base de datos.
Análisis de datosSe realizó una estadística descriptiva básica, expresándose los datos cuantitativos como media (desviación estándar) y los datos cualitativos como proporciones.
Se utilizó el paquete estadístico Microsoft Excel 2016.
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética e Investigación Clínica (CEIC) del hospital de referencia.
Todos los pacientes firmaron un consentimiento informado, previa intervención quirúrgica por parte del anestesiólogo, conforme eran informados de todos los mecanismos de acción del fármaco, sus riesgos y beneficios.
Siempre se mantuvo la confidencialidad profesional y, con el tratamiento de los datos durante la realización del estudio, se garantizó el estricto cumplimiento de la Ley 15/1999, de 13 de diciembre de protección de datos personales28.
El proyecto cumplió todos los preceptos exigibles actualmente para la investigación biomédica29.
ResultadosEl estudio incluyó 109 enfermos, de los cuales el 62% fueron hombres y el 38% mujeres. La edad media de los pacientes fue de 62 años (DT: 12,8). La estancia media en UCI fue de 4 días (DT: 1,3). El 24% de los pacientes fueron intervenidos de revascularización coronaria mediante la técnica de bypass, un 65% de recambio valvular, un 6% combinada y un 6% de otras tales como cirugía de aorta ascendente, defectos septales y resección de mixoma auricular. Al 100% de los enfermos se les realizó una esternotomía media y precisaron apoyo de CEC.
La media de horas que llevaron la perfusión de Dex fue de 12h (DT: 2,5), siendo el rango de horas de perfusión de 2,5 a 20h, con una dosis media de 0,4μg/kg/h (siendo el mínimo de 0,048 y el máximo de 1μg/kg/h). El valor medio para la escala RASS fue de −0,68 (DT: 0,8), siendo −3 el valor máximo de RASS al que llegaron a estar.
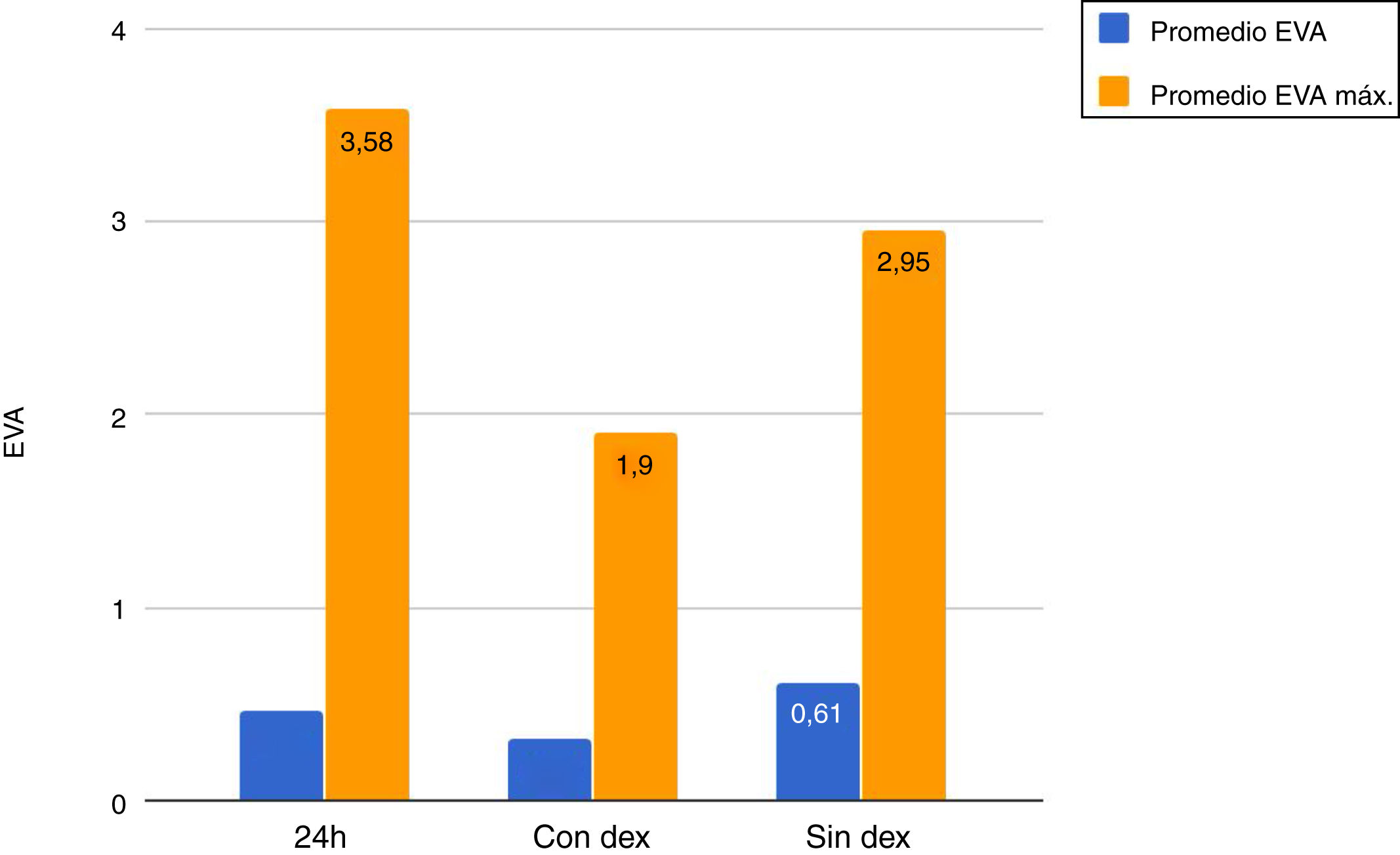
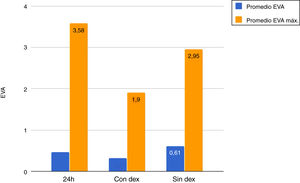
La media del dolor experimentado durante las primeras 24h de estancia en UCI fue de 0,47 (DT: 1,25), siendo la media de dolor máximo padecido por parte de los pacientes de 3,58 (DT: 2,18), con un rango de 0 a 8. Durante las horas que duró la perfusión de Dex los valores medios del EVA fueron de 0,32 (DT: 1,03), siendo la media del dolor máximo padecido de 1,90 (DT: 2,17). El valor medio de dolor una vez finalizó la perfusión de Dex fue de 0,62 (DT: 1,42), con una media de valor máximo percibido de 2,95 (DT: 2,32) (fig. 1).
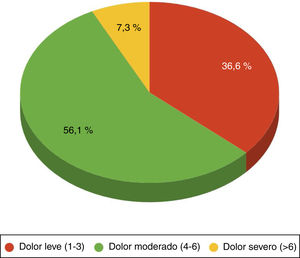
Al 100% de los pacientes se les administraba la analgesia convencional prescrita según el facultativo y portaban un elastómero de ropivacaína a nivel local de la esternotomía, así como opiáceos de rescate por si era ineficaz el tratamiento administrado, metadona y/o cloruro mórfico según el médico. Un 44,04% de los enfermos precisaron opiáceos de rescate. De estos pacientes, se analizó el valor de la variable EVA observando que a un 36,59% de los enfermos se les administró opiáceos con un dolor leve (EVA de 1 a 3), un 56,10% con un dolor moderado (EVA de 4 a 6) y un 7,32% con un dolor severo (EVA>6) (fig. 2).
Discusión y conclusionesEl presente estudio de investigación es el primero en relacionar el uso de la Dex como coadyuvante analgésico en pacientes postoperados de cirugía cardíaca en España por parte de las enfermeras.
El objetivo principal de nuestro estudio de investigación era valorar el grado de dolor del paciente operado de cirugía cardíaca con perfusión de Dex. A la vista de los resultados, los pacientes tuvieron un nivel bajo de dolor y un buen confort en general. Comparando los resultados del dolor con y sin perfusión de Dex llegamos a la conclusión de que hay una diferencia significativa, pudiendo constatar que durante la perfusión de Dex los pacientes tienen un mejor control del dolor.
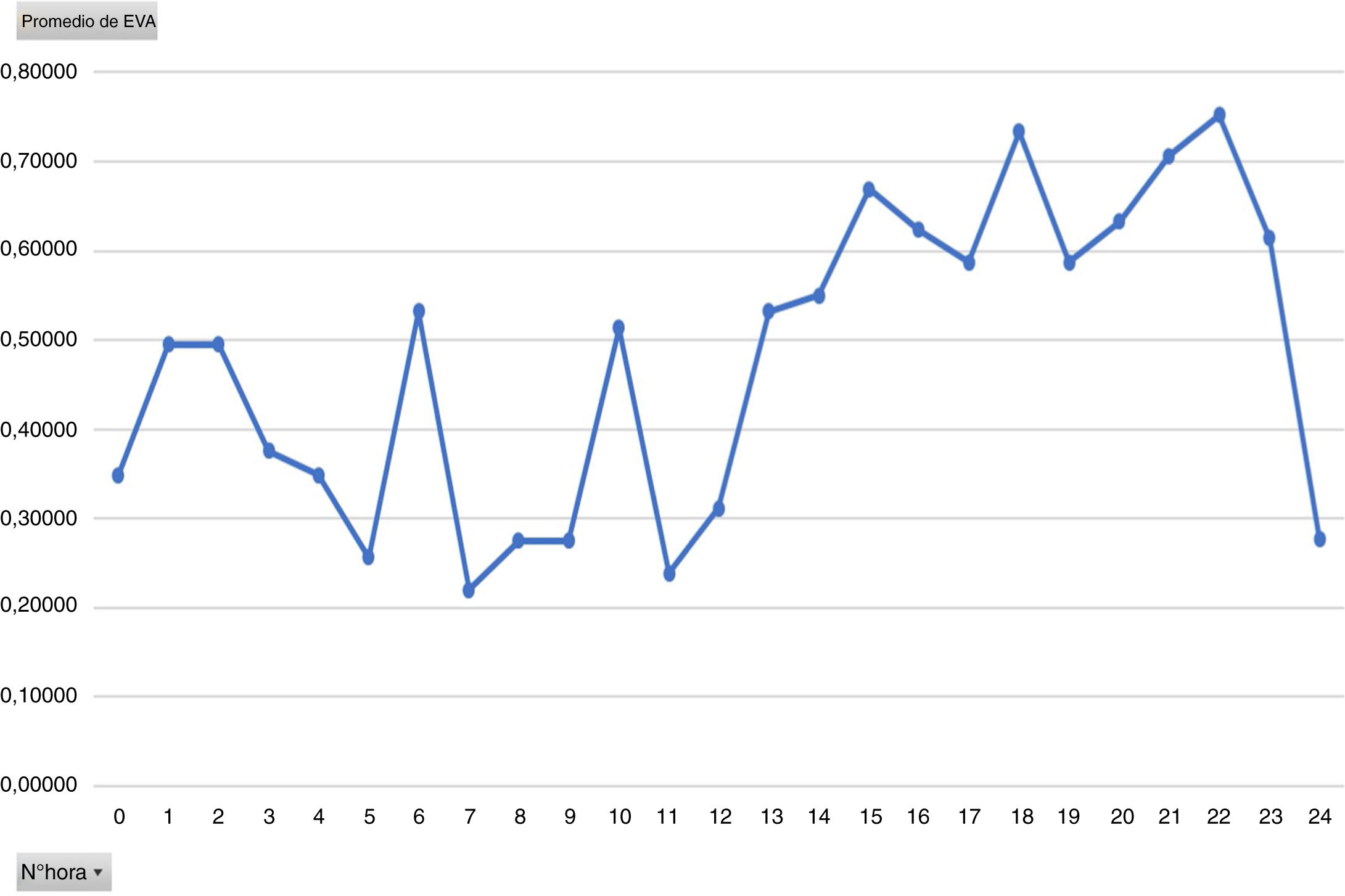
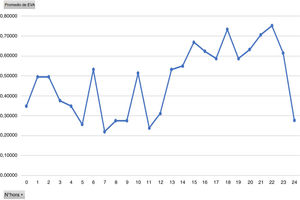
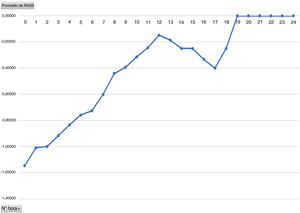
Analizando el promedio del dolor por horas, se evidencia un aumento del promedio del dolor a partir de las 12h, siendo esta la media de horas que los pacientes llevaron perfusión de Dex (fig. 3).
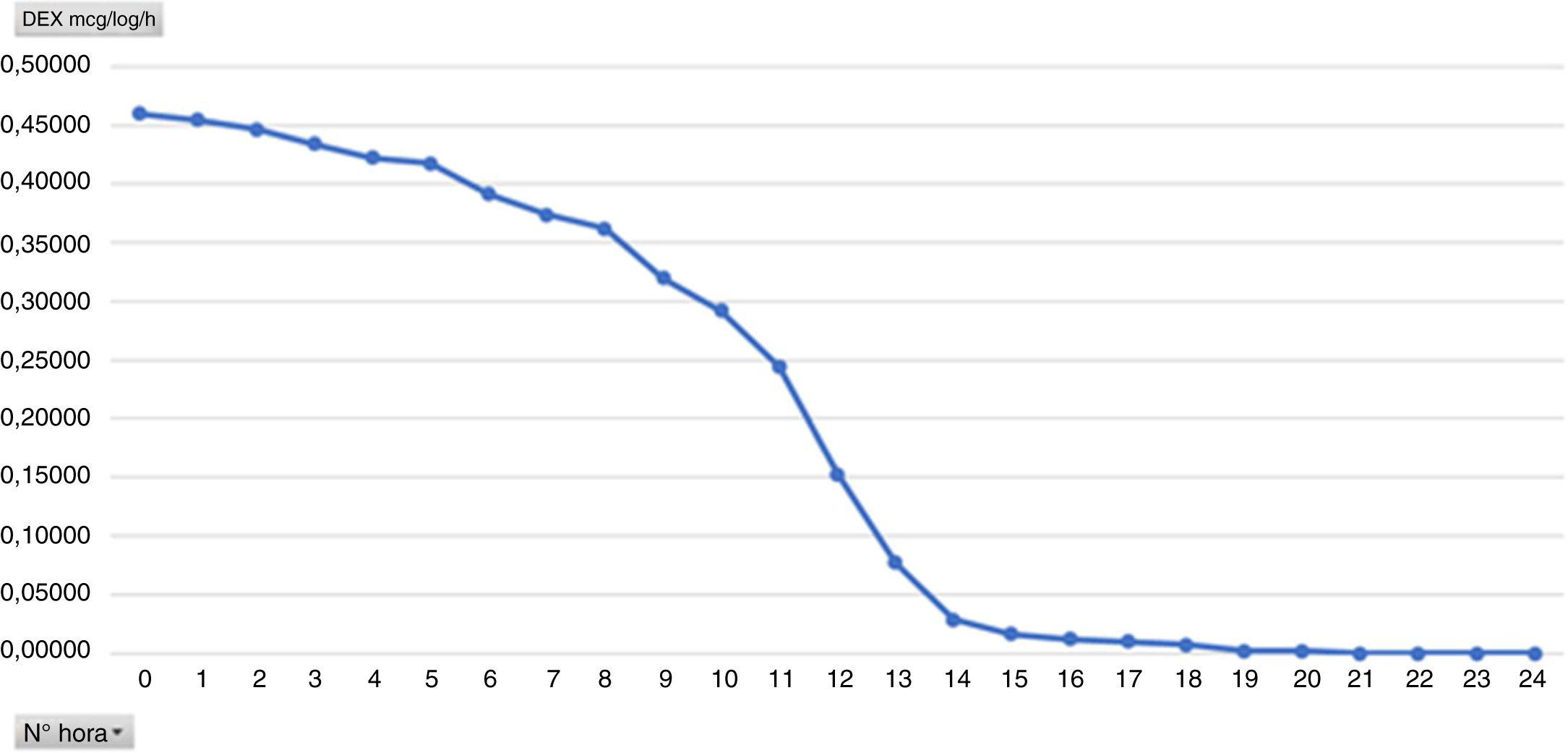
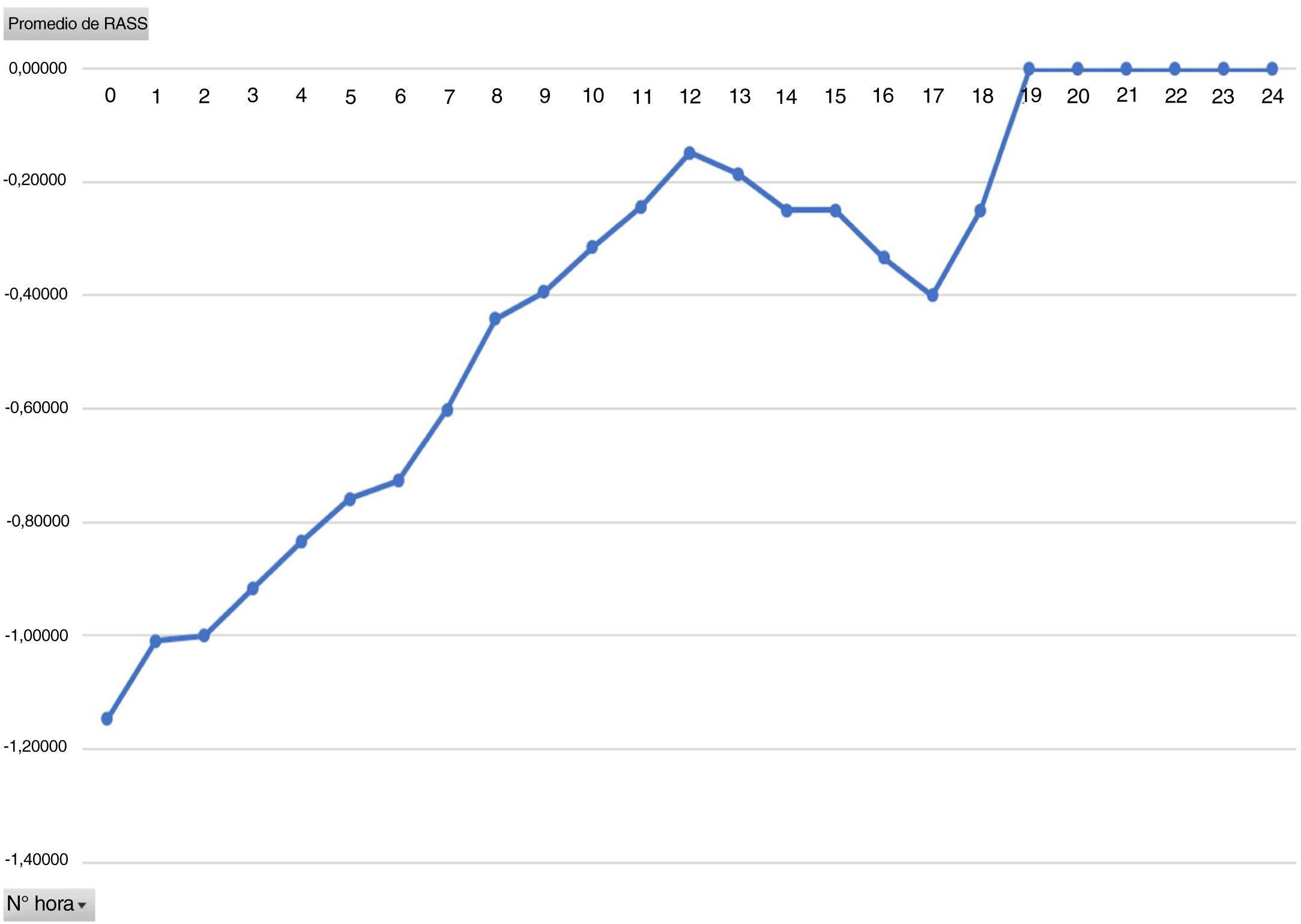
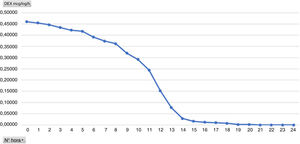
Uno de los objetivos secundarios era valorar el grado de sedación en estos pacientes ya que, a pesar de llegar extubados en UCI, son portadores de una perfusión de Dex, considerada como sedación. Se contempla que una sedación óptima para los pacientes extubados es de 0 a −2, con lo que estamos en el rango óptimo de sedación. Analizando por horas el promedio de la dosis de la Dex vemos que es directamente proporcional a la media del nivel de sedación, es decir, que a mayor dosis de la Dex los pacientes están más sedados (figs. 4 y 5). Durante el análisis de los resultados observamos una gran variedad tanto en horas de duración de la perfusión como en el nivel de RASS de los pacientes, por lo que recomendamos realizar un protocolo de sedación y la pauta del nivel de sedación deseado por parte del equipo médico.
Nuestra hipótesis pretendía demostrar que los pacientes con perfusión intravenosa de Dex tienen un grado de dolor leve y en consecuencia no precisan de opiáceos. Aunque hemos podido observar que el grado de dolor es bajo, el uso de opiáceos es elevado. Si lo analizamos profundamente, lo que destaca es la elevada administración de opiáceos con dolor leve. A la luz de estos resultados consideramos que hay una falta de educación por parte del equipo sanitario. Así mismo, a pesar de que no hay una técnica analgésica específica superior a otra para el manejo del dolor en cirugía cardíaca, consideramos que una falta de protocolo deriva en una forma muy subjetiva de tratar al paciente ya que cada enfermera valora el momento oportuno para administrar un opiáceo de rescate y esto puede llevar a un abuso de estos.
Creemos que con un protocolo analgésico con un abanico analgésico más amplio, teniendo en cuenta recomendaciones analgésicas como la analgesia multimodal o el «ascensor analgésico», contribuiría a disminuir la administración de opioides y nos permitiría tratar el dolor de manera más precisa y equitativa30-32.
La gran heterogeneidad encontrada en los estudios que valoran la administración de Dex dificulta la comparación de resultados; casi todos los estudios encontrados son de anestesiología, los cuales valoran tanto el dolor como la estabilidad hemodinámica con la administración de Dex durante la intervención, así como estudios de caso-control en pacientes intubados comparados con sedantes como el propofol; aun así, en todos ellos se demuestra el beneficio de la Dex para el control del dolor y como disminuye la necesidad de opiáceos con esta4,12,13,19-23. También encontramos un grado de recomendación fuerte y un nivel de evidencia moderado en la «Guía de práctica clínica basada en la evidencia para el manejo de la sedoanalgesia en el paciente adulto críticamente enfermo» de 2013, donde recomiendan el uso de la Dex como agente único o asociado a analgésicos opioides como sedoanalgesia de corta duración porque reduce significativamente la incidencia y la duración de delirio de los pacientes en postoperatorio de cirugía cardiovascular33.
Llegamos a la conclusión de que la implementación de la Dex en el manejo del dolor en el paciente postoperado de cirugía cardíaca es efectiva para el control del dolor. Aun así el uso de opiáceos sigue siendo elevado, y a la vista de los resultados, consideramos que se precisa implementar un protocolo analgésico y de sedación, una mayor formación del equipo asistencial y una reevaluación posterior.
Conflicto de interesesLos autores declaran no haber recibido ningún tipo de ayuda económica para su realización, no existiendo ningún conflicto de interés económico o personal que pueda sesgar o influir inadecuadamente en sus actuaciones.
Agradecemos al equipo multidisciplinar de la unidad de cuidados intensivos de CMT que ha colaborado en la recogida de datos, al Dr. Ruyra por sus aportaciones al estudio, a la directora de enfermería Sara Tor.