La deleción en el gen CCR5 (CCR5Δ32), el haplotipo HLA-B*27:05 y los polimorfismos rs2395029 y rs9264942 han sido relacionados con la lenta progresión de la infección por VIH-1.
MétodosAnalizamos a 408 pacientes en seguimiento. El análisis de la carga viral, linfocitosT CD4+ y demás variables clínicas fueron recogidas desde el diagnóstico.
ResultadosLa prevalencia de los marcadores genéticos rs9264942, CCR5wt/Δ32, rs2395029 y alelo HLA-B*27:05 fue del 17,9, del 11,5, del 7,6 y del 6,4%, respectivamente. Del total de los pacientes, 354 fueron clasificados como progresores y 46 como no progresores a largo plazo (LTNP). Exceptuando el alelo HLA-B*27:05, los demás marcadores genéticos se relacionaron con la lenta progresión: CCR5wt/Δ32 (p=0,011) y los SNP rs2395029 y rs9264942 (p<0,0001), así como su asociación (p<0,0001).
ConclusiónLa frecuencia hallada del alelo HLA-B*57:01 fue mayor a lo publicado a nivel nacional. Con respecto al alelo HLA-B*27:05, no hemos podido relacionar su presencia con la lenta progresión.
The deletion in the CCR5 gene (CCR5Δ32), the HLA-B*27:05, and polymorphisms rs2395029 and rs9264942 have been associated with slower progression of HIV-1.
MethodsAn analysis was performed on 408 patients on follow-up. The analysis of viral load, CD4+ Tlymphocytes and other clinical variables since the diagnosis of the infection were collected.
ResultsThe prevalence of the genetic markers rs9264942, CCR5wt/Δ32, rs2395029, HLA-B*27:05 was 17.9%, 11.5%, 7.6%, and 6.4%, respectively. Of all the patients, 354 were classified as progressors and 46 as long-term non-progressors (LTNPs). Except for the HLA-B*27:05 allele, other genetic markers were associated with slower progression: CCR5wt/Δ32 (P=.011) and SNPs rs2395029 and rs9264942 (P<.0001), as well as their association (P<.0001).
ConclusionThe prevalence of the HLA-B*57:01 allele was higher than described nationally. No association could be found between the HLA-B*27:05 allele and the presence of slower disease progression.
La mayoría de los pacientes infectados por el VIH-1 (80-85%) progresan a síndrome de inmunodeficiencia adquirida (sida) en ausencia de tratamiento de gran actividad (TARGA), en un periodo de entre 8-10años (progresores crónicos), debido a una caída progresiva en el número de linfocitosT CD4+1,2.
En base a la velocidad de la progresión de la infección se identifica a un subgrupo de pacientes (5-15%) conocidos como «no progresores a largo plazo» (long-term non-progressors [LTNP]), cuya evolución transcurre más lentamente, caracterizándose por permanecer clínicamente asintomáticos y/o inmunológicamente estables, con un recuento de linfocitosT CD4+ normal, durante al menos 8años3,4.
Gracias a la determinación de la carga viral, se comprobó que los LTNP poseían características fenotípicas que los diferenciaban en 3 subgrupos: «no controladores de viremia» (LTNP-NC), «controladores de viremia» (LTNP-CV) y «controladores élite» (LTNP-EC). Estos últimos representan un porcentaje (<1%) del total de los pacientes y se caracterizan por mantener la carga viral plasmática indetectable sin TARGA4.
Esta progresión lenta de la infección por VIH-1 depende de las interacciones entre el virus, el huésped y el medio ambiente5. Entre los factores genéticos del huésped se encuentran los polimorfismos genéticos que afectan a la capacidad de entrada del virus al interior celular, como ocurre con la deleción de 32pb en el gen que codifica para el co-receptor CCR5 (CCR5-Δ32), y los haplotipos asociados a la región de presentación de los antígenos leucocitarios humanos (HLA), como el alelo HLA-B*57:01 (SNP rs2395029), el alelo HLA-B*27:05 y la homocigosisC/C del SNP rs9264942 del HLA-C, que regulan la respuesta inmune específica de la infección en el huésped6-9.
El objetivo de este estudio ha sido analizar las características epidemiológicas, clínicas y analíticas de los pacientes infectados por VIH-1 seguidos en nuestro centro hospitalario, estimar la prevalencia de estos marcadores genéticos y determinar su relación con la progresión de la infección.
Material y métodosLos pacientes incluidos pertenecen a la consulta ambulatoria del paciente VIH+ del Complejo Hospitalario Universitario de Vigo (CHUVI). El estudio se realizó bajo la aprobación del Comité Ético Local de Investigación del CHUVI, adhiriéndose a la Declaración de Helsinki10.
Del total de los pacientes en seguimiento en enero de 2007 (n=917), se incluyó en el estudio a 408 pacientes que acudieron a la consulta durante el periodo de inclusión (enero de 2007-enero de 2009) y que realizaron al menos de 2 a 4 visitas al año desde su diagnóstico hasta el final del estudio (enero de 2013).
El recuento de las célulasT CD4+ se realizó por citometría de flujo (FACScalibur, Becton Dickinson, EE.UU.). La cuantificación de la carga viral (copias de VIH-1/ml) en plasma se realizó mediante la reacción en cadena de la polimerasa (PCR), COBAS® AmpliPrep/COBAS® TaqMan® HIV-1 Test, version 2.0 48 test IVD (Roche, Suiza). El ADN se extrajo a partir de sangre periférica usando el FlexiGene DNA kit (QIAGEN, Alemania).
Para la detección de la deleción (CCR5-Δ32) se utilizó el protocolo descrito en Huang et al.11. Para la amplificación mediante PCR del alelo HLA-B*27:05 se utilizaron los cebadores descritos por Sayer et al.12. Para la determinación del alelo HLA-B*57:01 se siguió la técnica descrita y validada por Martin et al.13. Para la amplificación del SNP rs9264942 se utilizaron los cebadores descritos por Van Manen et al.9.
Debido a la ausencia de una definición estándar de la clasificación de los pacientes en base a la progresión de la infección por VIH-1, hemos adoptado las definiciones descritas por Casado et al.14, tomando como criterios de progresión los descritos por Fellay et al.8.
Para la realización del análisis estadístico se empleó el programa SPSS versión 17 (SPSS Inc., Chicago, IL, EE.UU.).
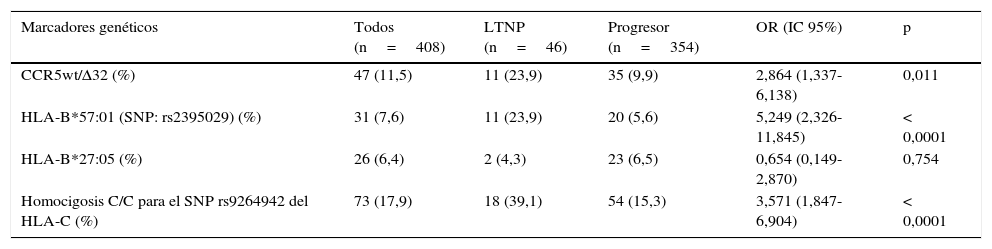
ResultadosEn nuestra cohorte, el marcador genético más prevalente fue el SNP rs9264942 en homocigosis, con un 17,9%, seguido de la deleción (CCR5-Δ32), con una prevalencia del 11,5%, hallándose en heterocigosis en todos los casos, mientras que la prevalencia para el alelo HLA-B*57:01 (SNP rs2395029) fue del 7,6%, y la del HLA-B*27:05 fue del 6,4%.
Del total de pacientes incluidos en este estudio (n=408), 4 fueron pérdidas de seguimiento y otros 4 no llegaron a cumplir con el criterio de «tiempo de seguimiento necesario para poder clasificar a los pacientes en base a la progresión de la infección por VIH-1», el cual debía de ser ≥8años. De estos 400 pacientes, 46 (11,5%) fueron categorizados como LTNP, mientras que el resto (n=354; 88,5%) fueron categorizados como progresores.
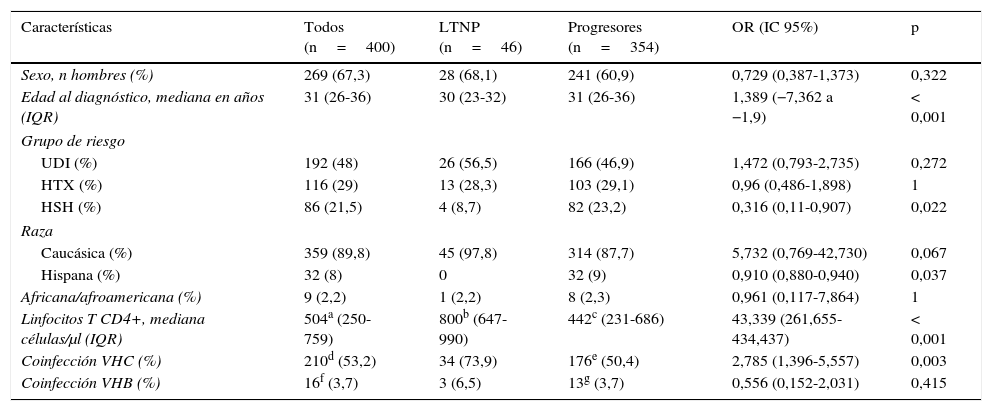
Las características epidemiológicas, clínicas y analíticas más relevantes de los 2 subgrupos de pacientes están resumidas en la tabla 1. La prevalencia y la distribución de los marcadores genéticos en base a la progresión de la infección están recogidas en la tabla 2, donde se puede observar que todos los marcadores estudiados, excepto el alelo HLA-B*27:05, presentaron diferencias estadísticamente significativas.
Características epidemiológicas, clínicas y analíticas al diagnóstico de la infección por VIH-1 de la población a estudio, clasificada en base a la progresión
| Características | Todos (n=400) | LTNP (n=46) | Progresores (n=354) | OR (IC 95%) | p |
|---|---|---|---|---|---|
| Sexo, n hombres (%) | 269 (67,3) | 28 (68,1) | 241 (60,9) | 0,729 (0,387-1,373) | 0,322 |
| Edad al diagnóstico, mediana en años (IQR) | 31 (26-36) | 30 (23-32) | 31 (26-36) | 1,389 (−7,362 a −1,9) | < 0,001 |
| Grupo de riesgo | |||||
| UDI (%) | 192 (48) | 26 (56,5) | 166 (46,9) | 1,472 (0,793-2,735) | 0,272 |
| HTX (%) | 116 (29) | 13 (28,3) | 103 (29,1) | 0,96 (0,486-1,898) | 1 |
| HSH (%) | 86 (21,5) | 4 (8,7) | 82 (23,2) | 0,316 (0,11-0,907) | 0,022 |
| Raza | |||||
| Caucásica (%) | 359 (89,8) | 45 (97,8) | 314 (87,7) | 5,732 (0,769-42,730) | 0,067 |
| Hispana (%) | 32 (8) | 0 | 32 (9) | 0,910 (0,880-0,940) | 0,037 |
| Africana/afroamericana (%) | 9 (2,2) | 1 (2,2) | 8 (2,3) | 0,961 (0,117-7,864) | 1 |
| Linfocitos T CD4+, mediana células/μl (IQR) | 504a (250-759) | 800b (647-990) | 442c (231-686) | 43,339 (261,655-434,437) | < 0,001 |
| Coinfección VHC (%) | 210d (53,2) | 34 (73,9) | 176e (50,4) | 2,785 (1,396-5,557) | 0,003 |
| Coinfección VHB (%) | 16f (3,7) | 3 (6,5) | 13g (3,7) | 0,556 (0,152-2,031) | 0,415 |
HSH: hombres que tienen sexo con hombres; HTX: heterosexual; IQR: rango intercuartílico; LTNP: no progresores a largo plazo; UDI: usuarios de drogas inyectadas.
Datos obtenidos de: an=340 pacientes; bn=43 pacientes; cn=297 pacientes; dn=395 pacientes; en=349 pacientes; fn=394 pacientes; gn=348 pacientes.
Prevalencia de los marcadores genéticos en la población a estudio, distribuidos en base a la progresión de la infección
| Marcadores genéticos | Todos (n=408) | LTNP (n=46) | Progresor (n=354) | OR (IC 95%) | p |
|---|---|---|---|---|---|
| CCR5wt/Δ32 (%) | 47 (11,5) | 11 (23,9) | 35 (9,9) | 2,864 (1,337-6,138) | 0,011 |
| HLA-B*57:01 (SNP: rs2395029) (%) | 31 (7,6) | 11 (23,9) | 20 (5,6) | 5,249 (2,326-11,845) | < 0,0001 |
| HLA-B*27:05 (%) | 26 (6,4) | 2 (4,3) | 23 (6,5) | 0,654 (0,149-2,870) | 0,754 |
| Homocigosis C/C para el SNP rs9264942 del HLA-C (%) | 73 (17,9) | 18 (39,1) | 54 (15,3) | 3,571 (1,847-6,904) | < 0,0001 |
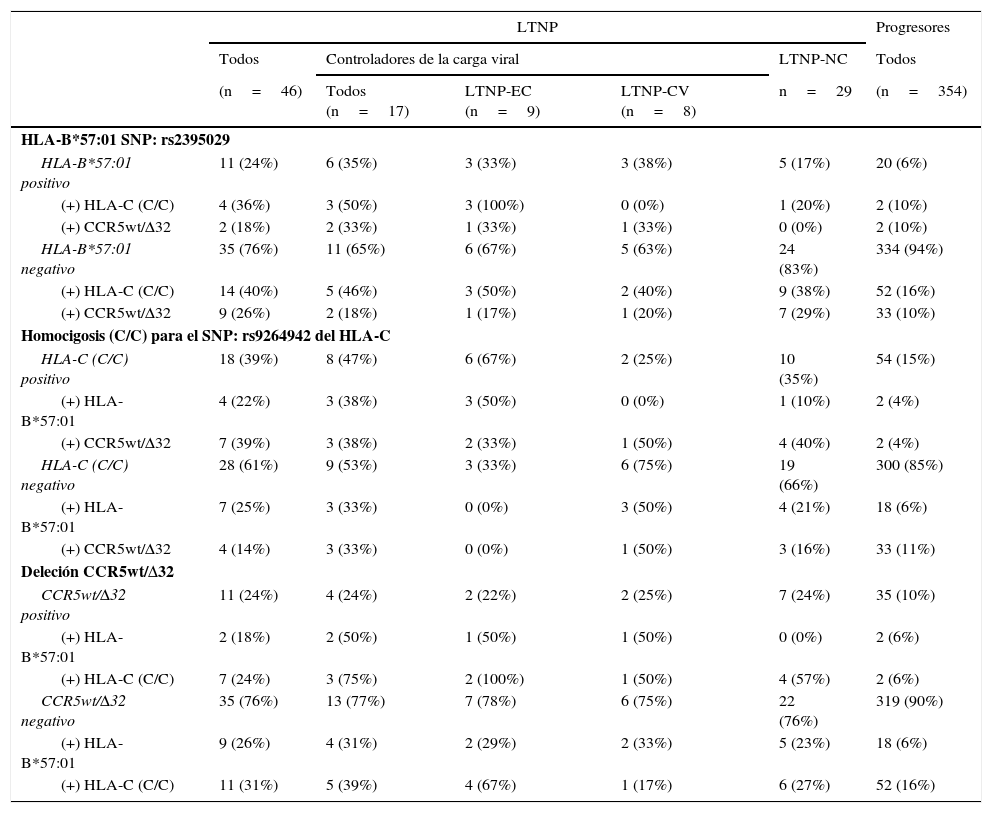
En el estudio de asociación entre las diferentes variantes genéticas y su relación con la lenta progresión (tabla 3), se observó que el 24% de los pacientes clasificados como LTNP (n=11) presentaron algún tipo de asociación, frente al 1,7% de los pacientes clasificados como progresores (n=6), obteniéndose diferencias significativas (p<0,0001; OR=18,229; IC95%: 6,335-52,283).
Prevalencia y asociación de los marcadores genéticos relacionados con la lenta progresión, distribuidos en los diferentes subgrupos de pacientes categorizados en base a la progresión de la infección por VIH-1
| LTNP | Progresores | |||||
|---|---|---|---|---|---|---|
| Todos | Controladores de la carga viral | LTNP-NC | Todos | |||
| (n=46) | Todos (n=17) | LTNP-EC (n=9) | LTNP-CV (n=8) | n=29 | (n=354) | |
| HLA-B*57:01 SNP: rs2395029 | ||||||
| HLA-B*57:01 positivo | 11 (24%) | 6 (35%) | 3 (33%) | 3 (38%) | 5 (17%) | 20 (6%) |
| (+) HLA-C (C/C) | 4 (36%) | 3 (50%) | 3 (100%) | 0 (0%) | 1 (20%) | 2 (10%) |
| (+) CCR5wt/Δ32 | 2 (18%) | 2 (33%) | 1 (33%) | 1 (33%) | 0 (0%) | 2 (10%) |
| HLA-B*57:01 negativo | 35 (76%) | 11 (65%) | 6 (67%) | 5 (63%) | 24 (83%) | 334 (94%) |
| (+) HLA-C (C/C) | 14 (40%) | 5 (46%) | 3 (50%) | 2 (40%) | 9 (38%) | 52 (16%) |
| (+) CCR5wt/Δ32 | 9 (26%) | 2 (18%) | 1 (17%) | 1 (20%) | 7 (29%) | 33 (10%) |
| Homocigosis (C/C) para el SNP: rs9264942 del HLA-C | ||||||
| HLA-C (C/C) positivo | 18 (39%) | 8 (47%) | 6 (67%) | 2 (25%) | 10 (35%) | 54 (15%) |
| (+) HLA-B*57:01 | 4 (22%) | 3 (38%) | 3 (50%) | 0 (0%) | 1 (10%) | 2 (4%) |
| (+) CCR5wt/Δ32 | 7 (39%) | 3 (38%) | 2 (33%) | 1 (50%) | 4 (40%) | 2 (4%) |
| HLA-C (C/C) negativo | 28 (61%) | 9 (53%) | 3 (33%) | 6 (75%) | 19 (66%) | 300 (85%) |
| (+) HLA-B*57:01 | 7 (25%) | 3 (33%) | 0 (0%) | 3 (50%) | 4 (21%) | 18 (6%) |
| (+) CCR5wt/Δ32 | 4 (14%) | 3 (33%) | 0 (0%) | 1 (50%) | 3 (16%) | 33 (11%) |
| Deleción CCR5wt/Δ32 | ||||||
| CCR5wt/Δ32 positivo | 11 (24%) | 4 (24%) | 2 (22%) | 2 (25%) | 7 (24%) | 35 (10%) |
| (+) HLA-B*57:01 | 2 (18%) | 2 (50%) | 1 (50%) | 1 (50%) | 0 (0%) | 2 (6%) |
| (+) HLA-C (C/C) | 7 (24%) | 3 (75%) | 2 (100%) | 1 (50%) | 4 (57%) | 2 (6%) |
| CCR5wt/Δ32 negativo | 35 (76%) | 13 (77%) | 7 (78%) | 6 (75%) | 22 (76%) | 319 (90%) |
| (+) HLA-B*57:01 | 9 (26%) | 4 (31%) | 2 (29%) | 2 (33%) | 5 (23%) | 18 (6%) |
| (+) HLA-C (C/C) | 11 (31%) | 5 (39%) | 4 (67%) | 1 (17%) | 6 (27%) | 52 (16%) |
LTNP: no progresores a largo plazo; LTNP-CV: controladores de viremia; LTNP-EC: controladores élite; LTNP-NC: no controladores de viremia.
Dentro del subgrupo de los LTNP, y concretamente en el subgrupo de los LTNP-EC (n=9), observamos que en el 44,4% de los casos está presente simultáneamente más de un marcador genético (n=4). Tanto en el 33,3% de los pacientes que presentaron el SNP rs2395029 (HLA-B*57:01) como en el 22,2% de los que presentaron la CCR5-wt/Δ32 también estaba presente el SNP rs9264942 en homocigosis. Solo un paciente perteneciente a este subgrupo presentó los 3 marcadores genéticos.
En el subgrupo de los LTNP-CV (n=8), al menos 2 pacientes (25%) presentaron a la vez 2 marcadores genéticos de protección, siendo uno de ellos la deleción CCR5wt/Δ32, combinada simultáneamente con el SNP rs2395029 (HLA-B*57:01) en uno de los casos y el SNP rs9264942 en homocigosis en el otro caso. En el subgrupo de LTNP-NC (n=29), 5 pacientes presentaron una combinación de 2 de estos marcadores, de los cuales 4 de ellos presentaron simultáneamente la CCR5wt/Δ32 y el SNP rs9264942 en homocigosis, y un paciente presentó conjuntamente el SNP rs2395029 (HLA-B*57:01) y el SNP rs9264942 en homocigosis.
Dentro del grupo de los progresores (n=354), 6 pacientes presentaron una combinación de 2 de estos marcadores genéticos (1,7%), de los cuales 2 pacientes (0,6%) presentaron el SNP rs9264942 en homocigosis y el SNP rs2395029 (HLA-B*57:01), otros 2 pacientes (0,6%) presentaron la deleción CCR5wt/Δ32 y el SNP rs9264942 en homocigosis, y otros 2 pacientes (0,6%) presentaron la deleción CCR5wt/Δ32 y el SNP rs2395029 (HLA-B*57:01).
DiscusiónEste es el primer estudio a nivel nacional que analiza los principales marcadores genéticos asociados con la lenta progresión del VIH-1, y más concretamente en la población gallega.
Según la literatura, la prevalencia del polimorfismo (CCR5-Δ32) varía con los diferentes grupos étnicos; en los pobladores del norte de Europa está presente en un 10-20%6,7. En el caso del alelo HLA-B*57:01, su prevalencia está en torno al 1-10% en caucásicos, africanos y asiáticos7, aunque recientemente un estudio epidemiológico (EPI 109839) demostró que la prevalencia de este alelo en España es superior al 6%, llegando a ser del 6,5% en caucásicos15. Por otro lado, la prevalencia del alelo HLA-B*27:05 está presente en el 1,4-8% de los ciudadanos de los principales continentes7, siendo mayor este porcentaje en los caucásicos (8-20%), con una mayor prevalencia en los países escandinavos16.
Estos datos de prevalencia concuerdan con los encontrados en nuestra serie de pacientes, aunque en el caso del alelo HLA-B*57:01 sorprende que la frecuencia de este alelo sea mayor (8,2%) a lo publicado a nivel nacional (6,5%).
En nuestro trabajo, la presencia del alelo HLA-B*57:01, la homocigosis del SNP rs9264942 y la deleción CCR5wt/Δ32 se relacionaron con un mejor pronóstico de la evolución de la infección por VIH-1. Sin embargo, en nuestra serie de pacientes no se encontró evidencia alguna del efecto protector del alelo HLA-B*27:05 en la evolución de la infección por VIH-1. Un estudio español de pacientes seroprevalentes encontró una frecuencia del alelo HLA-B*27 del 23% en 30LTNP controladores de la replicación del virus (LTNP-EC y LTNP-CV)17, mientras que en nuestro estudio tan solo se detectó en 2 pacientes LTNP-NC. Esta inconsistencia podría ser debida a que la presencia de este alelo varía según la latitud a la que se encuentra el país de origen del paciente, siendo su prevalencia prácticamente nula en las regiones próximas al ecuador (0%) y extremadamente alta en los países próximos al Ártico (40%)18. Otro de los motivos que podría explicar esta discrepancia sería la presencia del «sesgo de fragilidad» que se suele producir en los estudios de enfermedades letales, como lo es la infección por el VIH-119. Este tipo de sesgo suele presentarse en estudios que presentan un número pequeño de individuos en los que una población determinada se encuentra enriquecida, como ocurre en los estudios de cohorte en los que se incluye exclusivamente a LTNP, en los cuales alguna de las variables a estudio se relaciona con un evento determinado, como puede ser la lenta progresión. Pero cuando dichas variables son analizadas en una cohorte mucho más grande de pacientes, y cuando, como en nuestro trabajo, además se incluyeron pacientes progresores, esta relación se minimiza o desaparece7. Pero además, otros autores han destacado la relación existente entre diferentes genes, con un efecto sinérgico, cuya asociación podría ser posiblemente más importante que el propio HLA-B*27:05 en términos de mediación y modulación de la progresión de la enfermedad8,18,20-22.
Con relación al subgrupo de pacientes LTNP, se encontró la presencia de más de uno de estos marcadores genéticos, lo cual nos hace pensar en la existencia de sinergias entre estas combinaciones, pero debido al pequeño número de pacientes controladores de viremia (n=17) solo podemos hablar de tendencias. El dato más relevante fue que el 67% de los pacientes que presentaron simultáneamente el SNP rs2395029 (HLA-B*57:01) y la homocigosis del SNP rs9264942 se comportaron como LTNPs (n=4), y dentro de estos el 75% pertenecían al subgrupo de los LTNP-EC, dato que coincide con lo descrito8,14,23, por lo que este resultado refuerza la teoría de que la inmunidad celular juega un papel importante en el retraso del desarrollo de la enfermedad.
ConclusionesLa prevalencia de los marcadores genéticos estudiados en la población gallega es concordante a lo publicado en la literatura. Cabe destacar que la frecuencia hallada del alelo HLA-B*57:01 fue mayor a lo publicado a nivel nacional. Los marcadores genéticos estudiados se han relacionado con un mejor pronóstico de la evolución de la infección por VIH-1, excepto el alelo HLA-B*27:05, que, debido a su baja frecuencia en nuestra población, no hemos podido relacionar su presencia con un efecto protector de la progresión de la infección.
FinanciaciónINBIOMED 2009-063 Xunta de Galicia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Programa de Apoyo a las Capacidades Biomédicas (BIOCAPS). FP7-REGPOT316265.