Las infecciones gastrointestinales por norovirus tienen una elevada prevalencia, causando brotes especialmente en instituciones como las residencias de mayores. Describimos un brote originado por un genotipo de norovirus emergente.
Material y métodosDefinimos caso como residente o trabajador del centro con clínica de GEA del 14 al 29 de mayo de 2022, sin enfermedad de base que la justificara. Se elaboró una encuesta clínico/epidemiológica, recogiéndose muestras de heces de los pacientes con diarrea en el momento del estudio. El análisis virológico fue realizado en el servicio de microbiología de nuestro hospital mediante detección antigénica (Certest®, Biotec SL) y/o PCR multiplex (AllplexTM GI-Virus Assay, Seegene®). El Centro Nacional de Microbiología (CNM) realizó el genotipado viral mediate secuenciación.
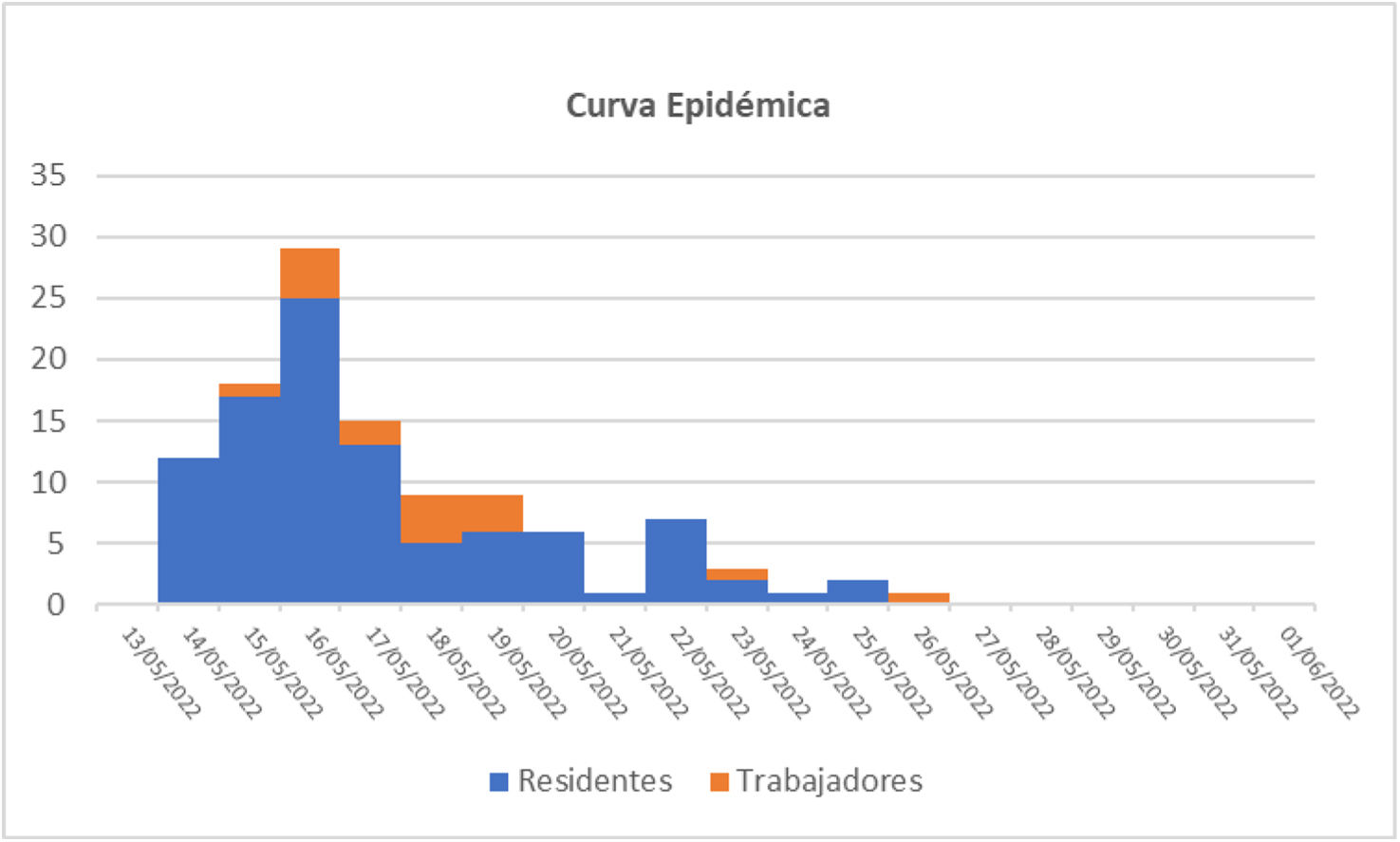
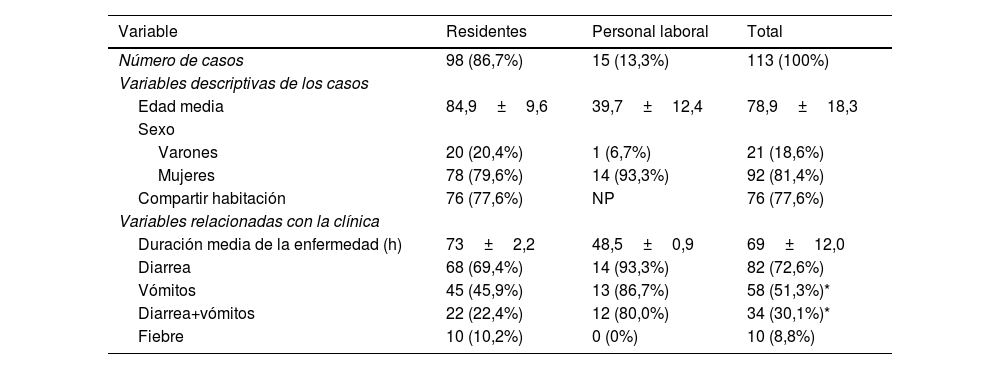
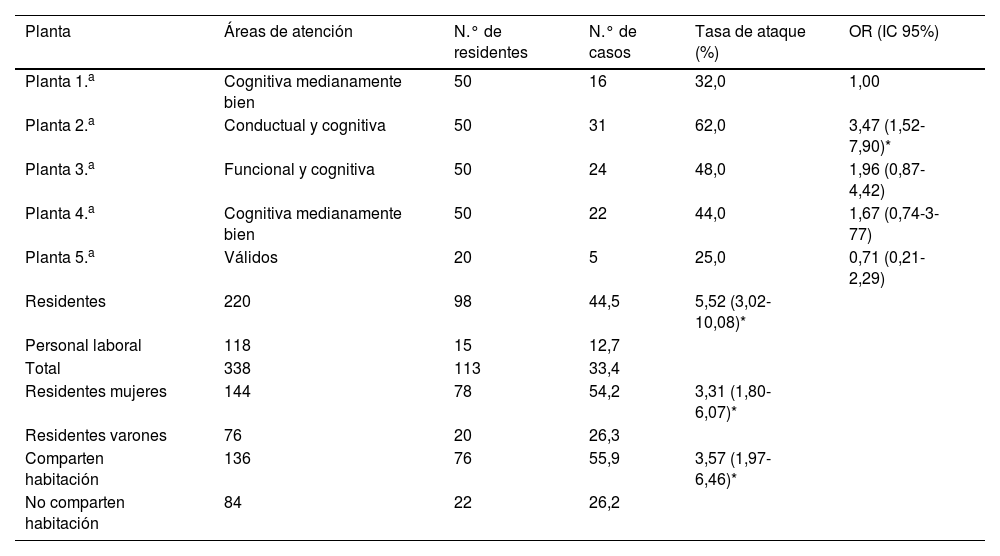
ResultadosEl brote sumó 114 casos (99 residentes, 15 trabajadores), extendiéndose durante 16 días. Los síntomas más frecuentes fueron vómitos y diarrea. La tasa de ataque global fue del 30,8% (en trabajadores 12,7%). Aumentaron rápidamente los casos en las primeras 48h, cayendo progresivamente en días sucesivos. Se descartó la contaminación de alimentos, siendo la transmisión persona a persona la más probable. Los afectados mejoraron clínicamente en menos de 72, sin fallecimientos. Analizamos 14 muestras de residentes, resultando positivas para norovirus GII. El CNM recibió 8 muestras, detectándose en 6 norovirus genogrupo GII, genotipo 17 [P17].
ConclusionesLos brotes de GEA por norovirus en las residencias de mayores pueden afectar a numerosos usuarios. En nuestro caso, norovirus genotipo GII.17 fue el agente etiológico, confirmando su gran difusión en la última década por todo el mundo.
Gastrointestinal norovirus infections are highly prevalent, causing outbreaks especially in institutions such as nursing homes. We describe an outbreak caused by an emerging norovirus genotype.
Material and methodsWe defined a case as a resident or worker of the centre with clinical signs and symptoms of AGE from 14 to 29 May 2022, with no underlying pathology to justify it. A clinical-epidemiological survey was carried out and stool samples were collected from patients with diarrhoea at the time of the study. Virological analysis was performed at the Microbiology Department of our hospital by antigenic detection (Certest®, Biotec SL) and/or multiplex PCR (AllplexTM GI-Virus Assay, Seegene®). Viral genotyping by sequencing was performed by the Centro Nacional de Microbiología (CNM).
ResultsThe outbreak totaled 114 cases (99 residents, 15 workers), extending over 16 days. The most frequent symptoms were vomiting and diarrhoea. The overall attack rate was 30.8% (in workers 12.7%). Cases increased rapidly in the first 48hours, falling progressively over successive days. Food contamination was ruled out, with person-to-person transmission being the most likely. Those affected improved clinically in less than 72hours, with no deaths. We tested 14 samples from residents, which were positive for norovirus GII. The CNM received 8 samples, detecting norovirus genogroup GII, genotype 17 [P17] in 6.
ConclusionsOutbreaks of norovirus GEA in nursing homes can affect numerous users. In our case, norovirus genotype GII.17 was the aetiological agent, confirming its widespread dissemination in the last decade worldwide.
Artículo
Socio de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica

Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la SEIMC, clique aquí