Introducción
Las infecciones fúngicas invasoras (IFI) son un grupo de enfermedades en aumento progresivo en las dos últimas décadas, fundamentalmente en ámbito nosocomial. Su importancia radica, además, en la morbilidad y mortalidad secundarias a estos procesos, especialmente en el caso de los causados por hongos filamentosos 1. Entre ellas, las candidiasis son los procesos más frecuentes, con una incidencia de candidemias de 0,9/1.000 ingresos en nuestro país 2, las cuales inciden más frecuentemente en pacientes con neoplasias hematológicas y en aquellos ingresados en áreas de cuidados intensivos de adultos o niños, sin olvidar la frecuencia en otros pacientes inmunodeprimidos como los que padecen infección por el virus de la inmunodeficiencia humana (VIH) avanzada o los receptores de trasplantes. Un aspecto que considerar es la frecuencia creciente de las especies diferentes a Candida albicans, menos sensibles a los antifúngicos y que pueden llegar a representar la mitad de los episodios. Entre los hongos filamentosos, deben destacarse las infecciones por especies de Aspergillus que inciden en pacientes con neutropenia profunda y prolongada, así como en receptores de trasplantes y otros inmunodeprimidos. Otras micosis invasoras son menos frecuentes, destacando las infecciones por Cryptococcus neoformans, sobre todo la forma de meningitis en pacientes con infección por el VIH avanzada, y las infecciones emergentes por otros hongos filamentosos.
El presente documento es una Guía de Práctica sobre el tratamiento de los pacientes con micosis invasoras para su uso en la práctica clínica diaria, basada en la evidencia existente en el momento de su elaboración y, por tanto, sujeta a las modificaciones derivadas de las nuevas evidencias que en el futuro estén disponibles, en un área del conocimiento con problemas de tratamiento aún no resueltos. Por otra parte, no es una revisión de la extensa literatura médica existente sobre las micosis invasoras ni una edición de las Guías de Práctica Clínica más prestigiosas sobre algunas de las micosis invasoras 3, a las que remitimos al lector interesado en profundizar en los diferentes aspectos de estos procesos. Del mismo modo, dado que recientemente se han revisado los fármacos antifúngicos 4, hemos excluido este apartado de la presente Guía.
Como método de elaboración de esta Guía se propuso un equipo compuesto por especialistas en Medicina Interna expertos en Enfermedades Infecciosas, cada uno de los cuales elaboró el primer borrador de uno de los cuatro apartados que la integran, con un formato y metodología predefinidos. Los documentos iniciales fueron discutidos en una sesión de trabajo, para dar lugar al primer borrador conjunto el cual se difundió a través del portal de Internet de la Sociedad Andaluza de Enfermedades Infecciosas (SAEI), para su estudio por todos los miembros de la SAEI durante 30 días y el envío de sugerencias al coordinador del documento. Con las sugerencias recibidas, el grupo de trabajo elaboró el borrador final, el cual fue finalmente debatido y aprobado en una sesión de trabajo de la SAEI el 25 de junio de 2005. La versión actual, documento oficial de la SAEI, se ha finalizado a partir de las modificaciones introducidas en dicha reunión.
Como se ha referido, esta Guía está basada en la evidencia científica. Para graduar ésta se han seguido los estándares de calidad propuestos por la Infectious Diseases Society of America 5:
1. Calidad de la evidencia.
a) Grado I. Evidencia desde al menos un ensayo controlado y aleatorizado, bien diseñado.
b) Grado II. Evidencia desde al menos un ensayo bien diseñado sin aleatorización, desde estudios analíticos de cohortes o casos y controles (preferiblemente de más de un centro), desde múltiples series temporales, o desde resultados muy evidentes en experimentos no controlados.
c) Grado III. Evidencia desde las opiniones de expertos respetados, basada en la experiencia clínica, estudios descriptivos o comités de expertos.
2. Potencia de la recomendación.
a) Categoría A. Buena evidencia que apoya la recomendación de uso.
b) Categoría B. Moderada evidencia que apoya la recomendación de uso.
c) Categoría C. Pobre evidencia para apoyar la recomendación de uso o contra su uso.
d) Categoría D. Moderada evidencia que apoya la recomendación contra su uso.
e) Categoría E. Buena evidencia que apoya la recomendación contra su uso.
Apartados del documento
1. Tratamiento de la candidiasis invasora.
2. Tratamiento de la criptococosis.
3. Tratamiento de la aspergilosis invasora.
4. Tratamiento de las infecciones invasoras por otros hongos filamentosos.
Tratamiento de la candidiasis invasora
Concepto y epidemiología
En este apartado nos vamos a centrar en comentar el tratamiento de las candidiasis sistémicas y/o con afectación orgánica, excluyendo aquellas formas de candidiasis mucocutáneas.
Especies y sensibilidad
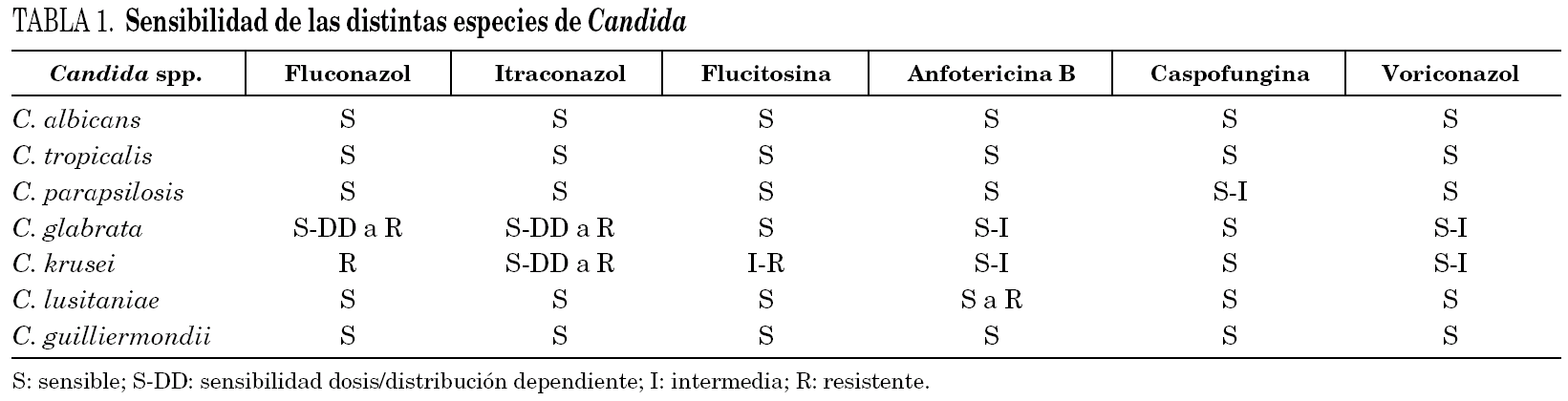
La profilaxis antifúngica con fluconazol en pacientes hematológicos y el amplio uso de antifúngicos en pacientes inmunodeprimidos y críticos, ha convertido a las resistencias en un problema serio y creciente. Las especies implicadas en patología humana y su patrón de sensibilidad están detalladas en la tabla 1.
Tratamiento
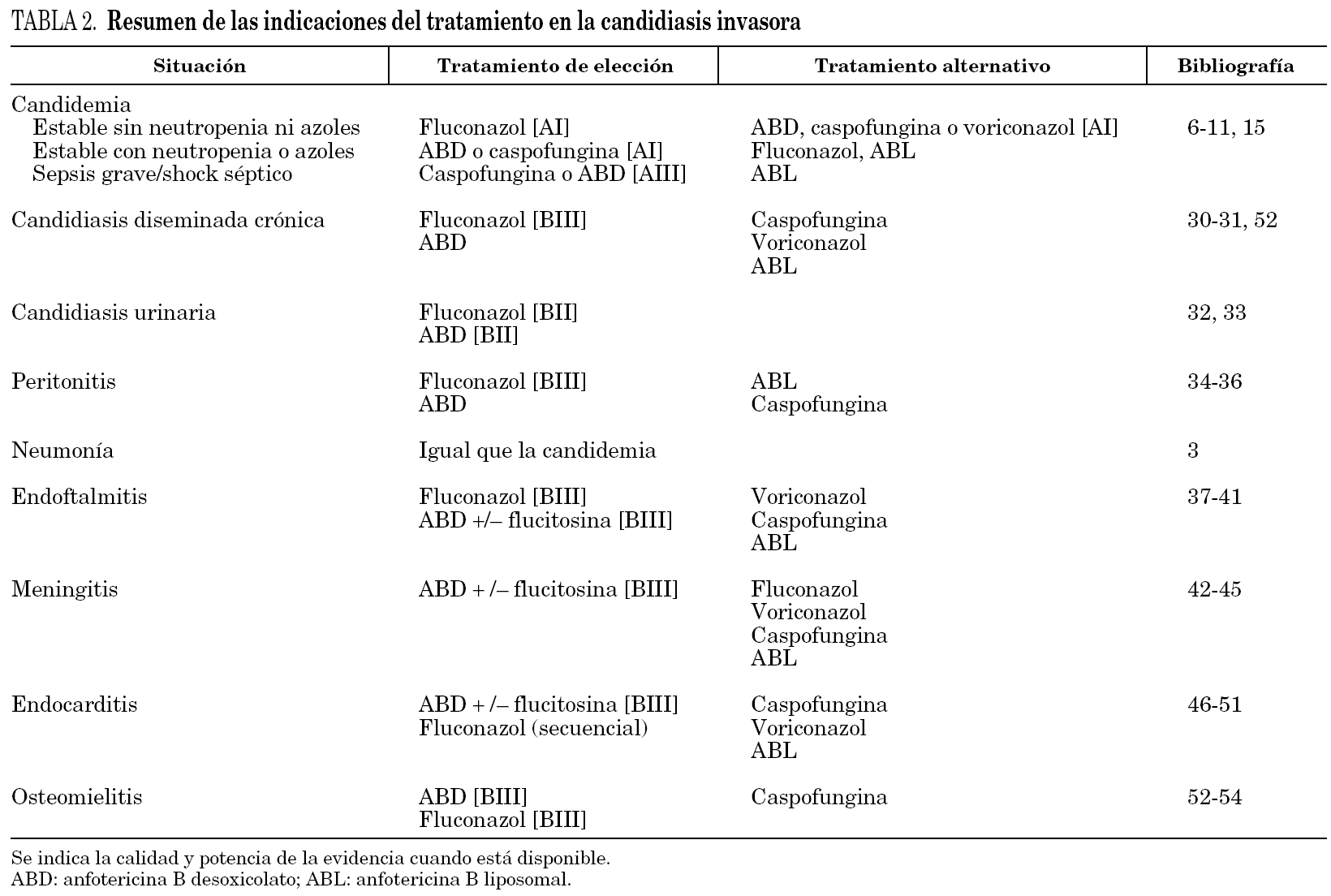
Las recomendaciones establecidas en este apartado están basadas en las publicaciones existentes, siendo éstas ensayos clínicos aleatorizados en las formas hematógenas agudas, y presentación de casos clínicos o series limitadas en las otras formas de presentación de la candidiasis. En la tabla 2 se resumen las indicaciones principales en el tratamiento de las candidiasis invasoras.
Candidemia y candidiasis diseminada
En la actualidad contamos, en el arsenal terapéutico frente a estas formas de candidasis invasora, con los derivados triazólicos, anfotericina B y caspofungina.
Disponemos de varios ensayos clínicos aleatorizados que muestran que fluconazol es, en aquellas especies susceptibles, tan eficaz como anfotericina B para el tratamiento de la candidemia y con un perfil de seguridad superior. El primer estudio 6, multicéntrico y aleatorizado, evaluó la seguridad y eficacia de anfotericina B desoxicolato (ABD) (0,5-0,6 mg/kg/día) y fluconazol (400 mg/día) en 206 pacientes, no neutropénicos ni inmunodeprimidos, evidenció que ambos fármacos tenían una tasa equivalente de éxitos (70% frente a 79% para fluconazol y ABD, respectivamente) con una toxicidad renal significativamente menor en el grupo de fluconazol (2% frente a 37%). En un segundo estudio 7, de diseño y población similares al anterior, los pacientes fueron aleatorizados a recibir ABD (0,6 mg/kg/día, 42 pacientes) o fluconazol (6 mg/kg/día tras dosis inicial de 12 mg/kg/día, 42 pacientes), obteniéndose el éxito terapéutico en el 57% de los pacientes que recibieron fluconazol y en el 62% de los que fueron tratados con ABD. Este estudio confirma el mejor perfil de seguridad de fluconazol (19% de deterioro de función renal en el grupo de fluconazol frente al 43% del grupo de ABD).
En un estudio multicéntrico, prospectivo y aleatorizado, anfotericina B complejo lipídico (ABCL), a dosis de 5 mg/kg/día, demostró actividad terapéutica equivalente a la ABD para el tratamiento de la candidemia nosocomial 8. En un ensayo clínico posterior, aleatorizado y doble ciego, de 224 pacientes con candidiasis invasora, caspofungina mostró eficacia terapéutica equivalente a ABD (73% frente a 62%) con una tasa significativamente menor de efectos adversos 9. Por último, en un ensayo reciente aleatorizado 2:1, se comparó voriconazol con ABD seguida de fluconazol, en 422 pacientes no neutropénicos con candidemia, mostrando tasas de éxito terapéutico equivalentes (65% frente a 71%) y sin diferencia en la mortalidad, existiendo significativamente mayor número de suspensiones del tratamiento a causa de cualquier efecto adverso en el grupo de voriconazol (15% frente a 7%) y, en cambio, con toxicidad renal significativamente mayor en el grupo de ABD/fluconazol (21% frente a 8%) 10.
Actualmente no está establecido el tratamiento combinado de la candidemia. Sólo disponemos de un ensayo clínico, aleatorizado, doble ciego, de 219 pacientes, no neutropénicos, donde el tratamiento de 2 semanas con fluconazol (800 mg/día), junto a ABD durante los primeros 5-6 días, demostró tasas similares de éxito al tratamiento aislado con fluconazol (800 mg/día) durante el mismo tiempo, aunque con una tendencia hacia un aclaramiento más rápido de la fungemia en el grupo de tratamiento combinado 11.
Por todo lo comentado previamente, consideramos que el tratamiento de elección para el paciente estable sin neutropenia, y que no ha recibido previamente azoles, es fluconazol [AI], a dosis de 6 mg/kg/día. ABD y caspofungina han demostrado una eficacia equivalente a fluconazol en estos pacientes [AI].
En pacientes estables que han recibido azoles o que tienen neutropenia el tratamiento de elección es ABD o caspofungina [AI]. En pacientes con sepsis grave o shock séptico el tratamiento recomendado sería ABD (≥ 0,7 mg/kg/día) o caspofungina [AIII].
Los efectos adversos de la ABD son muy frecuentes e importantes, y no sólo por su gravedad potencial, sino por impedir que se alcancen dosis eficaces frente a muchas IFI. Clásicamente, ABD se infundía durante un período de 2-6 h, aunque diversos estudios han mostrado que su infusión continua durante 24 h disminuye significativamente la tasa de efectos adversos, incluida la insuficiencia renal 12-14, y ello permite, incluso, alcanzar dosis más elevadas 13; hay que resaltar que la perfusión durante 24 h necesita una vía venosa específica. La insuficiencia renal es también menos frecuente si la ABD se administra junto a 500-1.000 ml/día de suero fisiológico 12-14. Por ello, siempre que se administre ABD debe considerarse su uso en perfusión continua y/o con sobrecarga salina.
Una vez se conozca la especie de Candida, se debe adecuar el tratamiento antifúngico atendiendo a la sensibilidad de la misma. Además, se recomienda una exploración oftalmológica para descartar endoftalmitis [AII] y la retirada del catéter venoso central siempre que sea la causa de la candidemia 15 [BII]. Debe tratarse hasta 2 semanas después del último hemocultivo positivo y de la resolución de los signos y síntomas de la infección, manteniendo un mínimo de 4 semanas si se constata afectación visceral.
Otras formas de candidiasis invasora
En estas situaciones no existen ensayos clínicos que avalen la utilidad de un antifúngico frente a otro, por lo que las recomendaciones que se especifican se han basado en la experiencia del manejo de las candidemias y las descripciones de series limitadas y casos aislados de las otras formas de candidiasis invasora que se describen a continuación [CIII], salvo que se indique lo contrario.
Candidiasis diseminada crónica (hepatoesplénica)
Esta manifestación de candidiasis ocurre casi exclusivamente en pacientes con neoplasias hematológicas que acaban de recuperarse de un episodio de neutropenia.
De la misma forma que en la candidemia, los pacientes clínicamente estables y que no han recibido profilaxis previa con azoles deben recibir fluconazol (6 mg/kg/día) [BIII], mientras que si no cumplen alguna de estas condiciones son candidatos al tratamiento con ABD (≥ 0,7 mg/kg/día). En los casos con intolerancia o toxicidad a la ABD se recomienda la utilización de caspofungina 16 o formulaciones lipídicas de anfotericina (3-5 mg/kg/día). Una vez transcurridas 1-2 semanas, conseguida la estabilización del paciente y conocida la especie y susceptibilidad, debe mantenerse un curso prolongado de fluconazol 17 por vía oral durante un mínimo de 6 semanas y hasta la calcificación o resolución de las lesiones. En caso de especies de Candida resistentes a fluconazol, puede utilizarse tratamiento de continuación con voriconazol o itraconazol por vía oral.
Candidiasis urinaria
En muchas ocasiones la candiduria no es expresión de IFI. Por ello, sólo está recomendado el tratamiento de la candiduria en pacientes sintomáticos, neutropénicos, receptores de trasplantes renales y en aquellos que van a ser sometidos a manipulaciones urológicas 18 [BIII]. En todos los casos es recomendable la retirada, o el recambio si ésta no es posible, del catéter urinario. Siempre debe descartarse que la candiduria sea expresión de una candidiasis diseminada.
Los antifúngicos recomendados actualmente son: fluconazol (200 mg/día v.o. o i.v.) 19 [BII] o, en caso de especies resistentes a azoles, ABD (0,3-1 mg/kg/día) 3 [BII]. La duración del tratamiento (7-14 días) debe ajustarse a las circunstancias clínicas. Dado que, a diferencia de la ABD, con las formulaciones lipídicas se alcanzan bajas concentraciones en riñón, está especialmente desaconsejado su uso en esta forma de candidiasis.
Peritonitis
Existen básicamente dos escenarios clínicos: la perforación de la pared intestinal, ya sea traumática o quirúrgica 20, y el paciente sometido a diálisis peritoneal.
El tratamiento implica la corrección del defecto anatómico, el drenaje quirúrgico del absceso y la retirada, durante al menos 2 semanas, del catéter de diálisis [BIII]. La mayoría de los clínicos consideran adecuado el tratamiento con fluconazol (6 mg/kg/día i.v.) [BIII], reservando el uso de ABD (≥ 0,7 mg/kg/día) en caso de especies resistentes a fluconazol 21. Si existe intolerancia a ABD puede utilizarse anfotericina B liposomal (ABL) (≥ 3 mg/kg/día). El tratamiento se debe mantener en función de la respuesta clínica, habitualmente 2-3 semanas 22. No se aconseja el uso de anfotericina B intraperitoneal por el elevado riesgo de peritonitis química.
Neumonía
En el contexto de una candidiasis hematógena diseminada, no requiere manejo específico. Las descripciones anecdóticas de neumonía primaria, en relación con aspiraciones orofaríngeas, se han tratado en la mayoría de los casos con ABD (0,7-1 mg/kg/día) 3 [BIII].
Endoftalmitis
Existen dos formas en función del mecanismo de adquisición: la hematógena, en el contexto de una candidiasis diseminada y la forma posquirúrgica.
Fluconazol (6-12 mg/kg/día) puede utilizarse inicialmente y como tratamiento de secuenciación oral 23 [BIII]. Otro tratamiento clásicamente recomendado es la utilización de ABD (1 mg/kg/día), que podría asociarse a flucitosina (100 mg/kg/día) en los casos más graves [BIII]. Voriconazol o caspofungina puede tener un papel en los casos donde los tratamientos de primera línea no pueden ser usados por toxicidad o resistencia 24,25. El tratamiento se debe mantener hasta la resolución o estabilización del cuadro, lo que generalmente se consigue en 6-12 semanas. La vitrectomía precoz y la administración intravítrea de anfotericina B (5-10 mg en 0,1 ml) se recomiendan en pacientes con déficit visual sustancial y en las formas posquirúrgicas 26,27.
Meningitis
Puede aparecer como complicación de una candidiasis diseminada o en relación con procedimientos neuroquirúrgicos o traumatismos.
ABD (0,7-1 mg/kg/día) 28, o dosis equivalente de una formulación lipídica 29, junto a flucitosina (100 mg/kg/día) parece ser el tratamiento de primera línea [BIII] mientras que fluconazol es utilizado principalmente como tratamiento secuencial o supresor 30. Caspofungina podría ser útil en situaciones refractarias al tratamiento convencional 31. La buena penetración de voriconazol en el sistema nervioso central (SNC) podría favorecer su futura indicación en esta forma de candidiasis invasora. El tratamiento debe mantenerse hasta un mínimo de 4 semanas tras la resolución de las manifestaciones clínicas, analíticas y radiológicas. En aquellos casos asociados a procesos neuroquirúrgicos es necesaria la retirada del material protésico.
Endocarditis candidiásica
Como en el resto de formas de candidiasis invasoras distintas a la hematógena aguda, no existen evidencias de cuál es el mejor tratamiento. ABD (0,7-1,2 mg/kg/día) con o sin flucitosina (100 mg/kg/día) podría ser el tratamiento recomendado [BIII]. En aquellos casos con respuesta al tratamiento y etiología por especies de Candida sensibles a azoles se puede continuar tratamiento secuencial con fluconazol a dosis de 400 mg/día.
También han sido utilizados con éxito ABL 32,33, caspofungina cuando el tratamiento convencional está limitado por su toxicidad y perfil de resistencias 34-36, y voriconazol, por su perfil farmacocinético, constituyen alternativas terapéuticas 37.
No debe olvidarse que el tratamiento de la endocarditis candidiásica es médico y quirúrgico. Se recomienda mantener el tratamiento antifúngico al menos 6 semanas tras el recambio valvular, el cual debería ser obligado. Si el recambio no es posible, se necesita un régimen supresor a largo plazo, probablemente indefinido [CIII].
Osteomielitis y artritis porCandida
Se recomienda iniciar el tratamiento médico con ABD (≥ 0,6 mg/kg/día) durante 2-3 semanas, seguido de fluconazol (400 mg/día) para completar un tratamiento de 6-12 meses 38 [BIII]. Caspofungina constituye un potencial componente del arsenal terapéutico en caso de fracaso con el tratamiento convencional y/o toxicidad 39. Es necesario, cuando sea posible, el desbridamiento o drenaje quirúrgico. En las infecciones de prótesis articulares está indicado el recambio del material protésico 40.
Tratamiento de la criptococosis
Concepto
La criptococosis es una infección sistémica causada por el hongo levaduriforme y capsulado denominado C. neoformans. La infección por el VIH es la causa predisponente en alrededor del 80-90% de los casos de criptococosis, ocurriendo por lo general en pacientes con recuento de linfocitos CD4+ inferiores a 100/ml 41. El uso de los tratamientos antirretrovirales de gran actividad (TARGA), ha reducido en los últimos años de forma drástica su incidencia en países desarrollados. El trasplante de órganos es la segunda causa predisponente de criptococosis, la cual, también ha sido descrita en pacientes con disminución idiopática de linfocitos CD4+*42,43. La meningitis es con mucha diferencia la forma clínica más frecuente y en la que existen evidencias sobre el tratamiento más eficaz, por lo que nos referiremos exclusivamente a ella.
Especies deCryptococcus
El género Cryptococcus incluye diversas especies, de las que C. neoformans se considera el patógeno humano más importante. Se han descrito casos de enfermedad en humanos por otras especies, C. laurentii y C. albicans, especialmente en sujetos inmunodeprimidos.
Tratamiento
En ausencia de tratamiento la meningitis criptocócica es una enfermedad de curso fatal. El tratamiento de elección consiste en una fase de inducción de 2 semanas con ABD a dosis de 0,7 mg/kg/día en combinación o no con flucitosina a dosis de 100 mg/kg/día, seguido de una fase de consolidación del tratamiento con fluconazol a dosis de 400 mg/día durante 8 semanas; en caso de respuesta microbiológica tardía, debe mantenerse el tratamiento 8 semanas desde que el cultivo de líquido cefalorraquídeo (LCR) sea estéril [AI]. Con esta pauta la mortalidad es baja (< 10%) y la respuesta microbiológica es aproximadamente el 70% 44,45. Se ha discutido sobre la conveniencia o no de añadir flucitosina a la ABD durante la fase de inducción del tratamiento de la meningitis criptocócica. La adición de flucitosina no mejora el pronóstico a corto plazo pero disminuye el riesgo de recidivas de la enfermedad y, además, es bien tolerada cuando se administra por un período de tan sólo 2 semanas 44,45. Se ha demostrado que itraconazol es menos eficaz que fluconazol cuando se emplea en la fase de consolidación del tratamiento 46 [BI].
El empleo de ABL (4 mg/kg/día) y ABCL (a dosis de 1, 2, 2,5 y 5 mg/kg/día) no mejora los resultados obtenidos por la ABD 45,47,48 [AI]. Las diferencias de coste entre las formulaciones lipídicas de anfotericina B y la ABD y el hecho de que no mejoren la eficacia obtenida con esta última, justifican en nuestra opinión que la ABD deba ser considerada de elección para el tratamiento de la meningitis criptocócica.
La combinación fluconazol y flucitosina ha demostrado su eficacia en el tratamiento de la meningitis criptocócica 49 [BII]. Sin embargo, el empleo de esta pauta se ha asociado a frecuente toxicidad, especialmente mielotoxicidad e intolerancia digestiva 49. Por ello, sólo se recomienda como alternativa al tratamiento estándar en caso de intolerancia o falta de respuesta 50 [CII].
La terapia óptima en pacientes con fracaso terapéutico es desconocida. Parece razonable recomendar el uso de ABD con o sin flucitosina en aquellos pacientes que hayan sido tratados con fluconazol inicialmente, manteniendo el tratamiento hasta que se verifique una respuesta clínica [BIII]. Voriconazol tiene una excelente actividad in vitro frente a Cryptococcus spp. y ha demostrado eficacia en el tratamiento de meningitis criptocócica que han fracasado al tratamiento 51 [CIII]. Por ello, puede ser una alternativa en caso de fracaso o intolerancia al tratamiento estándar 50. Las dosis de voriconazol recomendadas para el tratamiento de las meningitis criptocócicas son las habituales.
Los pacientes infectados por el VIH con criptococosis que han completado la terapia inicial deben seguir recibiendo tratamiento de forma indefinida (profilaxis secundaria) hasta que se consiga la restauración del sistema inmunitario como consecuencia de la realización del TARGA [AI]. Fluconazol a dosis de 200 mg/día es el fármaco de elección para esta indicación ya que ha demostrado mayor eficacia que itraconazol para prevenir la aparición de recidivas 52,53 [AI]. Así mismo, parece razonable extender esta recomendación a otros pacientes inmunodeprimidos mientras que permanezcan en esta situación [CIII].
No disponemos de los estudios necesarios para realizar una recomendación concluyente respecto a los criterios de retirada de la profilaxis secundaria anticriptocócica. Se ha sugerido que en pacientes infectados por el VIH se podría retirar la profilaxis secundaria en aquellos pacientes que permanecen asintomáticos respecto a la criptococosis y que hayan conseguido una respuesta inmunológica mantenida con el TARGA, definida como el incremento de las cifras absolutas de linfocitos CD4+ por encima de 100-200/ml durante al menos 6 meses y en al menos dos determinaciones 50 [CIII].
Tratamiento de la aspergilosis invasora
Concepto
La aspergilosis invasora (AI) se ha convertido en la primera causa de micosis por hongos filamentosos y la segunda causa de IFI, sólo superada por Candida spp. 54. Dado que Aspergillus es un hongo ubicuo, la exposición a sus esporas es habitual, si bien la enfermedad por invasión tisular de este hongo no es un evento frecuente y, como en el caso de otras infecciones fúngicas, aparece en el contexto de una situación de inmunosupresión.
La AI es una infección excepcionalmente grave, con una incidencia que oscila entre el 5 y el 20%, en pacientes con neutropenia o disfunción de neutrófilos y/o macrófagos, quimioterapia citotóxica, tratamiento crónico con corticoides, trasplante de progenitores hematopoyéticos u órgano sólido o con inmunodeficiencia congénita o adquirida 55,56.
La forma más frecuente de adquisición de Aspergillus es a través de inhalación de esporas, por lo que el órgano más frecuentemente afectado es el pulmón, y las manifestaciones más frecuentes de la AI son la neumonía y la rinosinusitis 57, si bien también se pueden ver afectados otros órganos y sistemas. Las formas clínicas más frecuentes se resumen en la tabla 3.
Especies y sensibilidad
El género Aspergillus incluye más de 185 especies, de las cuales unas 20 causan enfermedad en el ser humano. A. fumigatus es la especie que con más frecuencia causa enfermedad invasora, seguida en frecuencia por A. flavus y, a mayor distancia, A. niger. Los patrones de sensibilidad son fundamentalmente los mismos para las distintas especies de Aspergillus, siendo la mayoría de los aislados sensibles a anfotericina B, itraconazol, voriconazol y caspofungina. No obstante, se han descrito especies con concentración inhibitoria mínima (CMI) elevada para anfotericina B (A. terreus) y para itraconazol (A. fumigatus), aunque no para voriconazol, que en los distintos estudios realizados ha demostrado ser, junto a caspofungina, el agente antifúngico más activo frente a Aspergillus spp. 58-61.
Tratamiento
La mortalidad de la AI sin tratamiento es casi del 100%, y con tratamiento, en función de las formas de presentación y del estado inmunológico del paciente, se sitúa siempre por encima del 50%. Por ello, se debe ser agresivo en el diagnóstico en los pacientes de alto riesgo e iniciar el tratamiento lo más precozmente posible para intentar mejorar la supervivencia 62,63 [BII].
Tres son los componentes fundamentales del tratamiento de la AI:
Recuperación de las situaciones predisponentes
En los pacientes neutropénicos la recuperación de la médula ósea es fundamental en el control de la aspergilosis. Así, en los pacientes con trasplante de progenitores hematopoyéticos (TPH), el fracaso en el prendimiento del injerto conduce invariablemente a la muerte de paciente. En el año 2000, Patterson et al 64 comunicaron los resultados de un estudio retrospectivo en el que la supervivencia se correlacionó de forma inversa con el grado de inmunosupresión de los pacientes.
Por otro lado, el papel de los factores estimulantes de colonias de granulocitos, transfusiones de granulocitos y otras terapias inmunológicas (interferón γ [IFN-γ] recombinante) no está bien establecido. Se ha comunicado que el empleo de estas terapias es capaz de aumentar, in vitro, la actividad de los neutrófilos frente a hifas 65 y algunos estudios aleatorizados y controlados por placebo han demostrado la seguridad de estas terapias adyuvantes en el tratamiento de candidiasis invasora 66 y de la criptococosis en pacientes con infección por el VIH 67. Sin embargo, hasta la fecha no existe ningún ensayo clínico que haya evaluado la utilidad de las terapias inmunológicas en el tratamiento de la AI 68, por lo que habitualmente no se recomienda su empleo 56 [CIII].
Tratamiento médico
En el momento actual y en base a los datos publicados en los tres últimos años, tanto voriconazol como caspofungina han desplazado a la anfotericina B, en cualquiera de sus formulaciones, en el tratamiento de la AI.
Existen dos grandes estudios sobre voriconazol. El primero 69, no comparativo y abierto, evaluó su eficacia y seguridad en pacientes con aspergilosis como terapia de inicio (52%) o en rescate (48%). En ese estudio voriconazol obtuvo una respuesta favorable (completa o parcial) en el 59% de los casos cuando se administró como tratamiento inicial, y del 38% en los pacientes que habían fracasado con otro antifúngico. El segundo 70, multicéntrico, internacional, aleatorizado y abierto, comparó voriconazol frente a ABD como terapia inicial de 277 pacientes con AI. La respuesta favorable a las 12 semanas del 52% para el grupo del voriconazol frente a sólo 32% para el grupo de ABD, junto a una disminución significativa de la mortalidad en el grupo asignado a voriconazol (58% frente a 71%) [AI] han favorecido que en el momento actual sea el tratamiento de elección de la AI, incluyendo los casos con afectación del SNC 69 [BII].
Caspofungina está indicada en el momento actual en el tratamiento de la aspergilosis refractaria o cuando existe intolerancia al tratamiento con voriconazol. En un reciente trabajo la caspofungina consiguió una respuesta completa o parcial en el 45% de 90 pacientes tratados por intolerancia o fracaso al tratamiento de primera elección, resultados que fueron superiores al de un grupo control contemporáneo, rigurosamente elegido por un grupo de investigadores independientes 71. Estos resultados, motivaron la autorización por parte de la Food and Drug Administration (FDA) de caspofungina para el tratamiento de rescate de la AI [BII].
Como se desprende del análisis previo, el uso de la anfotericina B en la AI sólo debe considerarse tras el fracaso o la imposibilidad de uso de voriconazol [AI] y caspofungina [BII], sin que haya evidencia suficiente para hacer recomendaciones de unas u otras formulaciones en esta situación clínica.
El papel del itraconazol en la AI no está bien establecido. La biodisponibilidad variable de las formulaciones orales y el número elevado de interacciones farmacológicas limitan su utilización. Se han comunicado resultados satisfactorios utilizando itraconazol oral de forma secuencial con anfotericina B, una vez alcanzada una respuesta parcial con ésta 56,72, aunque no hay estudios que confirmen esta pauta [CIII]. En la actualidad no existen datos para recomendar el uso de itraconazol intravenoso en la AI.
Hasta el momento no se ha realizado ningún estudio aleatorizado usando tratamientos combinados, y toda la información disponible proviene de estudios observacionales con distintas combinaciones de fármacos y criterios de inclusión, todos ellos con serias limitaciones 73,74. Por tanto, no existe evidencia firme en la actualidad que permita aconsejar el tratamiento combinado en la AI [CIII]. Estudios futuros podrán contestar a esta interrogante en una patología con una mortalidad tan elevada.
La duración del tratamiento depende de la localización de la infección, la enfermedad subyacente y la respuesta al tratamiento 75 [BIII]. Por lo general debe mantenerse el tratamiento antifúngico 12 semanas y hasta al menos 2 semanas tras la resolución de los signos y síntomas de la infección, pero siempre valorando la posible inmunosupresión subyacente [BII]. La radiografía de tórax, si estaba alterada, debe haberse estabilizado y los signos de infección activa deben haber desaparecido [BIII]. Si bien no existen datos suficientes, en base a los resultados disponibles 70, si la evolución clínica es favorable, tras al menos 7 días de tratamiento intravenoso se podría completar el resto del tratamiento por vía oral [CIII].
Tratamiento quirúrgico
Su finalidad es eliminar el tejido necrótico. Es, habitualmente, imprescindible en el tratamiento de la sinusitis por Aspergillus, cuando existen lesiones cutáneas necróticas y en la afectación pulmonar con riesgo de hemoptisis 76 [CIII].
Tratamiento de las infecciones causadas por otros hongos filamentosos
Los hongos filamentosos patógenos para los seres humanos capaces de causar infecciones invasoras se clasifican en dos grupos, zigomicetos y hongos hialinos 78. En el primero de ellos se agrupan los agentes responsables de la mucormicosis (mucorales) 79. En el segundo grupo son clasificados los mohos hialinos y los mohos dermatofitos y dimórficos que quedan fuera del objeto de esta revisión (tabla 4).
Mucormicosis
Concepto y epidemiología
Con este término se designan una serie de enfermedades de características clínicas similares, causadas por diferentes hongos pertenecientes al orden mucorales. Es la segunda micosis filamentosa más frecuente después de la aspergilosis 79,80. Los agentes más frecuentemente aislados son las especies de Rhizopus y Rhizomucor y en menor medida Cunninghamella, Saksenaea y Apophysomyces.
Suelen ser hongos saprofitos que se encuentran en la tierra y materia orgánica en descomposición, que bajo determinadas condiciones del huésped (diabetes mellitus, infección por el VIH, receptores de trasplantes, pacientes oncológicos sometidos a tratamiento citostático, entre otros) pueden causar una enfermedad invasora 79. La diseminación se produce habitualmente por la inhalación de las esporas o, menos frecuentemente, por vía hematógena a partir de quemaduras o traumatismos graves 81, siendo excepcional en sujetos inmunocompetentes 82. La importancia clínica de esta enfermedad radica en su elevada mortalidad (mayor al 75% para las formas invasoras) 79,83-85.
Tratamiento
Debe iniciarse tratamiento de forma inmediata ante la sospecha de esta micosis invasora. El tratamiento se basa en tres pilares fundamentales 79,80,85: tratamiento de la enfermedad subyacente, desbridamiento quirúrgico agresivo para eliminar el tejido necrótico y el foco infeccioso, restableciendo el aporte sanguíneo, y uso de agentes antifúngicos. Anfotericina B a dosis elevadas, en cualquiera de sus formas, es el único agente con actividad in vitro demostrada 80, siendo el tratamiento de elección [BIII], con la que se han descrito tasas de respuesta de hasta el 63% 85. El uso de oxigenación hiperbárica como tratamiento coadyuvante en las formas rinocerebrales no ha mostrado beneficio adicional. En general, los mucorales muestran resistencia in vitro a caspofungina, flucitosina y azoles en monoterapia 78,79.
Scedosporium
Concepto y epidemiología
Son mohos emergentes que puede ser causa de micosis diseminadas, habitualmente de mal pronóstico. Las especies con trascendencia médica para el ser humano son S. apiospermum y S. profilicans, siendo esta última especie resistente a todos los antifúngicos disponibles.
Ambas especies son de distribución ubicua y pueden causar infecciones focales en pacientes inmunocompetentes o enfermedad diseminada fundamentalmente en pacientes oncológicos, receptores de trasplante, con neutropenia prolongada, enfermedad pulmonar crónica o infectados por el VIH 86,87.
Tratamiento
No existen ensayos controlados aleatorizados en los que se comparen las distintas posibilidades terapéuticas. Voriconazol tiene una buena actividad in vitro y es considerado el fármaco de elección 87-89 [CIII]. Caspofungina tiene también una buena actividad in vitro 90. La combinación de voriconazol o itraconazol con terbinafina parece tener un importante efecto sinérgico in vitro91,92, pero su eficacia clínica es desconocida. El tratamiento farmacológico debe ir asociado al de la enfermedad subyacente y desbridamiento quirúrgico cuando sea posible. El tratamiento de las IFI causadas por S. prolificans está por determinar 87.
Fusarium
Concepto y epidemiología
La fusariosis es una micosis oportunista emergente con una muy elevada morbimortalidad en pacientes no inmunocompetentes 93. Las especies patógenas más frecuentes son F. solani, F. oxysporum, F. monilifome y F. proliferatum.
Fusarium puede causar infecciones diseminadas en neutropénicos o receptores de trasplante, fundamentalmente hematológicos, siendo actualmente, junto con la mucormicosis, la segunda causa de IFI por hongos filamentosos tras Aspergillus94.
Tratamiento
Fusarium es uno de los hongos más resistentes a los tratamientos disponibles en la actualidad, en especial F. solani95, no existiendo datos en la actualidad que permitan establecer una recomendación de tratamiento basada en la evidencia.
En pacientes inmunodeprimidos no ha sido determinado con exactitud cual sería el tratamiento de elección 94 pues los fármacos antifúngicos habituales se caracterizan por una muy limitada actividad in vivo95 y porque las evidencias disponibles proceden de series breves de casos no aleatorizados. Anfotericina B y caspofungina no son activas en este tipo de micosis 96,97, aunque se han descrito casos curados con altas dosis de formulaciones lipídicas de anfotericina B 97,98, más aún si se usan dosis de hasta 5 mg/kg/día y se prolonga el tiempo de administración. Por otro lado, se han descrito resultados satisfactorios con la asociación de estas formulaciones de anfotericina B y terbinafina oral 99 o voriconazol 100 y con voriconazol en monoterapia 89. Pentamidina ha demostrado actividad fungistática in vitro frente a F. solani y actividad fungicida frente al resto de especies de Fusarium101.
Acremonium
Concepto y epidemiología
Las especies de Acremonium son hongos filamentosos oportunistas responsables de las poco habituales hialohifomicosis humanas. Las especies potencialmente patógenas para el ser humano son A. falciforme y A. strictum. Son microorganismos saprofitos y de distribución ubicua en el medio ambiente, que pueden ser responsables de infección diseminada y fungemia en pacientes inmunodeprimidos 78.
Tratamiento
El tratamiento de elección de las infecciones invasoras por Acremonium queda aún por determinar debido a la escasa información existente al respecto. En general, las especies de Acremonium suelen ser resistentes a la mayoría de antifúngicos disponibles, fundamentalmente anfotericina, fluconazol e itraconazol 102, aunque la sensibilidad parece ser especie dependiente. Se han descrito casos con buena evolución tratados con voriconazol 103, aunque probablemente anfotericina B sea el agente más eficaz, habiéndose comunicado al menos 2 casos con neutropenia profunda en los que existió respuesta satisfactoria con altas dosis de ABL 104.
Paecilomyces
Concepto y epidemiología
Es un hongo filamentoso que suele causar queratitis e infección de tejidos blandos. Las especies de Paecilomyces responsables de micosis invasoras son P. lilacinus y P. variotii. Estos hongos filamentosos son gérmenes habitualmente presentes en el aire, tierra y materia orgánica en descomposición, tejidos y plásticos 105. Pueden causar micosis profundas en el ser humano habitualmente asociadas a infección de prótesis y catéteres intravasculares en pacientes inmunodeprimidos 106.
Tratamiento
El tratamiento óptimo de las infecciones invasoras causadas por las especies de Paecilomyces no ha sido establecido, a diferencia de lo que ocurre con las infecciones localizadas 105. Se recomienda el uso de las formulaciones lipídicas de anfotericina o dosis elevadas de anfotericina convencional si es bien tolerada 78, salvo en el caso de infecciones invasoras por P. lilacinus resistente a anfotericina B y en el que se han descrito casos con buena respuesta a voriconazol 107.
Agradecimientos
Al Dr. Víctor Gutiérrez-Ravé Pecero y al Dr. Julián de la Torre Cisneros por sus comentarios críticos al borrador original de este documento. A D. Manuel Milla Martín por su colaboración en la confección final del manuscrito.
Correspondencia: Dr. Jerónimo Pachón.
Servicio de Enfermedades Infecciosas.
Hospitales Universitarios Virgen del Rocío.
Avda. Manuel Siurot, s/n. 41013 Sevilla. España.
Correo electrónico: jeronimo.pachon.sspa@juntadeandalucia.es
Manuscrito recibido el 1-10-2005; aceptado el 27-11-2005.