Estudiamos la tendencia y estacionalidad de las resistencias en Escherichia coli comunitario y se cuantifica su asociación con el uso previo de determinados antibióticos.
MétodosEstudio de series temporales de las resistencias de aislados comunitarios de E. coli y su relación con el consumo de antibióticos en un área de primaria durante 2008-2012. La tendencia y estacionalidad de las resistencias se estudiaron mediante regresión de Poisson.
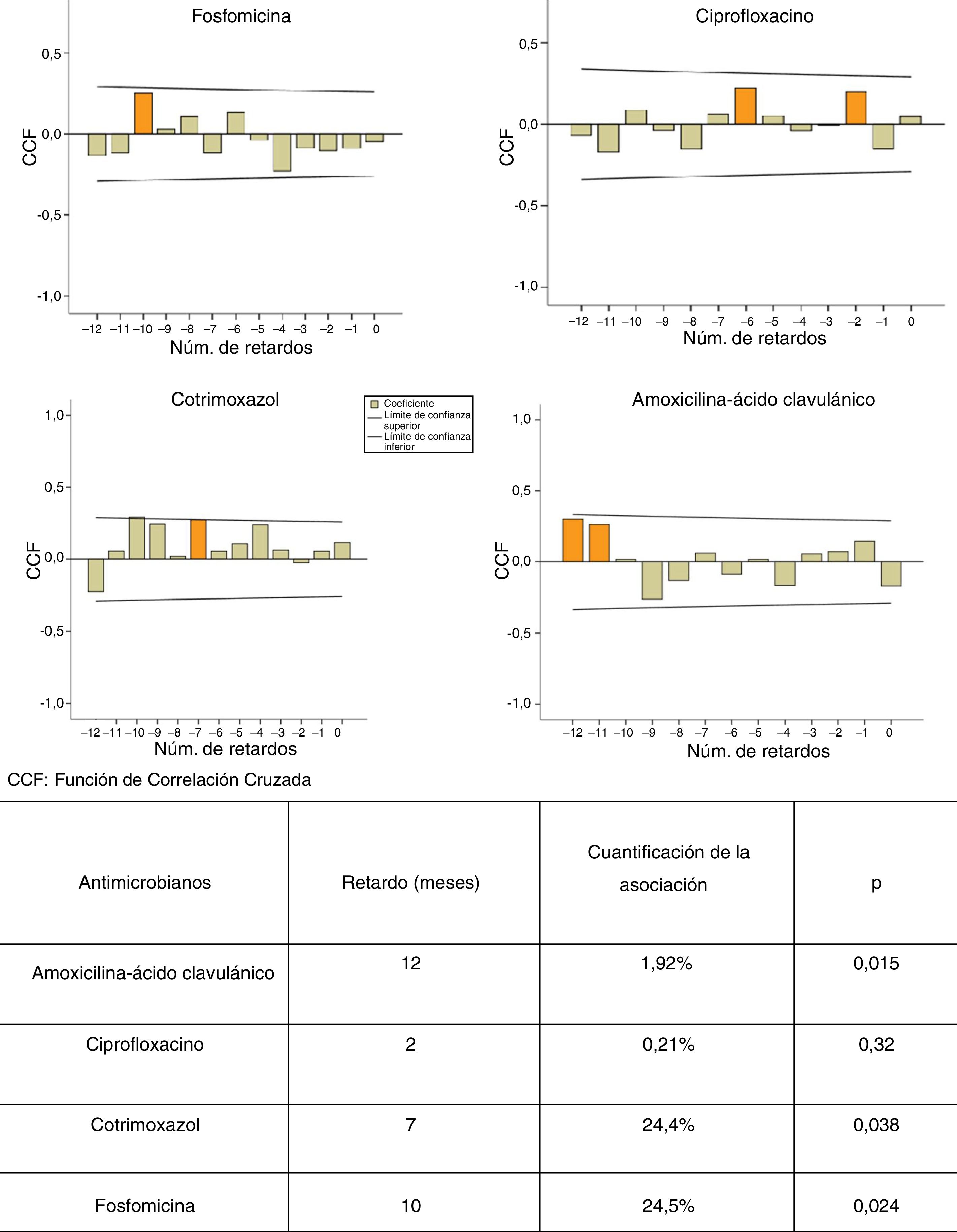
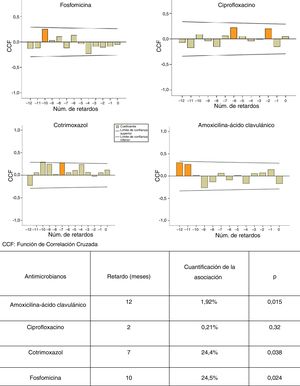
ResultadosSe observó un aumento significativo de la resistencia promedio de E. coli a cefalosporinas, nitrofurantoína y aminoglucósidos. La estacionalidad de las resistencias fue significativa en otoño-invierno para amoxicilina-ácido clavulánico y ciprofloxacino. Observamos un retardo de 7, 10 y 12 meses entre el consumo de cotrimoxazol (p<0,038), fosfomicina (p<0,024) y amoxicilina-ácido clavulánico (p<0,015), respectivamente, y la aparición de resistencias.
ConclusionesDetectamos un retardo medio de 10 meses entre la utilización de amoxicilina-ácido clavulánico, cotrimoxazol y fosfomicina, y la aparición de cepas resistentes de E. coli comunitarios.
We studied the trend and seasonality of community-acquired Escherichia coli resistance and quantified its correlation with the previous use of certain antibiotics.
MethodsA time series study of resistant community-acquired E. coli isolates and their association with antibiotic use was conducted in a Primary Health Care Area from 2008 to 2012. A Poisson regression model was constructed to estimate the trend and seasonality of E. coli resistance.
ResultsA significant increasing trend in mean E. coli resistance to cephalosporins, aminoglycosides and nitrofurantoin was observed. Seasonal resistance to ciprofloxacin and amoxicillin-clavulanic acid was significantly higher in autumn-winter. There was a delay of 7, 10 and 12 months between the use of cotrimoxazole (P<0.038), fosfomycin (P<0.024) and amoxicillin-clavulanic acid (P<0.015), respectively, and the occurrence of E. coli resistance.
ConclusionsAn average delay of 10 months between the previous use of amoxicillin-clavulanic acid, cotrimoxazole and fosfomycin and the appearance of resistant community-acquired E. coli strains was detected.
El aumento de las infecciones por microorganismos multirresistentes, que tanta alarma está creando por su elevada morbimortalidad y gasto sanitario1 se ha relacionado frecuentemente con la elevada presión selectiva de los antimicrobianos utilizados en salud humana2,3.
Los modelos autoregressive integrated moving average (ARIMA), herramienta estadística para encontrar patrones que permitan realizar estimaciones futuras, se han aplicado al control de la infección nosocomial4 y más recientemente, al diseño de un programa de gestión eficiente de antimicrobianos tras un brote de bacterias productoras de carbapenemasas5. Asimismo, permiten cuantificar la relación entre el uso de antibióticos y la aparición de resistencias, estimando, además, el tiempo que tarda (retardo) en producirse un incremento de resistencia a un antibiótico tras un aumento en el consumo del mismo6,7.
Los objetivos de este trabajo son estudiar la tendencia y estacionalidad de la resistencia de aislados de Escherichia coli (E. coli) comunitarios a determinados antimicrobianos y cuantificar, mediante modelos ARIMA, la relación dinámica entre el uso previo de antibióticos y la aparición de resistencias durante un período de 5 años.
Material y métodosEstudio retrospectivo de series temporales de las cepas de E. coli aisladas de pacientes procedentes de atención primaria (AP) de un área sanitaria con 211.533 habitantes, el consumo de antibióticos y la aparición de resistencias entre 2008 y 2012.
Los datos de consumo a antibióticos se refieren a la población estudiada, expresados como dosis diaria definida (DHD/1.000 habitantes/día) y proporcionados por la Dirección General de Farmacia de la Comunidad Autónoma. El estudio de sensibilidad a ampicilina (AM), amoxicilina-ácido clavulánico (AMC), cefoxitina (CFX), cefotaxima (CFT), cefuroxima (CFM), ciprofloxacino (CIP), cotrimoxazol (SXT), fosfomicina (F), nitrofurantoína (NF), gentamicina (G) y tobramicina (TO) se realizó mediante el sistema Vitek-2® (BioMérieux, France) en el laboratorio de microbiología del hospital de referencia. Los datos se expresaron en porcentaje de resistencia (número de aislados de E. coli resistentes al antibiótico/total de aislados). Tanto para el consumo como para las resistencias se utilizó como agregado temporal el mes.
La tendencia y estacionalidad de las resistencias se estudiaron mediante un modelo de regresión de Poisson, donde se introdujo como variable dependiente el porcentaje de resistencia. La tendencia se estimó mediante la variable que representa el número de meses transcurridos durante los 5 años, mientras que la estacionalidad se estimó mediante la variable que representa el mes del año, tomando como referencia el mes de enero. El resultado obtenido se interpretó como una razón de incidencias incidence rate ratio (IRR) y su intervalo de confianza del 95% (IC 95%). En el caso de la tendencia, el IRR indica el cambio relativo en la serie por cada año transcurrido y para la estacionalidad, el cambio relativo en cada mes respecto al mes de referencia.
Se construyeron diferentes modelos ARIMA de series temporales según la metodología descrita por Box et al. en 19768 y adaptada por López-Lozano et al. en el año 20006. En una primera fase, mediante gráficos de correlaciones cruzadas, se identificaron los retardos en los que la asociación consumo-resistencia fue más significativa. Posteriormente se construyeron modelos de transferencia para la cuantificación de la relación entre el consumo de AMC, CIP, SXT y F, y la aparición de resistencias en los aislados de E. coli.
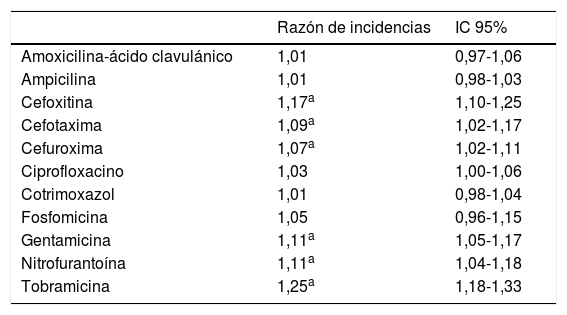
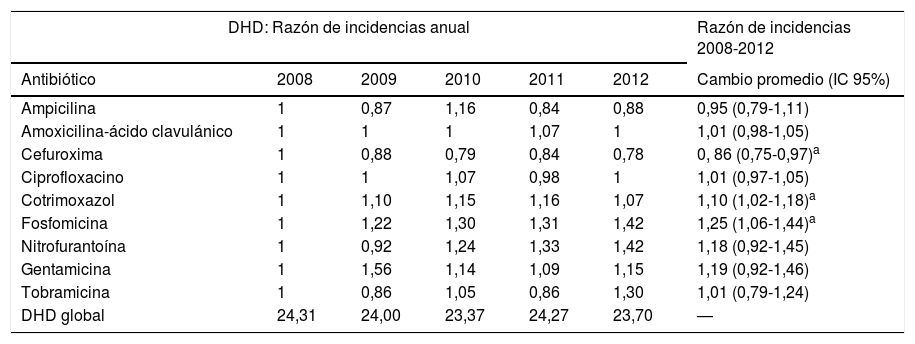
ResultadosSe estudiaron un total de 9.326 aislados comunitarios de E. coli. El cambio promedio del porcentaje de resistencias y del consumo de antibióticos se muestran en las tablas 1 y 2, respectivamente. Encontramos un aumento progresivo del consumo de fosfomicina, cotrimoxazol y nitrofurantoína, mientras que el de ciprofloxacino se mantuvo estable a lo largo del periodo estudiado. Se observó una tendencia ascendente de las resistencias a las cefalosporinas estudiadas, con un aumento de la resistencia promedio del 7, 9 y 17% para CFM, CFT y CFX, respectivamente. También aumentaron significativamente las resistencias promedio a aminoglucósidos (AMG): 11% para G y 25% para TO, así como un 11% para NF. Hubo 2 picos de aumento de resistencia a AMC, uno en 2009 (IRR: 1,25; IC 95%: 1,06-1,47; p=0,008) y el otro en 2011 (IRR: 3,55; IC 95%: 1,14-1,58; p<0,001). La resistencia a CIP aumentó a partir de 2010 (IRR: 1,22; IC 95%: 1,06-1,40; p=0,006).
Cambio promedio del porcentaje de resistencias (2008-2012)
| Razón de incidencias | IC 95% | |
|---|---|---|
| Amoxicilina-ácido clavulánico | 1,01 | 0,97-1,06 |
| Ampicilina | 1,01 | 0,98-1,03 |
| Cefoxitina | 1,17a | 1,10-1,25 |
| Cefotaxima | 1,09a | 1,02-1,17 |
| Cefuroxima | 1,07a | 1,02-1,11 |
| Ciprofloxacino | 1,03 | 1,00-1,06 |
| Cotrimoxazol | 1,01 | 0,98-1,04 |
| Fosfomicina | 1,05 | 0,96-1,15 |
| Gentamicina | 1,11a | 1,05-1,17 |
| Nitrofurantoína | 1,11a | 1,04-1,18 |
| Tobramicina | 1,25a | 1,18-1,33 |
Cambio promedio del consumo de antibióticos (2008-2012)
| DHD: Razón de incidencias anual | Razón de incidencias 2008-2012 | |||||
|---|---|---|---|---|---|---|
| Antibiótico | 2008 | 2009 | 2010 | 2011 | 2012 | Cambio promedio (IC 95%) |
| Ampicilina | 1 | 0,87 | 1,16 | 0,84 | 0,88 | 0,95 (0,79-1,11) |
| Amoxicilina-ácido clavulánico | 1 | 1 | 1 | 1,07 | 1 | 1,01 (0,98-1,05) |
| Cefuroxima | 1 | 0,88 | 0,79 | 0,84 | 0,78 | 0, 86 (0,75-0,97)a |
| Ciprofloxacino | 1 | 1 | 1,07 | 0,98 | 1 | 1,01 (0,97-1,05) |
| Cotrimoxazol | 1 | 1,10 | 1,15 | 1,16 | 1,07 | 1,10 (1,02-1,18)a |
| Fosfomicina | 1 | 1,22 | 1,30 | 1,31 | 1,42 | 1,25 (1,06-1,44)a |
| Nitrofurantoína | 1 | 0,92 | 1,24 | 1,33 | 1,42 | 1,18 (0,92-1,45) |
| Gentamicina | 1 | 1,56 | 1,14 | 1,09 | 1,15 | 1,19 (0,92-1,46) |
| Tobramicina | 1 | 0,86 | 1,05 | 0,86 | 1,30 | 1,01 (0,79-1,24) |
| DHD global | 24,31 | 24,00 | 23,37 | 24,27 | 23,70 | — |
DHD global: DHD total del grupo terapéutico J01 (antibacterianos de uso sistémico) en los centros de salud de nuestra área por cada año de estudio.
En cuanto a la estacionalidad, las resistencias a AMC y CIP aumentaron significativamente en otoño-invierno; CIP en diciembre (IRR: 1,27; IC 95%: 1,03-1,57; p=0,025) y AMC en septiembre (IRR: 1,30; IC 95%: 1,01-1,68; p=0,039), octubre (IRR: 1,41; IC 95%: 1,10-1,81; p=0,007) y diciembre (IRR: 2,19; IC 95%: 1,03-1,70; p=0,029).
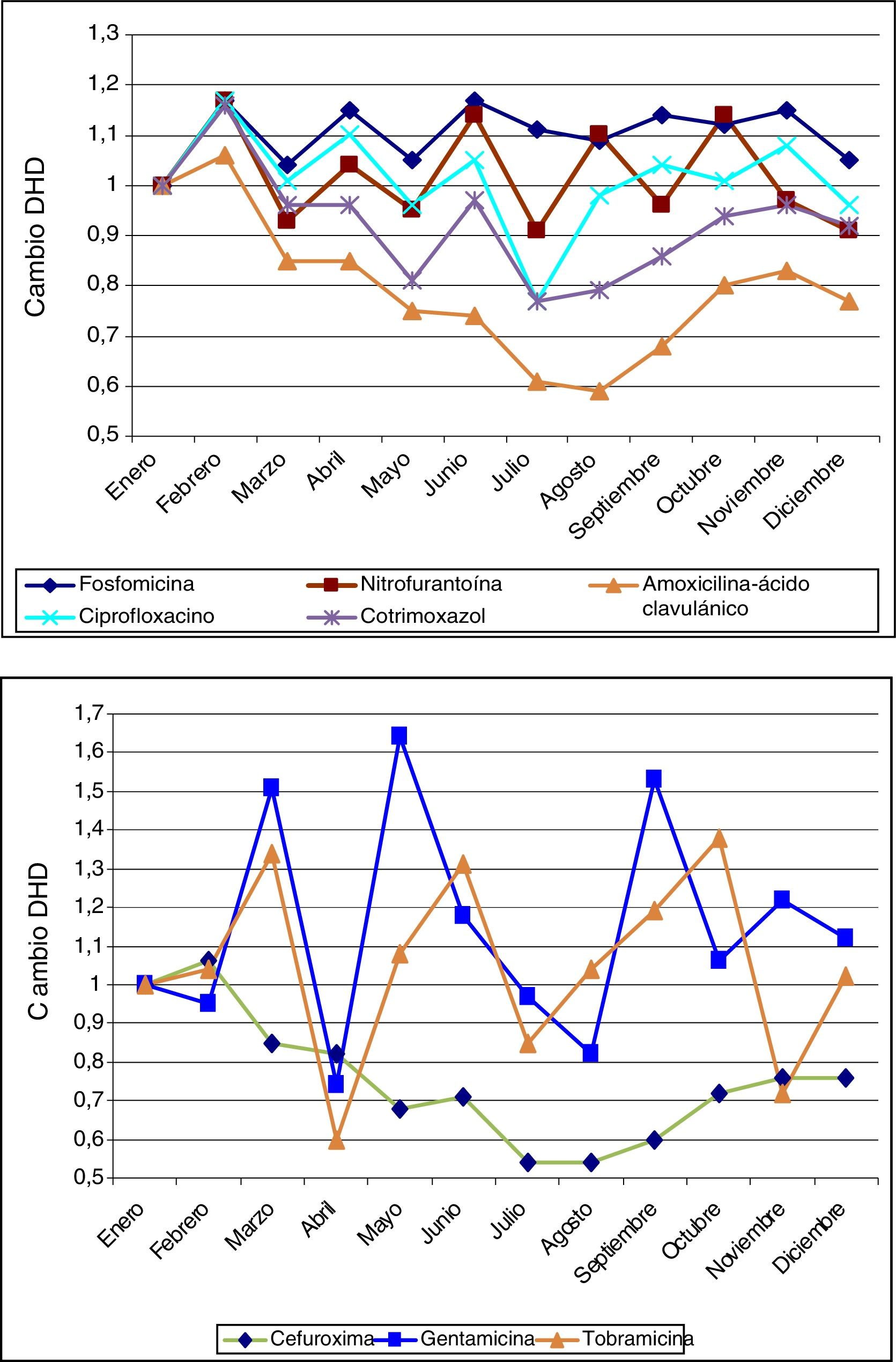
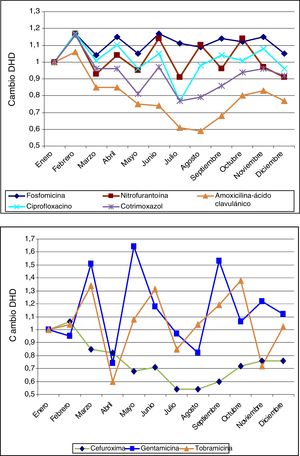
La figura 1 muestra los modelos ARIMA para AMC, CIP, SXT y F. Se observa una relación positiva entre la prescripción de estos antimicrobianos y la aparición de resistencias en E. coli comunitarios, con un retardo que osciló entre 2 y 12 meses, y que fue significativa para AMC, SXT y F. La figura 2 muestra la estacionalidad del consumo promedio.
Estacionalidad del consumo promedio mensual de los antibióticos estudiados (2008-2012). Los antibióticos de la gráfica de arriba son los más utilizados en primaria: fosfomicina, nitrofurantoína, amoxicilina-ácido clavulánico, ciprofloxacino y cotrimoxazol, y muestran una estacionalidad más homogénea que los de la gráfica de abajo: cefuroxima, gentamicina y tobramicina.
Nuestro estudio muestra, una vez más, la sólida relación entre el uso de los antimicrobianos y la aparición de resistencias para un microorganismo tan prevalente como E. coli. El análisis de series temporales permite predecir el comportamiento futuro de la serie estudiada basándose en su comportamiento histórico. Con esta base pretendemos predecir la aparición de resistencias en aislados comunitarios de E. coli en función de las series de resistencia y consumo de CIP, AMC, SXT y F obtenidas en los 5 años previos, así como estimar el retardo en su presentación.
La tendencia ascendente de las resistencias de E. coli a cefalosporinas, NF y AMG encontrada en nuestro estudio coincide con los datos del informe del European Antimicrobial Resistance Surveillance System9, y podría relacionarse con la difusión de las betalactamasas de espectro extendido en la comunidad, creciente desde los años 198010, y que frecuentemente presentan corresistencia a otros antibióticos como fluoroquinolonas y AMG. Otra posible causa sería la adquisición de cefalosporinas en E. coli procedentes del medio animal11. Los picos de aumento de resistencia a AMC podrían relacionarse con un mayor consumo estacional de este, y otros antibióticos, a raíz de la epidemia de gripe A iniciada en España en abril de 2009, conduciendo a una mayor morbilidad y sobreinfecciones.
Son varios los estudios que aplican los modelos ARIMA para determinar la relación entre el consumo de antibióticos y la aparición de resistencias6,7,12,13. Así, Hsueh et al. observan que el aumento en la resistencia de E. coli a CFT y CIP se relacionó significativamente con el incremento en el consumo de beta-lactámicos, carbapenemas, FQ y AMG12. Un estudio francés muestra una asociación significativa entre el consumo de fluoroquinolonas y el incremento en la resistencia para ofloxacino y CIP en cepas de E. coli de origen urinario de pacientes hospitalizados, con retardos menores de 6 meses7. Según nuestro trabajo, por cada aumento de 1 unidad de consumo de SXT, F, y AMC se espera un aumento en la resistencia con retardos de 7, 10 y 12 meses, respectivamente. Consideramos que la difusión de estos datos podría orientar al médico en la prescripción empírica de antibióticos.
Nuestro consumo medio de antibióticos extrahospitalarios en DHD (23,93) es superior a la media española (20,30) e incluso a la europea (21,16) en el mismo periodo14. Dado que el control del uso de antimicrobianos en el ámbito comunitario es mucho menor que en especializada, la aplicación de estos modelos de predicción en nuestra área nos ofrecería la posibilidad de intervenir activamente para reducir las consecuencias de esta deficiente racionalización de la prescripción antibiótica, orientando la diana de los Programas de Optimización de antibióticos en AP, cuya implantación es prioritaria en la mayoría de comunidades españolas15. Por ello, sería conveniente realizar estudios multicéntricos que permitieran evaluar la validez de la asociación y los retardos encontrados, así como ampliar el estudio a otras combinaciones de microorganismos y antimicrobianos.
Este estudio presenta las limitaciones propias de los estudios retrospectivos, con mayor riesgo de presentar sesgos de información y selección. Otra limitación es la falta de aplicación de las DHD a la población infantil.
En conclusión, observamos una relación positiva entre consumo de los antimicrobianos analizados y la aparición de resistencias en E. coli comunitarios, siendo significativa para AMC, SXT y F. El retardo de la aparición de estas resistencias osciló entre 7 y 12 meses. De esta manera, los modelos ARIMA nos permitirían establecer previsiones para racionalizar el uso de antibióticos en el ámbito comunitario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Dr. José María Tenías Burillo por su apoyo incondicional.