Las infecciones de la piel y los tejidos blandos causadas por micobacterias no tuberculosas (MNT) se han asociado a procedimientos como inyecciones, liposucción, cirugía plástica y acupuntura. Estudiamos un brote de infección en tejidos blandos, debido a MNT posterior a mesoterapia, un procedimiento cosmético que consiste en inyectar una mezcla de sustancias para reducir hipotéticamente el tejido adiposo localizado.
MétodosSe entrevistó a pacientes con lesiones en la piel, con antecedentes de mesoterapia, que acudieron al Departamento de Dermatología del Hospital Público de la Ciudad de Barinas, Venezuela, en el período comprendido entre noviembre de 2004 y febrero de 2005. Se tomaron muestras clínicas y ambientales para el aislamiento de micobacterias.
ResultadosLas entrevistas revelaron que 68 pacientes se infectaron con MNT. Todos recibieron tratamiento en el mismo centro estético, a cargo del mismo terapeuta y con el mismo producto. De las muestras de 5 pacientes se aisló Mycobacterium abscessus. Ninguna de las soluciones utilizadas en la mesoterapia estuvo disponible para el análisis, pero se aisló M. abscessus de una muestra del ambiente tomada en el centro cosmético. La tipificación de las cepas con técnicas basadas en PCR (ERIC-PCR, BOXA1R y RAPD) mostró que los aislados de los pacientes fueron indistinguibles entre sí, pero diferentes del aislado del medio ambiente del centro.
ConclusiónLo más probable es que este brote se haya causado por un producto contaminado utilizado en la mesoterapia y no por una micobacteria del ambiente del centro. Hacemos énfasis en la importancia de un mejor control microbiológico de estos productos. Este brote, que afectó al menos a 68 pacientes, es en nuestro conocimiento el más grande descrito en la literatura médica posterior a mesoterapia.
Skin and soft tissue infections caused by nontuberculous mycobacteria (NMT) are reported to be associated with injections, liposuction, plastic surgery, and acupuncture. Herein, we describe an outbreak of soft tissue infection due to NMT following mesotherapy, a cosmetic procedure involving injection of poorly defined mixtures alleged to reduce local adiposity.
MethodsPatients with skin lesions and a history of mesotherapy treatment, who visited the dermatology department of the public hospital in Barinas, Venezuela, from November 2004 to February 2005 were interviewed. Clinical and environmental samples were taken for mycobacteria isolation.
ResultsThe interviews revealed that 68 patients who had been treated for cosmetic purposes at the same clinic by the same therapist had received injections with the same product and were infected with NMT. Clinical specimens from 5 patients grew Mycobacterium abscessus. No mesotherapy solution was available for analysis but M. abscessus was isolated from an environmental sample in the clinic. PCR-based strain typing techniques (ERIC-PCR, BOXA1R and RAPD) showed that the patient's isolates were undistinguishable from each other but different from the environmental isolate.
ConclusionsThis outbreak was likely caused by a contaminated injectable mesotherapy product and not by mycobacteria from the clinic environment. We emphasize the importance of better microbiological control of these products. To our knowledge, this outbreak, which affected at least 68 patients, appears to be the largest ever associated with mesotherapy and described in the literature.
Las micobacterias atípicas o no tuberculosas (MNT), pertenecientes el género Mycobacterium se pueden encontrar en el ambiente. Se han identificado más de 100 especies, de las que alrededor de 20 están clasificadas dentro el grupo de riesgo tipo ii, es decir que son patógenos oportunistas1,2. Algunas de ellas, que se caracterizan por ser de crecimiento rápido, como Mycobacterium abscessus, Mycobacterium chelonae y Mycobacterium fortuitum, se han asociado a infecciones en la piel y el tejido blando, posterior a procedimientos estéticos, acupuntura, cirugías y otros procedimientos invasivos 3–7. La resistencia de las micobacterias frente a desinfectantes como amonios cuaternarios, glutaraldehído y al cloro libre es bien conocida. Son varias las publicaciones de brotes posteriores a procedimientos estéticos y cirugías, en los que se muestra como causa de las infecciones la deficiente esterilización del material crítico y semicrítico; se entiende el primero como aquel que tiene contacto con tejidos estériles o con el sistema vascular, y el segundo es el que tiene contacto con membranas, mucosas o piel no intacta8–12. Un ejemplo de esto ocurrió en Venezuela, donde a un grupo de 8 pacientes se les realizó liposucción, y posteriormente presentaron infecciones causadas por M. abscessus y M. fortuitum, debido a que las cánulas se desinfectaron con un desinfectante de bajo nivel12. Asimismo, productos y medicinas se han indicado como fuente de infección en brotes causados por micobacterias5,13,14. En el 2002 se publicó un brote en China, en el que 86 pacientes presentaron lesiones en la piel, posterior a la inyección con penicilina. En el estudio se determinó que las cepas asociadas como foco de infección estaban en las tapas de los viales de los antibióticos y en el suelo donde éstos se almacenaban13. Otra publicación de Colombia describe un brote en el que 350 pacientes presentaban lesiones en la piel, posterior a inyecciones intramusculares con lidocaína, y la fuente de infección se asoció a la reutilización de un inyector común14. En el presente artículo se evaluó un brote de infecciones posterior a la mesoterapia, en el que se involucró a 68 pacientes que presentaron lesiones en la piel y el tejido blando, causado por MNT.
Materiales y métodosSe evaluaron 68 pacientes que acudieron entre noviembre de 2004 y febrero de 2005 a la Unidad de Dermatología del Hospital General Dr. Luis Razetti en Barinas,Venezuela, con lesiones en la piel y el tejido blando, posterior a la mesoterapia. Se entrevistó a estos pacientes, y se obtuvieron datos como: antecedente previo a la infección, lugar y fecha del procedimiento, producto aplicado durante el tratamiento y personal que realizó el procedimiento. Se tomaron muestras de pacientes de lesiones cerradas mediante aspirado en condiciones asépticas y de lesiones abiertas mediante hisopos, que se transportaron en tubos secos estériles. Las secreciones de lesiones cerradas se sembraron directamente sin previa descontaminación. Los hisopos tomados de lesiones abiertas se descontaminaron mediante el método de Petroff. Todas las muestras se sembraron en medio de Löwenstein-Jensen2 a 37°C durante 6 semanas o hasta que se observara crecimiento bacteriano.
Aislamiento de micobacterias no tuberculosas del ambienteSe obtuvieron muestras ambientales del lugar donde se llevó a cabo la mesoterapia para el aislamiento de micobacterias: 5 muestras provenientes de las ventanas del consultorio y de la sala, 3 muestras de tierra del patio, 2 muestras de tierra de las plantas ubicadas en la sala de espera y 2 litros de agua de los grifos del baño del consultorio. Adicionalmente, se estudiaron muestras de productos utilizados durante y después de la mesoterapia: 3 soluciones antisépticas (polivinilpirrolidona yodada), un jabón antiséptico, un producto denominado «lipoescultor» inyectado en pacientes durante otro período y 3 muestras de cremas de extracto de algas.
Las muestras líquidas con más de 100ml (agua de los baños) se decantaron previamente por 12h y los primeros 50ml se concentraron mediante centrifugación (3.000g por 30min). Las soluciones con menos de 100ml se centrifugaron directamente. Las muestras de tierra y cremas se mezclaron en el vórtex con agua estéril, se centrifugaron por 3min a 3.000g, y los sobrenadantes se tomaron para centrifugar nuevamente a 3.000g por 30min. Las muestras tomadas con hisopos se mantuvieron en 2ml de agua estéril a 4°C durante una noche, posteriormente se mezcló, y el agua se centrifugó a 3.000g por 30min. A continuación se descontaminaron los sedimentos con cloruro de hexadecilpiridinio al 0,75% y se neutralizó con un lavado de agua estéril.
Los sedimentos obtenidos se sembraron en medios de cultivos de Löwenstein-Jensen2. Se incubaron durante 6 semanas a 37°C. A aquellos cultivos en los que se evidenciaron colonias se les realizó la tinción de Ziehl Neelsen.
IdentificaciónLas especies se identificaron usando las características de crecimiento junto con la identificación molecular, a través del análisis de restricción enzimática del producto de PCR del gen hsp65 (PRA)15. Los patrones observados se compararon con patrones publicados en PRASITE16.
Estudios de epidemiología molecularSe realizó la extracción de ADN de las cepas mediante ebullición a partir del cultivo en medio líquido, de acuerdo con el protocolo descrito por Mello et al17. Posteriormente se tipificó a través de la amplificación de elementos repetidos ERIC-PCR17, BOXA1R18 y la amplificación aleatorizada de ADN polimórfico (RAPD) usando diferentes iniciadores (IOPA1819, IS98619, INS-219, OPAZ20). Los productos de PCR se separaron en geles de agarosa al 2% y se tiñeron con bromuro de etidio (10μg/ml). Una mezcla de fragmentos de λ ADN/HindIII y de φχ174 RF ADN/HaeIII (PROMEGA) se usó como estándar molecular. Los geles se digitalizaron con Fluor-S Multimager y se analizaron con Quantity One Program y Bionumerics versión 4.5.
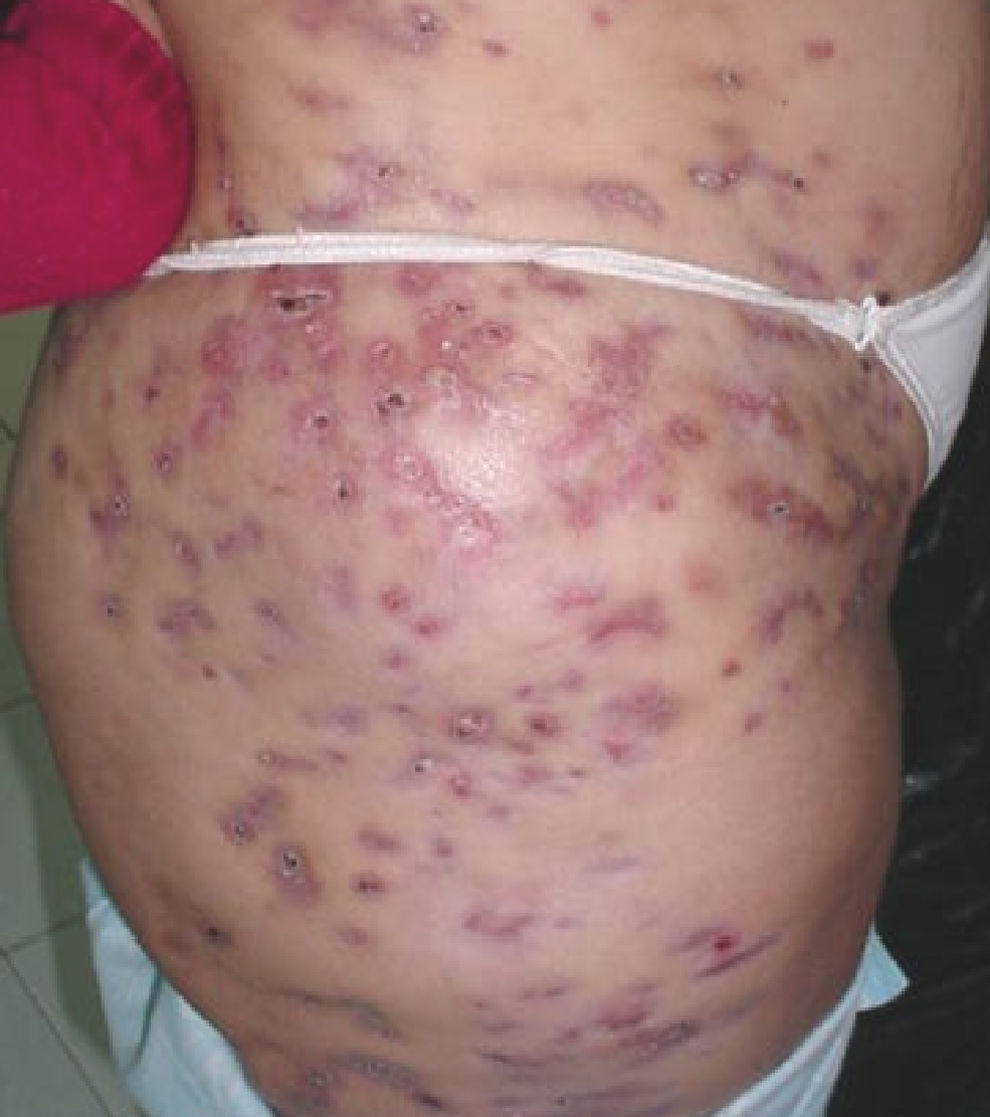
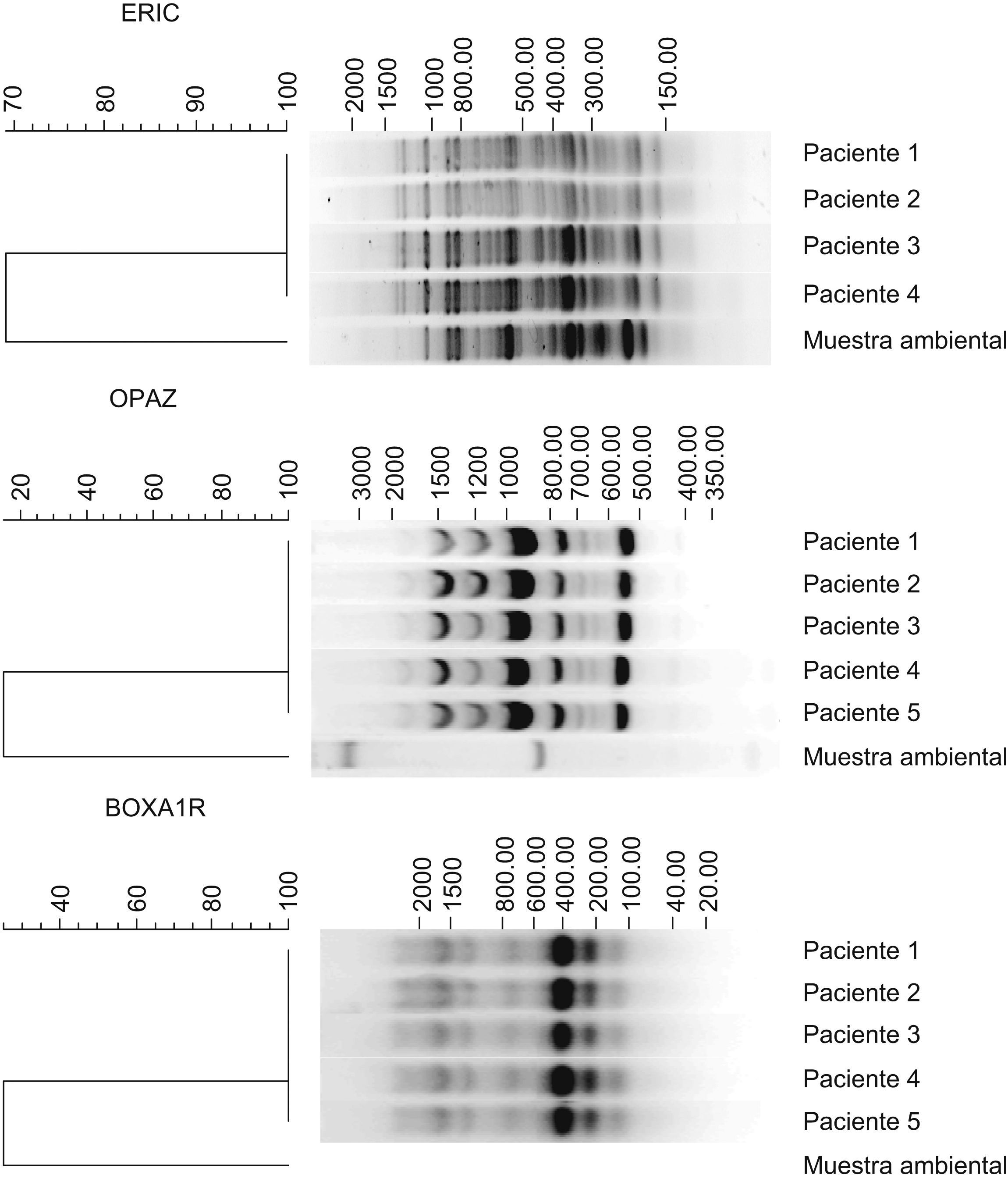
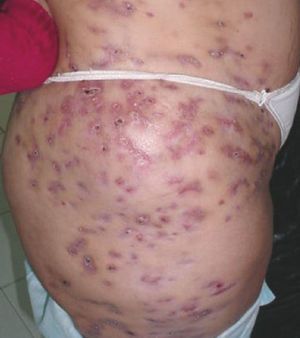
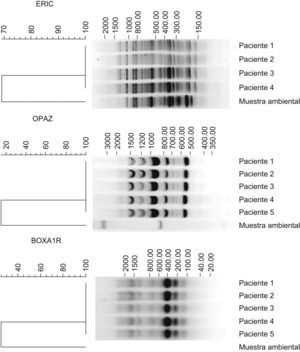
ResultadosLos 68 pacientes que acudieron a la Unidad de Dermatología se clasificaron en 2 grupos: 5 casos confirmados y 63 casos sospechosos. Los casos confirmados se caracterizaron por acudir al mismo centro en la Ciudad de Barinas, porque les realizó mesoterapia con fines estéticos, entre el período de noviembre de 2004 a enero de 2005 el mismo terapista, porque presentaron lesiones con las mismas características (granulomatosas, abscesadas o ulcerativas) en los sitios de inoculación, sin respuesta a tratamiento antibiótico, y porque tuvieron un cultivo positivo para micobacterias. Los casos sospechosos reúnen las mismas características pero sin el aislamiento del agente causal. Todos los pacientes mostraron lesiones en el torso, abdomen y piernas, en forma de úlceras supurativas y abscesos (fig. 1). El producto inyectado a todos estos pacientes en la mesoterapia fue una sustancia denominada «lipoescultor», que refiere contener plantas, algas, minerales y sales, usados comúnmente en la homeopatía. Sin embargo, los viales originales no estaban disponibles para la investigación. El terapista informó que utilizaba inyectadoras individuales en cada paciente y que las soluciones utilizadas en el procedimiento estaban en una presentación de multidosis (100ml), que se usaron en varios pacientes. Previamente, desinfectaba la piel con soluciones iodadas que resultaron cultivo negativo para micobacterias. De 20 muestras tomadas del ambiente del consultorio, sólo una resultó cultivo positivo y se identificó como M. abscessus. Esta muestra provenía de la tierra de una planta ubicada en la sala donde se realizaba la mesoterapia. Las cepas aisladas de los pacientes y la cepa ambiental se compararon mediante las técnicas de tipificación molecular previamente descritas. En los ensayos ERIC y BOXA1R, RAPD-OPAZ y RAPD-OPA2 se observaron entre 8 y 20 bandas con tamaños desde 190 hasta 2.000 pb (fig. 2). En las 3 técnicas se evidenció que las 5 cepas aisladas de los pacientes fueron indistinguibles entre ellas (el 100% de similaridad), pero claramente diferentes de la cepa ambiental (menos del 80% de similaridad). Adicionalmente, los resultados de RAPD ensayado con los iniciadores IOPA18, IS986, INS-2 mostraron los mismos resultados (datos no mostrados).
Tipificación de las cepas de Mycobacterium abscessus aislados de pacientes y el aislado del ambiente. El ADN de las cepas fue sometido a ERIC-PCR, BOXA1R y RAPD. Los dendogramas se realizaron con el programa de Bionumerics V4.5. Las cepas aisladas de los pacientes presentaron igual patrón genético (el 100% de similaridad) y la cepa aislada del centro mostró un patrón genético diferente al resto de los aislados (<80% de similaridad).
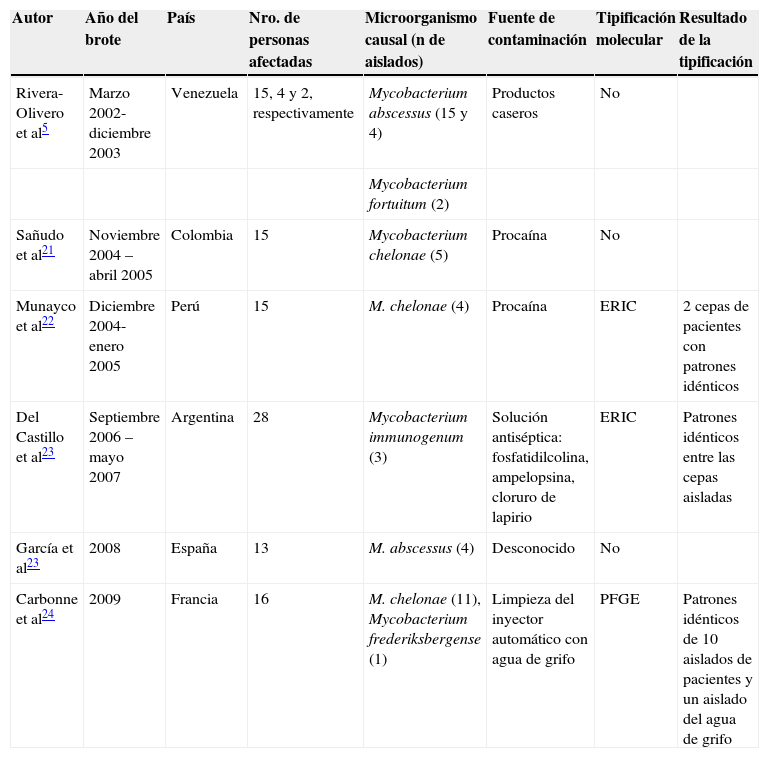
En países de Latinoamérica es común el uso de la mesoterapia con fines estéticos para reducir la masa corporal y la celulitis. En Venezuela5, Colombia21, Perú22 y Argentina23 y también en Europa (España23 y Francia24) se han publicado en los últimos 3 años varios brotes de infecciones causados por MNT, posterior a la aplicación de este procedimiento (tabla 1).
Estudios publicados de brotes de infecciones causados por micobacterias no tuberculosas posterior a mesoterapia
| Autor | Año del brote | País | Nro. de personas afectadas | Microorganismo causal (n de aislados) | Fuente de contaminación | Tipificación molecular | Resultado de la tipificación |
| Rivera-Olivero et al5 | Marzo 2002-diciembre 2003 | Venezuela | 15, 4 y 2, respectivamente | Mycobacterium abscessus (15 y 4) | Productos caseros | No | |
| Mycobacterium fortuitum (2) | |||||||
| Sañudo et al21 | Noviembre 2004 –abril 2005 | Colombia | 15 | Mycobacterium chelonae (5) | Procaína | No | |
| Munayco et al22 | Diciembre 2004-enero 2005 | Perú | 15 | M. chelonae (4) | Procaína | ERIC | 2 cepas de pacientes con patrones idénticos |
| Del Castillo et al23 | Septiembre 2006 – mayo 2007 | Argentina | 28 | Mycobacterium immunogenum (3) | Solución antiséptica: fosfatidilcolina, ampelopsina, cloruro de lapirio | ERIC | Patrones idénticos entre las cepas aisladas |
| García et al23 | 2008 | España | 13 | M. abscessus (4) | Desconocido | No | |
| Carbonne et al24 | 2009 | Francia | 16 | M. chelonae (11), Mycobacterium frederiksbergense (1) | Limpieza del inyector automático con agua de grifo | PFGE | Patrones idénticos de 10 aislados de pacientes y un aislado del agua de grifo |
PFGE: electroforesis de campo pulsado.
En Venezuela, un estudio publicado muestra que en el período de 2002 a 2003, 49 pacientes presentaron infecciones causadas por M. abscessus y M. fortuitum posterior a mesoterapia. De estos pacientes, 21 estaban agrupados en 3 brotes distintos e involucraban a 15, 4 y 2 pacientes. Los brotes se caracterizaban por el uso de productos caseros sin ningún registro sanitario5.
En el año 2007, en Colombia, se publicaron 15 casos de pacientes con infecciones causadas por M. chelonae durante el período de noviembre de 2004 a abril de 2005 posterior a mesoterapia (tabla 1). Los pacientes acudieron a diferentes centros estéticos y en el estudio se presume como fuente de infección la procaína usada durante el tratamiento, ya que ésta era del mismo proveedor21.
En el año 2008 se registraron en Perú 15 pacientes con infecciones en el tejido blando asociadas a la mesoterapia, entre diciembre de 2004 y enero de 2005 (tabla 1). De 4 pacientes se aisló M. chelonae22. Esta especie también se aisló de un vial de procaína usado en el tratamiento. Se sometió a las cepas a técnicas moleculares (ERIC) para confirmar el brote. Solo 2 aislados de pacientes presentaron patrones idénticos, mientras que el resto de los aislados de los pacientes y el de procaína fueron diferentes. La fuente de infección no pudo confirmarse.
Otro país de Latinoamérica, Argentina, publica en el año 2009 un brote que ocurrió entre septiembre de 2006 y mayo de 200723. Veintiocho pacientes desarrollaron lesiones en la piel posterior a la aplicación de mesoterapia en un centro estético. De 10 pacientes se tomaron muestras de biopsias, de las que 3 resultaron cultivo positivo para Mycobacterium immunogenum. Al igual que en el presente estudio, los productos aplicados en los pacientes no estuvieron disponibles para la investigación. Se sometió a las cepas aisladas a ERIC, y se observaron patrones idénticos que confirmaron relación entre ellas, e indicaron una fuente de infección en común.
En España también han surgido infecciones causadas por MNT posterior a mesoterapia. Se publicó una carta24, en la que se hace referencia a un brote que involucró a 13 pacientes que recibieron mesoterapia, llevada a cabo en una misma clínica. De 4 pacientes se obtuvieron cultivos positivos para M. abscessus, y se desconocía la fuente de infección.
En Francia, recientemente se publicó un brote posterior a la aplicación de esta técnica24. En el estudio se aislaron 11 cepas de M. chelonae: 10 cepas provenientes de pacientes y una cepa proveniente del ambiente donde se realizó la mesoterapia. Esta cepa provenía del agua no estéril que se usaba para limpiar el inyector repetitivo automático, después de cada aplicación. Las cepas se evaluaron por electroforesis de campo pulsado, lo que mostró patrones idénticos en las 11 cepas.
En común, estos brotes asociados a la mesoterapia se caracterizan por: a) el uso de productos contaminados o la contaminación de éstos, y b) fallas en la esterilidad o desinfección del material usado durante el procedimiento.
El brote descrito en este estudio involucró a 68 pacientes con infecciones causadas por MNT posterior a mesoterapia, y es, entonces, el más grande publicado en la literatura médica. Se logró aislar 5 cepas, que provienen de muestras tomadas por aspirado de secreciones de lesiones cerradas, mientras que el resto de las muestras (biopsias e hisopados de lesiones abiertas) resultaron cultivo negativo. Estos resultados pueden deberse a que las muestras de biopsias e hisopados requieren descontaminación previa a la siembra; en este paso no solo se elimina flora asociada, sino que también pueden eliminarse micobacterias presentes en esta. Es por eso que la muestra óptima para el aislamiento de micobacterias de infecciones en la piel es el aspirado de lesiones cerradas, que no requieren descontaminación, como también describieron previamente Rivera-Olivero et al5.
Los pacientes tenían datos epidemiológicos en común, tales como acudir al mismo centro estético y la aplicación del mismo producto. Adicionalmente, realizó la mesoterapia un mismo terapista. Con las técnicas de epidemiología molecular se mostró que los aislamientos de los pacientes tenían patrones genéticos 100% similares, lo que confirma que estos casos tenían una fuente de infección en común. Del muestreo ambiental solo se logró aislar una cepa de M. abscessus, que mostró un patrón genético diferente a las cepas de los pacientes. Estos resultados alejan la idea de que la fuente de infección provenga del ambiente. En cuanto al estudio de los cultivos del material que utilizó el terapista, todos resultaron negativos. Por otro lado, la inyección se realizó mediante jeringas desechables. Sin embargo, un dato resaltante es que la solución administrada en los pacientes estaba en presentación de multidosis (100ml), y es bien conocido en la literatura médica que el uso de este tipo de presentaciones podría favorecer la contaminación del producto y el riesgo de infección durante la mesoterapia.
Como se mencionó previamente, varios brotes han ocurrido en Venezuela posterior a esta técnica. Estos brotes han tenido en común la utilización de inyecciones de soluciones adelgazantes que no tienen ningún control de calidad microbiológico o no tienen un permiso sanitario. Por eso la importancia de considerar la evaluación y control de éstos, así como los centros y el personal que aplican estos tratamientos, para la prevención de la aparición de nuevos brotes.
Conflictos de interésLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste estudio fue financiado a través de subvención de investigación SHELL Venezuela, de acuerdo con la Ley Orgánica de Ciencia, Tecnología e Innovación (LOCTI).
Al profesor José Bubis, Universidad Simón Bolívar Departamento de Biología Celular, por su colaboración en la revisión y corrección del artículo. Al personal del Departamento de Microbiologia, Inmunologia e Parasitologia, Universidade de São Paulo, que colaboró con el análisis de los patrones genéticos.