La reactivación de citomegalovirus (CMV) puede complicar la evolución de los pacientes con gastritis inducida por los inhibidores de puntos de control inmunitario.
MétodosSe describe la experiencia en nuestro centro, y se realiza una revisión de la literatura.
ResultadosSe describe un caso de gastritis grave secundaria al tratamiento con un inhibidor del receptor de muerte celular programada-1 (anti-PD1), asociado a la reactivación de CMV. En la revisión sistemática, identificamos 5 casos de gastritis inmunomediada asociados a la reactivación de CMV. El tratamiento con ganciclovir contribuyó a la remisión clínica en la mayoría de los pacientes.
ConclusiónLa identificación precoz de una infección por CMV en los pacientes con gastritis inmunomediada grave o refractaria, permitirá el inicio del tratamiento dirigido, y podrá evitar aumentar la terapia inmunosupresora.
Reactivation of cytomegalovirus can complicate the evolution of patients with gastritis induced by immune checkpoint inhibitors.
MethodsThe experience in our center is described and a review of the literature is performed.
ResultsA case of severe gastritis induced by treatment with a programmed cell death receptor-1 (anti-PD1) inhibitor, associated with reactivation of cytomegalovirus (CMV) is described. In the systematic review, we identified 5 cases of immune-related gastritis associated with CMV reactivation. Ganciclovir treatment contributed to clinical improvement in most patients.
ConclusionThe early identification of a CMV infection in patients with severe or refractory immune-related gastritis will allow the initiation of targeted treatment, and may avoid increasing immunosuppressive therapy.
Los inhibidores de puntos de control inmunitario representan actualmente la vanguardia de los tratamientos oncológicos. Los anticuerpos monoclonales más estudiados están dirigidos contra el antígeno 4 asociado al linfocito T citotóxico (CTLA-4) y frente al receptor de muerte celular programada-1 (PD-1) o su ligando (PD-L1). Estos puntos de control inmunitario regulan la respuesta inmunitaria con la finalidad de evitar la autoinmunidad o el exceso de activación inmunitaria frente a un estímulo. El cáncer se apropia de este mecanismo inactivando a las células T que han reconocido las células tumorales. El bloqueo de estos puntos de control inmunitario reactiva la respuesta inmune antitumoral, y puede derivar asimismo en el desarrollo de células T autorreactivas y, consecuentemente, en fenómenos autorreactivos o eventos adversos relacionados con el sistema inmunitario (irAE, por sus siglas en inglés), con similares manifestaciones clínicas a las enfermedades autoinmunes1.
La colitis es uno de los irAE más comunes, sin embargo, la afectación del tracto gastrointestinal superior se ha reportado con menor frecuencia2. Las formas graves de gastritis inmunomediada se manifiestan con intolerancia digestiva y se asocian a un alto riesgo de perforación gástrica. Los corticoides representan el tratamiento inicial de la gastritis inmunomediada, reservándose el uso de infliximab o micofenolato para los casos graves o refractarios1.
La reactivación de citomegalovirus (CMV) ha sido ampliamente descrita en pacientes con enfermedad inflamatoria intestinal (EII) en asociación con el uso de corticoides, recomendándose su despistaje y tratamiento en los brotes graves de la enfermedad3. Su patogenicidad ha sido considerada en algunas series de colitis inmunomediada refractaria4, sin embargo, no ha sido establecida en pacientes con gastritis inmunomediada.
MétodosSe describe la experiencia en nuestro centro, y se realiza una revisión sistemática de la literatura. Se realizó una búsqueda bibliográfica en PubMed y Embase hasta febrero de 2022, incluyendo todas las publicaciones sobre la reactivación de CMV en pacientes con gastritis inmunomediada. Se utilizaron los siguientes términos de búsqueda: «immune checkpoint inhibitor», «immunotherapy», «pembrolizumab», «nivolumab», «atezolizumab», «ipilimumab», «gastritis», «citomegalovirus». Se revisaron los artículos con texto completo, y se identificaron estudios adicionales mediante la evaluación de las listas de referencias de los manuscritos evaluados.
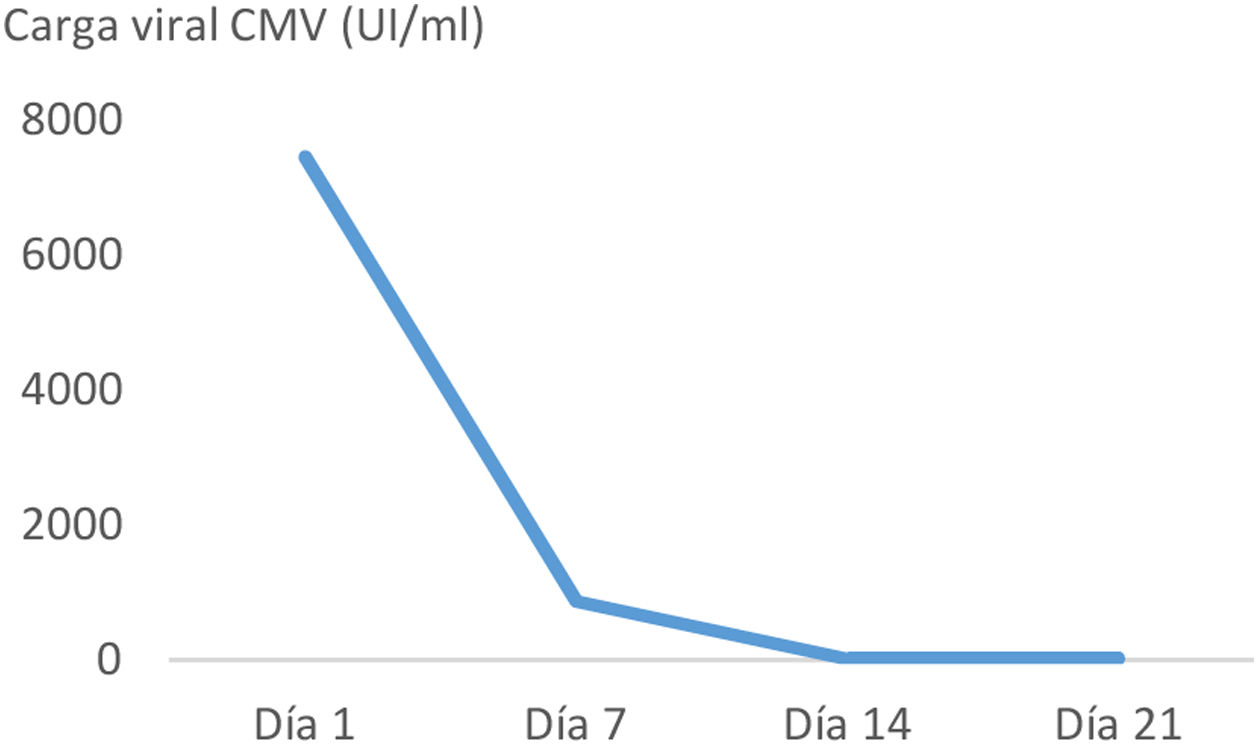
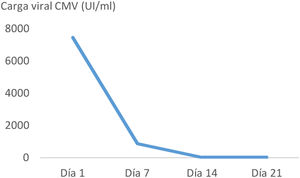
ResultadosPresentamos el caso de una mujer de 45 años con melanoma metastásico en primera línea de tratamiento sistémico con pembrolizumab. Tras la administración del tercer ciclo de inmunoterapia inició un cuadro de náuseas y vómitos. En las siguientes 2 semanas tras el inicio de los síntomas, la tomografía computarizada abdominal, realizada con contraste intravenoso y oral, mostró un engrosamiento mural gástrico, acompañado de edema submucoso y realce mucoso. Con la sospecha de gastritis de origen inmunomediado se instauró tratamiento con metilprednisolona a dosis altas. La endoscopia realizada un día después del inicio de la corticoterapia, mostró gastroduodenitis erosiva grave. La anatomía patológica reveló infiltración linfoplasmocitaria intraepitelial y de lámina propia, con criptitis apoptótica y visualización de cuerpos de inclusión de CMV mediante inmunohistoquímica en cuerpo y antro gástricos y bulbo duodenal. La carga viral de CMV mediante PCR cuantitativa en tiempo real (RealStar® CMV PCR Kit) en plasma fue de 7.500 UI/ml. Presentaba serología compatible con infección pasada por CMV antes del inicio de la inmunoterapia, y también al diagnóstico del irAE (IgG positivo, IgM negativo). La paciente precisó soporte nutricional parenteral ante la ausencia de mejoría clínica en la primera semana de tratamiento con corticoides. El inicio de ganciclovir condujo a una rápida mejoría sintomática. El tratamiento con antiviral se mantuvo durante 21 días, inicialmente ganciclovir durante 7 días, y tras mejoría clínica y con adecuada tolerancia oral se completó la pauta con valganciclovir oral. En los controles sucesivos de carga viral durante el tratamiento antiviral se constató negatividad de la viremia (fig. 1). El tratamiento con corticoterapia, ganciclovir y el inhibidor de la bomba de protones, así como la interrupción del pembrolizumab, permitieron alcanzar una completa remisión clínica. No se realizó endoscopia de control considerando la excelente evolución.
De la revisión de la literatura realizada, tan solo identificamos 5 casos con gastritis inmunomediada asociados a la reactivación de CMV5–9. Se excluyó un caso de miocarditis inmunomediada que presentó esofagitis y gastroduodenitis con reactivación de CMV en contexto del paciente crítico, y tras más de un mes de tratamiento con corticoide y micofenolato, haciendo poco probable una naturaleza inmunomediada inicial10 (tabla 1).
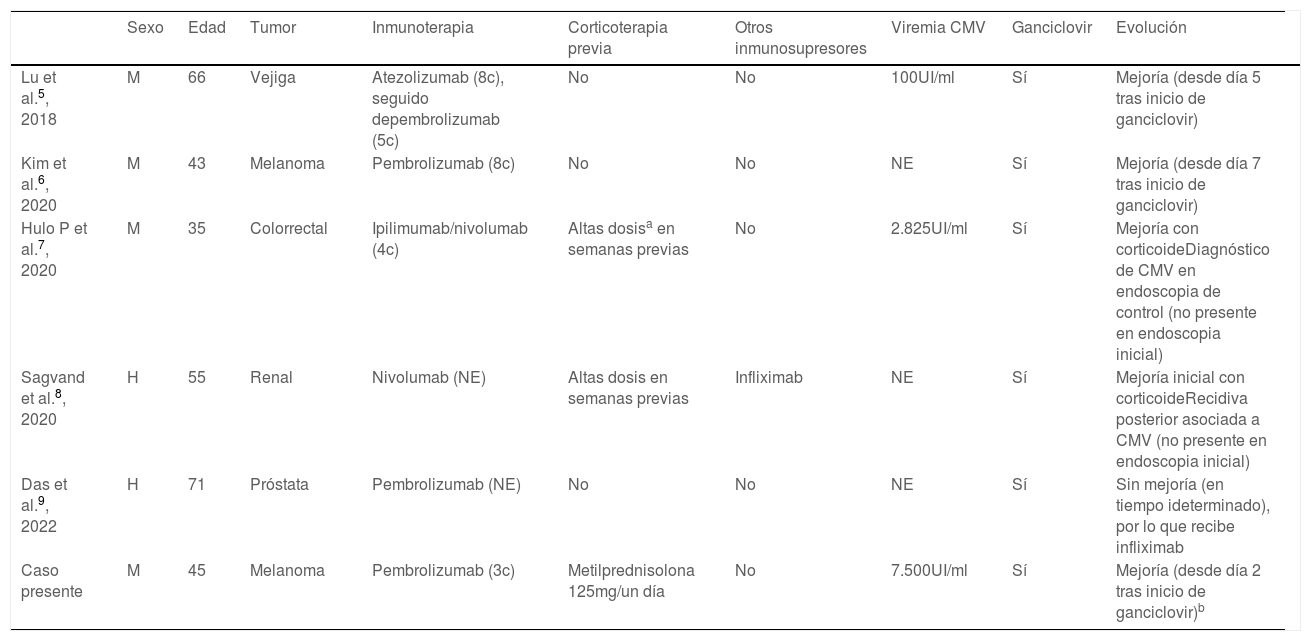
Resultados de la revisión sistemática de pacientes con gastritis inmunomediada con reactivación de citomegalovirus
| Sexo | Edad | Tumor | Inmunoterapia | Corticoterapia previa | Otros inmunosupresores | Viremia CMV | Ganciclovir | Evolución | |
|---|---|---|---|---|---|---|---|---|---|
| Lu et al.5, 2018 | M | 66 | Vejiga | Atezolizumab (8c), seguido depembrolizumab (5c) | No | No | 100UI/ml | Sí | Mejoría (desde día 5 tras inicio de ganciclovir) |
| Kim et al.6, 2020 | M | 43 | Melanoma | Pembrolizumab (8c) | No | No | NE | Sí | Mejoría (desde día 7 tras inicio de ganciclovir) |
| Hulo P et al.7, 2020 | M | 35 | Colorrectal | Ipilimumab/nivolumab (4c) | Altas dosisa en semanas previas | No | 2.825UI/ml | Sí | Mejoría con corticoideDiagnóstico de CMV en endoscopia de control (no presente en endoscopia inicial) |
| Sagvand et al.8, 2020 | H | 55 | Renal | Nivolumab (NE) | Altas dosis en semanas previas | Infliximab | NE | Sí | Mejoría inicial con corticoideRecidiva posterior asociada a CMV (no presente en endoscopia inicial) |
| Das et al.9, 2022 | H | 71 | Próstata | Pembrolizumab (NE) | No | No | NE | Sí | Sin mejoría (en tiempo ideterminado), por lo que recibe infliximab |
| Caso presente | M | 45 | Melanoma | Pembrolizumab (3c) | Metilprednisolona 125mg/un día | No | 7.500UI/ml | Sí | Mejoría (desde día 2 tras inicio de ganciclovir)b |
c: ciclo; CMV: citomegalovirus; H: hombre; M: mujer; NA: no aplica; NE: no especificado.
a Dosis 1-2mg/kg de prednisona o equivalente, con posterior descenso durante 3-4 semanas.
b La inducción del tratamiento con corticoide se realizó con bolos de metilprednisolona 125mg, en 3 días consecutivos, y posteriormente prednisona 1mg/kg hasta completar una semana; en adelante, el descenso de dosis fue progresivo en las siguientes semanas hasta su suspensión.
Los irAE gastrointestinales se manifiestan fundamentalmente como colitis, siendo menos frecuente la afectación del tracto superior. Sin embargo, algunos estudios han reportado una mayor incidencia de compromiso gastrointestinal alto respecto a la descrita en los principales ensayos clínicos, objetivando frecuentes presentaciones asintomáticas o paucisintomáticas11,12. Si bien la respuesta a corticoides es satisfactoria en la mayoría de los pacientes, algunas formas graves o refractarias requieren una mayor terapia inmunosupresora asociada. En los casos refractarios es fundamental el despistaje de una posible reactivación de CMV, para lo cual resultará clave la evaluación histológica de la biopsia gástrica.
El tratamiento con corticoides a altas dosis representa la piedra angular de tratamiento de los irAE. Tras alcanzar mejoría clínica, se recomienda un lento descenso de dosis durante al menos 4 semanas para evitar un rebrote. La corticoterapia es probablemente la principal responsable de la inmunodepresión celular que caracteriza a los pacientes con complicaciones inmunomediadas y reactivación viral. Sin embargo, es posible la reactivación viral antes del inicio de la corticoterapia, como demuestra nuestro caso y la experiencia descrita por Lu et al.5, Kim et al.6 y Das et al.9.
El CMV puede permanecer latente en varios tejidos, especialmente en el colon. La respuesta inmune celular del huésped resulta clave para controlar la reactivación de estos virus. La inflamación de la mucosa, la disregulación del sistema inmune inducida por la inmunoterapia, y la inmunodepresión relacionada con los corticoides, han sido propuestos como los principales mecanismos de la reactivación del CMV latente en la mucosa colónica4, considerándose una fisiopatogenia similar en la reactivación del CMV en la mucosa gástrica. La quimioterapia previa o en curso, contribuirá también a la inmunosupresión del huésped.
La relevancia de la reactivación viral en la evolución clínica de la gastritis inmunomediada es incierto. La mejoría clínica de nuestra paciente, y la experiencia de Lu et al.5 y Kim et al.6, así como los resultados de los pacientes con EII con colitis por CMV, apoyan el tratamiento con ganciclovir.
El creciente número de pacientes tratados con inhibidores de puntos de control inmunitario justificará un aumento de la toxicidad gastrointestinal relacionada con estos. El uso de corticoides deberá evaluarse de forma individualizada considerando el riesgo de infecciones oportunistas. El clínico deberá sospechar la reactivación de CMV en los pacientes con formas graves o refractarias. De esta manera, los pacientes podrán beneficiarse de un manejo optimizado de forma precoz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos el trabajo del Servicio de Medicina del Aparato Digestivo y de Anatomía Patológica del Hospital 12 de Octubre por su colaboración en los casos descritos.