El objetivo de este trabajo fue conocer, mediante una encuesta nacional, los métodos y técnicas empleados para el diagnóstico de Helicobacter pylori (Hp) en los distintos servicios/laboratorios de microbiología clínica en España, así como datos de resistencia antibiótica.
MétodosEn la encuesta se preguntaba sobre los métodos de diagnóstico realizados (serología, detección de antígeno en heces, cultivo de biopsias gástricas y PCR) y por la realización de pruebas de sensibilidad antibiótica. También fueron solicitados el número de muestras procesadas en 2016, la positividad de cada técnica empleada y porcentajes de resistencia antibiótica. La encuesta fue enviada por correo electrónico entre octubre y diciembre de 2017 a los responsables de 198 laboratorios de microbiología clínica.
ResultadosEn total, 51 centros de 29 provincias respondieron a la encuesta y 48 de ellos realizaban algún tipo de técnica de diagnóstico de Hp en su laboratorio. En cuanto a las técnicas empleadas, el cultivo de biopsia gástrica fue el más utilizado (37/48), seguido de la detección de antígeno en heces (35/48), la serología (19/48) y la PCR (5/48). Respecto a la sensibilidad antibiótica, se observaron altas tasas de resistencia, especialmente a metronidazol y claritromicina (superiores al 33%).
ConclusiónEl cultivo de biopsia gástrica fue la técnica diagnóstica de Hp utilizada por más centros, mientras que la detección de antígeno en heces mediante inmunocromatografía fue con la que se analizaron el mayor número de muestras. En España, en la actualidad, es preocupante el aumento de resistencia de Hp a antibióticos de «primera línea».
The aim of this study was to know, through a national survey, the methods and techniques used for the diagnosis of Helicobacter pylori (Hp) in the different Clinical Microbiology Services/Laboratories in Spain, as well as antibiotic resistance data.
MethodsThe survey requested information about the diagnostic methods performed for Hp detection in Clinical Microbiology laboratories, including serology, stool antigen, culture from gastric biopsies, and PCR. In addition, the performance of antibiotic susceptibility was collected. Data on the number of samples processed in 2016, positivity of each technique and resistance data were requested. The survey was sent by email (October-December 2017) to the heads of 198 Clinical Microbiology Laboratories in Spain.
ResultsOverall, 51 centers from 29 regions answered the survey and 48/51 provided Hp microbiological diagnostic testing. Concerning the microbiological methods used to diagnose Hp infection, the culture of gastric biopsies was the most frequent (37/48), followed by stool antigen detection (35/48), serology (19/48) and biopsy PCR (5/48). Regarding antibiotic resistance, high resistance rates were observed, especially in metronidazole and clarithromycin (over 33%).
ConclusionCulture of gastric biopsies was the most frequent method for detection of Hp, but the immunochromatographic stool antigen test was the one with which the largest number of samples were analyzed. Nowadays, in Spain, it concerns the problem of increased antibiotic resistance to ‘first-line’ antibiotics.
Helicobacter pylori (Hp) es una bacteria patógena gramnegativa de forma espiral que coloniza la mucosa del estómago humano gracias a su movilidad y a su capacidad para resistir su elevada acidez. Los países o áreas geográficas con un bajo desarrollo socioeconómico presentan las cifras de prevalencia más altas (el 60-80% de la población en edad adulta está infectado por Hp); en cambio, en las zonas con un alto desarrollo socioeconómico, la tasa de infección en población adulta se sitúa en torno al 30-50%1. La mayor prevalencia se sitúa en África (79,1%), Sudamérica y Caribe (63,4%), y la menor en Norteamérica (37,1%) y Oceanía (24,4%)2. Respecto a la situación en Europa, los países del sur y del este, como Portugal o Polonia, tienen la mayor tasa de prevalencia, mientras que los países del norte tienen la más baja3,4. En España varios estudios han situado la prevalencia de Hp por encima del 50%2,4. En la mayoría de los casos la infección por Hp cursa asintomática y solo un pequeño porcentaje de personas presenta manifestaciones clínicas como: gastritis, úlcera péptica (entre un 10-15% de los individuos afectados), linfoma asociado a mucosa (MALT) y adenocarcinoma gástrico (1-3%)5,6.
El diagnóstico de la infección por Hp puede realizarse por métodos invasivos (requieren endoscopia) o no invasivos, existiendo una variedad de técnicas que a su vez pueden ser realizadas por diferentes especialistas como microbiólogos, bioquímicos, patólogos y gastroenterólogos. Hasta la fecha se desconocían las técnicas de diagnóstico de Hp utilizadas en los laboratorios de microbiología clínica españoles. En cuanto al tratamiento antibiótico frente a Hp, el aumento en las tasas de resistencia a antibióticos considerados de «primera línea» como claritromicina y metronidazol7 es una preocupación de muchos países, incluido el nuestro. Es muy importante conocer el porcentaje de resistencia antibiótica actual en nuestro país para un mejor manejo de las pautas de tratamiento.
El objetivo de este trabajo fue obtener, mediante una encuesta nacional, datos acerca de los métodos empleados para el diagnóstico de Hp en los distintos servicios/laboratorios de microbiología clínica en España y para el estudio de sensibilidad así como los datos de resistencia antibiótica.
MétodosLa encuesta fue elaborada contando con la opinión de un panel de 11 microbiólogos expertos en el campo de Hp y, posteriormente, evaluada por ellos para comprobar que su funcionamiento era correcto y que se adecuaba a los objetivos planteados. La encuesta fue diseñada utilizando la plataforma Google Forms y contenía 37 apartados con preguntas tanto de respuesta múltiple como de texto corto. En la encuesta se solicitaba información acerca de los métodos diagnósticos empleados para la detección de Hp en los laboratorios de microbiología clínica de España, incluyendo serología, detección de antígeno (Ag) en heces, cultivo de biopsia gástrica y PCR. A su vez, se preguntaba acerca de la realización de pruebas de sensibilidad antibiótica. Se preguntaron datos como el número de muestras procesadas en 2016, positividad de cada técnica empleada y porcentajes de resistencia antibiótica. En la encuesta también se preguntaba por la realización del test del aliento y del test rápido de la ureasa en biopsia gástrica.
El enlace de la encuesta fue enviado por correo electrónico entre octubre y diciembre de 2017 a través del Grupo de Estudio para la Gestión en Microbiología Clínica (GEGMIC) de la Sociedad Española de Infecciosas y Microbiología Clínica (SEIMC) a los responsables de 198 laboratorios clínicos de microbiología de España.
Las respuestas de la encuesta eran guardadas directamente desde Google Forms en la plataforma Google Spreadsheet y fueron exportadas a Microsoft Excel 2013 para su posterior análisis. Para el análisis estadístico se utilizó el programa OpenEpi software versión 3.01.
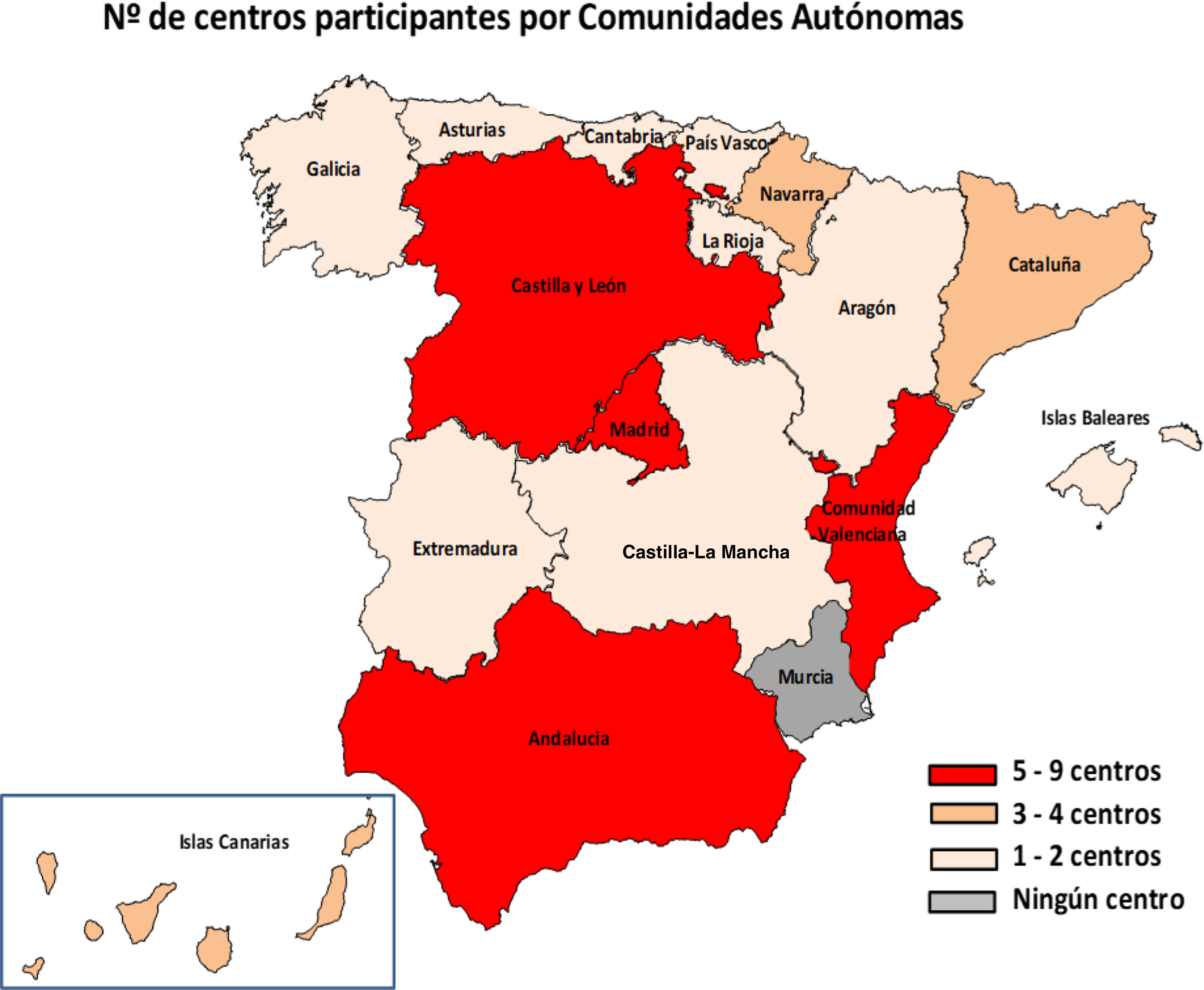
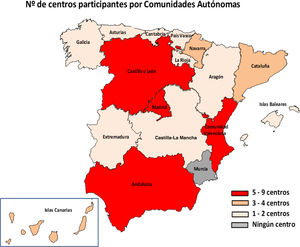
ResultadosEn total, 51 centros (25,7%) de 29 provincias respondieron a la encuesta (fig. 1). En cuanto a los centros, 46 eran públicos, 4 públicos de gestión privada y uno privado; 48 centros atendían tanto población adulta como pediátrica, 2 solo adultos y uno solo población pediátrica. El 94,1% (48/51) llevaba a cabo métodos de diagnóstico de Hp en el laboratorio de microbiología de su centro y los 3 restantes enviaban las muestras a otros centros.
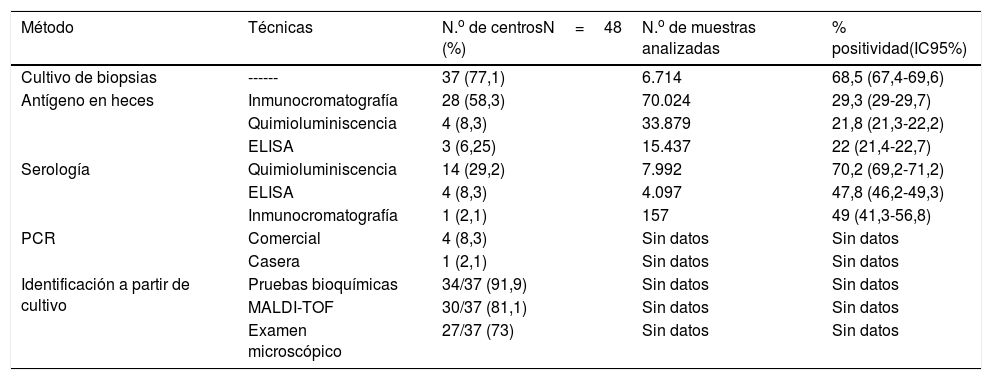
Respecto a los métodos de diagnóstico empleados, el más frecuente fue el cultivo de biopsia gástrica (77%, 37/48), seguido de la detección de Ag en heces (72,9%, 35/48), serología (39,6%, 19/48) y PCR de biopsia gástrica (10,4%, 5/48). Las tablas 1 y 2 muestran las diferentes técnicas utilizadas, el número de centros que realizan cada una de ellas, el número de muestras analizadas y la positividad de cada técnica en 2016.
Métodos y técnicas empleados para el diagnóstico de Hp y su positividad en 2016
| Método | Técnicas | N.o de centrosN=48 (%) | N.o de muestras analizadas | % positividad(IC95%) |
|---|---|---|---|---|
| Cultivo de biopsias | ------ | 37 (77,1) | 6.714 | 68,5 (67,4-69,6) |
| Antígeno en heces | Inmunocromatografía | 28 (58,3) | 70.024 | 29,3 (29-29,7) |
| Quimioluminiscencia | 4 (8,3) | 33.879 | 21,8 (21,3-22,2) | |
| ELISA | 3 (6,25) | 15.437 | 22 (21,4-22,7) | |
| Serología | Quimioluminiscencia | 14 (29,2) | 7.992 | 70,2 (69,2-71,2) |
| ELISA | 4 (8,3) | 4.097 | 47,8 (46,2-49,3) | |
| Inmunocromatografía | 1 (2,1) | 157 | 49 (41,3-56,8) | |
| PCR | Comercial | 4 (8,3) | Sin datos | Sin datos |
| Casera | 1 (2,1) | Sin datos | Sin datos | |
| Identificación a partir de cultivo | Pruebas bioquímicas | 34/37 (91,9) | Sin datos | Sin datos |
| MALDI-TOF | 30/37 (81,1) | Sin datos | Sin datos | |
| Examen microscópico | 27/37 (73) | Sin datos | Sin datos |
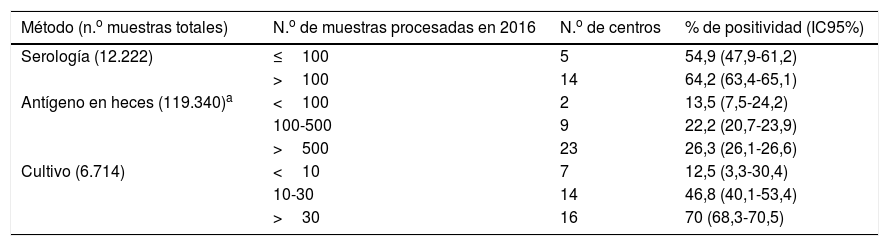
Métodos empleados para el diagnóstico de Hp y su positividad en función del número de muestras analizadas en 2016
| Método (n.o muestras totales) | N.o de muestras procesadas en 2016 | N.o de centros | % de positividad (IC95%) |
|---|---|---|---|
| Serología (12.222) | ≤100 | 5 | 54,9 (47,9-61,2) |
| >100 | 14 | 64,2 (63,4-65,1) | |
| Antígeno en heces (119.340)a | <100 | 2 | 13,5 (7,5-24,2) |
| 100-500 | 9 | 22,2 (20,7-23,9) | |
| >500 | 23 | 26,3 (26,1-26,6) | |
| Cultivo (6.714) | <10 | 7 | 12,5 (3,3-30,4) |
| 10-30 | 14 | 46,8 (40,1-53,4) | |
| >30 | 16 | 70 (68,3-70,5) |
Diecinueve laboratorios realizaban serología de Hp y todos ellos utilizaban, al menos, otro método diagnóstico aparte de la serología. La técnica serológica más empleada fue la quimioluminiscencia (14/19), seguida de ELISA (4/19) y la inmunocromatografía (1/19).
Antígeno en hecesTreinta y cinco laboratorios realizaban detección de Ag en heces, siendo la inmunocromatografía la técnica más utilizada (28/35), seguida de la quimioluminiscencia (4/35) y ELISA (3/35). Para 6 laboratorios la detección de Ag en heces era el único método diagnóstico empleado, aunque 3 de ellos enviaban biopsias gástricas para cultivo a otro centro.
PCR de biopsia gástricaSolo 5 laboratorios llevaban a cabo PCR de Hp y todos ellos contaban, al menos, con otro método diagnóstico; 4 de estos 5 laboratorios utilizaban una PCR comercial y solo uno utilizaba una PCR casera.
Cultivo de biopsias gástricasTreinta y siete de los 48 laboratorios realizaban cultivo de biopsias gástricas, lo que convierte a este método en el más utilizado. De estos 37, 14 (37,8%) indicaron que el cultivo se realizaba solo después de fracaso del tratamiento. En lo que respecta a los medios de cultivo empleados, el 73% (27/37) utilizaban un medio selectivo comercial para Hp. El 70,4% (19/27) acompañaban el medio selectivo con agar sangre y/o agar chocolate. En cuanto a las técnicas de identificación a partir de cultivo, la mayoría (91,9%, 34/37) emplea test bioquímicos (ureasa y catalasa) y espectrometría de masas MALDI-TOF (81,1%, 30/37). Asimismo, el 73% (27/37) realizaba también examen microscópico, siendo la tinción de Gram la más empleada por los laboratorios (70,4%, 19/27). Otras tinciones utilizadas fueron Gram modificado con fucsina (5/27), giemsa (1/27), fucsina (1/27) y naranja de acridina (1/27).
Test del alientoDe los 51 laboratorios que respondieron a la encuesta, el 82,3% (42/51) indicaron que en sus centros se realizaba test del aliento; 4 respondieron que no sabían si se hacía este test.
Test de la ureasa en biopsiaEl 58,82% (30/51) de los laboratorios indicaron que los gastroenterólogos de su centro llevaban a cabo el test de la ureasa en biopsia; 13 contestaron que no sabían si se realizaba.
Sensibilidad a antibióticosDe los 37 laboratorios que realizaban cultivo de biopsias gástricas, 34 llevaban a cabo pruebas de sensibilidad antibiótica; el 32,5% (11/34) indicaron que estas pruebas solo las realizaban en pacientes con fracaso de tratamiento y el 29,4% (10/34) que se hacían tanto en pacientes naive como en los previamente tratados. El resto contestaron que desconocían estos datos de los pacientes. Los antibióticos estudiados y el método empleado se muestran en la tabla 3. Respecto a los puntos de corte utilizados, el 64,7% (22/34) empleaban los criterios de EUCAST, el 8,8% (3/34) los del CLSI y el 23,5% (8/34) ambos (EUCAST+CLSI). La tabla 4 muestra los datos de resistencia antibiótica. Destacan los altos porcentajes de resistencia tanto a metronidazol como a claritromicina, alcanzándose en algunos casos cifras cercanas al 50%. También se observa una importante resistencia a rifampicina (superior al 34%) y levofloxacino (cercana al 20%). Por el contrario, amoxicilina y tetraciclina presentan una baja tasa de resistencia.
Número de laboratorios que prueban cada antibiótico y método utilizado
| Antibiótico probado | N.o de centros (N=34) | N.o de centros que realizan cada estudio | |
|---|---|---|---|
| Tira de gradiente | Difusión con discos | ||
| Metronidazol | 34 | 32 | 2 |
| Claritromicina | 34 | 31 | 3 |
| Amoxicilina | 33 | 30 | 3 |
| Tetraciclina | 32 | 26 | 6 |
| Levofloxacino | 32 | 28 | 4 |
| Rifampicina | 16 | 12 | 4 |
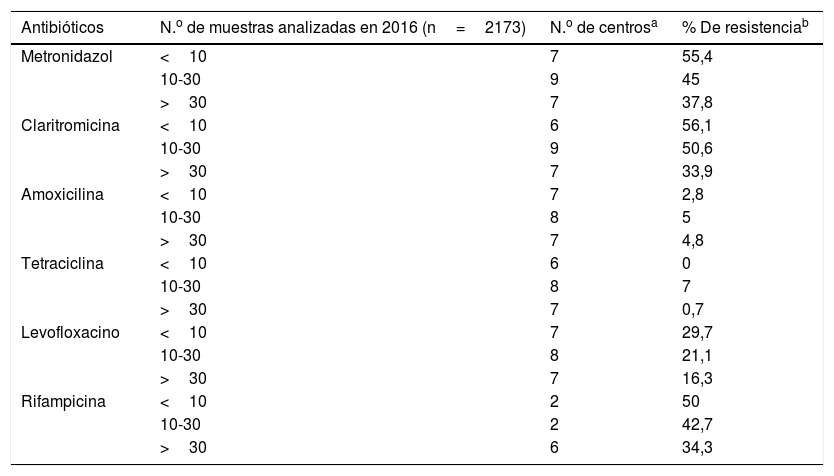
Resistencia antibiótica en función de las muestras analizadas en 2016
| Antibióticos | N.o de muestras analizadas en 2016 (n=2173) | N.o de centrosa | % De resistenciab |
|---|---|---|---|
| Metronidazol | <10 | 7 | 55,4 |
| 10-30 | 9 | 45 | |
| >30 | 7 | 37,8 | |
| Claritromicina | <10 | 6 | 56,1 |
| 10-30 | 9 | 50,6 | |
| >30 | 7 | 33,9 | |
| Amoxicilina | <10 | 7 | 2,8 |
| 10-30 | 8 | 5 | |
| >30 | 7 | 4,8 | |
| Tetraciclina | <10 | 6 | 0 |
| 10-30 | 8 | 7 | |
| >30 | 7 | 0,7 | |
| Levofloxacino | <10 | 7 | 29,7 |
| 10-30 | 8 | 21,1 | |
| >30 | 7 | 16,3 | |
| Rifampicina | <10 | 2 | 50 |
| 10-30 | 2 | 42,7 | |
| >30 | 6 | 34,3 |
La realización de esta encuesta nacional ha permitido conocer los métodos para el diagnóstico de Hp empleados en la actualidad en los servicios/laboratorios de microbiología clínica en España, así como datos de resistencia antibiótica. La inmensa mayoría (94%) de los centros que contestaron a la encuesta realizaban algún método de diagnóstico de Hp. El resto de los que contestaron enviaban las muestras a otro centro para su diagnóstico.
El método de diagnóstico más empleado fue el cultivo de biopsias de mucosa gástrica, seguido muy de cerca por la detección de Ag en heces. Respecto al cultivo, la mayoría utilizan un medio selectivo para Hp. En la actualidad, para la identificación de Hp en cultivo, la espectrometría de masas MALDI-TOF es ya ampliamente utilizada por un gran número de centros. Esto concuerda con el gran uso extendido de esta técnica en los últimos años en el ámbito del diagnóstico bacteriológico.
Aunque el cultivo fue la técnica utilizada por más centros, se procesaron muchas más muestras mediante detección de Ag en heces y serología, debido probablemente a que se utiliza una muestra obtenida por método no invasivo. Respecto al porcentaje de positividad, en los 3 métodos este porcentaje aumentó en función del número de muestras procesadas. En el caso del cultivo fue especialmente llamativo (12,5% si se procesaban menos de 10 muestras/año a 70% si eran más de 30 muestras/año las procesadas, p<0,001) y la explicación más probable es que en el cultivo de Hp la experiencia al procesar muestras sea un factor clave para obtener cultivos positivos.
La detección de Ag en heces fue el método no invasivo más empleado y cada vez va en aumento debido, en gran parte, a la facilidad en la toma de la muestra, y a que a diferencia de la serología sirve no solo para el diagnóstico inicial de la infección sino también para el control de la respuesta al tratamiento. Esto se debe a que la serología no discrimina entre infección activa o pasada ya que los anticuerpos IgG pueden permanecer durante años. Otra ventaja respecto a la serología es que tiene mejor sensibilidad y especificidad en población pediátrica. También presenta ventajas respecto al test del aliento ya que no es necesario que acuda el propio paciente a realizarse la prueba sino que puede entregar la muestra. En Reino Unido, en una encuesta nacional sobre diagnóstico de Hp similar a esta que se realizó en 2016, la detección de Ag en heces era el método más empleado, siendo utilizado por el 94% de los centros8. El cultivo de biopsia gástrica se realizaba en Reino Unido solo en el 23,4% de los centros, un porcentaje mucho menor que el obtenido en nuestra encuesta nacional. Respecto a las técnicas empleadas para la detección de Ag en heces en nuestro estudio se observó que la inmunocromatografía fue la más utilizada (80% de los centros que realizan detección de Ag en heces se decantan por esta técnica). Se trata de la técnica más sencilla, menos laboriosa y más rápida (la duración del test es de unos 15min aproximadamente) y esto facilita mucho su implantación en los laboratorios. Sin embargo, hay que tener en cuenta que, en la última guía del Consenso Maastricht V se recomienda la utilización de pruebas de Ag en heces basadas en ELISA y que utilicen anticuerpos monoclonales y no se recomienda la utilización de inmunocromatografía9. Recientemente se han publicado estudios de detección de Ag en heces mediante inmunocromatografía, tanto en adultos como en niños, que muestran unos valores de sensibilidad y especificidad muy elevados, superiores al 90%10–13.
En lo que respecta a la serología de Hp, la técnica más empleada fue la quimioluminiscencia, la cual es la técnica para el diagnóstico serológico más extendida actualmente. Esta técnica de serología presentó una tasa de positividad más elevada que el ELISA y la inmunocromatografía, que puede ser explicada por la muy alta sensibilidad de la quimioluminiscencia y su bajo límite de detección14. La detección de anticuerpos frente Hp en saliva u orina todavía no está recomendada por las guías pero en 2017 se han publicado 2 estudios con resultados prometedores15,16. En uno de ellos incluso se obtuvieron unos resultados de sensibilidad y especificidad para la detección de IgG superiores en saliva que en suero3. A pesar de estos datos, son necesarios más estudios que confirmen estos resultados.
En cuanto a la PCR de Hp, el bajo número de centros que la hacen puede deberse a su mayor complejidad de realización y a un mayor coste respecto a otros métodos de diagnóstico. Como alternativa a la utilización de biopsias gástricas se han publicado estudios que realizan PCR sobre jugo gástrico, obteniéndose los mismos resultados con ambas muestras17 o a partir de muestras de heces con resultados prometedores18.
La prueba del aliento es realizada en la mayoría de los centros, aunque muchas veces corre a cargo de los servicios de bioquímica.
Prácticamente todos los centros que realizan cultivo de biopsias gástricas llevan a cabo pruebas de sensibilidad antibiótica, si bien es cierto que el número de muestras probadas en algunos de ellos es muy bajo (menos de 10 muestras/año). Las tiras de gradientes antimicrobianos son la opción más utilizada por los laboratorios para la determinación de la sensibilidad antibiótica. Respecto a los datos de resistencia aportados por los centros se observa que claritromicina y metronidazol alcanzan ya un porcentaje de resistencia global cercano al 50%. Estos altos datos de resistencia concuerdan con estudios previos realizados en diversos países19–26. En un estudio europeo multicéntrico de 2009 estos 2 antibióticos presentaban en adultos en los países del Sur de Europa (incluido España) un porcentaje de resistencia del 21,5% y del 29,7% respectivamente, lo que pondría de manifiesto el aumento que se ha producido en los últimos años27. Estas cifras tan elevadas de resistencia han llevado a una disminución de eficacia de la triple terapia «clásica»: inhibidor de la bomba de protones, claritromicina y amoxicilina o metronidazol. Respecto a otros antibióticos, la rifampicina también alcanza un porcentaje de resistencia elevado, cercano al 35%, y levofloxacino se sitúa ya con más de un 20% de resistencia (en el estudio multicéntrico de 2009 se situaba en un 13,1%)27. Por su parte, la resistencia a tetraciclina y amoxicilina continúa siendo muy baja.
Las elevadas tasas de resistencia en Hp son ya un motivo de preocupación a nivel mundial, de hecho en 2017 la Organización Mundial de la Salud incluyó a Hp resistente a claritromicina en una lista de patógenos con alta prioridad para la investigación y desarrollo de nuevos antibióticos28. En todos los antibióticos probados se observa que a mayor número de muestras el porcentaje de resistencia disminuye. Esto puede deberse al hecho de que quizás en los centros que procesan mayor número de muestras estas procedan tanto de pacientes previamente tratados como de pacientes naive, los cuales es de esperar que presenten cepas de Hp con tasas de resistencia menores que los sometidos a tratamientos antibióticos previos.
La mayor limitación de este estudio es que solo el 25,7% de los centros respondieron la encuesta. Es muy probable que la mayoría de los centros que no contestaron no realicen diagnóstico de Hp, de ahí la ausencia de respuesta. Además, algunos centros que sí respondieron no aportaron datos de resistencia o muestras analizadas. Otra limitación es que el cuestionario se envió solo a los responsables de los servicios de microbiología o unidades de microbiología dependientes de servicios de análisis y no a los de gastroenterología o responsables de los servicios de análisis clínicos, lo que nos impide saber con más exactitud cómo se realiza el diagnóstico de Hp en España. No obstante, consideramos que el número de respuestas ha sido adecuado en cuanto a que están representadas casi todas las comunidades autónomas y nos permite comprender los métodos realizados desde los servicios/laboratorios de microbiología. Respecto a los datos de resistencia antibiótica obtenidos, una limitación muy importante del estudio es que no discrimina entre resultados de pacientes naive o previamente tratados, lo que no permite conocer las tasas de resistencia primaria y secundaria. Sería conveniente la realización de estudios diferenciando ambos grupos de pacientes y comparando sus tasas de resistencia.
En vista de los resultados obtenidos en esta primera encuesta nacional, podemos afirmar que la técnica diagnóstica de Hp más ampliamente utilizada en los servicios/laboratorios de microbiología clínica en España fue el cultivo de biopsia gástrica, aunque la detección de Ag en heces mediante inmunocromatografía se empleó en un mayor número de muestras. En lo que respecta a los datos de resistencia antibiótica, es preocupante el aumento de resistencia de Hp a antibióticos de «primera línea», lo que requiere que haya una mayor vigilancia y más estudios sobre este aspecto en un futuro.
Conflicto de interesesLos autores declaran no haber tenido ninguna fuente de financiación para la elaboración de este documento ni tener conflicto de intereses.
Agradecemos al Grupo de Estudio para la Gestión en Microbiología Clínica (GEGMIC) de la Sociedad Española de Infecciosas y Microbiología Clínica (SEIMC) el envío de la encuesta a los distintos laboratorios.
Andalucía: Ana Isabel Suárez Barrenechea - Hospital Universitario Virgen Macarena, Sevilla; María Andrades Ortega - Hospital Universitario Virgen del Rocío, Sevilla; Julio Vargas Romero - Hospital de Valme, Sevilla; Ignacio Correa Gómez – Hospital Universitario Reina Sofía de Córdoba; Ana Correa Ruiz - Agencia Sanitaria Costa del Sol, Málaga; Juan Carlos Alados Arboledas - Hospital Universitario de Jerez; Julio Vargas Romero - Hospital de Valme, Sevilla; Federico García García - Hospital Universitario San Cecilio, Granada; Francisco Franco Álvarez de Luna - Hospital Universitario Juan Ramón Jiménez, Huelva. Aragón: Carmen Aspíroz Sancho - Hospital Royo Villanova, Zaragoza; Mª Pilar Chocarro Escanero - Hospital Obispo Polanco, Teruel; Principado de Asturias: Julio Díaz Gigante - Hospital del Oriente de Asturias. Islas Baleares: Ana Mena Ribas - Hospital Universitario Son Espases, Mallorca; Mª Paz Díaz Antolín - Hospital Son Llatzer, Mallorca. Canarias: Laura Sante Fernández - Hospital Universitario de Canarias, Tenerife; Pino del Carmen Suárez Bordón - Hospital General de Fuerteventura; Ana Bordes Benítez - Hospital Universitario de Gran Canaria Dr. Negrín, Las Palmas. Cantabria: Jorge Calvo Montes - Hospital Universitario Marqués de Valdecilla, Santander. Castilla y León: Miguel Ángel Bratos Pérez - Hospital Clínico Universitario de Valladolid; Mª Antonia García Castro - Complejo Asistencial Universitario de Palencia; Gregoria Megías Lobón - Hospital Universitario de Burgos; Raquel Elisa Rodríguez Tarazona y Noelia Arenal Andrés - Hospital Santos Reyes de Aranda del Duero, Burgos; Isabel Fernández Natal - Complejo Asistencial Universitario de León. Castilla-La Mancha: Mª José Rodríguez Escudero - Hospital Virgen de La Luz, Cuenca; César Gómez Hernando - Complejo Hospitalario de Toledo. Cataluña: Goretti Sauca - Hospital de Mataró, Barcelona; Pepa Pérez Jové - Catlab (Parc Logístic de Salut), Barcelona; Francesc Marco Reverté - Hospital Clinic, Barcelona; Virginia Rodríguez Garrido - Hospital Vall d́Hebron, Barcelona. Comunidad Valenciana: Juan Carlos Rodríguez Díaz y Javier Coy Coy - Hospital General Universitario de Alicante; María Navarro Cots - Hospital Vega Baja, Alicante; Carmen Martínez Peinado - Hospital Marina Baixa de Villajoyosa, Alicante; Aurora Blasco Molla - Hospital General Universitario de Castellón; Javier Buesa Gómez - Hospital Clínico Universitario de Valencia. Extremadura: Pedro María Aguirre Bernat - Hospital Campo Arañuelo, Cáceres. Galicia: José Llovo Taboada - Hospital Clínico Universitario de Santiago de Compostela; Patricia Álvarez García - Complejo Hospitalario Universitario de Pontevedra. Comunidad de Madrid: Ana Miqueleiz Zapatero, Claudio Alba Rubio, Diego Domingo García y Teresa Alarcón Cavero - Hospital Universitario de La Princesa, Madrid; Rafael Cantón Moreno y Elia Gómez García de la Pedrosa - Hospital Universitario Ramón y Cajal, Madrid; Mercedes Alonso Sanz - Hospital Infantil Universitario Niño Jesús, Madrid; Mª Ángeles Orellana Miguel - Hospital Universitario 12 de Octubre, Madrid; Alberto Delgado-Iribarren Gª-Campero - Hospital Universitario Fundación Alcorcón, Madrid; Esteban Aznar Cano - Laboratorio Central de Madrid (BRSalud); Mª Isabel Sánchez Romero - Hospital Universitario Puerta del Hierro, Madrid; Sagrario Reyes Pecharromán - Hospital Universitario Severo Ochoa, Madrid; Mª Teresa Pérez Pomata - Hospital Universitario de Móstoles, Madrid. Comunidad Foral de Navarra: José Leiva León - Clínica Universidad de Navarra; Matilde Elía López - Complejo Hospitalario de Navarra; José Javier García Irure - Hospital Reina Sofía de Tudela, Navarra. País Vasco: Milagrosa Montes Ros - Hospital Universitario Donostia, San Sebastián; Silvia Hernáez Crespo - Hospital Universitario de Álava. La Rioja: Marta Lamata Subero - Fundación Hospital de Calahorra, La Rioja.