Conocer el grado de aplicación de las recomendaciones de cribado de cáncer en personas con VIH (PCVIH) en España.
MétodosSe diseñó un cuestionario autoadministrado sobre las estrategias empleadas para la detección precoz de los principales tipos de cáncer en PCVIH. La encuesta se distribuyó electrónicamente entre los médicos vinculados a la cohorte nacional CoRIS.
ResultadosSe recibieron 106 cuestionarios procedentes de 12 comunidades autónomas, con una tasa global de respuesta entre los que accedieron al cuestionario del 60,2%. La mayoría respondieron que seguían las recomendaciones de las guías de práctica clínica para la detección precoz de los cánceres de hígado (94,3%), cérvix (93,2%) y mama (85,8%). En el cáncer colorrectal y anal la proporción fue del 68,9% y del 63,2%, y en el de próstata y pulmón del 46,2% y del 19,8%, respectivamente. En hospitales con mayor número de camas se observó una tendencia a realizar más cribados y una mayor participación de las unidades de enfermedades infecciosas/VIH en el cribado. Se observaron diferencias significativas en la frecuencia de cribados de cáncer colorrectal y anal entre las comunidades autónomas. Las razones más frecuentes para no realizar cribado fueron la escasez de recursos materiales y/o humanos y la falta de información sobre las recomendaciones en las guías de práctica clínica.
ConclusionesExisten barreras y oportunidades para extender los programas de cribado de cáncer en las PCVIH, especialmente en los cánceres colorrectal, anal y pulmonar. Se necesita asignar recursos para el diagnóstico precoz del cáncer en las PCVIH, pero también difundir las recomendaciones de cribado entre los médicos especialistas.
To assess the degree of implementation of cancer screening recommendations in people living with HIV (PLHIV) in Spain.
MethodsA self-administered questionnaire was designed on the strategies used for early detection of the main types of cancer in PLHIV. The survey was distributed electronically to HIV physicians participating in the Spanish CoRIS cohort.
ResultsOne hundred and six questionnaires were received from 12 different Spanish autonomous communities, with an overall response rate among those who accessed the questionnaire of 60.2%. The majority responded that they followed the clinical practice guidelines recommendations for the early detection of liver (94.3%), cervical (93.2%) and breast (85.8%) cancers. In colorectal and anal cancer, the proportion was 68.9% and 63.2%, and in prostate and lung cancer of 46.2% and 19.8%, respectively. In hospitals with a greater number of beds, a tendency to perform more cancer screening and greater participation of the infectious diseases/HIV services in the screening programs was observed. Significant differences were observed in the frequency of colorectal and anal cancer screening among the different autonomous communities. The most frequent reasons for not performing screening were the scarcity of material and/or human resources and not being aware of what is recommended in the clinical practice guidelines.
ConclusionsThere are barriers and opportunities to expand cancer screening programs in PLHIV, especially in colorectal, anal and lung cancers. It is necessary to allocate resources for the early detection of cancer in PLHIV, but also to disseminate clinical practice guidelines screening recommendations among medical specialists.
La incidencia y mortalidad por cáncer son más altas en las personas con VIH (PCVIH) que en la población general, y el diagnóstico se realiza con frecuencia a edades más tempranas y/o en estadios más avanzados1–5. El exceso de riesgo se atribuye a la inmunosupresión por el VIH, a una mayor prevalencia de coinfecciones virales como las causadas por el virus de la hepatitis C y B o el virus del papiloma humano y a determinados factores relacionados con el estilo de vida como el hábito tabáquico1. Los denominados cánceres no definitorios de sida (CNDS) constituyen ya la principal causa de muerte en las PCVIH y se espera que tengan una importancia creciente a medida que estas envejecen6.
El diagnóstico precoz del cáncer tiene como objetivo detectar la enfermedad en una fase temprana, en la que el tratamiento resulta más efectivo. Actualmente, las guías de práctica clínica (GPC) europeas recomiendan llevar a cabo diversas estrategias para la detección precoz de algunos tipos de cáncer en las PCVIH, recomendaciones que en la mayoría de los cánceres están basadas en estudios internacionales que han demostrado una reducción de la morbimortalidad en la población general7,8. Sin embargo, existen pocos datos sobre la implementación de los programas de detección propuestos y los métodos que se emplean en la práctica clínica en las PCVIH.
Para explorar la situación en España, se ha realizado una encuesta nacional entre médicos clínicos expertos en VIH/sida con el objetivo de conocer el grado de aplicación de las recomendaciones de cribado, las estrategias empleadas y las barreras percibidas por los profesionales para incorporar la detección precoz de cáncer en la atención sanitaria de las PCVIH.
MétodosPoblación y cuestionarioSe invitó a participar en el estudio a médicos especialistas en VIH/sida de centros sanitarios españoles vinculados a la cohorte de la Red Nacional de Investigación en sida (CoRIS), una cohorte multicéntrica constituida en 2004, en la que se incluye a PCVIH atendidas en Unidades/Servicios de Enfermedades Infecciosas/VIH (UEI/VIH) de 13 de las 17 comunidades autónomas (CC.AA.) del Sistema Nacional de Salud que se considera muy representativa del conjunto del Estado9.
Los coordinadores del estudio diseñaron un cuestionario anonimizado de 14 preguntas con opciones múltiples que incluía preguntas sobre el centro de trabajo (localización geográfica, número de camas y número de PCVIH en seguimiento) y sobre la práctica o no de cribado y la estrategia de detección empleada en los siguientes tipos de cáncer: cérvix, ano, pulmón, mama, colorrectal, próstata e hígado. En cada tipo de cáncer, si la estrategia realizada no era la recomendada en las GPC se preguntaba por los motivos y barreras para la implementación de la estrategia considerada óptima. Se estimó que la cumplimentación de la encuesta requería un tiempo comprendido entre 10 y 15min.
Distribución del cuestionarioLa encuesta se distribuyó a través de la plataforma Mailmeteor® [https://mailmeteor.com/es/] mediante el servidor de la Universidad Miguel Hernández de Alicante [Google Workspace] a los correos profesionales de la lista de distribución de los médicos vinculados a CoRIS. Se realizó una sola invitación a participar el día 20 de marzo de 2023 sin recordatorios posteriores y se aceptaron las respuestas recibidas en el plazo de 2 semanas. La encuesta era de cumplimentación anónima y no recogía ningún dato que permitiera identificar a los participantes (ver material adicional).
Análisis estadísticoLas respuestas recibidas se exportaron para su procesamiento informático al programa Microsoft Excel 2017 y se analizaron estadísticamente con el software R (R-Core Team 2023, R-4.3.0). Las variables cualitativas se describieron mediante tablas de frecuencias y distribución de porcentajes. Para la comparación de las proporciones se utilizó la prueba de chi-cuadrado y la prueba exacta de Fisher.
Consideraciones éticasEl estudio se llevó a cabo de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). Se garantizó en todo momento la confidencialidad de los datos. La participación en la encuesta fue voluntaria.
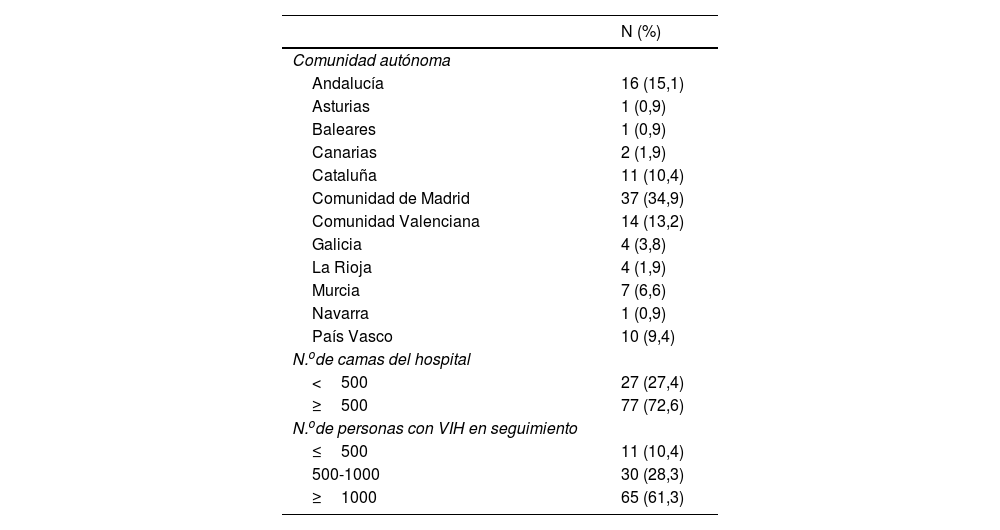
ResultadosSe enviaron 298 correos electrónicos, de los que 231 fueron abiertos por los destinatarios y un total de 176 accedieron al enlace del cuestionario. Se recibieron 106 cuestionarios correctamente cumplimentados en los 7 días siguientes al envío de la invitación procedentes de médicos de 12 CC.AA., con una tasa global de respuesta entre los que accedieron al cuestionario del 60,2%. La procedencia de los cuestionarios recibidos y las características de los centros de trabajo se resumen en la tabla 1. Las CC.AA. más representadas fueron Madrid (n=37; 34,9%), Andalucía (n=16; 15,1%), Comunidad Valenciana (n=14; 13,2%), Cataluña (n=11; 10,4%), País Vasco (n=10; 9,4%) y Murcia (7; 6,6%). Con respecto al número de camas hospitalarias y PCVIH en seguimiento de los centros, la mayor parte de las encuestas contestadas correspondían a hospitales de entre 500-1000 camas (47,2%), seguida de centros de menos de 500 camas (27,4%) y de los de más de 1000 camas (25,5%); 65 (61,3%) de los 106 encuestados trabajaban en hospitales con más de 1000 PCVIH en seguimiento, 30 (38,3%) correspondían a centros con entre 500-1000 PCVIH y 11 (10,4%) procedían de hospitales con<500 PCVIH.
Procedencia de los cuestionarios recibidos y características de los centros de trabajo de los médicos que completaron la encuesta (n=106)
| N (%) | |
|---|---|
| Comunidad autónoma | |
| Andalucía | 16 (15,1) |
| Asturias | 1 (0,9) |
| Baleares | 1 (0,9) |
| Canarias | 2 (1,9) |
| Cataluña | 11 (10,4) |
| Comunidad de Madrid | 37 (34,9) |
| Comunidad Valenciana | 14 (13,2) |
| Galicia | 4 (3,8) |
| La Rioja | 4 (1,9) |
| Murcia | 7 (6,6) |
| Navarra | 1 (0,9) |
| País Vasco | 10 (9,4) |
| N.ode camas del hospital | |
| <500 | 27 (27,4) |
| ≥500 | 77 (72,6) |
| N.ode personas con VIH en seguimiento | |
| ≤500 | 11 (10,4) |
| 500-1000 | 30 (28,3) |
| ≥1000 | 65 (61,3) |
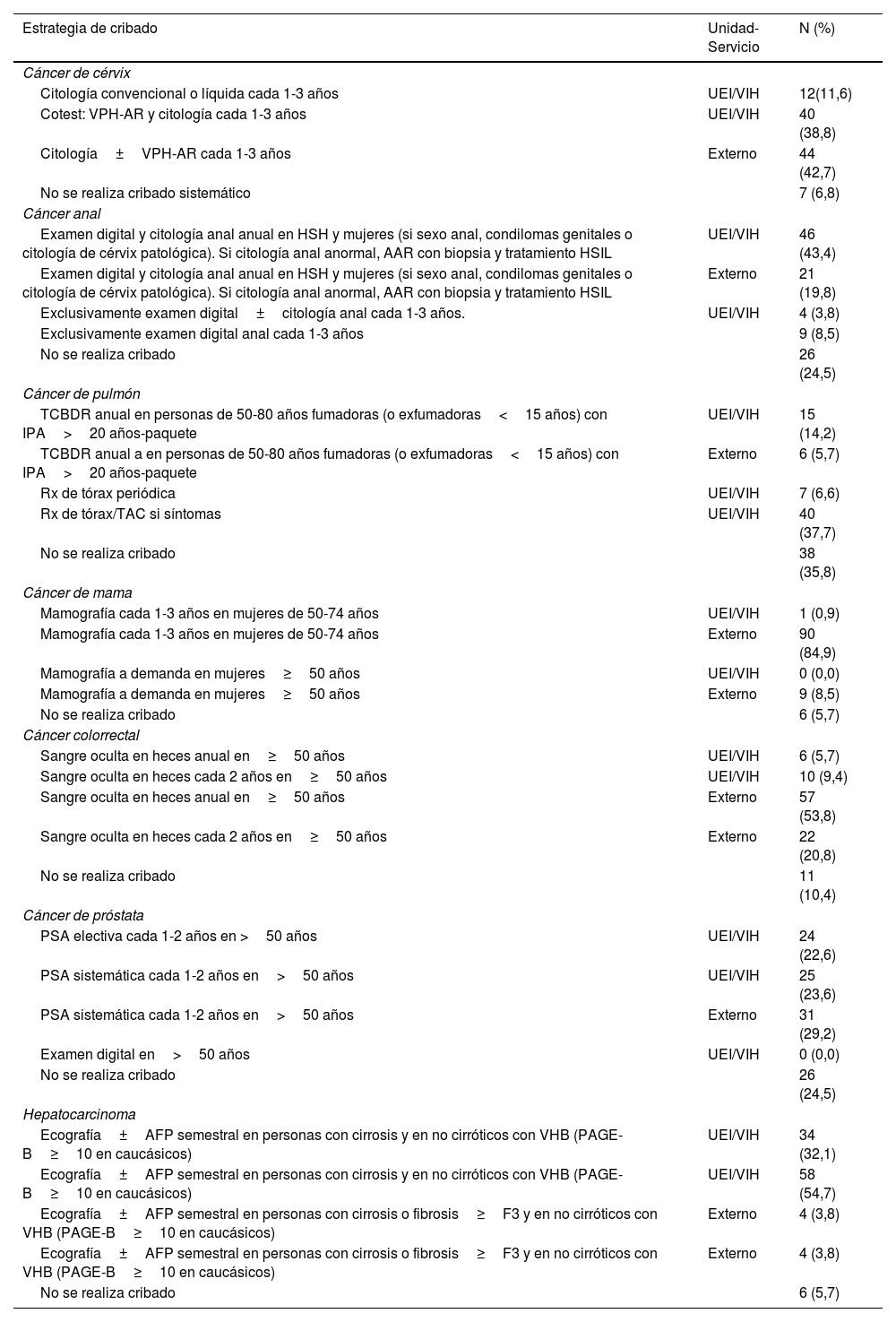
La mayoría de los encuestados respondieron que las PCVIH atendidas en su consulta seguían regularmente las recomendaciones de las GPC para la detección precoz de cáncer hepático (100/106; 94,3%), de cérvix (95/103; 93,2%) y de mama (91/106; 85,8%). En el cáncer colorrectal y anal, la proporción de PCVIH que seguían las estrategias de cribado recomendadas era del 68,9% (73/106) y del 63,2% (67/106), respectivamente, y en el cáncer de próstata y de pulmón, era del 46,2% (49/106) y 19,8% (21/106), respectivamente. Los métodos de cribado empleados en cada uno de los cánceres se detallan en la tabla 2.
Estrategias de cribado de cáncer realizadas en las personas con VIH atendidas en los centros de trabajo de los médicos que completaron la encuesta (n=106) y servicios donde se realiza el cribado
| Estrategia de cribado | Unidad-Servicio | N (%) |
|---|---|---|
| Cáncer de cérvix | ||
| Citología convencional o líquida cada 1-3 años | UEI/VIH | 12(11,6) |
| Cotest: VPH-AR y citología cada 1-3 años | UEI/VIH | 40 (38,8) |
| Citología±VPH-AR cada 1-3 años | Externo | 44 (42,7) |
| No se realiza cribado sistemático | 7 (6,8) | |
| Cáncer anal | ||
| Examen digital y citología anal anual en HSH y mujeres (si sexo anal, condilomas genitales o citología de cérvix patológica). Si citología anal anormal, AAR con biopsia y tratamiento HSIL | UEI/VIH | 46 (43,4) |
| Examen digital y citología anal anual en HSH y mujeres (si sexo anal, condilomas genitales o citología de cérvix patológica). Si citología anal anormal, AAR con biopsia y tratamiento HSIL | Externo | 21 (19,8) |
| Exclusivamente examen digital±citología anal cada 1-3 años. | UEI/VIH | 4 (3,8) |
| Exclusivamente examen digital anal cada 1-3 años | 9 (8,5) | |
| No se realiza cribado | 26 (24,5) | |
| Cáncer de pulmón | ||
| TCBDR anual en personas de 50-80 años fumadoras (o exfumadoras<15 años) con IPA>20 años-paquete | UEI/VIH | 15 (14,2) |
| TCBDR anual a en personas de 50-80 años fumadoras (o exfumadoras<15 años) con IPA>20 años-paquete | Externo | 6 (5,7) |
| Rx de tórax periódica | UEI/VIH | 7 (6,6) |
| Rx de tórax/TAC si síntomas | UEI/VIH | 40 (37,7) |
| No se realiza cribado | 38 (35,8) | |
| Cáncer de mama | ||
| Mamografía cada 1-3 años en mujeres de 50-74 años | UEI/VIH | 1 (0,9) |
| Mamografía cada 1-3 años en mujeres de 50-74 años | Externo | 90 (84,9) |
| Mamografía a demanda en mujeres≥50 años | UEI/VIH | 0 (0,0) |
| Mamografía a demanda en mujeres≥50 años | Externo | 9 (8,5) |
| No se realiza cribado | 6 (5,7) | |
| Cáncer colorrectal | ||
| Sangre oculta en heces anual en≥50 años | UEI/VIH | 6 (5,7) |
| Sangre oculta en heces cada 2 años en≥50 años | UEI/VIH | 10 (9,4) |
| Sangre oculta en heces anual en≥50 años | Externo | 57 (53,8) |
| Sangre oculta en heces cada 2 años en≥50 años | Externo | 22 (20,8) |
| No se realiza cribado | 11 (10,4) | |
| Cáncer de próstata | ||
| PSA electiva cada 1-2 años en >50 años | UEI/VIH | 24 (22,6) |
| PSA sistemática cada 1-2 años en>50 años | UEI/VIH | 25 (23,6) |
| PSA sistemática cada 1-2 años en>50 años | Externo | 31 (29,2) |
| Examen digital en>50 años | UEI/VIH | 0 (0,0) |
| No se realiza cribado | 26 (24,5) | |
| Hepatocarcinoma | ||
| Ecografía±AFP semestral en personas con cirrosis y en no cirróticos con VHB (PAGE-B≥10 en caucásicos) | UEI/VIH | 34 (32,1) |
| Ecografía±AFP semestral en personas con cirrosis y en no cirróticos con VHB (PAGE-B≥10 en caucásicos) | UEI/VIH | 58 (54,7) |
| Ecografía±AFP semestral en personas con cirrosis o fibrosis≥F3 y en no cirróticos con VHB (PAGE-B≥10 en caucásicos) | Externo | 4 (3,8) |
| Ecografía±AFP semestral en personas con cirrosis o fibrosis≥F3 y en no cirróticos con VHB (PAGE-B≥10 en caucásicos) | Externo | 4 (3,8) |
| No se realiza cribado | 6 (5,7) |
AAR: anoscopia de alta resolución; AFP: alfafetoproteína; F3: fibrosis 3; HSH: hombres que tienen sexo con hombres; HSIL: lesión intraepitelial escamosa de alto grado; IPA: índice paquetes año; PAGE-B: escala de riesgo de hepatocarcinoma basada en la cifra de plaquetas, edad y sexo; TAC: tomografía axial computarizada; TCBDR: tomografía computarizada de baja dosis de radiación; UEI/VIH: Servicios o Unidades de Enfermedades Infecciosas/VIH; VHB: virus de la hepatitis B; VPH-AR: virus del papiloma humano de alto riesgo.
Respecto a las unidades o servicios en los que se realizaba el cribado de cáncer, los encuestados indicaron que las UEI/VIH estaban directamente implicados en los programas de cribado del cáncer hepático (92/106; 86,8%), cérvix (52/103; 50,5%), próstata (49/106; 46,2%), ano (46/106; 43,4%) y pulmón (15/106; 14,1%), mientras que los cribados de cáncer colorrectal y de mama se realizaban mayoritariamente en los Servicios de Salud Pública.
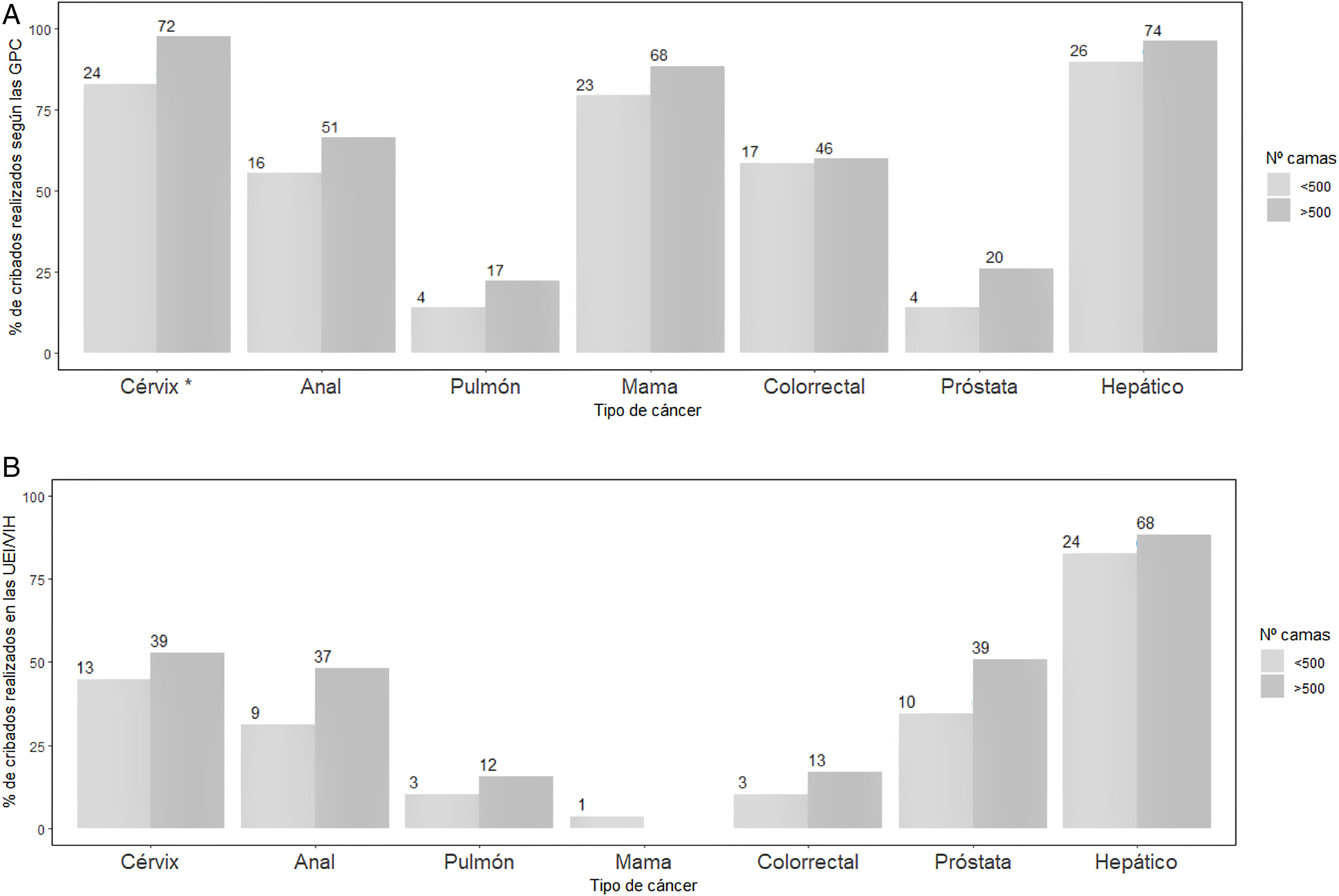
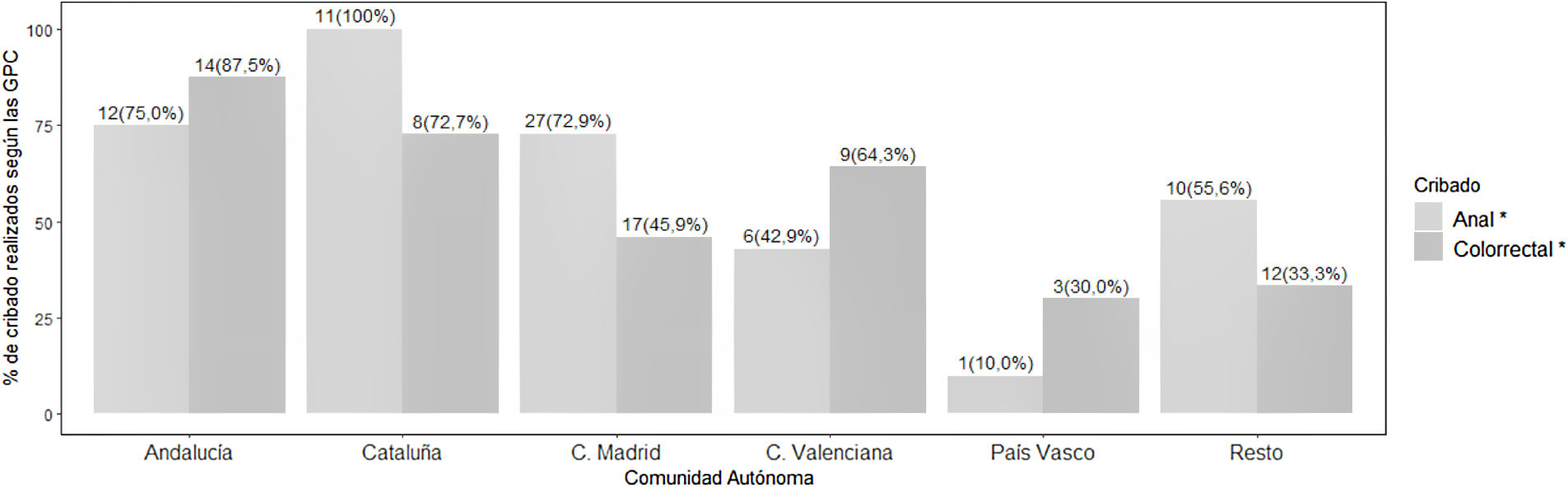
No hubo diferencias en la proporción de cribados realizados según el número de PCVIH en seguimiento en los centros de filiación de los encuestados (datos no mostrados). En hospitales con más de 500 camas se observó una tendencia a realizar con más frecuencia cribados de cáncer de cérvix, ano, mama y próstata que en los centros más pequeños, y una mayor participación de las UEI/VIH en los programas de cribado (figs. 1A y B). Se observaron diferencias significativas en la frecuencia de realización de los cribados de cáncer colorrectal y anal según la comunidad autónoma en la que trabajaban los encuestados (fig. 2).
(A) Frecuencia de realización de cribado de cáncer en personas con VIH según el número de camas del hospital (<500 vs.>500) de los médicos que completaron el cuestionario (n=106).
Valores expresados como n (%). (*) p<0,05 para la diferencia en la proporción de cribados según el número de camas.
Figura 1(B) Cribados de cáncer en personas con VIH efectuados directamente en las Unidades/Servicios de Enfermedades Infecciosas/VIH (UEI/VIH) del centro según el número de camas del hospital (<500 vs.>500) de los médicos que completaron el cuestionario (n=106). Valores expresados como n (%).
GPC: guías de práctica clínica.
Frecuencia de realización de cribado de cáncer colorrectal y anal en personas con VIH según la comunidad autónoma de los médicos que completaron el cuestionario (n=106). GPC: guías de práctica clínica. Valores expresados como n (%). (*) p<0,05 para la diferencia en la frecuencia de cribados entre las CC.AA.
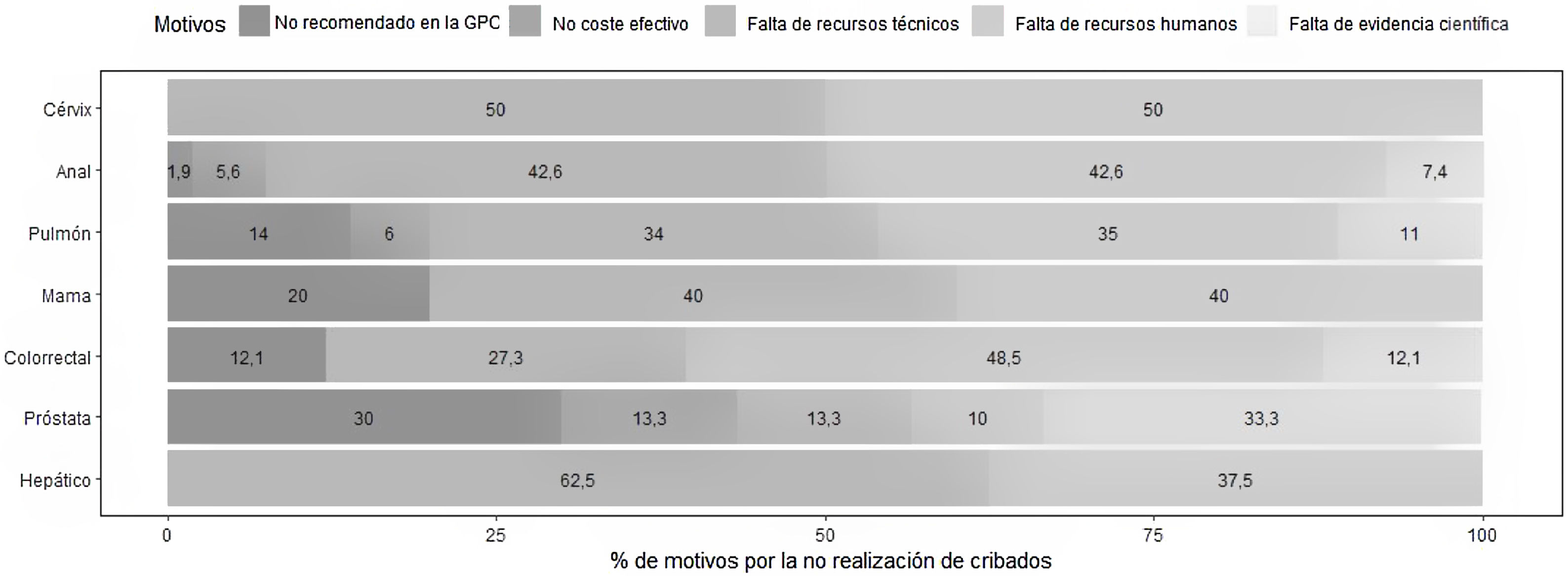
En cuanto a los motivos por los que no se llevaban a cabo las estrategias de cribado consideradas óptimas, la respuesta más frecuente fue la escasez de recursos materiales o humanos, seguida por la falta de recomendación de esa estrategia en las GPC, un motivo esgrimido por el 34,6% de los encuestados en el caso del cribado del cáncer de próstata, por el 20% en el cáncer de mama, el 16% del cáncer de pulmón y el 12% en el cáncer colorrectal (fig. 3).
DiscusiónLos resultados del estudio indican que la mayoría de las PCVIH atendidas en las consultas de los médicos que respondieron a la encuesta siguen regularmente programas de cribado de cáncer hepático, de cérvix y de mama. Sin embargo, el grado de aplicación del cribado para el cáncer colorrectal, anal y pulmonar es todavía bajo. Los cribados de cáncer de mama y colorrectal se desarrollan mayoritariamente en el marco de los programas poblacionales incluidos en la cartera común de servicios del Sistema Nacional de Salud. Por el contrario, el cribado de cáncer hepático se realiza predominantemente en las UEI/VIH, que también contribuyen en gran medida al cribado del cáncer de ano, cérvix, próstata y pulmón. La principal barrera percibida por los médicos encuestados para incorporar la detección precoz de algunos tipos de cáncer en la atención sanitaria de las PCVIH es la falta de recursos materiales y/o humanos.
El diagnóstico precoz es uno de los objetivos prioritarios del Plan Europeo de Lucha contra el Cáncer que aspira a que los Estados miembros logren que en 2025 el 90% de la población tenga acceso al cribado de cáncer de mama, cérvix y colorrectal10. España cuenta con programas de cribado poblacional para el diagnóstico precoz del cáncer de mama y del cáncer colorrectal, aunque su implantación es desigual en los distintos territorios del Estado11,12. El cribado del cáncer de mama tiene una amplia cobertura nacional con un elevado grado de participación en todas las CC.AA. Los resultados de la presente encuesta muestran que las PCVIH en general tienen acceso a este programa, aunque la participación se sitúa por debajo del 90% y tiende a ser inferior en los centros más pequeños. A diferencia del cáncer de mama, el cribado del cáncer colorrectal está todavía en fase de implantación en algunas CC.AA.13. Los datos aportados por los médicos encuestados en este trabajo sitúan la participación de las PCVIH por debajo del 70%, con diferencias significativas entre las distintas CC.AA., una cifra inferior a la cobertura del programa a nivel nacional13.
Las respuestas de los encuestados indican que las UEI/VIH participan activamente en el cribado de los cánceres más estrechamente asociados con la infección por el VIH y las coinfecciones virales, como el cáncer hepático, de cérvix y ano. El cáncer hepático es el segundo CNDS más frecuente en las PCVIH14 y la segunda causa de muerte relacionada con los CNDS15. La encuesta indica que en la mayoría de las PCVIH se realiza el cribado hepático directamente en las UEI/VIH y el método de cribado preferido por los encuestados es la realización semestral de una ecografía±determinación de alfafetoproteína a los pacientes con cirrosis o fibrosis≥F3 y a no cirróticos con virus de la hepatitis B PAGE≥10, que sigue siendo la principal estrategia recomendada en las GPC a pesar de la escasa evidencia que respalde su eficacia para detectar cánceres en etapas tempranas en PCVIH5.
En el caso del cáncer de cérvix, los especialistas encuestados indicaron que las UEI/VIH participaban en uno de cada 2 cribados dando preferencia al denominado «cotest», prueba conjunta de detección molecular del virus del papiloma humano y citología cervical cada 1-3 años. Aunque en fechas recientes se ha puesto en marcha en España un programa de cribado poblacional, hasta ahora el cribado del cáncer de cérvix se ha ofrecido de manera oportunista a las mujeres entre 25 y 65 años, mediante citología cervical cada 3-5 años, una estrategia considerada subóptima en las mujeres con VIH, un grupo de alto riesgo en el que las guías recomiendan un cribado de inicio más temprano y más frecuente que en la población general7,16,17.
Un hallazgo inesperado de la encuesta fue que en más del 60% de las PCVIH atendidas por los médicos encuestados se realiza ya cribado de cáncer anal, con marcadas diferencias entre las CC.AA. El cáncer anal es la neoplasia con el mayor exceso de incidencia y mortalidad entre todos los CNDS2,18 y el primer CNDS en años de vida perdidos en PCVIH en los EE. UU.19. La historia natural del cáncer anal puede modificarse mediante el tratamiento temprano de la lesión intraepitelial escamosa de alto grado, precursor del carcinoma invasivo20. Hasta la fecha, no existe un consenso internacional sobre la detección sistemática del cáncer anal, si bien los resultados del ensayo ANCHOR, publicado recientemente21, sugieren que la detección y tratamiento de la lesión intraepitelial escamosa de alto grado debe incorporarse como un procedimiento de rutina entre los cánceres detectables mediante cribado en las PCVIH con mayor riesgo de padecer esta neoplasia.
Solamente en una de cada 5 PCVIH atendidas en las consultas de los médicos participantes se realizaba cribado de cáncer de pulmón, una cifra muy baja si tenemos en cuenta que el cáncer de pulmón es el CNDS más frecuente y la principal causa de mortalidad por cáncer en PCVIH14. Los programas de detección precoz de cáncer de pulmón basados en la realización de tomografía computarizada de baja dosis de radiación tienen una sólida evidencia científica, se han implantado ya en algunos países para el cribado de cáncer de pulmón en población general de alto riesgo22,23 y la Sociedad Europea de SIDA los recomienda para PCVIH7. Lamentablemente, en España todavía no se ha puesto en marcha este programa de cribado en el Sistema Nacional de Salud lo que probablemente está obstaculizando el diagnóstico temprano del cáncer de pulmón en las PCVIH, un grupo particularmente vulnerable en el que la incidencia duplica la de la población general2, ocurre a edades más jóvenes y su mortalidad es hasta 4 veces mayor2,24, probablemente por encontrarse en fase avanzada en el momento del diagnóstico.
Uno de los objetivos del estudio era conocer los motivos para la no realización de cribados. Aunque la principal barrera percibida por los médicos encuestados fue la escasez de recursos materiales y/o humanos, una proporción apreciable de los encuestados respondió que no realizaba cribado debido a la falta de evidencia científica en el caso del cáncer colorrectal o de mama, enfermedades en las que está bien demostrado que el diagnóstico precoz reduce la morbimortalidad y el cribado poblacional es ampliamente recomendado.
Las principales limitaciones del trabajo derivan de la muestra estudiada y del tipo de cuestionario empleado. Todos los profesionales que participaron desarrollan su actividad en centros vinculados a la cohorte de la RIS y una elevada proporción correspondía a hospitales de tamaño mediano y grande con un número considerable de PCVIH en seguimiento, por lo que los resultados pueden no ser generalizables a otros entornos en los que las PCVIH pueden recibir atención sanitaria. La distribución territorial de los encuestados se relaciona con el grado de vinculación de las distintas CC.AA. en la cohorte de la RIS y no necesariamente representa al número de PCVIH atendidas en cada una de ellas. Además, dado que la cumplimentación era anónima y no se recogía ningún dato que permitiera identificar a los encuestados, no es posible asegurar que los centros a los que estaban adscritos los participantes que cumplimentaron la encuesta representen al universo de CoRIS. El modelo de cuestionario con preguntas cerradas y respuestas dentro de un marco limitado de opciones puede haber favorecido que los encuestados eligieran en algunos casos las opciones consideradas deseables u óptimas. Algunos de los centros donde trabajan los encuestados participan en un ensayo clínico multicéntrico en el que se evalúan 2 estrategias de cribado de cáncer, lo que también podría haber influido en la elección de sus respuestas25. Por otra parte, los encuestados no fueron preguntados acerca de la frecuencia con la que realizaban los cribados, lo que no permite hacer una estimación del grado de participación de las PCVIH en cada uno de los cribados y menos aún del grado de adherencia al cribado, que en general suele ser subóptima en cribados realizados por los médicos clínicos que atienden a las PCVIH26, y menor que en los no infectados en cribados de base poblacional27–29. Finalmente, se preguntó exclusivamente a los profesionales y no se evaluó la perspectiva de los pacientes, cuyas opiniones sobre las barreras para la implementación de los programas de cribado pueden diferir de las esgrimidas por los profesionales30.
En resumen, el estudio informa sobre la situación del cribado de cáncer en PCVIH en España e identifica barreras y oportunidades para extender los programas de detección precoz de cáncer en las personas que viven con el VIH, especialmente en el caso del cáncer colorrectal, anal y pulmonar. Los resultados ponen de manifiesto la necesidad de asignar recursos estructurales y humanos para el diagnóstico temprano del cáncer en PCVIH, pero también de profundizar en el conocimiento y difundir las recomendaciones de cribado entre los médicos especialistas. Los mensajes específicos sobre la eficacia y los beneficios de la detección precoz del cáncer en PCVIH pueden mejorar la aceptación y la adopción de los programas de cribado por parte de los profesionales, y también la participación y adherencia a los mismos de las personas que viven con el virus.
FinanciaciónEste trabajo contó con el apoyo de los proyectos RD16/0025/0038 y CB21/13/00011 del Plan Nacional de Investigación+Desarrollo+Innovación (I+D+I) del Instituto de Salud Carlos III - Fondo Europeo de Desarrollo Regional (subvenciones PI16/01740, PI18/01861, CM19/00160, CM20/00066, CM21/00186) y la Conselleria de Innovación, Universidades y Ciencia de la Generalitat Valenciana (AICO /2021/205).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El estudio no habría sido posible sin la colaboración desinteresada de todos los médicos que han participado en el proyecto completando la encuesta.