El papel de las micobacterias no tuberculosas (MNT) en los pacientes con fibrosis quística (FQ) está, en ocasiones, en controversia. El objetivo del trabajo es evaluar la prevalencia y las características clínicas/microbiológicas de pacientes adultos con FQ colonizados con MNT, destacando Mycobacterium abscessus (M. abscessus).
MétodosSe ha realizado un estudio retrospectivo en 92 pacientes adultos con FQ en el que se diferenció: grupo control, 64 pacientes no colonizados por MNT, y grupo a estudio, 28 pacientes colonizados por MNT. Se han analizado variables como la edad, mutación F508del, función pulmonar, afectación pancreática, tinción de auramina y recolonizaciones entre ambos grupos.
ResultadosLa prevalencia de MNT encontrada ha sido 30,4%. La MNT más prevalente fue Mycobacterium avium complex seguida por M. abscessus. Para M. abscessus, en el estudio comparativo con pacientes colonizados por otras MNT, se obtuvieron diferencias estadísticamente significativas en las variables de edad.
DiscusiónHemos encontrado alta prevalencia de MNT en pacientes adultos con FQ y relacionamos la aparición de M. asbcessus con edades inferiores a 30 años y F508del. Con el fin de conocer mejor el papel patógeno de las MNT, especialmente de M. asbcessus, se requieren estudios multicéntricos en población con FQ.
The role of non-tuberculous mycobacteria (NTM) among cystic fibrosis (CF) patients, on occasion, remains unknown. The aim of our study is to evaluate the prevalence and clinical/microbiological characteristics of CF adult patients colonized by NTM, highlighting Mycobacterium abscessus (M. abscessus).
MethodsA retrospective study was conducted with 92 CF adult patients: including a control group of 64 patients, not colonized by NTM, and a study group of 28 patients, colonized by NTM. We have analyzed variables such as age, F508del mutation, lung function, pancreatic involvement, auramine staining and co-colonizations between both groups.
ResultsThe prevalence of NTM found was 30.4%. The most prevalent was Mycobacterium avium complex followed by M. abscessus. For M. abscessus, in the comparative study with patients colonized by other NTM, significant results were obtained for variables age.
DiscussionWe have found a high prevalence of NTM among adult patients with CF, and we associated the presence of M. asbcessus with ages less than 30 years and F508del. Due to the pathogenic role of NTM, especially M. asbcessus, multicenter studies are required within the population suffering from CF.
La fibrosis quística (FQ), la enfermedad genética letal más frecuente en la población blanca, se transmite de forma autosómica recesiva. En España se estima una incidencia de uno de cada 4.500 - 5.000 nacidos vivos. Es consecuencia de mutaciones en el gen que reside en el cromosoma 7 q31-32. Este gen codifica para una proteína llamada proteína reguladora de la conductabilidad transmembrana (CFTR) responsable de actuar como canal de cloro en los tejidos exocrinos. Las mutaciones en el gen CFTR resultan en la falta de proteína funcionalmente activa. La más frecuente es la deleción F508del, pero se han descrito más de 2.000 mutaciones posibles del gen, 347 que causan la enfermedad, que varían ampliamente según el origen étnico y la localización geográfica de cada población1.
El defecto en el transporte del ion cloro conduce a una deshidratación de las secreciones respiratorias, pancreáticas, hepáticas, intestinales y genitourinarias, aumentando su viscosidad y espesor. Entre otros, se produce un efecto en la función pulmonar caracterizado por una disminución del volumen espiratorio forzado en el primer segundo (FEV1) y de la capacidad vital forzada (FVC), además de insuficiencia pancreática o aparición de diabetes relacionada con la FQ1.
La principal causa de mortalidad asociada a FQ es la afectación pulmonar crónica, con un alto índice de colonizaciones permanentes e infecciones recurrentes, siendo los agentes causales más comunes Staphylococcus aureus (S. aureus), Haemophilus influenzae y Pseudomonas aeruginosa (P. aeruginosa). Las colonizaciones/infecciones por micobacterias no tuberculosas (MNT) en este contexto están menos documentadas debido a su menor prevalencia. Por ello, la repercusión clínica de estas MNT en FQ está aún en discusión. Sin embargo, su importancia va en aumento a medida que se establece mayor claridad de su patogenicidad2,3. Además, varios autores destacan el papel de Mycobacterium abscessus(M. abscessus) por presentar un patrón más patógeno al tener mayor impacto en la función pulmonar a lo largo del tiempo4.
El objetivo de este estudio es determinar la prevalencia y las características clínicas y microbiológicas de pacientes con FQ colonizados/infectados con MNT, así como, la prevalencia y características clínicas de los pacientes que han tenido cultivo positivo para M. abscessus, en relación con aquellos pacientes en los que se aislaron otras MNT.
MetodologíaSe han analizado retrospectivamente los datos clínicos y microbiológicos de pacientes adultos atendidos en la consulta monográfica de FQ del Hospital Universitario de La Princesa en el periodo 2010-2017, estableciéndose dos grupos:
- -
Grupo a estudio: 28 pacientes seleccionados por tener al menos un aislamiento positivo de MNT. En el caso de tener más de un cultivo positivo, se seleccionó el último para el análisis.
- -
Grupo control: 64 pacientes no colonizados/infectados por MNT.
Por otro lado, se han subanalizado los pacientes con aislamientos positivos para micobacterias distintas a M. abscessus (21 pacientes) con aquellos con aislamiento positivo para M. abscessus (7 pacientes).
Se ha realizado el estudio microbiológico sobre las muestras de esputo recogidas de estos pacientes. Todas fueron procesadas siguiendo la metodología convencional para el estudio de bacterias, hongos y micobacterias. La identificación de bacterias se llevó a cabo mediante espectrometría de masas MALDI-TOF (MALDI Biotyper® system, Bruker Daltonics, Fremont, CA, EE. UU.) y MicroScan (Dade Beckman Coulter Inc., CA, EE. UU.); las micobacterias con espectrometría de masas MALDI-TOF y PCR seguida de hibridación reversa (Genotype Mycobacterium CM y Genotype Mycobacterium AS, Hain Lifescience, Alemania); y, MALDI-TOF e identificación microscópica para los hongos.
Las variables estudiadas han sido: edad en el primer aislamiento, edad en el último aislamiento de MNT, edad actual de los pacientes del grupo control, sexo, porcentaje de volumen espiratorio forzado (%FEV1), porcentaje de capacidad vital forzada (%FVC), índice FEV1/FVC, presencia de insuficiencia pancreática y diabetes relacionada con la FQ, determinación del índice de masa corporal (IMC), presencia de aspergilosis broncopulmonar alérgica (ABPA) y mutación F508del. Además, se ha analizado la coinfección con S. aureus, S. aureus resistente a meticilina (SARM), P. aeruginosa, Burkholderia spp., Aspergillus spp., Candida spp., y otros hongos.
La prevalencia de micobacterias se ha definido como aquellos pacientes con al menos un cultivo positivo para MNT durante los años de estudio.
En el análisis descriptivo de las variables cuantitativas se utilizó la media y la desviación estándar y para las variables cualitativas los porcentajes. Para analizar las diferencias entre variables según los grupos se ha utilizado el t-Student para las variables cuantitativas y el test de Chi cuadrado, o Fisher cuando fue necesario, para las variables cualitativas. El nivel máximo de error admisible fue p<0,05.
ResultadosLa prevalencia de infección por MNT en los pacientes con FQ de nuestra unidad es del 30,4%.
La MNT más frecuentemente aislada fue Mycobacterium avium complex (MAC) en 12 pacientes (42,9%), seguida por M. abscessus en 7 pacientes (25%) y Mycobacterium lentiflavum en 6 (21,4%). Otras micobacterias aisladas, cada una en un paciente, fueron: Mycobacterium kansasii (3,6%), Mycobacterium gordonae (3,6%); y, un paciente cocolonizado por Mycobacterium intracellulare y Mycobacterium chimaera (3,6%).
Es reseñable que el porcentaje de tinción positiva en los casos con aislamiento positivo fue del 7,1%.
Las tablas 1 y 2 muestran el análisis de las variables estudiadas en los distintos grupos.
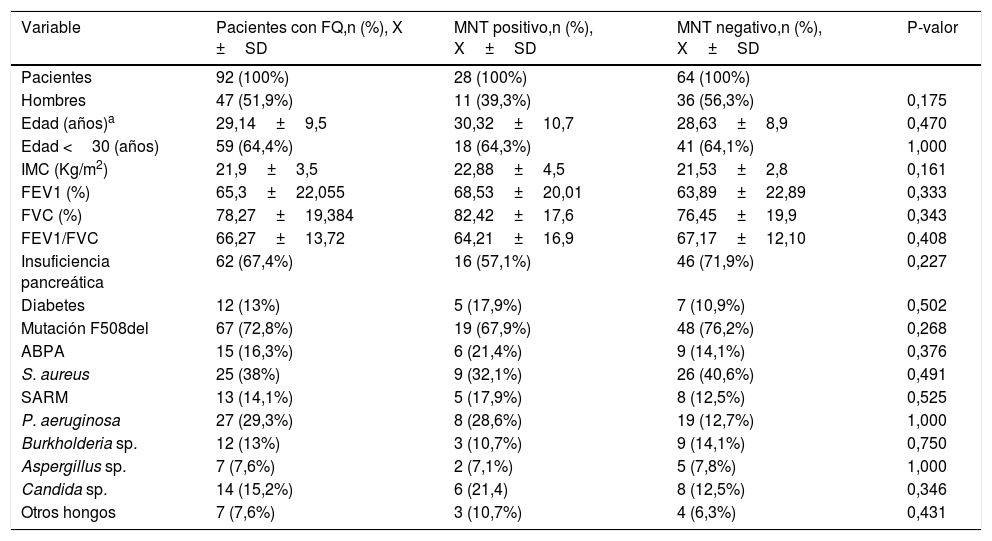
Descripción de las diferentes variables clínicas y microbiológicas en el total de pacientes con FQ y agrupados en MNT positivo o negativo
| Variable | Pacientes con FQ,n (%), X ±SD | MNT positivo,n (%), X±SD | MNT negativo,n (%), X±SD | P-valor |
|---|---|---|---|---|
| Pacientes | 92 (100%) | 28 (100%) | 64 (100%) | |
| Hombres | 47 (51,9%) | 11 (39,3%) | 36 (56,3%) | 0,175 |
| Edad (años)a | 29,14±9,5 | 30,32±10,7 | 28,63±8,9 | 0,470 |
| Edad <30 (años) | 59 (64,4%) | 18 (64,3%) | 41 (64,1%) | 1,000 |
| IMC (Kg/m2) | 21,9±3,5 | 22,88±4,5 | 21,53±2,8 | 0,161 |
| FEV1 (%) | 65,3±22,055 | 68,53±20,01 | 63,89±22,89 | 0,333 |
| FVC (%) | 78,27±19,384 | 82,42±17,6 | 76,45±19,9 | 0,343 |
| FEV1/FVC | 66,27±13,72 | 64,21±16,9 | 67,17±12,10 | 0,408 |
| Insuficiencia pancreática | 62 (67,4%) | 16 (57,1%) | 46 (71,9%) | 0,227 |
| Diabetes | 12 (13%) | 5 (17,9%) | 7 (10,9%) | 0,502 |
| Mutación F508del | 67 (72,8%) | 19 (67,9%) | 48 (76,2%) | 0,268 |
| ABPA | 15 (16,3%) | 6 (21,4%) | 9 (14,1%) | 0,376 |
| S. aureus | 25 (38%) | 9 (32,1%) | 26 (40,6%) | 0,491 |
| SARM | 13 (14,1%) | 5 (17,9%) | 8 (12,5%) | 0,525 |
| P. aeruginosa | 27 (29,3%) | 8 (28,6%) | 19 (12,7%) | 1,000 |
| Burkholderia sp. | 12 (13%) | 3 (10,7%) | 9 (14,1%) | 0,750 |
| Aspergillus sp. | 7 (7,6%) | 2 (7,1%) | 5 (7,8%) | 1,000 |
| Candida sp. | 14 (15,2%) | 6 (21,4) | 8 (12,5%) | 0,346 |
| Otros hongos | 7 (7,6%) | 3 (10,7%) | 4 (6,3%) | 0,431 |
ABPA: aspergilosis broncopulmonar alérgica; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; SARM: Staphyloccocus aureus resistente a meticilina.
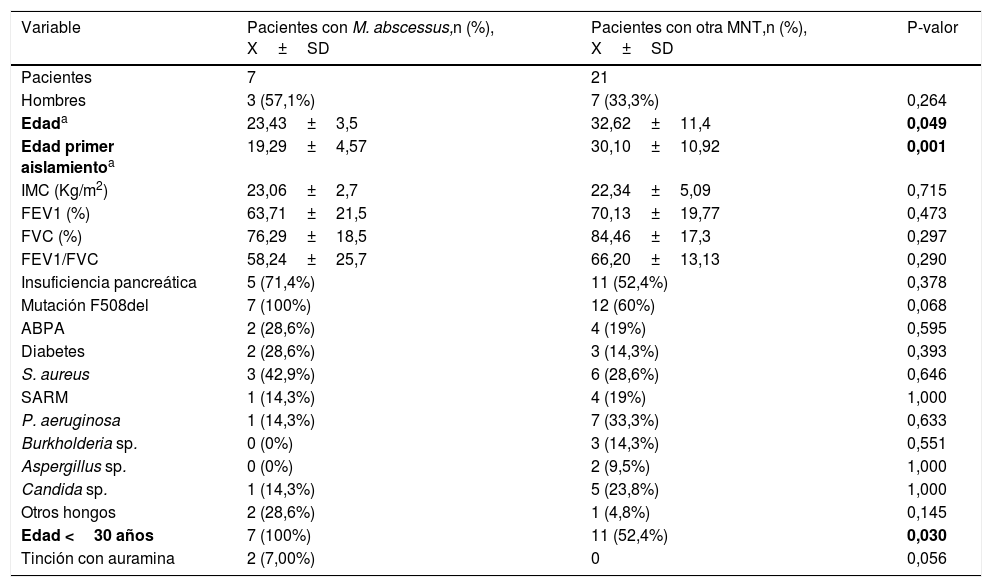
Descripción de las diferentes variables clínicas y microbiológicas en los pacientes con aislamiento de M. abscessus frente a aquellos con otra MNT
| Variable | Pacientes con M. abscessus,n (%), X±SD | Pacientes con otra MNT,n (%), X±SD | P-valor |
|---|---|---|---|
| Pacientes | 7 | 21 | |
| Hombres | 3 (57,1%) | 7 (33,3%) | 0,264 |
| Edada | 23,43±3,5 | 32,62±11,4 | 0,049 |
| Edad primer aislamientoa | 19,29±4,57 | 30,10±10,92 | 0,001 |
| IMC (Kg/m2) | 23,06±2,7 | 22,34±5,09 | 0,715 |
| FEV1 (%) | 63,71±21,5 | 70,13±19,77 | 0,473 |
| FVC (%) | 76,29±18,5 | 84,46±17,3 | 0,297 |
| FEV1/FVC | 58,24±25,7 | 66,20±13,13 | 0,290 |
| Insuficiencia pancreática | 5 (71,4%) | 11 (52,4%) | 0,378 |
| Mutación F508del | 7 (100%) | 12 (60%) | 0,068 |
| ABPA | 2 (28,6%) | 4 (19%) | 0,595 |
| Diabetes | 2 (28,6%) | 3 (14,3%) | 0,393 |
| S. aureus | 3 (42,9%) | 6 (28,6%) | 0,646 |
| SARM | 1 (14,3%) | 4 (19%) | 1,000 |
| P. aeruginosa | 1 (14,3%) | 7 (33,3%) | 0,633 |
| Burkholderia sp. | 0 (0%) | 3 (14,3%) | 0,551 |
| Aspergillus sp. | 0 (0%) | 2 (9,5%) | 1,000 |
| Candida sp. | 1 (14,3%) | 5 (23,8%) | 1,000 |
| Otros hongos | 2 (28,6%) | 1 (4,8%) | 0,145 |
| Edad <30 años | 7 (100%) | 11 (52,4%) | 0,030 |
| Tinción con auramina | 2 (7,00%) | 0 | 0,056 |
ABPA: aspergilosis broncopulmonar alérgica; IMC: índice de masa corporal; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; SARM: Staphyloccocus aureus resistente a meticilina.
En negrita, valores estadísticamente significativos (p-valor<0,05).
La prevalencia de micobacterias de nuestro estudio (30,4%) contrasta con la que reportan otros estudios de entre 3,3% y 24%2,5,6. En nuestro medio, esta prevalencia ha sufrido un aumento desde 20017. Este aumento puede deberse a diversos factores: el aumento de la vigilancia4, la supervivencia de los pacientes, el uso prolongado de la terapia antibiótica inhalada3, el cambio de microbioma en los pulmones por el uso prolongado de antimicrobianos, una mayor conciencia de los clínicos y una mejora en las técnicas microbiológicas de aislamiento e identificación de micobacterias.
Las MNT más aisladas coinciden con las descritas en la literatura8, MAC y M. abscessus. Sin embargo, las prevalencias representadas por Adjemian et al. - MAC 69% y M. abscessus 31% - difieren de las descritas en nuestro estudio, 42,9% y 25% respectivamente. La variabilidad geográfica de la infección por MNT2,5,6,8 puede justificar esta diferencia.
Atendiendo a las variables clínicas y demográficas estudiadas, la media de edad fue ligeramente mayor en los pacientes con cultivo positivo para MNT (30,3 años) respecto a aquellos con cultivo negativo (28,6 años), no encontrándose diferencias estadísticamente significativas. La presencia de micobacterias es más frecuente en pacientes de edades más avanzadas por su carácter oportunista y por colonizar los pulmones con lesiones previas. Asimismo, este tipo de infección se relaciona con el tiempo de exposición, que se incrementa con la edad de los pacientes9. Sin embargo, en el caso de M.abscessus, en nuestro trabajo el 100% de los aislamientos se produjo en pacientes menores de 30 años (p<0,05). Este hecho disiente de otros trabajos en los que los pacientes infectados por MAC y M. abscessus son diagnosticados de FQ en edades más tardías8. Además, el primer aislamiento para M. abscessus fue en pacientes de menor edad (p<0,05).
La presencia de MNT no se relacionó con peor función pulmonar. Sin embargo, en los pacientes en los que se aisló M. abscessus, la función pulmonar fue peor que en aquellos con otras MNT, aunque las diferencias no fueron estadísticamente significativas. Es posible que un seguimiento a lo largo del tiempo nos hubiese mostrado valores significativos, como ha ocurrido en trabajos previos, especialmente en los relacionados con M. abscessus4.
Las variables IMC, la presencia o no de diabetes y la insuficiencia pancreática se recogieron porque se asocian con un estado clínico peor y pueden ser un factor de confusión a la hora de realizar asociaciones. Sin embargo, no mostraron resultados significativos.
Si bien no hemos podido demostrar la asociación entre la infección por MNT y la presencia de la mutación F508del, merece la pena mencionar que la prevalencia de la mutación F508del entre los pacientes infectados con MNT (67,9%) cumple la premisa de que la mutación está presente en alrededor de un 70% de los pacientes10. Además, esta mutación se encontró en el 100% de los pacientes infectados con M. abscessus y la relación con esta fue casi significativa. No obstante, se necesitan más estudios para probar la relación lo que apoyaría la teoría de que la infección se relaciona con formas más severas de FQ11.
A pesar de las controvertidas asociaciones propuestas con otros microorganismos12, nuestro estudio no demostró ninguna relación entre el aislamiento de MNT y la coinfección con los patógenos estudiados.
La razón de haber estudiado por separado las implicaciones clínicas de la colonización con M. abscessus se debe a que diversos estudios la han relacionado con un mayor deterioro de la función pulmonar4. La cuestión de si la aparición de la infección por M. abscessus es la causa o la consecuencia de un empeoramiento de la función pulmonar ha sido motivo de debate, sin embargo, tanto el hecho de que la eliminación de la micobacteria conlleve a una mejora de esta, como que la disminución de la misma se produzca durante la infección, apoya la teoría de que la infección por M. abscessus es la causa de la disminución de la función pulmonar4.
Este estudio tiene varias limitaciones por tratarse de un estudio retrospectivo realizado en un único centro y solo con población adulta. El hecho de ser un estudio transversal limita en parte las variables estudiadas, ya que un seguimiento longitudinal de los pacientes, en especial su evolución clínica y el tratamiento antimicrobiano, habrían aportado más información en el conocimiento del poder patógeno de estos microorganismos; así como la diferenciación entre las subespecies dentro de M. abscessus.
Por todo ello, y visto el potencial patógeno de las MNT, especialmente de M. abscessus, creemos necesario plantear un estudio multicéntrico que recoja un mayor número de pacientes, incluyendo población infantil y diferentes orígenes geográficos, que permitan consolidar los resultados obtenidos en el presente estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.