La otitis externa maligna (OEM), también denominada externa necrotizante, es una entidad poco habitual en nuestro medio, con una incidencia recientemente estimada en 1,30 casos anuales por millón de habitantes1. Afecta generalmente a pacientes de edad avanzada con diabetes mellitus (DM) mal controlada o inmunosupresión1. Tras originarse en el epitelio escamoso del conducto auditivo externo (CAE), la OEM puede invadir por contigüidad las estructuras óseas adyacentes y dar lugar a una osteomielitis de la base del cráneo de evolución potencialmente mortal. Si bien más del 90% de los episodios están causados por Pseudomonas aeruginosa, la OEM por Aspergillus spp. está bien descrita en pacientes con infección por el virus de la inmunodeficiencia humana (VIH) o neutropenia, siendo más raras otras etiologías fúngicas2-4. Presentamos a continuación un caso de OEM por Candida albicans complicada con una osteomielitis de la base del cráneo en un paciente sin patologías predisponentes y discutimos el papel de las equinocandinas en el tratamiento de este escenario poco habitual.
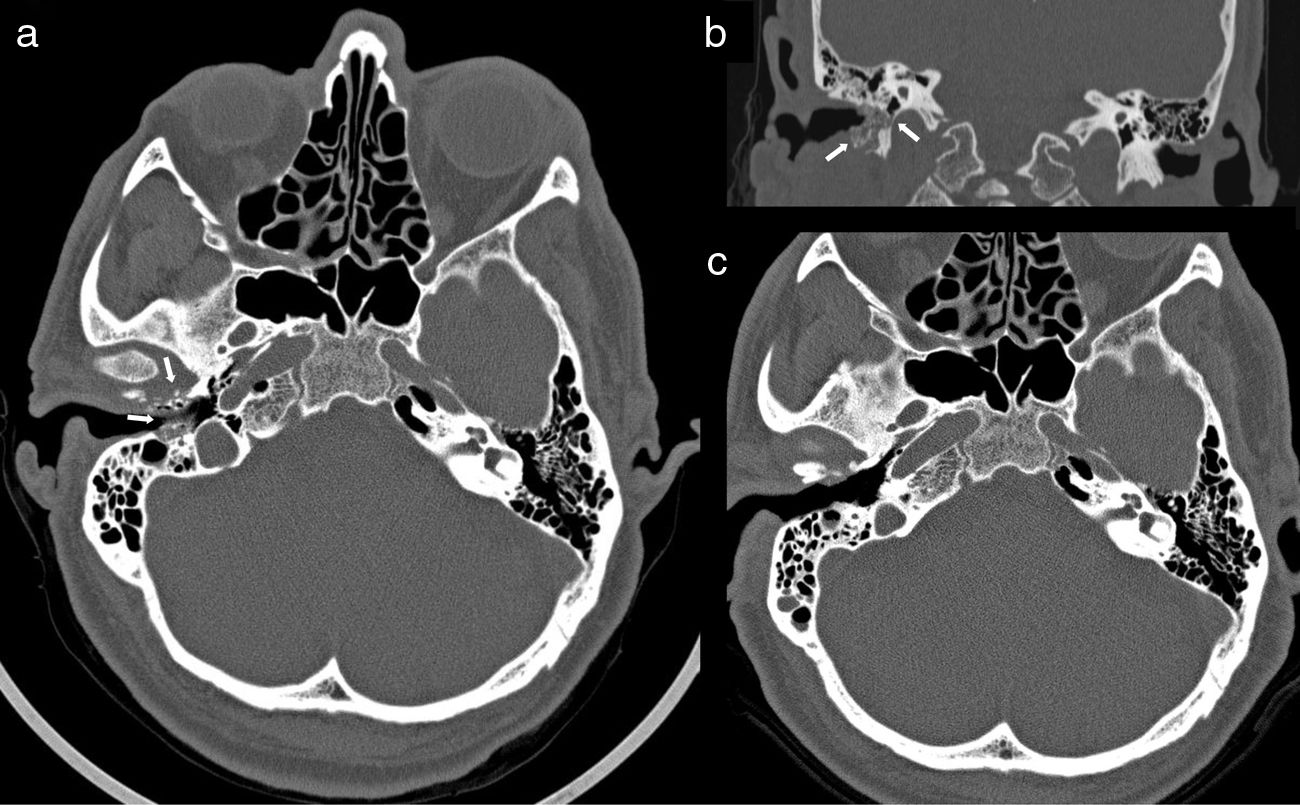
Se trata de un paciente de 63 años, natural de Ecuador y residente en nuestro país desde hacía más de 20 años, entre cuyos antecedentes personales figuraba la presencia de HTA, dislipidemia, hipotiroidismo subclínico y gota. Su tratamiento habitual comprendía bisoprolol, simvastatina y ácido acetilsalicílico. La sintomatología se había iniciado al menos 2 meses antes de la consulta inicial y consistía en otalgia, hipoacusia y otorrea por el oído derecho (OD). La otoscopia mostró en ese momento un CAE de paredes edematosas y eritematosas con tímpano íntegro. Tras realizar un ciclo de tratamiento tópico con dexametasona y gentamicina, una nueva otoscopia reveló una laceración del suelo del CAE que dejaba expuesto tejido óseo, con reacción inflamatoria y abundante otorrea. El paciente refería empeoramiento progresivo de la otalgia y del dolor preauricular a pesar del tratamiento analgésico. Una vez establecido el diagnóstico clínico de OEM se inició tratamiento con ciprofloxacino oral y tópico y se solicitó una tomografía computarizada (TC) de oídos y mastoides. Dicha exploración puso de manifiesto la existencia de áreas de rarefacción osteolítica que afectaban a las paredes del CAE derecho, con secuestros óseos y pequeñas burbujas de gas, hallazgos compatibles en su conjunto con una osteomielitis de la base del cráneo secundaria a OEM (figs. 1a y b). Por ese motivo se llevó a cabo una intervención quirúrgica por abordaje retroauricular que permitió confirmar la destrucción ósea de las paredes posterior, inferior y anterior del CAE, completándose con una meatoplastia y canaloplastia mediante fresado (hasta la obtención de un plano de tejido óseo sano) y posterior cobertura con un injerto de fascia temporal. El cultivo de todas las muestras obtenidas durante este acto quirúrgico (un total de 3, incluyendo tejido óseo y partes blandas) fue positivo para C. albicans con elevado número de colonias y sin otros aislamientos microbiológicos. La biopsia de la piel del CAE mostró tejido fibroconectivo y material necrobiótico, sin evidencia de malignidad ni demostración de estructuras fúngicas. A la anamnesis dirigida el paciente negó antecedentes de traumatismos óticos o la realización de actividades de jardinería. El cribado básico de inmunodeficiencia fue negativo, y tanto las glucemias basales repetidas como la determinación de hemoglobina glicosilada (5,7%) fueron normales. Se administró un ciclo de 3 semanas de anidulafungina (dosis de carga de 200mg seguida de 100mg cada 24h), que fue posteriormente completado con fluconazol (400mg cada 24h) por vía oral durante 3 meses y limpieza tópica del OD con alcohol boricado. El paciente experimentó una mejoría progresiva de la otalgia y de la otorrea hasta su desaparición, permaneciendo asintomático en el momento actual. Una TC de seguimiento realizada al cabo de 5 meses mostró la completa normalización de la anatomía del CAE y de las celdas mastoideas (fig. 1c).
Tomografía computarizada (TC) de oídos y mastoides con imágenes axiales (a) y coronales (b) realizada en el momento del diagnóstico de osteomielitis de la base del cráneo asociada a otitis externa maligna (OEM) derecha, que muestra la existencia de áreas de osteólisis que afectaba a las paredes anterior y posterior y al suelo del conducto auditivo externo, con secuestros y burbujas de gas de pequeño tamaño en el interior del hueso compacto y aumento inflamatorio de partes blandas (flechas blancas); (c) TC de seguimiento realizada 5 meses después del desbridamiento quirúrgico y tras un ciclo de 3 meses de tratamiento antifúngico en la que se comprueba la resolución de los hallazgos de OEM y del componente de osteomielitis.
Dentro de su carácter infrecuente, los ejemplos de OEM fúngica contenidos en la literatura están causados mayoritariamente por Aspergillus fumigatus y se circunscriben a pacientes diabéticos o con diversas formas de inmunosupresión (infección avanzada por VIH, leucemia mieloide aguda con neutropenia profunda, tratamiento esteroideo o alteraciones primarias de la fagocitosis)2-4. Si bien en nuestro caso no se realizó estudio histológico del tejido óseo de las paredes del CAE a fin de demostrar la invasión tisular por estructuras fúngicas, el aislamiento de C. albicans en todas las muestras intraoperatorias, la ausencia de agentes alternativos y la respuesta al tratamiento antifúngico permiten albergar un elevado grado de certeza en relación con el diagnóstico. En la serie más amplia de OEM fúngica publicada hasta la fecha (9 casos diagnosticados en un único centro a lo largo de 18 años), el antecedente de DM estuvo presente en el 89% de los pacientes5. En comparación con los casos producidos por P. aeruginosa, los pacientes con OEM fúngica presentaron con más frecuencia parálisis del VII par y compromiso de la base del cráneo a lo largo del seguimiento radiológico5. Una reciente revisión sistemática de la literatura a partir del 2000 identificó 25 casos de OEM fúngica, en 7 de los cuales (todos ellos pacientes diabéticos) Candida spp. fue el microorganismo causal3. Por este motivo resulta llamativa la ausencia de factores de riesgo aparentes en el presente caso. El grupo de Netea ha investigado a nivel funcional la inmunidad innata y adaptativa en una serie de 6 pacientes sin inmunodepresión subyacente que habían desarrollado una osteomielitis de la base del cráneo por Aspergillus. En comparación con controles sanos, se observó una menor producción de interleucina (IL)-17 e IL-22 en las células mononucleares de sangre periférica sometidas a un estímulo antigénico específico para A. fumigatus y C. albicans, sugiriendo la presencia de una respuesta Th17 deficiente frente a patógenos fúngicos que podría actuar como factor predisponente6.
Si bien el abordaje óptimo de la OEM fúngica no está bien establecido, parece clave la reversión de los factores subyacentes (particularmente el control metabólico adecuado de la DM) combinada con un amplio desbridamiento quirúrgico y un tratamiento antifúngico prolongado. En la serie anteriormente citada, la limpieza quirúrgica fue necesaria en el 78% de los casos de OEM fúngica, frente a tan solo el 18% de los pacientes con infección de etiología bacteriana (en su mayor parte por P. aeruginosa) que precisaron de tal intervención5. Respecto al régimen antifúngico, la mayor parte de los casos publicados recibieron un triazol (fluconazol, voriconazol o itraconazol), asociado en ocasiones a anfotericina B durante las primeras semanas2,3,5. La duración media del tratamiento en la revisión sistemática de la literatura fue de 178 días3, si bien no es posible establecer una recomendación firme al respecto. Solo en un caso de OEM por A. flavus se empleó una equinocandina (caspofungina) como parte del tratamiento (que también incluyó terapia hiperbárica y un curso prolongado de voriconazol), obteniéndose una evolución favorable7. En nuestro paciente el tratamiento con fluconazol se mantuvo hasta completar un total 110 días, superponible a la duración media de 100 días comunicada en la serie de Hamzany et al.5. Es posible que la ausencia de inmunosupresión, la administración de un ciclo de inducción con equinocandina y la menor virulencia de Candida en comparación con los hongos filamentosos hayan contribuido a la evidente mejoría clínica, obviando la necesidad de cursos de tratamiento más extensos. Si bien no se aborda de forma específica el tratamiento de la OEM con compromiso de la base del cráneo, las guías de práctica clínica más recientes recomiendan en la osteomielitis por Candida el uso de fluconazol (6mg/kg cada 24h) durante 6-12 meses, ya sea en monoterapia o precedido de un ciclo de al menos 2 semanas con una equinocandina8. En un modelo experimental de otitis media por A. fumigatus se demostró que el empleo de caspofungina durante 7 días se acompañaba de una respuesta clínica, microbiológica e histológica comparable a la obtenida con anfotericina B9. La adecuada distribución de las equinocandinas en el tejido óseo10, asociada a su favorable perfil de seguridad, convierten a este grupo de antifúngicos en una alternativa atractiva para el tratamiento de la OEM por Candida con extensión a la base del cráneo, tal y como pone de manifiesto la presente experiencia.
FinanciaciónMFR disfruta de un contrato «Miguel Servet» (CP18/00073) y MRR de un contrato de formación en investigación «Río Hortega» (CM17/00098), en ambos casos del Instituto de Salud Carlos III, Ministerio de Ciencia, Innovación y Universidades (España).