La tuberculosis genitourinaria (TGU) es la afección extrapulmonar más frecuente tras la pleural y ganglionar. Dada su escasa sintomatología clínica su diagnóstico y tratamiento son, a menudo, tardíos.
MétodosEstudio de las características clínicas, epidemiológicas y evolutivas de los pacientes diagnosticados de TGU en nuestro centro los últimos 10 años. Se han incluido los pacientes con cultivo de Löwenstein positivo, en orina o en muestras de biopsies o con estudio anatomopatológico compatible con tuberculosis. Los casos de tuberculosis multifocal, Löwenstein positivo sin clínica urinaria ni alteraciones radiológicas se consideraron micobacteriuria.
ResultadosSe han analizado 45 pacientes (el 62% hombres con una edad media de 49,4 años). En el 33% coexistía enfermedad de base (14 infectados por el virus de la inmunodeficencia humana). Se diagnosticaron de tuberculosis renal 26 pacientes (57%), 5 (11%) de orquiepididimitis y 14 (31%) se catalogaron como micobacteriuria. La sintomatología más frecuente fue síndrome miccional (60%), dolor lumbar (44%) y hematuria macroscópica (12%). La tinción de Ziehl fue positiva en el 38% de los casos. El urocultivo fue positivo para otros gérmenes en 9 pacientes (20%). La urografía intravenosa orientó el diagnóstico en 28/32 casos (87,5%). El intervalo medio de síntomas previos al diagnóstico fue de 15 meses. La curación sin secuelas se logró en el 60%. Se indicó cirugía en 10 casos.
ConclusionesSe debe incrementar el grado de sospecha de TGU ante síndromes urinarios de repetición. La menor utilización actual de la urografía frente a otras pruebas de imagen y el hallazgo de otros gérmenes en el urocultivo pueden retrasar el diagnóstico.
Genitourinary tuberculosis (GUT) is the third most frequent extrapulmonary tuberculous infection, following pleural and nodal involvement. Associated clinical symptoms are mild, and the diagnosis and treatment of this condition are often delayed.
MethodsThis study determines the clinical and epidemiological characteristics, and outcome of patients diagnosed with GUT in our center over the last 10 years. Patients with positive Löwenstein-Jensen urine or biopsy culture, or pathologic study suggestive of tuberculosis were included. Cases of multifocal tuberculosis and positive Löwenstein-Jensen, but with no urinary symptoms or radiological alterations, were considered to have mycobacteriuria.
ResultsForty-five patients were analyzed (62% men; mean age, 49.4 years). Among the total, 33% had a coexisting disease (14 were infected by human immunodeficiency virus). Twenty-six patients (57%) had renal tuberculosis, 5 (11%) orchiepididymitis, and 14 (31%) were classified as having mycobacteriuria. The most frequent clinical manifestations were urination syndrome (61%), low back pain (44%), and macroscopic hematuria (12%). Ziehl stain was positive in 38% cases. Urine culture was positive for other microorganisms in 9 patients (20%). Intravenous urography oriented the diagnosis in 87.5% of cases. The average interval between onset of symptoms and diagnosis was 15 months. Cure without sequelae was obtained in 60%. Surgery was indicated in 10 patients.
ConclusionsThe index of suspicion for GUT should be high when patients present with repeated urinary syndromes. The current use of imaging studies other than urography and the finding of other microorganisms in urine culture can delay the diagnosis.
La tuberculosis sigue siendo en la actualidad un problema de salud pública mundial. La coexistencia con la infección por el virus de la inmunodeficiencia humana (VIH), que condiciona una mayor susceptibilidad de los infectados frente a esta enfermedad, ha sido un factor clave en el incremento de casos tanto en los países en desarrollo como en el nuestro, y se estima que 1,6 millones de personas fallecieron en 2005 por esta causa1. La tuberculosis es una enfermedad prevalente en nuestro país, aunque, gracias a la implementación de los programas de control, su incidencia ha disminuido de forma progresiva en los últimos 15 años desde una tasa del 39,9 hasta el 21,6 en Cataluña (23,6 casos por 100.000 habitantes en 2004)2.
Cerca del 20% de los enfermos de tuberculosis desarrolla manifestaciones extrapulmonares y de éstos, entre el 4 y el 8% presenta afectación de la vía urinaria; ésta es, precisamente, la tercera localización más frecuente después de la pleural y la ganglionar3.
La tuberculosis genitourinaria tiene su origen en la diseminación de Mycobacterium tuberculosis por vía sanguínea a partir de un foco primario, y los riñones son el órgano diana, aunque también pueden verse afectados el uréter, el epidídimo y la próstata, ya sea por vía hematógena o por contigüidad a partir de la orina infectada3.
Dado que la clínica es, a menudo, insidiosa, con síntomas inespecíficos (dolor lumbar, hematuria, disuria) y en la mayoría de los casos sin un cuadro constitucional acompañante, el diagnóstico de tuberculosis genitourinaria es, con frecuencia, tardío y, a menudo, se llega a él en situación de enfermedad avanzada. Se requiere un alto índice de sospecha para realizar un diagnóstico precoz y, por lo tanto, evitar las secuelas que derivan de esta entidad.
El objetivo del estudio es describir las características clínicas y analizar los factores que influyen en la dificultad y el retraso diagnóstico.
MétodosSe han analizado de forma retrospectiva los datos clínicos, epidemiológicos y evolutivos de todos los pacientes diagnosticados de tuberculosis genitourinaria durante el período comprendido entre 1995 y 2006. Se han incluido los pacientes con cultivo de Lowenstein positivo, ya sea en la orina como en las muestras de biopsias, o bien si presentaban un estudio anatomopatológico de la pieza quirúrgica con lesiones granulomatosas caseificantes sugestivas de esta entidad.
Se consideró que había afección renal y/o ureterovesical cuando la clínica y las alteraciones eran características en la urografía intravenosa: borramiento o irregularidad de la papila, amputación de uno o más grupos de cálices, dilatación calicial por estenosis infundibular, formación de cavernas en el parénquima renal, estenosis ureteral, ausencia de función del riñón (autonefrectomía) o retracción vesical; y orquiepididimitis si la clínica local era compatible.
Los casos con tuberculosis simultánea en otros territorios (tuberculosis multifocal) con cultivo de Lowenstein de orina positivo, pero sin clínica urinaria previa o actual ni alteraciones en las pruebas de imagen nefrourológicas fueron catalogados como micobacteriuria.
ResultadosDatos clínico-epidemiológicosSe han incluido en el estudio 45 pacientes, con una edad media de 49,4 ± 13,36 años (rango: 28-78 años). Un total de 28 (62%) eran hombres. En el 33% de los casos coexistía una enfermedad de base: 14 (31%) estaban infectados por el VIH y se encontraban en un estado de inmunosupresión avanzada (CD4 137 ± 108,2 céls./μl), 2 pacientes (4%) padecían diabetes mellitus y 7 (16%) aceptaban un consumo superior a 40 g de alcohol diarios. El 21% refería antecedentes de tuberculosis pulmonar previa. Del total de los pacientes, 5 (11%) eran de procedencia africana.
Fueron diagnosticados de tuberculosis renal 26 pacientes (57%). El síntoma más frecuente (60%) fue la clínica urinaria baja inespecífica (disuria, urgencia miccional, polaquiuria o tenesmo). Presentaron dolor lumbar o hipogástrico 11 (44%) y hematuria macroscópica 3 (12%). El 48% de los pacientes había sido diagnosticado previamente, por su clínica urológica, de infecciones urinarias bacterianas.
Hubo 5 pacientes (11%) que se diagnosticaron de orquiepididimitis. Los motivos de consulta fueron abscesos epididimarios o escrotales y tumoración testicular. De ellos, en 4 se objetivaron alteraciones radiológicas compatibles con afectación renal concomitante.
Fueron catalogados dentro del grupo de micobacteriuria 14 pacientes (31,1%) que presentaban, al diagnóstico, tuberculosis activa en otras localizaciones: pulmonar (10 pacientes), ganglionar (4 pacientes), medular (1 paciente), meníngea (3 pacientes) y ósea (2 pacientes). Ninguno de los 14 presentaba clínica urológica ni alteración radiológica acompañante. Dichos pacientes tenían una edad media (41,4 ± 14,0 años) significativamente inferior (p = 0,0033, t de Student) que los pacientes afectados de tuberculosis focal (53,4 ± 11,2 años); 11 (78,5%) estaban infectados por el VIH, uno era diabético y otro padecía enolismo crónico.
Sólo los pacientes con tuberculosis multifocal presentaban síntomas constitucionales como fiebre prolongada, pérdida de peso, anorexia o debilidad.
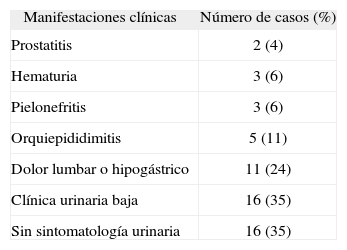
En la tabla 1 se exponen los síntomas clínicos que la mayoría de los pacientes presentaban de forma reiterada y prolongada antes de la confirmación diagnóstica.
Número de casos de las diferentes manifestaciones clínicas previas al diagnóstico que presentaban los pacientes
| Manifestaciones clínicas | Número de casos (%) |
| Prostatitis | 2 (4) |
| Hematuria | 3 (6) |
| Pielonefritis | 3 (6) |
| Orquiepididimitis | 5 (11) |
| Dolor lumbar o hipogástrico | 11 (24) |
| Clínica urinaria baja | 16 (35) |
| Sin sintomatología urinaria | 16 (35) |
El número total de casos supera al de pacientes puesto que algunos de ellos presentaban más de una manifestación clínica.
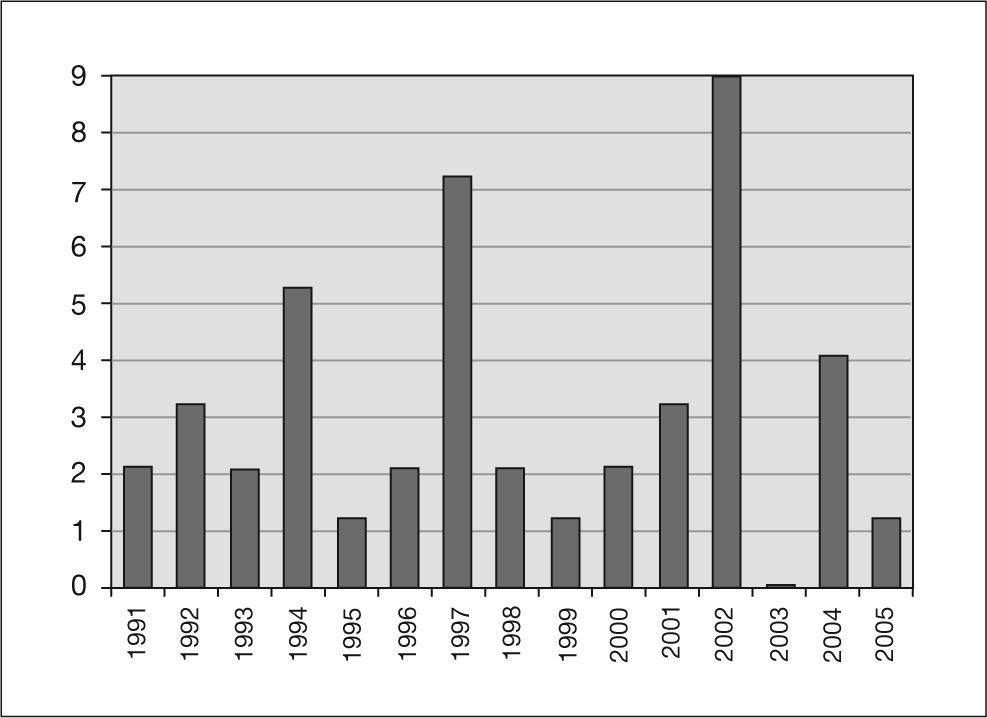
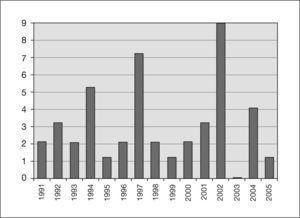
En la figura 1 se puede observar la distribución temporal de los casos de tuberculosis genitourinaria.
Diagnóstico de laboratorioEn 42 pacientes (93,3%) el cultivo de Lowenstein en orina fue positivo. El germen aislado fue M. tuberculosis en 39 casos, en uno M. bovis (no había recibido instilaciones de bacilo de Calmette-Guérin [BCG]), en uno M. avium intracelulare y en uno M. simiae (los dos últimos pertenecían a pacientes con tuberculosis multifocal). M. simiae fue aislado en el esputo y la orina y coexistía con M. tuberculosis que fue hallado en la médula ósea. En tres casos el cultivo fue negativo: 2 pacientes con pionefrosis en las que el diagnóstico fue anatomopatológico y otro con afección renal y tinción de Ziehl positiva en orina. La tinción de Ziehl-Neelsen fue positiva sólo en 16 casos (38%) pero llegaba al 80% en los casos de orquiepididimitis.
El sedimento urinario mostraba leucocituria en el 61,5% de los pacientes. Ninguno de los pacientes con tuberculosis multifocal presentaba piuria en el examen del sedimento. Sin embargo, el cultivo de Lowenstein fue positivo en todos ellos.
El examen citológico de orina de un paciente con baciloscopia negativa mostró abundantes células gigantes multinucleadas junto con componente polimorfonuclear que orientaron el diagnóstico.
Se había realizado cultivo de orina convencional en el 68% de los pacientes, siendo positivo en 9 (29%) (5 eran mujeres). Un total de 6 pacientes tenían cultivos positivos de repetición. Los gérmenes aislados fueron bacilos gramnegativos en 8 casos (Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa), 4 enterococos (E. faecalis), 2 estreptococos (S. agalactiae), un estafilococo coagulasa-negativo y un Candida spp. Estos dos últimos crecían en combinación con E. faecalis y E. coli, respectivamente.
Exploraciones radiológicasLas alteraciones halladas en la urografía intravenosa permitieron orientar el diagnóstico en 28 de los 32 pacientes a los que se le practicó esta exploración (87,5%). Las anomalías que se detectaron con más frecuencia fueron caliciliares (96,4%), alteraciones vesicales (53,5%), hidronefrosis (50%), calcificaciones (28,5%) y estenosis ureterales en el 3,5%.
La ecografía abdominal fue practicada en 28 casos, y mostraban alteraciones el 42,8% de las veces. Los hallazgos más comunes fueron atrofia y cicatrices corticales (58,3%), calcificaciones (33,3%), dilataciones y quistes pielocaliciales (50%) e hidronefrosis (16,6%). La tomografía computarizada (TC) realizada en 11 casos sólo mostró alteraciones 4 de ellos, aunque en 2 pacientes las imágenes radiológicas apuntaron el diagnóstico.
Ninguno de los pacientes con tuberculosis multifocal y micobacteriuria presentaba alteraciones urológicas en las exploraciones radiológicas realizadas.
La radiografía de tórax fue patológica en el 57,8% de los pacientes y mostraba alteraciones sugestivas de infección tuberculosa activa en 10 de ellos (24,3%); todos ellos correspondían a casos con micobacteriuria.
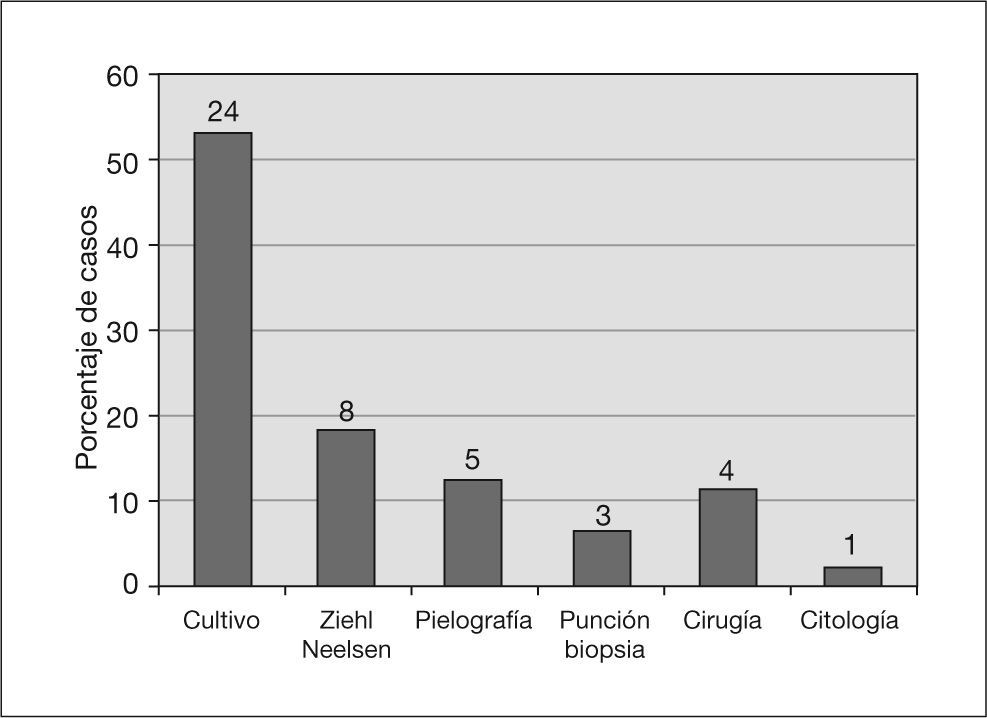
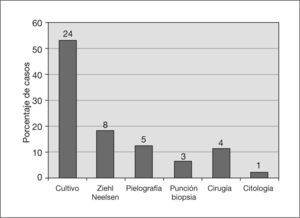
La figura 2 muestra la prueba diagnóstica en que se apoyó el inicio del tratamiento con tuberculostáticos.
Tratamiento y evoluciónSe ha constatado una importante demora entre el inicio de la sintomatología y el diagnóstico con una media de 468 ± 572 días, una mediana de 180 días y un intervalo intercuartil de entre 30 y 402. Esta demora se ha mostrado inferior (p = 0,05, test Kolmogorov-Smirnov) para los casos de tuberculosis multifocal (media de 94 ± 114 días) en comparación con el resto (611 ± 756 días). El intervalo medio entre la sospecha clínica y el inicio del tratamiento fue de 24,7 días.
El 60% de los pacientes había recibido tratamiento antibiótico por su clínica urológica, previamente al diagnóstico definitivo.
El tratamiento tuberculostático fue triple (isoniazida, rifampicina, pirazinamida) en 29 y cuádruple (isoniazida, rifampicina, pirazinamida y etambutol) en 14 casos. El caso afectado con M. bovis se trató con isoniazida, rifampicina y etambutol, y el que se aisló M. avium intracelulare con azitromicina, etambutol y rifabutina. Se mantuvo durante un período comprendido entre 6 y 9 meses. El cultivo de control al finalizar el tratamiento fue negativo en todos los casos. No se detectaron resistencias a los fármacos empleados.
La curación sin secuelas se logró en 27 pacientes (60%), mientras que el resto tuvo una evolución tórpida, con persistencia de los síntomas (dolor lumbar y/o síndrome miccional). No se han detectado recidivas a los 48 meses de haber finalizado el tratamiento.
Fue necesaria la intervención quirúrgica en 10 casos; 3 de ellos precisaron nefrectomía por pionefrosis, 4 requirieron drenaje renal, se practicó una epididectomía y a 2 pacientes se les realizó durante su seguimiento un reimplante ureteral.
DiscusiónEl hecho de que entre el 7,4 y el 40% de las tuberculosis genitourinarias de diversas series4–6 sean diagnosticadas de forma casual y el prolongado período sintomático previo al diagnóstico definitivo ilustran el hecho de que la tuberculosis renal sea una enfermedad insidiosa, a veces olvidada, que favorece el retraso diagnóstico y también terapéutico.
Existen ciertos signos o síntomas indirectos que pueden orientar su diagnóstico: cistitis de repetición con poca respuesta al tratamiento, leucocituria con urocultivos negativos, macro o microhematuria, aumento de tamaño y/o endurecimiento indoloro del epidídimo e induración o palpación de nódulos en el examen prostático. Los síntomas urológicos en nuestra serie son similares a los descritos, aunque destaca la menor presencia de hematuria macroscópica (el 6,6% frente al 35-39%)5,7. Los síntomas constitucionales, habituales en los pacientes con tuberculosis en otras localizaciones, suelen ser poco llamativos en la afectación genitourinaria.
El diagnóstico microbiológico de tuberculosis requiere el aislamiento de micobacteria en el cultivo o en el material biopsiado. Los bacilos ácido-alcohol resistentes pueden detectarse con la tinción de Ziehl-Neelsen, con una sensibilidad que oscila entre el 22 y el 81%8, lo que permite orientar el diagnóstico, hasta que se obtiene el cultivo definitivo. Ciertas micobacterias ambientales como M. smegmatis pueden contaminar la parte final de la uretra y ocasionar falsos positivos, por lo que la tinción debe interpretarse con cautela. En nuestra serie, el cultivo ha permitido el diagnóstico microbiológico en el 93,3% de los casos, aunque la tinción de Ziehl sólo fue positiva en el 38% de ellos.
El 29% de los pacientes tenía urocultivos positivos para otros microorganismos, por lo que consideramos importante recalcar que la presencia de un cultivo bacteriológico positivo no descarta tuberculosis y que la orina debe ser cultivada de forma seriada en medios específicos para micobacterias en aquellos pacientes con clínica compatible o con infecciones del tracto urinario persistentes o de repetición. A pesar de que la recogida y el procesamiento de la orina se realicen de forma correcta, el 10% de los cultivos son negativos. Uno de los factores que pueden contribuir a ello es el paso intermitente y escaso de bacilos desde las lesiones renales a la orina, especialmente en riñones anulados (riñón mastic). No hemos podido valorar en nuestro trabajo si el tratamiento con quinolonas, muy utilizadas en el tratamiento de las infecciones de orina pero que a su vez tienen una reconocida acción tuberculostática9, parece tener algún impacto en la sensibilidad de la tinción de Ziehl o en el cultivo de Lowenstein. En nuestra serie, el 57,7% había recibido diversos tratamientos antibióticos y, de ellos, el Lowenstein sólo fue negativo en 2 casos con pionefrosis.
En los últimos años se ha publicado algún estudio que valida la técnica de la reacción en cadena de la polimerasa (PCR) para la detección de M. tuberculosis y M. bovis en la tuberculosis genitourinaria, con unos datos de sensibilidad y especificidad que llegan al 84 y al 85%, respectivamente10. Debe tenerse en cuenta que ciertas sustancias inhibitorias de la orina pueden ocasionar falsos negativos. Pese a ello, la PCR se incorpora como una técnica útil que puede acelerar el diagnóstico de tuberculosis11.
A pesar de la utilización de nuevos métodos radiológicos como herramientas diagnósticas, la urografía intravenosa ha sido y es la técnica con más alta rentabilidad, con una sensibilidad en nuestra serie del 87,5%. Puede mostrar una amplia gama de alteraciones que tienen correlación clínica con la gravedad de la infección y, en manos expertas, puede detectar pequeños cambios calicilares, que, si bien, son inespecíficos, orientan hacia el diagnóstico en muchos casos. En fases iniciales se observa edema de la mucosa calicial y cavitación de los cálices; en estadios avanzados se detectan estenosis debidas a la fibrosis, cavitaciones, colecciones, calcificaciones, abscesos perinefríticos y fístulas. Cabe destacar que en entre el 10 y el 15% de los casos con tuberculosis renal activa, la urografía puede ser normal12.
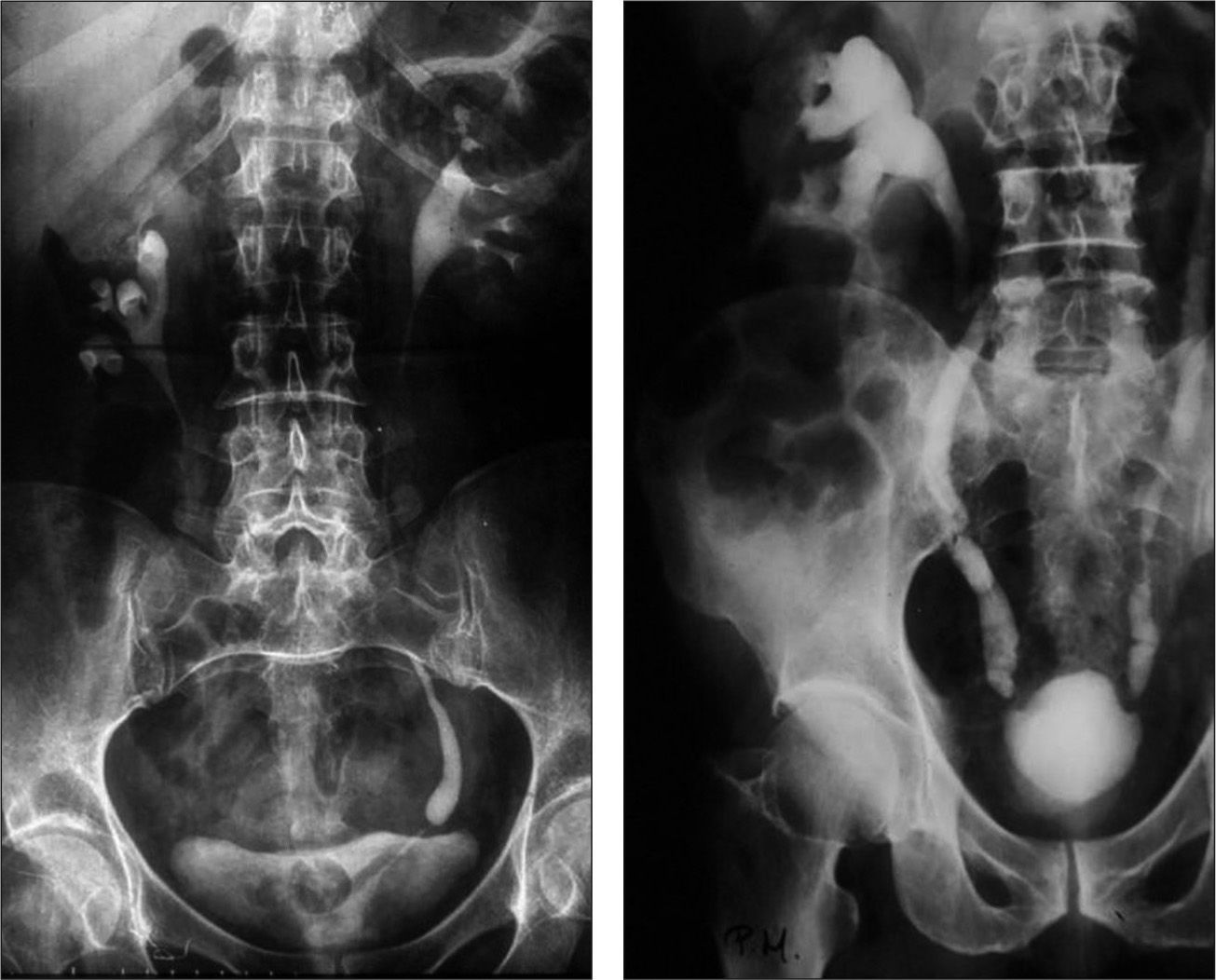
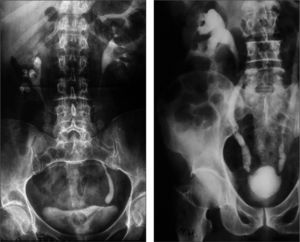
La afectación ureteral secundaria al paso de la orina infectada muestra en etapas iniciales una dilatación con irregularidad de la mucosa que puede progresar a estenosis/fibrosis preferentemente en el meato uretral. La vejiga urinaria suele mostrar una pérdida de volumen que evoluciona hacia la esclerosis vesical, con irregularidades múltiples. La afectación ureteral (3,5%) y vesical (53,5%) en nuestros pacientes se explicarían por la presencia de formas evolucionadas (fig. 3).
La TC no es una técnica de elección en el diagnóstico de sospecha de tuberculosis genitourinaria, si bien es útil para determinar la extensión de la afectación renal o extrarrenal, así como para descartar otras patologías (masas renales, autonefrectomía, etc.)8. La urorresonancia no aporta más sensibilidad ni especificidad que la urografía o la TC y estaría indicada sólo en casos en los que se prefiriera evitar el contraste.
La ecografía renal, muy utilizada en la actualidad, es menos sensible y específica que la urografía o la TC en la evaluación de la tuberculosis renal, aunque puede dar información sobre el tamaño del riñón o mostrar dilatación de los cálices en fases avanzadas. Aunque en nuestra serie, dada la larga historia de molestias urinarias, se había realizado ecografía en el 62% de los casos, las alteraciones que se detectaron eran inespecíficas y aportaban poca orientación sobre el diagnóstico.
En ningún caso de tuberculosis multifocal se hallaron alteraciones radiológicas compatibles con enfermedad renal. Ya en 1879, Cohnheim presentó la teoría de la eliminación de las micobacterias a través de la orina en la tuberculosis miliar13 y, posteriormente, en 1949 Medlar14 confirmó que la afectación cortical renal inducida por la tuberculosis era debida a diseminación hematógena a partir de un foco primario. En la mayoría de los casos, dicha afectación cortical es asintomática y tiende a permanecer estable a menos que las micobacterias penetren en la médula renal, donde factores locales pueden acelerar la infección. En personas inmunocompetentes el intervalo entre la infección y la enfermedad renal activa suele producirse años después e incluso décadas. Dado el paso de micobacterias a la orina durante la enfermedad tuberculosa, la búsqueda de micobacterias en orina se podría incluir como método de cribado en los casos de sospecha de tuberculosis también en otras localizaciones. Ya es conocido que hasta el 25% de los pacientes con tuberculosis miliar6, el 10% de los pacientes con tuberculosis pulmonar15 y hasta el 77% en los pacientes con sida y tuberculosis de cualquier localización a los que se les realiza un urocultivo16 pueden detectarse micobacterias en orina. Un trabajo reciente17 obtenía cultivo positivo en el 61 y el 57% de los pacientes con afectación vertebral y articular, respectivamente. En nuestra serie, el 31% de los pacientes presentaba micobacteriuria.
La punción-aspiración con aguja fina guiada por ecografía permite obtener material que puede mostrar alteraciones celulares específicas de tuberculosis, y también cultivarse. Esta técnica tiene una alta rentabilidad diagnóstica inmediata (88,9%)18 y una baja incidencia de complicaciones, por lo que estaría indicada en los casos de riñón no funcionante, masas renales o cuando existe una alta sospecha de tuberculosis renal y los exámenes de orina son negativos.
Mientras que sólo el 10% de las tuberculosis genito-urinarias muestran lesiones pulmonares activas, el antecedente de tuberculosis previa es frecuente (27-76%), dado que esta patología habitualmente se produce por la reactivación de lesiones renales antiguas causadas por diseminación hematógena a partir del foco pulmonar. Observamos en nuestra serie lesiones pulmonares agudas en un porcentaje elevado (24,3%). Tiene un papel importante en este punto la infección por el VIH, que padecía el 31% de nuestros pacientes, como factor predisponente para infección tuberculosa diseminada.
Los tuberculostáticos son el pilar fundamental del tratamiento. Las guías nacionales e internacionales vigentes7,19,20 recomiendan una duración del tratamiento de 6 meses. Sólo en casos complicados, recidivas e inmunodeprimidos podrían requerirse duraciones superiores (entre 9 y 12 meses). Cabe recalcar la importancia en el diagnóstico e inicio precoz del tratamiento tuberculostático, ya que en fases iniciales evita la progresión de las complicaciones, pero en fases avanzadas, a pesar del tratamiento tuberculostático correcto, la evolución puede ser tórpida. El 40% de nuestros pacientes refería síntomas tras finalizar el tratamiento.
Es importante el tratamiento precoz de las estenosis ureterales, ya sea mediante nefrostomía o bien con colocación de stents intraureterales, para permitir, posteriormente, una reconstrucción quirúrgica. Con la excepción de lo anteriormente citado se recomienda un tratamiento médico de 4 semanas antes de cualquier intervención quirúrgica. En los casos de obstrucciones ureterales progresivas se puede considerar añadir corticoides20 al tratamiento tuberculostático a las 2 semanas de iniciado el mismo si la evolución no es óptima y antes de optar por el procedimiento quirúrgico.
La nefrectomía sólo debe indicarse para las complicaciones de la tuberculosis renal tales como infecciones piógenas graves de repetición, litiasis renales, dolor persistente, sospecha de malignidad o hipertensión. En nuestra serie, 3 pacientes requirieron nefrectomía (2 por pionefrosis y otro por hidronefrosis y dolor no controlable con obstrucción ureteral evolucionada).
La existencia en nuestra casuística de formas evolucionadas es el resultado de retrasos diagnóstico-terapéuticos que pueden ser debidos a la conjunción de varios factores: a) la baja sospecha diagnóstica: la mayoría de los pacientes había tenido sintomatología previa al diagnóstico durante períodos prolongados de tiempo; b) la menor utilización de la urografía intravenosa en las infecciones recidivantes del tracto urinario frente al mayor uso de la ecografía; c) una valoración errónea debido a la existencia de urocultivos positivos o contaminados por otros gérmenes, y d) al alto porcentaje de baciloscopias negativas.
Para concluir, dado que la tuberculosis urogenital es una gran imitadora de otras enfermedades, ante síntomas urológicos poco específicos y recidivantes debe ser tenida en cuenta y perseguir su diagnóstico.